A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن فيروس SARS-CoV-2 عن طريق التضخيم متساوي الحرارة بوساطة النسخ العكسي
In This Article
Summary
نقدم هنا بروتوكولا كاملا لتوحيد وتنفيذ طريقة الكشف عن فيروس SARS-CoV-2 في العينات البشرية عن طريق التضخيم متساوي الحرارة بوساطة حلقة النسخ العكسي (RT-LAMP). يمكن تكييف هذه الطريقة ، التي تتم في غضون 60 دقيقة ، مع أي مختبر أو نقطة رعاية بتكلفة منخفضة وباستخدام معدات غير مكلفة.
Abstract
أثر فيروس كورونا 2 المسبب للمتلازمة التنفسية الحادة الوخيمة (SARS-CoV-2) بشكل كبير على صحة الإنسان. لا يزال يشكل تهديدا للمجتمع الحديث لأن الكثير من الناس يموتون نتيجة للعدوى. يتم تشخيص المرض باستخدام الاختبارات المصلية والجزيئية ، مثل تفاعل البوليميراز المتسلسل في الوقت الفعلي القياسي الذهبي (RT-PCR). الأخير له العديد من العيوب لأنه يتطلب بنية تحتية متخصصة ومعدات مكلفة وموظفين مدربين. هنا ، نقدم بروتوكولا يحدد الخطوات المطلوبة للكشف عن فيروس SARS-CoV-2 باستخدام التضخيم متساوي الحرارة بوساطة حلقة النسخ العكسي (RT-LAMP) في العينات البشرية. يتضمن البروتوكول تعليمات لتصميم البادئات في السيليكو ، وإعداد الكواشف ، والتضخيم ، والتصور. بمجرد توحيدها ، يمكن تنفيذ هذه الطريقة بسهولة وتكييفها مع أي مختبر أو نقطة رعاية في غضون 60 دقيقة بتكلفة منخفضة وباستخدام معدات غير مكلفة. إنه قابل للتكيف للكشف عن مسببات الأمراض المختلفة. وبالتالي ، يمكن استخدامه في الميدان وفي المراكز الصحية لإجراء المراقبة الوبائية في الوقت المناسب.
Introduction
يسبب فيروس كورونا 2 المسبب للمتلازمة التنفسية الحادة الوخيمة (SARS-CoV-2) مرض فيروس كورونا 2019 (COVID-19). أعلنت منظمة الصحة العالمية حالة طوارئ صحية عمومية تثير قلقا دوليا في 30 كانون الثاني/يناير 2020 وجائحة في 11 آذار/مارس 2020. أدى الوباء إلى أكثر من 760 مليون حالة و 6.87 مليون حالة وفاة حتى تاريخ كتابة هذا المقال1.
وقد سلط تأثير هذا الفيروس الضوء على الحاجة إلى أدوات مراقبة أفضل وأكثر دقة وأسرع ومتاحة على نطاق أوسع لتحسين الكشف عن الأمراض المعدية ومكافحتها 2,3. خلال الوباء ، استندت الاختبارات التشخيصية ل SARS-CoV-2 إلى اكتشاف الحمض النووي والأجسام المضادة والبروتينات ، لكن اكتشاف RT-PCR للحمض النووي هو المعيار الذهبي4. ومع ذلك ، فإن RT-PCR لديه بعض القيود. يتطلب معدات متخصصة وبنية تحتية وموظفين مدربين في البيولوجيا الجزيئية ، مما يقصر تطبيقه على المختبرات المتخصصة. علاوة على ذلك ، فهي تستغرق وقتا طويلا (4-6 ساعات) ، ولا تشمل الوقت اللازم لنقل العينات إلى المختبر ، الأمر الذي قد يستغرق5 أيام. وتحول هذه القيود دون المعالجة الفعالة للعينات والحصول على المعلومات اللازمة للتخطيط للطوارئ وإدارة الأوبئة.
يتميز التضخيم متساوي الحرارة بوساطة حلقة النسخ العكسي (RT-LAMP) بالعديد من المزايا مقارنة بتفاعل البوليميراز المتسلسل بالنسخ العكسي ، مما يجعله استراتيجية جذابة لتصميم الاختبارات التشخيصية المستقبلية في نقاط الرعاية (POCT) ، لا سيما في البيئات المحدودة الموارد6. أولا ، إنه محدد إلى حد كبير لأنه يستخدم ما بين أربعة وستة بادئات تتعرف على ستة إلى ثمانية مناطق في التسلسل المستهدف ، سواء كان الحمض النووي أو الحمض النوويالريبي 7,8. ثانيا ، نظرا لأنه يعمل عند درجة حرارة ثابتة ، فإنه لا يتطلب معدات متطورة مثل الدراجات الحرارية في الوقت الفعلي لتوليد التضخيم ، ولا يتطلب موظفين مدربين تدريبا عاليا لتشغيله. ثالثا ، وقت رد الفعل قصير جدا (~ 60 دقيقة) ، ويتم استخدام الكواشف غير المتخصصة للغاية ، مما يجعلها أداة فعالة من حيث التكلفة6. بالنظر إلى ما سبق وحالة الطوارئ الصحية الناجمة عن جائحة COVID-19 ، يمكن اعتبار هذه التقنية طريقة تشخيصية بديلة سريعة وغير مكلفة وسهلة التنفيذ في أي مختبر بحثي9.
تم وصف بروتوكول توحيد وتنفيذ RT-LAMP للكشف عن SARS-CoV-2 بطرق القياس اللوني باستخدام جهاز تدوير حراري وحمام مائي في هذه المقالة (الشكل 1). تتم مناقشة النقاط الحرجة وحدودها وبدائل النهوض بها.
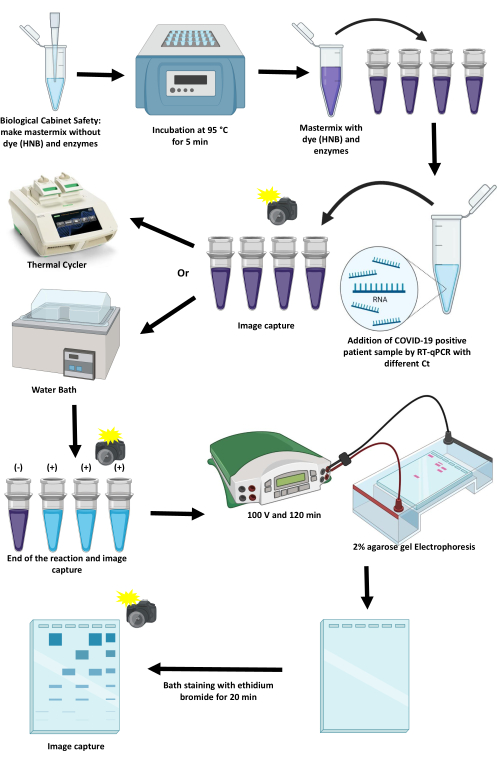
الشكل 1: مخطط بروتوكول تضخيم SARS-CoV-2 باستخدام تقنية RT-LAMP. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تم توفير العينات المستخدمة من قبل المختبر السريري لمستشفى Fundación Valle del Lili الجامعي وتتوافق مع الحمض النووي الريبي المنقى من المرضى الذين ثبتت إصابتهم ب COVID-19 باستخدام تقنية RT-qPCR. قدم جميع المرضى موافقة مستنيرة للبحث ، وتمت الموافقة على هذه الدراسة من قبل لجنة أخلاقيات البيولوجيا للدراسات البشرية من مستشفى جامعة Fundación Valle del Lili.
1. تصميم وإعداد التمهيدي RT-LAMP
ملاحظة: يمكن استخدام بادئات LAMP مع مجموعة متنوعة من الأنظمة الأساسية ، بما في ذلك New England BioLabs (NEB) LAMP و Primer Explorer و LAMP assay multianalysis (LAVA). ومع ذلك ، بالنسبة لهذا البروتوكول ، تم استخدام أداة NEB LAMP. يمكن إجراء تصميم التمهيدي باستخدام جينومات SARS-CoV-2 التي تم الحصول عليها من قاعدة بيانات NextStrain10. يوضح الجدول 1 مجموعة التمهيدي المستخدمة في هذا البروتوكول.
- تصميم التمهيدي لماب
- الحصول على تسلسل الجينوم الفيروسي.
- قم بإجراء محاذاة التسلسل للحصول على تسلسل الإجماع.
- انتقل إلى منصة أداة تصميم التمهيدي NEB LAMP11 واتبع التعليمات الواردة في الدليل السريع. تنتج هذه الأداة نفس النتائج مثل التمهيدي Explorer V5 ، ولكنها أكثر سهولة في الاستخدام في مخرجاتها. استخدم أدلة مستخدم مستكشف التمهيدي كدليل لتصميم التمهيدي.
- التقييم الديناميكي الحراري لمجموعة الاشعال
- استخدم الأداة Primer-Dimer12 لإجراء تحليل ديناميكي حراري على الاشعال التي تم الحصول عليها.
- ضع تسلسلات التمهيدي في الأداة. ثم حدد الخيار تحليل تعدد الإرسال وتقرير بنية ديمر.
- حدد مجموعات التمهيدي التي تحتوي على ΔG لا تقل عن -5.
- تقييم خصوصية الاشعال المصممة
- استخدم قاعدة بيانات مجموعة النوكليوتيدات (nt / nt) في BLAST13 لتحليل كل كتاب تمهيدي.
- لإجراء تحليل BLAST الأول ، حدد قاعدة بيانات Refseq_rna وقم بتصفية البحث باستخدام مجموعة الأجناس التي تنتمي إلى الفصيلة الفرعية Orthocoronavirinae. هم فيروس ألفا كورونا (taxid: 693996) ، وفيروس جاما كورونا (taxid: 694013) ، وفيروس دلتا كورونا (taxid: 1159901). بالإضافة إلى ذلك، قم بتقييم التسلسل مقابل الفيروسات الأخرى التي تدور بشكل مشترك كنوع فرعي H1N1 (taxid:114727) وفيروس الأنفلونزا A (taxid:11320) وفيروس الأنفلونزا B (taxid:11520).
- لإجراء تحليل BLAST الثاني ، حدد بنك جينات Betacoronavirus وقم بتصفية البحث باستخدام Coronaviridae (taxid: 11118) و SARS (taxid: 694009). تحتوي هذه المجموعات على تسلسلات لجميع جينومات فيروس كورونا السارس المحددة ، بما في ذلك الجينومات الموجودة في الخفافيش ، فيروس كورونا بيتا (taxid: 694002).
- بالنسبة لهذا البروتوكول ، تأكد من أن البادئات لا تتوافق مع الجينومات بخلاف الجينوم المستهدف ، SARS-CoV-2.
- إعداد التمهيدي
- قم بتدوير القوارير التي تحتوي على البادئات المجففة Iyoالمجففة باستخدام جهاز طرد مركزي دقيق (10000 × جم ، 1 دقيقة في درجة حرارة الغرفة [RT]) لتجنب الخسائر أثناء فتح الأنبوب.
- أعد ترطيب المسحوق المجفف بالأيوكربونات في ماء ثنائي إيثيل بيروكربونات (DEPC) بنسبة 0.1٪ أو ماء خال من النيوكلياز إلى تركيز نهائي يبلغ 100 ميكرومتر (الجدول 2) ويذوب تماما عن طريق السحب لأعلى ولأسفل. بعد ذلك ، قم بالدوران بأقصى سرعة (10000 × جم ، 1 دقيقة في RT) في جهاز طرد مركزي دقيق لجمع كل المحاليل الأولية في قاع الأنبوب.
- قم بإعداد مزيج التمهيدي 10x تحت خزانة السلامة الأحيائية باستخدام التمهيدي الداخلي الأمامي (FIP) ، والتمهيدي الداخلي الخلفي (BIP) ، والتمهيدي الخارجي الأمامي (F3) ، والتمهيدي الخارجي الخلفي (B3) ، والحلقة الخلفية (LB) ، والحلقة الأمامية (LF) ، كما ورد في الجدول 2. لمنع الخسائر ، ماصة أو دوامة بلطف حل التمهيدي قبل إجراء دوران سريع (10000 × غرام ، 1 دقيقة في RT) مع جهاز طرد مركزي دقيق.
- قم بتخزين مزيج التمهيدي 10x في -20 درجة مئوية للتخزين طويل الأجل ؛ ومع ذلك ، قم بإعداد ما يكفي لخمس تجارب كحد أقصى ، بغض النظر عن عدة عينات لتجنب الكثير من دورات التجميد والذوبان.
ملاحظة إذا كانت هناك حاجة إلى حجم أصغر من مزيج التمهيدي ، فقم بضبط القيم عن طريق حساب وحدات التخزين الجديدة (الجدول 2). علاوة على ذلك ، لا تتضمن مجموعات RdRp و RdRp / Hel التمهيدي LF لأن البدايات الحلقية غير مطلوبة لتفاعلات RT-LAMP. نتيجة لذلك ، استبدل حجم LF التمهيدي بماء خال من النيوكلياز أو 0.1٪ ماء DEPC.
2. رد فعل RT-LAMP
- قم بتشغيل خزانة التدفق الصفحي وفقا لتعليمات الشركة المصنعة وانتظر لمدة 3 دقائق على الأقل حتى يستقر تدفق الهواء.
- بمجرد استقرار تدفق الهواء ، قم بتنظيف وتعقيم الأسطح الداخلية للخزانة باستخدام تقنية التعقيم. لتحقيق ذلك ، استخدم المطهرات التالية بهذا الترتيب: 1000 جزء في المليون من الأمونيوم الرباعي (كلوريد البنزالكونيوم) ، 2٪ هيبوكلوريت ، 3٪ بيروكسيد الهيدروجين ، و 70٪ إيثانول.
ملاحظة: في هذه الحالة ، تستلزم تقنية التعقيم تطبيق المطهر وإزالته بالمناديل من داخل المقصورة إلى الخارج دون المرور فوق الأسطح التي تم تنظيفها مسبقا. - باستخدام المطهرات من الخطوة 2.2 ، قم بتنظيف المواد التي ستدخل المقصورة بنفس الترتيب.
ملاحظة: يجب إحضار الماصات الدقيقة ، وصناديق أطراف المرشح ، والقوارير ذات الأنابيب 1.5 مل و 0.6 مل ، وأنابيب PCR 0.2 مل ، والرفوف ، ودورق 400 مل إلى الخزانة. - أحضر بعض المناديل وقفازات النتريل إلى المقصورة. بعد ذلك ، قم بإيقاف تشغيل الخزانة وتعريضها للأشعة فوق البنفسجية (UV) لمدة 15 دقيقة.
تنبيه: لتجنب تلف الأنسجة والحمض النووي من التعرض للإشعاع لفترات طويلة، تجنب الأشعة فوق البنفسجية حتى انتهاء الوقت المحدد في الخطوة 2.4.
ملاحظة قم بإجراء التجميع الموضح في الشكل 2 قبل بدء البروتوكول ، وابدأ حمام الماء بعد إكمال الخطوة 2.4. من الأهمية بمكان ملء الحاوية المعدنية حتى أسنانها تقريبا بمياه الشرب وضبط درجة حرارة لوحة تسخين مختبر الحديد على 90 °C ، حيث سيؤدي ذلك إلى درجة حرارة ~ 66.3 °C في النظام ، والتي يتم مراقبتها باستخدام مقياس الحرارة الزئبقي. - بعد انتهاء فترة التشعيع ، أعد تشغيل الخزانة واتبع التوصيات الواردة في الخطوة 1.1.
- ضع الكواشف (الجدول 3 والجدول 4 والجدول 5) في مبرد مملوء بالثلج أو ثلاجة صغيرة من البوليسترين. ضع الحاوية داخل الخزانة بعد تنظيفها بنسبة 70٪ إيثانول.
- في أنبوب طرد مركزي دقيق سعة 0.6 مل ، قم بإعداد مزيج LAMP للجين المراد تضخيمه (RdRp و N-A و RdRp / Hel) ، مع إضافة المكونات التالية فقط: 10x Buffer ، MgSO4 ، dNTPs ، مزيج البادئات 1x والماء الخالي من النيوكلياز أو 0.1٪ ماء DEPC ؛ تخلط جيدا عن طريق ماصة لتجانس.
تنبيه: بسبب التعامل غير السليم والسلوك داخل الخزانة ، هناك خطر كبير من تلوث الكاشف. يجب اتباع القواعد التالية للتخفيف من هذه المشكلة: (أ) استخدام نصائح معقمة ومرشحة. (ii) استخدم نصيحة واحدة لكل كاشف ؛ (iii) التحرك ببطء وحذر لتجنب تعطيل التدفق الصفحي ؛ (iv) الحفاظ على النظام واستخدام أقل عدد من المواد؛ و (v) استخدم قفازات مختلفة لتحضير المزيج وإضافة المادة الوراثية.
ملاحظة: احتفظ بجميع الكواشف ، وخاصة الإنزيمات ، على الجليد لأن التغيرات في درجات الحرارة يمكن أن تفسدها وتغير نشاط البلمرة. - ضع الأنبوب (الأنابيب) سعة 0.6 مل مع إغلاق الغطاء في كتلة تسخين واحتضانها على حرارة 95 درجة مئوية لمدة 5 دقائق.
ملاحظة: قم بتشغيل كتلة التسخين لأنابيب 1.5-2.0 مل الموجودة خارج الخزانة لمدة 30 دقيقة على الأقل قبل البدء في تحضير مزيج LAMP ومراقبة درجة الحرارة (95 درجة مئوية) باستخدام مقياس حرارة الزئبق أو الكحول. - عند اكتمال الحضانة ، ضع الأنابيب في مبرد البوليسترين المملوء بالثلج لمدة 5 دقائق.
- أعد الأنابيب إلى خزانة التدفق الصفحي وأكمل تحضير مزيج LAMP بإضافة إنزيمات بوليميراز الحمض النووي (Bst 3.0) ، والنسخ العكسي ، وبوليميراز الحمض النووي عالي الدقة (الجدول 3 ، الجدول 4 ، والجدول 5). في حالة استخدام الكشف اللوني ، أضف صبغة الهيدروكسينافثول الأزرق (HNB).
- بعد إضافة هذه الكواشف ، امزج كواشف LAMP جيدا عن طريق سحبها لإذابة الإنزيمات والصبغة.
- املأ كل أنبوب PCR ب 22.0 ميكرولتر من المزيج ، مع الحرص على عدم إنشاء فقاعات. ثم أضف 3.0 ميكرولتر من 0.1٪ ماء DEPC أو ماء خال من النيوكلياز إلى التحكم السلبي أو الأنبوب بدون قالب تحكم (NTC) واترك الأنبوب (الأنابيب) المتبقية جانبا للإضافة (المادة الوراثية).
ملاحظة: احتفظ بأنابيب تفاعل البوليميراز المتسلسل في مبرد مملوء بالثلج حتى تتم إضافة العينة لتجنب تنشيط إنزيم Bst 3.0 وبدء التفاعل قبل الأوان. - قم بإزالة جميع المواد من الخزانة واستخدم 70٪ إيثانول لتنظيف الأسطح. ثم قم بإيقاف تشغيله باتباع تعليمات الشركة المصنعة.
- في منطقة منفصلة ، أضف 3 ميكرولتر من العينة إلى كل أنبوب PCR وقم بتجانسها تماما. استخدم ماصة صغيرة سعة 20 ميكرولتر ونصائح تصفية لتحقيق ذلك.
تنبيه: يجب استخدام الماصة الدقيقة المستخدمة لإضافة المادة الوراثية حصريا لهذا الغرض ولا يمكن استخدامها لتحضير المزيج. بهذه الطريقة ، يتم تجنب تلوث الكواشف. بالإضافة إلى ذلك ، احتفظ بعينات الحمض النووي الريبي على الجليد في جميع الأوقات لتقليل احتمالية تدهور الحمض النووي الريبي. استخدم معدات الحماية الشخصية التالية (PPE) لإضافة العينة: ثوب يمكن التخلص منه ، وغطاء ، وقناع N95 ، وطماق ، ونظارات معملية ، وقفازات من النتريل. - قبل إجراء التفاعل اللوني ، التقط صورا لأنابيب PCR بكاميرا عالية الجودة. لون البداية مع HNB هو البنفسجي.
- نفذ التفاعل في النظام أو المعدات التالية: (i) جهاز تدوير حراري و (ii) حمام مائي.
- التدوير الحراري: قم بإيداع الأنابيب في كتلة التفاعل وقم بإعداد الملف الحراري (انظر الجدول 6) على الجهاز.
- حمام مائي: قم بإيداع الأنابيب في حاويات دائرية وضبطها جيدا لمنعها من الخروج. بعد ذلك ، ضع الحاويات في حمام مائي (الشكل 2 أ ، ب) عند درجة الحرارة المدرجة في الجدول 6.
- في حالة الحمام المائي ، بمجرد أن تكون الأنابيب داخل النظام ، ابدأ المؤقت لمدة 60 دقيقة (الجدول 6).
- قم بإزالة الأنابيب من جهاز التدوير الحراري أو الحمام المائي بعد وقت التفاعل وقم بتخزينها عند 4 درجات مئوية للتشغيل الكهربائي أو عند -20 درجة مئوية حتى الاستخدام.
- إذا تم إجراء تفاعل لوني ، التقط صورا لأنابيب PCR باستخدام كاميرا عالية الجودة. اللون النهائي مع HNB هو السماء الزرقاء.
3. تحليل منتجات التضخيم في هلام الاغاروز
ملاحظة: تقترح هذه الخطوات كفحوصات إضافية للتفاعل اللوني أو التحكم في الأداء أثناء خطوة التقييس. وذلك لأن هذه التقنية يمكن أن تشكل خطر تلوث كبير للمختبر الذي يجري هذه الاختبارات.
- ضع السرير داخل غرفة الرحلان الكهربائي بحيث تلمس مطاط الحافة الجدران ، مما يخلق مساحة مغلقة لإضافة الأغاروز (الغرفة الداخلية) (الشكل 3 أ ، ب).
- بعد الانتهاء من الخطوة 3.1 ، قم بوزن الكمية اللازمة من الأغاروز في دورق سعة 500 مل للحصول على 2٪ هلام. بعد ذلك ، أضف الحجم المطلوب من 0.5x Tris-acetate EDTA (TAE) العازلة والميكروويف لمدة 1-2 دقيقة.
ملاحظة: يذوب الأغاروز تماما عندما يكون شفافا وخاليا من التكتل عند إزالته من الفرن. إذا لم يتم تأكيد ذلك ، فقد تبقى مناطق هلامية سيئة ، مما يتسبب في تغيير تشغيل الرحلان الكهربائي وتصور منتجات التضخيم. - أخرج الدورق من الفرن واسكب الأغاروز في الحجرة الداخلية التي تم إنشاؤها في الخطوة 3.1 (الشكل 3C). بعد ذلك ، تحقق من عدم وجود فقاعات ، وإذا كانت موجودة ، فقم بإزالتها باستخدام طرف micropipite.
- رتب المشط لتشكيل الآبار واترك الأغاروز حتى ينضج لمدة 30 دقيقة تقريبا في درجة حرارة الغرفة (RT).
- بعد هذا الوقت ، أضف 5 مل من المخزن المؤقت 0.5x TAE لتسهيل إزالة الأمشاط والسرير الذي يحتوي على الجل. ثم ضع الجل بحيث تكون الآبار في الأنود (الشكل 3D).
- املأ غرفة الرحلان الكهربائي بمخزن مؤقت 0.5x TAE إلى السعة المحددة من قبل الشركة المصنعة ، مما يضمن أن الأقطاب الكهربائية على اتصال بالمخزن المؤقت.
- أضف 3 ميكرولتر من علامة الوزن الجزيئي إلى البئر الأول من الجل وأضف 9 ميكرولتر من NTC وكل عينة إلى الآبار التالية. اصنعها من خلال الجمع بين 7 ميكرولتر من منتج التضخيم مع 3 ميكرولتر من مخزن التحميل المؤقت ؛ ثم قم بتحميل 9 ميكرولتر من هذا الخليط في آبار الهلام.
- قم بتغطية غرفة الرحلان الكهربائي بالغطاء وقم بتوصيل الكابلات بمنافذ إمداد الطاقة بنمط الألوان. اضبط مصدر الطاقة على المعلمات التالية: 100 فولت وتيار ثابت لمدة 120 دقيقة.
- بعد اكتمال التشغيل الكهربائي ، ضع الجل في الحاوية بمحلول التلوين (بروميد الإيثيديوم) واحتضانه لمدة 30 دقيقة.
- بعد الحضانة ، قم بإزالة الجل من محلول التلوين وضعه في كيس بسحاب. هذا يمنع تلوث المعدات التي سيتم استخدامها لتصور amplicons.
- تصور الجل على جهاز نقل أو تصوير مثل Amersham Imager 600.
النتائج
يبدأ تنفيذ البروتوكول بتصميم مجموعة البادئات لكل جين مستهدف باتباع البروتوكول الموصوف أعلاه. في يونيو 2020، تم الحصول على 5000 جينوم SARS-CoV-2 من قاعدة بيانات NextStrain، مع تمثيل 10٪ للجينومات الكولومبية. تمت محاذاة هذه التسلسلات للحصول على تسلسل الإجماع الذي تم استخدامه في عملية تصميم التمهيدي.
Discussion
على الرغم من أن RT-LAMP يعتبر منهجية تكميلية لإجراء التشخيص الجزيئي ، إلا أنه يحتوي أيضا على بعض القيود والخطوات الحاسمة التي يجب مراعاتها عند توحيد البروتوكول وتنفيذه.
قام توحيد LAMP للكشف عن SARS-CoV-2 بتقييم المعلمات والمكونات التالية في المزيج الرئيسي: (أ) تركيز ودرجة حرارة محاذا...
Disclosures
ناتاليا كامبيلو بيدروزا هي الرئيس التنفيذي لشركة BioDx: Diagnóstico y Soluciones Biotecnológicas S.A.S. يعلن بقية المؤلفين عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذا العمل من قبل النظام العام للعودة في كولومبيا ، رقم المنحة BPIN 2020000100092 ، وجامعة Icesi - Convocatoria Interna ، رقم المنحة CA0413119. تم تمويل MFVT أيضا من قبل صناديق الأستاذية المساعدة من جامعة لوس أنديس. لم تشارك كيانات التمويل في تصميم وتنفيذ الأنشطة وجمع البيانات وتحليل البيانات وإعداد المخطوطة. نشكر مستشفى جامعة Fundación Valle del Lili على الحمض النووي الريبي الفيروسي من عينات Sars -CoV-2 والدكتور ألفارو باريرا أوكامبو على التعليقات على المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 1 kb DNA Ladder | SOLIS BIODYNE | 07-12-00050 | Store at -20 °C |
| 50x TAE Electrophoresis Buffer | ThermoScientific | B49 | Store at roome temperature |
| Accuris High Fidelity Polymerase | ACCURIS LIFE SCIENCE REAGENTS | PR1000-HF-200 | It can be used in case Q5 High-Fidelity DNA polymerase cannot be purchased. For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Agarose | PanReacAppliChem | A8963,0100 | N/A |
| Bst 3.0 DNA Polymerase 8000 IU/mL | New England BioLabs | M0374S/M0374L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Deoxynucleotide (dNTP) Solution Set | New England BioLabs | N0446S | Store at -20 °C |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220-25G | Handle it with caution under an extraction cabinet |
| GeneRuler 100 bp Plus DNA Ladder, ready-to-use | ThermoScientific | SM0322 | Store at -20 °C |
| Hydroxy naphthol blue disodium salt | Santa Cruz Biotechnology | sc-215156B | N/A |
| Q5 High-Fidelity DNA polymerase 2000 IU/mL | New England BioLabs | M0491S/M0491L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| WarmStart RTx Reverse Transcriptase 15000 IU/mL | New England BioLabs | M0380S/M0380L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
References
- World Health Organization. . Who coronavirus (COVID-19) dashboard (no date). , (2023).
- Ibrahim, N. K. Epidemiologic surveillance for controlling Covid-19 pandemic: types, challenges and implications. Journal of Infection and Public Health. 13 (11), 1630-1638 (2020).
- Rojas-Gallardo, D. M., et al. COVID-19 in Latin America: Contrasting phylodynamic inference with epidemiological surveillance. (Molecular epidemiology of COVID-19 in Latin America). medRxiv. , (2020).
- Liu, R., et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clinica Chimica Acta. 505, 172-175 (2020).
- Kevadiya, B. D., et al. Diagnostics for SARS-CoV-2 infections. Nature Materials. 20 (5), 593-605 (2021).
- Tomita, N., Mori, Y., Kanda, H., Notomi, T. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature Protocols. 3 (5), 877-882 (2008).
- Li, Y., Fan, P., Zhou, S., Zhang, L. Loop-mediated isothermal amplification (LAMP): A novel rapid detection platform for pathogens. Microbial Pathogenesis. 107, 54-61 (2017).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects. Journal of Microbiology. 53 (1), 1-5 (2015).
- Augustine, R., et al. Loop-mediated isothermal amplification (LAMP): A rapid, sensitive, specific, and cost-effective point-of-care test for coronaviruses in the context of COVID-19 pandemic. Biology (Basel). 9 (8), 182 (2020).
- . Nextstrain Available from: https://nextstrain.org/ (2023)
- . Neb Lamp, NEB LAMP Available from: https://lamp.neb.com/ (2023)
- . Blast: Basic local alignment search tool (no date) Available from: https://blast.ncbi.nlm.nih.gov/ (2023)
- Zhang, Y., et al. Rapid molecular detection of SARS-CoV-2 (COVID-19) virus RNA using colorimetric LAMP. medRxiv. , (2020).
- Lu, R., et al. Development of a novel reverse transcription loop-mediated isothermal amplification method for rapid detection of SARS-CoV-2. Virologica Sinica. 35 (3), 344-347 (2020).
- Najafov, A., Hoxhaj, G. . PCR Guru. , (2017).
- Zhang, Y., et al. Enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride. Biotechniques. 69 (3), 178-185 (2020).
- Ramírez-Chavarría, R. G., et al. Automatic analysis of isothermal amplification via impedance time-constant-domain spectroscopy: A SARS-CoV-2 case study. Chemosensors. 11 (4), 230 (2023).
- Haque, M. F. U., et al. A novel RdRp-based colorimetric RT-LAMP assay for rapid and sensitive detection of SARS-CoV-2 in clinical and sewage samples from Pakistan. Virus Research. 302, 198484 (2021).
- Donia, A., et al. Integration of RT-LAMP and microfluidic technology for detection of SARS-CoV-2 in wastewater as an advanced point-of-care platform. Food and Environmental Virology. 14, 364-373 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved