Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение вируса SARS-CoV-2 с помощью изотермической амплификации, опосредованной петлей обратной транскрипции
В этой статье
Резюме
Здесь мы предоставляем полный протокол для стандартизации и реализации метода обнаружения вируса SARS-CoV-2 в образцах человека с помощью изотермической амплификации с обратной транскрипцией, опосредованной петлей (RT-LAMP). Этот метод, выполненный в течение 60 минут, может быть адаптирован к любой лаборатории или месту оказания медицинской помощи по низкой цене и с использованием недорогого оборудования.
Аннотация
Вирус тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2) оказал серьезное воздействие на здоровье человека. Она продолжает оставаться угрозой для современного общества, потому что многие люди умирают в результате инфекции. Заболевание диагностируется с помощью серологических и молекулярных тестов, таких как золотой стандарт полимеразной цепной реакции в реальном времени (ОТ-ПЦР). Последний имеет ряд недостатков, поскольку требует специализированной инфраструктуры, дорогостоящего оборудования и обученного персонала. В этой статье мы представляем протокол, в котором изложены шаги, необходимые для обнаружения вируса SARS-CoV-2 с помощью изотермической амплификации, опосредованной обратной транскрипцией (RT-LAMP) в образцах человека. Протокол включает в себя инструкции по проектированию праймеров in silico, приготовлению реагентов, амплификации и визуализации. После стандартизации этот метод может быть легко внедрен и адаптирован к любой лаборатории или месту оказания медицинской помощи в течение 60 минут по низкой цене и с использованием недорогого оборудования. Он приспосабливается к обнаружению различных патогенов. Таким образом, он потенциально может быть использован в полевых условиях и в медицинских центрах для проведения своевременного эпидемиологического надзора.
Введение
Коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2) вызывает коронавирусную инфекцию 2019 года (COVID-19). 30 января 2020 г. Всемирная организация здравоохранения объявила чрезвычайную ситуацию в области общественного здравоохранения, имеющую международное значение, а 11 марта 2020 г. – пандемию. На момент написания этой статьи пандемия привела к более чем 760 миллионам случаев заболевания и 6,87 миллионам смертей1.
Воздействие этого вируса высветило необходимость в более совершенных, точных, быстрых и широко доступных инструментах эпиднадзора для улучшения выявления инфекционных заболеваний и борьбы с ними 2,3. Во время пандемии диагностические тесты SARS-CoV-2 были основаны на обнаружении нуклеиновых кислот, антител и белков, но обнаружение нуклеиновых кислот методом ОТ-ПЦР является золотым стандартом4. Однако ОТ-ПЦР имеет некоторые ограничения; Для этого требуется специализированное оборудование, инфраструктура и персонал, обученный молекулярной биологии, что ограничивает его применение специализированными лабораториями. Кроме того, это трудоемкий процесс (4-6 часов), не считая времени на транспортировку образцов в лабораторию, которая может занять5 дней. Эти ограничения препятствуют эффективной обработке проб и получению информации, необходимой для планирования действий в чрезвычайных ситуациях и эпидемиологического управления.
Изотермическая амплификация, опосредованная петлей обратной транскрипции (RT-LAMP), имеет ряд преимуществ по сравнению с ОТ-ПЦР, что делает ее привлекательной стратегией для разработки будущих диагностических тестов (POCT) в местах оказания медицинской помощи, особенно в условиях ограниченных ресурсов6. Во-первых, он очень специфичен, потому что использует от четырех до шести праймеров, которые распознают от шести до восьми областей в целевой последовательности, будь то ДНК или РНК 7,8. Во-вторых, поскольку он работает при постоянной температуре, он не требует сложного оборудования, такого как термоциклеры в реальном времени для создания усиления, а также не требует высококвалифицированного персонала для работы с ним. В-третьих, время реакции очень короткое (~ 60 мин), и используются реагенты, которые не очень специализированы, что делает его экономически эффективным инструментом6. Учитывая вышеизложенное и чрезвычайную ситуацию в области здравоохранения, вызванную пандемией COVID-19, этот метод можно рассматривать как альтернативный метод диагностики, который является быстрым, недорогим и простым в реализации в любой исследовательской лаборатории9.
Протокол стандартизации и реализации RT-LAMP для выявления SARS-CoV-2 колориметрическими методами с использованием амплификатора и водяной бани описан в данной статье (рисунок 1). Обсуждаются критические точки, их ограничения и альтернативы их преодоления.
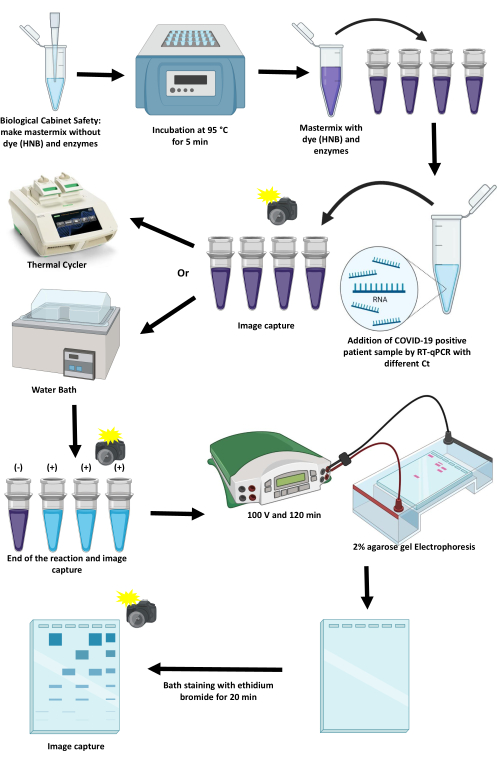
Рисунок 1: Схема протокола амплификации SARS-CoV-2 с использованием метода RT-LAMP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Используемые образцы были предоставлены клинической лабораторией университетской больницы Fundación Valle del Lili и соответствовали очищенной РНК пациентов с положительным результатом теста на COVID-19 с использованием метода ОТ-кПЦР. Все пациенты дали информированное согласие на проведение исследования, и это исследование было одобрено биоэтическим комитетом по исследованиям на людях из университетской больницы Fundación Valle del Lili.
1. Проектирование и подготовка грунтовки RT-LAMP
ПРИМЕЧАНИЕ: Праймеры LAMP можно использовать с различными платформами, включая New England BioLabs (NEB) LAMP, Primer Explorer и универсальный анализ LAMP (LAVA). Однако для этого протокола использовался инструмент NEB LAMP. Дизайн праймера может быть выполнен с использованием геномов SARS-CoV-2, полученных из базы данных NextStrain10. В таблице 1 приведен набор праймеров, используемый в этом протоколе.
- Проектирование грунтовки для LAMP
- Получение последовательностей вирусного генома.
- Выполните выравнивание последовательностей для получения согласованной последовательности.
- Перейдите к платформе11 инструмента проектирования грунтовки NEB LAMP и следуйте инструкциям в кратком руководстве. Этот инструмент дает те же результаты, что и Primer Explorer V5, но он гораздо более удобен в использовании. Используйте руководства пользователя Primer Explorer в качестве руководства по проектированию грунтовки.
- Термодинамическая оценка набора грунтовок
- С помощью инструмента Primer-Dimer12 выполните термодинамический анализ полученных грунтов.
- Поместите последовательности грунтовок в инструмент. Затем выберите опцию «Мультиплексный анализ» и «Отчет о структуре димера».
- Выберите наборы грунтовок, которые имеют ΔG не менее -5.
- Оценка специфичности проектируемых грунтовок
- Используйте базу данных Nucleotide collection (nt/nt) в BLAST13 для анализа каждого праймера.
- Чтобы выполнить первый анализ BLAST, выберите базу данных Refseq_rna и отфильтруйте поиск по группе родов, которые относятся к подсемейству Orthocoronavirinae. Это Alphacoronavirus (taxid:693996), Gammacoronavirus (taxid:694013) и Deltacoronavirus (taxid:1159901). Кроме того, оцените последовательность в сравнении с другими вирусами, которые циркулируют как подтип H1N1 (taxid:114727), вирус гриппа A (taxid:11320) и вирус гриппа B (taxid:11520).
- Чтобы выполнить второй анализ BLAST, выберите Betacoronavirus GenBank и отфильтруйте поиск по Coronaviridae (taxid:11118) и SARS (taxid:694009). Эти группы содержат последовательности всех идентифицированных геномов коронавируса SARS, включая геномы, обнаруженные у летучих мышей, Betacoronavirus (taxid:694002).
- Для этого протокола убедитесь, что праймеры не совпадают с геномами, отличными от целевого генома SARS-CoV-2.
- Подготовка грунтовки
- Открутите флаконы, содержащие иёфилизированные праймеры, с помощью микроцентрифуги (10 000 x g, 1 мин при комнатной температуре [RT]), чтобы избежать потерь при открытии пробирки.
- Регидратируйте иёфилизированный порошок в 0,1% диэтилпирокарбонате (DEPC) воде или воде без нуклеаз до конечной концентрации 100 мкМ (Таблица 2) и тщательно растворите путем пипетирования вверх и вниз. Затем вращайте с максимальной скоростью (10 000 x g, 1 мин при RT) в микроцентрифуге, чтобы собрать все растворы праймера на дне пробирки.
- Приготовьте 10-кратную грунтовочную смесь в биобезопасном шкафу с передним внутренним грунтовкой (FIP), обратной внутренней грунтовкой (BIP), передней наружной грунтовкой (F3), обратной наружной грунтовкой (B3), петлевой обратной (LB) и петлевой прямой (LF) грунтовками, как указано в таблице 2. Чтобы предотвратить потери, пипетируйте или осторожно нанесите раствор праймера перед выполнением быстрого отжима (10 000 x g, 1 мин при RT) с помощью микроцентрифуги.
- Хранить 10-кратную грунтовочную смесь при температуре −20 °C для длительного хранения; Тем не менее, подготовьтесь достаточно для максимум пяти экспериментов, независимо от нескольких образцов, чтобы избежать слишком большого количества циклов замораживания-размораживания.
ПРИМЕЧАНИЕ Если требуется меньший объем грунтовочной смеси, то скорректируйте значения, рассчитав новые объемы (Таблица 2). Кроме того, наборы RdRp и RdRp/Hel не включают праймер LF, поскольку для реакций RT-LAMP не требуются петлевые праймеры. В результате замените объем LF-праймера на воду, не содержащую нуклеаз, или 0,1% DEPC-воды.
2. Реакция RT-LAMP
- Включите шкаф с ламинарным потоком в соответствии с инструкциями производителя и подождите не менее 3 минут, чтобы поток воздуха стабилизировался.
- Как только поток воздуха стабилизируется, очистите и продезинфицируйте внутренние поверхности шкафа с помощью асептического метода. Для этого используйте следующие дезинфицирующие средства в следующем порядке: 1000 ppm четвертичного аммония (бензалкония хлорида), 2% гипохлорита, 3% перекиси водорода и 70% этанола.
ПРИМЕЧАНИЕ: В этом случае асептический метод предполагает нанесение дезинфицирующего средства и его удаление салфетками изнутри салона наружу, не проходя по ранее очищенным поверхностям. - Используя дезинфицирующие средства из шага 2.2, очистите материалы, которые будут поступать в кабину, в том же порядке.
ПРИМЕЧАНИЕ: В шкаф необходимо заносить микропипетки, коробки с фильтрующими наконечниками, колбы с пробирками объемом 1,5 мл и 0,6 мл, ПЦР-пробирки объемом 0,2 мл, штативы и стакан объемом 400 мл. - Возьмите с собой в каюту салфетки и нитриловые перчатки. После этого выключите шкаф и подвергните его воздействию ультрафиолетового (УФ) света в течение 15 минут.
ВНИМАНИЕ: Во избежание повреждения тканей и ДНК в результате длительного воздействия радиации избегайте ультрафиолетового излучения до истечения времени, указанного в шаге 2.4.
ПРИМЕЧАНИЕ Выполните сборку, показанную на рисунке 2 , перед началом протокола и начните водяную баню после завершения шага 2.4. Очень важно наполнить металлическую емкость почти до краев питьевой водой и установить температуру железной лабораторной нагревательной пластины на уровне 90 °C, так как это приведет к температуре ~66,3 °C в системе, которая контролируется ртутным термометром. - После окончания периода облучения перезапустите шкаф и следуйте рекомендациям в пункте 1.1.
- Поместите реагенты (Таблица 3, Таблица 4 и Таблица 5) в холодильник со льдом или небольшой холодильник из полистирола. Поместите контейнер в шкаф после очистки его 70% этанолом.
- В микроцентрифужной пробирке объемом 0,6 мл приготовьте смесь LAMP гена, подлежащего амплификации (RdRp, N-A и RdRp/Hel), добавив только следующие компоненты: 10x Buffer, MgSO4, dNTP, 1x смесь праймеров и воду без нуклеаз или 0,1% воды DEPC; Хорошо перемешайте с помощью пипетки для гомогенизации.
ВНИМАНИЕ: Из-за неправильного обращения и поведения внутри шкафа существует высокий риск загрязнения реагентами. Для смягчения этой проблемы необходимо соблюдать следующие правила: (i) используйте стерильные и фильтрующие наконечники; (ii) использовать один наконечник для каждого реагента; (iii) двигайтесь медленно и осторожно, чтобы не нарушить ламинарный поток; (iv) следить за порядком и использовать как можно меньше материалов; и (v) использовать различные перчатки для приготовления смеси и добавления генетического материала.
ПРИМЕЧАНИЕ: Храните все реагенты, особенно ферменты, на льду, потому что изменения температуры могут денатурировать их и изменить активность полимеразы. - Поместите пробирку (пробирки) объемом 0,6 мл с закрытой крышкой в нагревательный блок и инкубируйте при температуре 95 °C в течение 5 минут.
ПРИМЕЧАНИЕ: Перед началом приготовления смеси LAMP включите нагревательный блок для трубок объемом 1,5-2,0 мл, расположенный снаружи шкафа, не менее чем за 30 минут и контролируйте температуру (95 °C) ртутным или спиртовым термометром. - Когда инкубация будет завершена, поместите пробирки в охладитель из полистирола со льдом на 5 минут.
- Верните трубки в ламинарный шкаф и завершите приготовление смеси LAMP, добавив ферменты ДНК-полимеразу (Bst 3.0), обратную транскриптазу и высокоточную ДНК-полимеразу (Таблица 3, Таблица 4 и Таблица 5). В случае использования колориметрического детектирования добавляют краситель гидроксинафтол синий (HNB).
- После добавления этих реагентов очень хорошо перемешайте реагенты LAMP, пипетируя их для растворения ферментов и красителя.
- Заполните каждую пробирку ПЦР 22,0 μл смеси, стараясь не создавать пузырьков. Затем добавьте 3,0 мкл 0,1% воды DEPC или воды, не содержащей нуклеаз, в отрицательный контрольный или пробирочный контроль без матрицы (NTC) и отложите оставшуюся пробирку (пробирки) для добавления (генетического материала).
ПРИМЕЧАНИЕ: Храните пробирки для ПЦР в холодильнике, наполненном льдом, до тех пор, пока образец не будет добавлен, чтобы избежать активации фермента Bst 3.0 и преждевременного начала реакции. - Удалите все материалы из шкафа и используйте 70% этанол для очистки поверхностей. Затем выключите его, следуя инструкциям производителя.
- В отдельной области добавьте по 3 мкл образца в каждую ПЦР-пробирку и тщательно гомогенизируйте ее. Для этого используйте микропипетку объемом 20 мкл и фильтрующие наконечники.
ВНИМАНИЕ: Микропипетка, используемая для добавления генетического материала, должна использоваться исключительно для этой цели и не может использоваться для приготовления смеси. Таким образом, предотвращается загрязнение реагентов. Кроме того, постоянно держите образцы РНК на льду, чтобы снизить вероятность деградации РНК. Используйте следующие средства индивидуальной защиты (СИЗ) для добавления образца: одноразовый халат, шапочку, маску N95, леггинсы, лабораторные очки и нитриловые перчатки. - Перед проведением колориметрической реакции сделайте фотографии ПЦР-пробирок с помощью высококачественной камеры. Исходный цвет с HNB — фиолетовый.
- Реакцию проводят в следующей системе или оборудовании: (i) термоамплификаторе и (ii) водяной бане.
- Термоамплификатор: Поместите трубки в реакционный блок и установите термопрофиль (см. Таблицу 6) на оборудовании.
- Водяная баня: Поместите трубки в круглые контейнеры и очень хорошо отрегулируйте их, чтобы они не вышли. После этого поместите емкости на водяную баню (рисунок 2А, В) при температуре, указанной в таблице 6.
- В случае водяной бани, как только трубки окажутся внутри системы, запустите таймер на 60 минут (Таблица 6).
- Извлеките трубки из термоамплификатора или водяной бани после времени реакции и храните их при температуре 4 °C для электрофоретического цикла или при −20 °C до использования.
- Если проводилась колориметрическая реакция, сделайте фотографии пробирок ПЦР с помощью высококачественной камеры. Итоговый цвет с HNB — небесно-голубой.
3. Анализ продуктов амплификации в агарозном геле
ПРИМЕЧАНИЕ: Эти шаги предлагаются в качестве дополнительных проверок колориметрической реакции или контроля производительности на этапе стандартизации. Это связано с тем, что этот метод может представлять огромный риск загрязнения для лаборатории, проводящей эти тесты.
- Поместите ложе внутрь камеры электрофореза так, чтобы краевые резинки касались стенок, создавая герметичное пространство для добавления агарозы (внутреннюю камеру) (рисунок 3А, Б).
- После выполнения шага 3.1 взвесьте необходимое количество агарозы в стакане объемом 500 мл для получения 2% геля. После этого добавьте необходимый объем 0,5x Трис-ацетат ЭДТА (ТАЕ) буфер и разогрейте в микроволновой печи на 1-2 минуты.
ПРИМЕЧАНИЕ: Агароза полностью плавится, когда она полупрозрачна, и без комков при извлечении из духовки. Если это не подтвердится, могут остаться плохо гелеобразные участки, что приведет к изменению электрофоретического цикла и визуализации продуктов усиления. - Достаньте стакан из духовки и вылейте агарозу во внутреннюю камеру, созданную на шаге 3.1 (рисунок 3C). Впоследствии проверьте, чтобы пузырьков не было, и если они есть, удалите их с помощью наконечника для микропипетки.
- Разложите гребень так, чтобы образовались лунки, и оставьте агарозу до состояния геля примерно на 30 минут при комнатной температуре (RT).
- По истечении этого времени добавьте 5 мл 0,5x TAE буфера, чтобы облегчить удаление расчесок и ложа, содержащего гель. Затем расположите гель таким образом, чтобы лунки находились в аноде (рисунок 3D).
- Заполните камеру электрофореза 0,5x буфером TAE до емкости, указанной производителем, убедившись, что электроды находятся в контакте с буфером.
- Добавьте 3 мкл маркера молекулярной массы в первую лунку геля и добавьте 9 мкл NTC и каждый образец в следующие лунки. Сделайте это, соединив 7 мкл продукта амплификации с 3 мкл загрузочного буфера; затем загрузите 9 μL этой смеси в лунки геля.
- Накройте камеру электрофореза крышкой и подключите кабели к портам питания в цвете. Установите источник питания на следующие параметры: 100 В и постоянную силу тока в течение 120 мин.
- После завершения электрофоретического прогона поместите гель в емкость с окрашивающим раствором (бромидом этидия) и инкубируйте в течение 30 минут.
- После инкубации извлеките гель из окрашивающего раствора и поместите его в пакет с застежкой-молнией. Это предотвращает загрязнение оборудования, которое будет использоваться для визуализации ампликонов.
- Визуализируйте гель на трансиллюминаторе или тепловизоре, таком как Amersham Imager 600.
Результаты
Реализация протокола начинается с разработки набора праймеров для каждого гена-мишени в соответствии с описанным выше протоколом. В июне 2020 года из базы данных NextStrain было получено 5 000 геномов SARS-CoV-2, репрезентативность которых составила 10% от колумбийских геномов. Эти последовательнос?...
Обсуждение
Несмотря на то, что RT-LAMP рассматривается как дополнительная методология для выполнения молекулярной диагностики, она также имеет некоторые ограничения и критические шаги, которые необходимо учитывать при стандартизации и внедрении протокола.
В рамках стандартизации LAM...
Раскрытие информации
Наталья Кампильо-Педроза является генеральным директором компании BioDx: Diagnóstico y Soluciones Biotecnológicas S.A.S. Остальные авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа финансировалась Генеральной системой королевских прав (Sistema General de Regalías) из Колумбии, грант номер BPIN 2020000100092, и Universidad Icesi – Convocatoria Interna, грант No CA0413119. MFVT также финансировался из фондов доцентов Андского университета. Финансирующие организации не принимали участия в разработке, выполнении мероприятий, сборе данных, анализе данных и подготовке рукописи. Выражаем благодарность Университетской больнице Fundación Valle del Lili за вирусную РНК из образцов Sars-CoV-2 и доктору Альваро Баррере-Окампо за комментарии к рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 kb DNA Ladder | SOLIS BIODYNE | 07-12-00050 | Store at -20 °C |
| 50x TAE Electrophoresis Buffer | ThermoScientific | B49 | Store at roome temperature |
| Accuris High Fidelity Polymerase | ACCURIS LIFE SCIENCE REAGENTS | PR1000-HF-200 | It can be used in case Q5 High-Fidelity DNA polymerase cannot be purchased. For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Agarose | PanReacAppliChem | A8963,0100 | N/A |
| Bst 3.0 DNA Polymerase 8000 IU/mL | New England BioLabs | M0374S/M0374L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Deoxynucleotide (dNTP) Solution Set | New England BioLabs | N0446S | Store at -20 °C |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220-25G | Handle it with caution under an extraction cabinet |
| GeneRuler 100 bp Plus DNA Ladder, ready-to-use | ThermoScientific | SM0322 | Store at -20 °C |
| Hydroxy naphthol blue disodium salt | Santa Cruz Biotechnology | sc-215156B | N/A |
| Q5 High-Fidelity DNA polymerase 2000 IU/mL | New England BioLabs | M0491S/M0491L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| WarmStart RTx Reverse Transcriptase 15000 IU/mL | New England BioLabs | M0380S/M0380L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
Ссылки
- World Health Organization. . Who coronavirus (COVID-19) dashboard (no date). , (2023).
- Ibrahim, N. K. Epidemiologic surveillance for controlling Covid-19 pandemic: types, challenges and implications. Journal of Infection and Public Health. 13 (11), 1630-1638 (2020).
- Rojas-Gallardo, D. M., et al. COVID-19 in Latin America: Contrasting phylodynamic inference with epidemiological surveillance. (Molecular epidemiology of COVID-19 in Latin America). medRxiv. , (2020).
- Liu, R., et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clinica Chimica Acta. 505, 172-175 (2020).
- Kevadiya, B. D., et al. Diagnostics for SARS-CoV-2 infections. Nature Materials. 20 (5), 593-605 (2021).
- Tomita, N., Mori, Y., Kanda, H., Notomi, T. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature Protocols. 3 (5), 877-882 (2008).
- Li, Y., Fan, P., Zhou, S., Zhang, L. Loop-mediated isothermal amplification (LAMP): A novel rapid detection platform for pathogens. Microbial Pathogenesis. 107, 54-61 (2017).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects. Journal of Microbiology. 53 (1), 1-5 (2015).
- Augustine, R., et al. Loop-mediated isothermal amplification (LAMP): A rapid, sensitive, specific, and cost-effective point-of-care test for coronaviruses in the context of COVID-19 pandemic. Biology (Basel). 9 (8), 182 (2020).
- . Nextstrain Available from: https://nextstrain.org/ (2023)
- . Neb Lamp, NEB LAMP Available from: https://lamp.neb.com/ (2023)
- . Blast: Basic local alignment search tool (no date) Available from: https://blast.ncbi.nlm.nih.gov/ (2023)
- Zhang, Y., et al. Rapid molecular detection of SARS-CoV-2 (COVID-19) virus RNA using colorimetric LAMP. medRxiv. , (2020).
- Lu, R., et al. Development of a novel reverse transcription loop-mediated isothermal amplification method for rapid detection of SARS-CoV-2. Virologica Sinica. 35 (3), 344-347 (2020).
- Najafov, A., Hoxhaj, G. . PCR Guru. , (2017).
- Zhang, Y., et al. Enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride. Biotechniques. 69 (3), 178-185 (2020).
- Ramírez-Chavarría, R. G., et al. Automatic analysis of isothermal amplification via impedance time-constant-domain spectroscopy: A SARS-CoV-2 case study. Chemosensors. 11 (4), 230 (2023).
- Haque, M. F. U., et al. A novel RdRp-based colorimetric RT-LAMP assay for rapid and sensitive detection of SARS-CoV-2 in clinical and sewage samples from Pakistan. Virus Research. 302, 198484 (2021).
- Donia, A., et al. Integration of RT-LAMP and microfluidic technology for detection of SARS-CoV-2 in wastewater as an advanced point-of-care platform. Food and Environmental Virology. 14, 364-373 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены