需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过逆转录环介导的等温扩增检测 SARS-CoV-2 病毒
摘要
在这里,我们提供了一个完整的协议,用于标准化和实施通过逆转录环介导的等温扩增 (RT-LAMP) 检测人类样本中 SARS-CoV-2 病毒的方法。这种方法在 60 分钟内完成,可以以低成本和廉价的设备适用于任何实验室或护理点。
摘要
严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 病毒对人类健康产生了巨大影响。它仍然是对现代社会的威胁,因为许多人因感染而死亡。该疾病通过血清学和分子检测进行诊断,例如金标准实时聚合酶链反应 (RT-PCR)。后者有几个缺点,因为它需要专门的基础设施、昂贵的设备和训练有素的人员。在这里,我们提出了一种协议,概述了在人类样本中使用逆转录环介导的等温扩增 (RT-LAMP) 检测 SARS-CoV-2 病毒所需的步骤。该方案包括 计算机模拟设计引物、制备试剂、扩增和可视化的说明。一旦标准化,这种方法可以在 60 分钟内以低成本和廉价的设备轻松实施并适应任何实验室或护理点。它适用于检测不同的病原体。因此,它有可能在现场和卫生中心使用,以开展及时的流行病学监测。
引言
严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 导致 2019 冠状病毒病 (COVID-19)。世界卫生组织于 2020 年 1 月 30 日宣布为国际关注的突发公共卫生事件,并于 2020 年 3 月 11 日宣布为大流行。截至本文撰写之日,大流行已导致超过 7.6 亿例病例和 687 万人死亡1.
这种病毒的影响凸显了需要更好、更准确、更快和更广泛可用的监测工具,以改善传染病的检测和控制2,3。在大流行期间,SARS-CoV-2 诊断测试基于检测核酸、抗体和蛋白质,但核酸的 RT-PCR 检测是金标准4。然而,RT-PCR有一些局限性;它需要专门的设备、基础设施和接受过分子生物学培训的人员,将其应用限制在专业实验室。此外,它很耗时(4-6 小时),不包括将标本运送到实验室的时间,这可能需要第5 天。这些制约因素妨碍了有效的样本处理和获取应急计划和流行病学管理所需的信息。
与RT-PCR相比,逆转录环介导的等温扩增(RT-LAMP)具有多项优势,使其成为设计未来即时诊断检测(POCT)的有吸引力的策略,特别是在资源有限的环境中6。首先,它具有极强的特异性,因为它使用四到六个引物来识别靶序列中的六到八个区域,无论是 DNA 还是 RNA 7,8。其次,由于它在恒定温度下运行,因此不需要复杂的设备(如实时热循环仪)来产生扩增,也不需要训练有素的人员来操作。第三,反应时间很短(~60 min),并且采用了不是很专业的试剂,这使其成为一种具有成本效益的工具6.鉴于上述情况以及 COVID-19 大流行造成的突发卫生事件,该技术可以被视为一种替代诊断方法,该方法快速、廉价且易于在任何研究实验室中实施9.
本文描述了标准化和实施RT-LAMP以使用热循环仪和水浴通过比色法检测SARS-CoV-2的协议(图1)。讨论了关键点、它们的局限性以及推进这些临界点的替代方案。
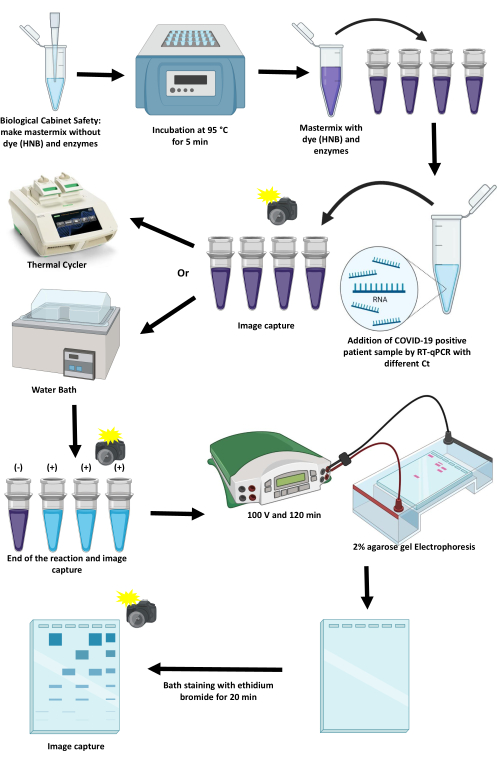
图 1:使用 RT-LAMP 技术扩增 SARS-CoV-2 的方案。 请点击这里查看此图的较大版本.
研究方案
使用的样本由 Fundación Valle del Lili 大学医院的临床实验室提供,对应于 使用 RT-qPCR 技术检测出 COVID-19 阳性的患者的纯化 RNA。所有患者都为研究提供了知情同意书,该研究得到了 Fundación Valle del Lili 大学医院的人类研究生物伦理委员会的批准。
1. RT-LAMP底漆设计与制备
注:LAMP 引物可用于多种平台,包括 New England BioLabs (NEB) LAMP、Primer Explorer 和 LAMP assay versatile analysis (LAVA)。但是,对于此协议,使用了NEB LAMP工具。可以使用从 NextStrain 数据库10 获得的 SARS-CoV-2 基因组进行引物设计。 表1 显示了该协议中使用的引物组。
- LAMP的底漆设计
- 获取病毒基因组序列。
- 执行序列比对以获得共识序列。
- 导航到 NEB LAMP 引物设计工具平台11,并按照快速指南中的说明进行操作。该工具产生与引物探索器 V5 相同的结果,但它的输出更加人性化。使用引物浏览器用户手册作为引物设计的指南。
- 引物组的热力学评价
- 使用Primer-Dimer12 工具对获得的引物进行热力学分析。
- 将引物序列放入工具中。然后,选择选项 多路复用分析和二聚体结构报告。
- 选择ΔG不小于-5的引物组。
- 设计引物的特异性评价
- 使用 BLAST13 中的核苷酸收集 (nt/nt) 数据库分析每种引物。
- 要执行第一次 BLAST 分析,请选择 Refseq_rna 数据库,并使用属于 Orthocoronavirinae 亚科的属组过滤搜索。它们是阿尔法冠状病毒(taxid:693996)、γcoronavirus(taxid:694013)和Deltacoronavirus(taxid:1159901)。此外,评估针对作为 H1N1 亚型 (taxid:114727)、甲型流感病毒 (taxid:11320) 和乙型流感病毒 (taxid:11520) 共同传播的其他病毒的序列。
- 要执行第二次BLAST分析,请选择Betacoronavirus GenBank,并使用Coronaviridae(taxid:11118)和SARS(taxid:694009)过滤搜索。这些组包含所有已确定的SARS冠状病毒基因组的序列,包括在蝙蝠中发现的基因组,Betacoronavirus(taxid:694002)。
- 对于该协议,请确保引物与目标基因组 SARS-CoV-2 以外的基因组不一致。
- 引物制备
- 用微量离心机(10,000× g,室温[RT]下1分钟)旋转含有Iyophilized引物的小瓶,以避免在管打开期间损失。
- 将Iyophilized粉末在0.1%焦碳酸二乙酯(DEPC)水或无核酸酶水中再水化至终浓度为100μM(表2),并通过上下移液彻底溶解。然后,在微量离心机中以最大速度(10,000× g,室温下1分钟)旋转,以收集管底部的所有引物溶液。
- 如 表2所示,在生物安全柜下使用前向内引物(FIP)、后向内引物(BIP)、前向外引物(F3)、后向引物(B3)、环向后(LB)和环前向(LF)引物制备10x引物混合物。为防止损失,在用微量离心机进行快速旋转(10,000× g,室温下1分钟)之前,移液管或轻轻涡旋引物溶液。
- 将10x引物混合物储存在−20°C下以进行长期储存;但是,无论使用多个样品,都应为最多五次实验做好准备,以避免过多的冻融循环。
注意:如果需要较小体积的引物混合物,则通过计算新体积来调整值(表2)。此外,RdRp 和 RdRp/Hel 组不包括 LF 引物,因为 RT-LAMP 反应不需要环引物。因此,用无核酸酶水或0.1%DEPC水替换LF引物的体积。
2. RT-LAMP反应
- 根据制造商的说明打开层流柜,并等待至少 3 分钟,让气流稳定下来。
- 一旦气流稳定,使用无菌技术清洁和消毒机柜的内表面。为此,请按以下顺序使用以下消毒剂:1000 ppm 季铵(苯扎氯铵)、2% 次氯酸盐、3% 过氧化氢和 70% 乙醇。
注意:在这种情况下,无菌技术需要涂抹消毒剂并用餐巾纸从机舱内部到外部将其清除,而无需经过先前清洁过的表面。 - 使用步骤 2.2 中的消毒剂,以相同的顺序清洁将进入机舱的材料。
注意:必须将微量移液器、过滤吸头盒、带有 1.5 mL 和 0.6 mL 试管的烧瓶、0.2 mL PCR 管、支架和 400 mL 烧杯带入机柜。 - 将一些餐巾纸和丁腈手套带入机舱。之后,关闭机柜并将其暴露在紫外线 (UV) 下 15 分钟。
注意:为避免长时间暴露于辐射造成的组织和 DNA 损伤,请在步骤 2.4 中设定的时间到期之前避免使用紫外线。
注意:在开始协议之前执行 图 2 中所示的组装,并在完成步骤 2.4 后开始水浴。至关重要的是,将金属容器装满饮用水,并将铁实验室加热板的温度设置为 90 °C,因为这将导致系统中的温度为 ~66.3 °C,使用水银温度计进行监测。 - 辐照期结束后,重新启动机柜并按照步骤 1.1 中的建议进行操作。
- 将试剂(表3、表4和 表5)置于充满冰的冷却器或小型聚苯乙烯冰箱中。用 70% 乙醇清洁后将容器放入柜内。
- 在 0.6 mL 微量离心管中,制备待扩增基因的 LAMP 混合物(RdRp、N-A 和 RdRp/Hel),仅加入以下组分:10x 缓冲液、MgSO4、dNTP、1x 引物混合物和无核酸酶水或 0.1% DEPC 水;通过移液使均匀混合。
注意:由于机柜内的处理和行为不当,试剂污染的风险很高。为了缓解这个问题,必须遵循以下规则:(i) 使用无菌和过滤吸头;(ii) 每种试剂使用一个吸头;(iii) 缓慢而小心地移动,以避免破坏层流;(iv) 维持秩序并使用最少的材料;(v)使用不同的手套制备混合物并添加遗传物质。
注意:将所有试剂(尤其是酶)放在冰上,因为温度变化会使它们变性并改变聚合酶活性。 - 将 0.6 mL 管(s)盖子关闭放入加热块中,并在 95 °C 下孵育 5 分钟。
注意: 在开始 LAMP 混合物制备之前,打开位于机柜外的 1.5-2.0 mL 管的加热块至少 30 分钟,并使用水银或酒精温度计监测温度 (95 °C)。 - 孵育完成后,将试管放入充满冰的聚苯乙烯冷却器中5分钟。
- 将试管返回到层流柜中,并通过添加酶DNA聚合酶(Bst 3.0),逆转录酶和高保真DNA聚合酶完成LAMP混合物制备(表3,表4和 表5)。在使用比色检测的情况下,加入染料羟氧西酚蓝(HNB)。
- 加入这些试剂后,通过移液将 LAMP 试剂充分混合,以溶解酶和染料。
- 用 22.0 μL 混合物填充每个 PCR 管,注意不要产生气泡。然后,将 3.0 μL 0.1% DEPC 水或无核酸酶水加入阴性对照或管无模板对照 (NTC) 中,并留出剩余的管用于添加(遗传物质)。
注意:将PCR管保持在充满冰的冷却器中,直到添加样品,以避免激活 Bst 3.0酶并过早开始反应。 - 从机柜中取出所有材料,并使用 70% 乙醇清洁表面。然后按照制造商的说明将其关闭。
- 在单独的区域中,将 3 μL 样品添加到每个 PCR 管中并彻底均一化。使用 20 μL 微量移液器和过滤器吸头来实现此目的。
注意:用于添加遗传物质的微量移液器必须专门用于此目的,不能用于制备混合物。通过这种方式,可以避免试剂的污染。此外,始终将 RNA 样品放在冰上,以减少 RNA 降解的可能性。使用以下个人防护设备 (PPE) 添加样品:一次性防护服、帽子、N95 口罩、紧身裤、实验室护目镜和丁腈手套。 - 在进行比色反应之前,用高质量相机拍摄PCR管的照片。HNB 的起始颜色是紫罗兰色。
- 在以下系统或设备中进行反应:(i) 热循环仪和 (ii) 水浴。
- 热循环仪:将试管放入反应块中,并在设备上设置热分布仪(见 表6)。
- 水浴:将管子放入圆形容器中,并很好地调整它们以防止它们流出。之后,将容器置于水浴中(图2A,B),温度为表6中列出的温度。
- 在水浴的情况下,一旦管子进入系统内部,启动计时器 60 分钟(表 6)。
- 反应时间后,从热循环仪或水浴中取出试管,并将它们储存在4°C进行电泳运行,或储存在-20°C直至使用。
- 如果进行了比色反应,则使用高质量相机拍摄PCR管的照片。HNB的最终颜色是天蓝色。
3. 琼脂糖凝胶中扩增产物的分析
注:建议将这些步骤作为在标准化步骤中对比色反应或性能控制的附加检查。这是因为该技术可能会给进行这些测试的实验室带来巨大的污染风险。
- 将床放在电泳室内,使边缘橡胶接触壁,从而为添加琼脂糖(内室)形成一个密封空间(图3A,B)。
- 完成步骤 3.1 后,在 500 mL 烧杯中称量所需量的琼脂糖以获得 2% 凝胶。之后,加入所需体积的0.5x Tris-乙酸EDTA(TAE)缓冲液和微波炉1-2分钟。
注意:琼脂糖在从烤箱中取出时是半透明且无结块时会完全熔化。如果这一点没有得到证实,可能会留下凝胶不良的区域,导致电泳运行和扩增产物的可视化发生变化。 - 将烧杯从烤箱中取出,将琼脂糖倒入步骤3.1中创建的内腔中(图3C)。随后,检查是否没有气泡,如果有,请使用微量移液器吸头将其去除。
- 布置梳子形成孔,并将琼脂糖在室温(RT)下凝胶约30分钟。
- 在此时间之后,加入 5 mL 的 0.5x TAE 缓冲液以利于去除梳子和含有凝胶的床。然后以使孔位于阳极中的方式放置凝胶(图3D)。
- 用0.5x TAE缓冲液填充电泳室至制造商指定的容量,确保电极与缓冲液接触。
- 向凝胶的第一个孔中加入 3 μL 分子量标记物,并将 9 μL NTC 和每个样品加入到下一个孔中。通过将 7 μL 扩增产物与 3 μL 上样缓冲液混合来制备这些样品;然后将 9 μL 该混合物加载到凝胶的孔中。
- 用盖子盖住电泳室,并以颜色图案将电缆连接到电源端口。将电源设置为以下参数:100 V 和恒定 amp120 分钟。
- 电泳运行完成后,将凝胶放入装有染色溶液(溴化乙锭)的容器中,孵育30分钟。
- 孵育后,从染色溶液中取出凝胶,并将其放入拉链袋中。这样可以防止用于可视化扩增子的设备受到污染。
- 在透射仪或成像仪(如 Amersham Imager 600)上观察凝胶。
结果
该协议的实施首先要按照上述协议为每个靶基因设计一组引物。2020 年 6 月,从 NextStrain 数据库获得了 5,000 个 SARS-CoV-2 基因组,哥伦比亚基因组的代表性为 10%。对这些序列进行比对,以获得引物设计过程中使用的共识序列。 表 1 显示了为引物 RdRp/Hel 和 RdRp 选择的引物组。基因 N 扩增的引物组来自先前发表的报告14。
协议标准化的第一步是避免N...
讨论
尽管RT-LAMP被认为是执行分子诊断的补充方法,但它也有一些局限性和关键步骤,在标准化和实施协议时必须考虑这些限制和关键步骤。
用于检测 SARS-CoV-2 的 LAMP 标准化评估了预混液中的以下参数和成分:(a) 引物的浓度和比对温度;(b) 酶的浓度;(c) 镁浓度;(d) 反应时间;(e) 含有BSA、DMSO、氯化胍等添加剂;(f) 引物的设计;(g) 添加着色剂;(h) 使用内部生产的反?...
披露声明
纳塔利娅·坎皮略-佩德罗萨(Natalia Campillo-Pedroza)是BioDx: Diagnóstico y Soluciones Biotecnológicas S.A.S.公司的首席执行官。其余作者声明没有利益冲突。
致谢
这项工作由哥伦比亚的Sistema General de Regalías资助,资助号为BPIN 2020000100092,Universidad Icesi - Convocatoria Interna,资助号为CA0413119。MFVT还得到了安第斯大学的助理教授基金的资助。资助实体没有参与手稿的设计、活动执行、数据收集、数据分析和准备。我们感谢 Valle del Lili 大学医院提供来自 SARS -CoV-2 样本的病毒 RNA,并感谢 Alvaro Barrera-Ocampo 博士对手稿的评论。
材料
| Name | Company | Catalog Number | Comments |
| 1 kb DNA Ladder | SOLIS BIODYNE | 07-12-00050 | Store at -20 °C |
| 50x TAE Electrophoresis Buffer | ThermoScientific | B49 | Store at roome temperature |
| Accuris High Fidelity Polymerase | ACCURIS LIFE SCIENCE REAGENTS | PR1000-HF-200 | It can be used in case Q5 High-Fidelity DNA polymerase cannot be purchased. For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Agarose | PanReacAppliChem | A8963,0100 | N/A |
| Bst 3.0 DNA Polymerase 8000 IU/mL | New England BioLabs | M0374S/M0374L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Deoxynucleotide (dNTP) Solution Set | New England BioLabs | N0446S | Store at -20 °C |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220-25G | Handle it with caution under an extraction cabinet |
| GeneRuler 100 bp Plus DNA Ladder, ready-to-use | ThermoScientific | SM0322 | Store at -20 °C |
| Hydroxy naphthol blue disodium salt | Santa Cruz Biotechnology | sc-215156B | N/A |
| Q5 High-Fidelity DNA polymerase 2000 IU/mL | New England BioLabs | M0491S/M0491L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| WarmStart RTx Reverse Transcriptase 15000 IU/mL | New England BioLabs | M0380S/M0380L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
参考文献
- World Health Organization. . Who coronavirus (COVID-19) dashboard (no date). , (2023).
- Ibrahim, N. K. Epidemiologic surveillance for controlling Covid-19 pandemic: types, challenges and implications. Journal of Infection and Public Health. 13 (11), 1630-1638 (2020).
- Rojas-Gallardo, D. M., et al. COVID-19 in Latin America: Contrasting phylodynamic inference with epidemiological surveillance. (Molecular epidemiology of COVID-19 in Latin America). medRxiv. , (2020).
- Liu, R., et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clinica Chimica Acta. 505, 172-175 (2020).
- Kevadiya, B. D., et al. Diagnostics for SARS-CoV-2 infections. Nature Materials. 20 (5), 593-605 (2021).
- Tomita, N., Mori, Y., Kanda, H., Notomi, T. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature Protocols. 3 (5), 877-882 (2008).
- Li, Y., Fan, P., Zhou, S., Zhang, L. Loop-mediated isothermal amplification (LAMP): A novel rapid detection platform for pathogens. Microbial Pathogenesis. 107, 54-61 (2017).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects. Journal of Microbiology. 53 (1), 1-5 (2015).
- Augustine, R., et al. Loop-mediated isothermal amplification (LAMP): A rapid, sensitive, specific, and cost-effective point-of-care test for coronaviruses in the context of COVID-19 pandemic. Biology (Basel). 9 (8), 182 (2020).
- . Nextstrain Available from: https://nextstrain.org/ (2023)
- . Neb Lamp, NEB LAMP Available from: https://lamp.neb.com/ (2023)
- . Blast: Basic local alignment search tool (no date) Available from: https://blast.ncbi.nlm.nih.gov/ (2023)
- Zhang, Y., et al. Rapid molecular detection of SARS-CoV-2 (COVID-19) virus RNA using colorimetric LAMP. medRxiv. , (2020).
- Lu, R., et al. Development of a novel reverse transcription loop-mediated isothermal amplification method for rapid detection of SARS-CoV-2. Virologica Sinica. 35 (3), 344-347 (2020).
- Najafov, A., Hoxhaj, G. . PCR Guru. , (2017).
- Zhang, Y., et al. Enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride. Biotechniques. 69 (3), 178-185 (2020).
- Ramírez-Chavarría, R. G., et al. Automatic analysis of isothermal amplification via impedance time-constant-domain spectroscopy: A SARS-CoV-2 case study. Chemosensors. 11 (4), 230 (2023).
- Haque, M. F. U., et al. A novel RdRp-based colorimetric RT-LAMP assay for rapid and sensitive detection of SARS-CoV-2 in clinical and sewage samples from Pakistan. Virus Research. 302, 198484 (2021).
- Donia, A., et al. Integration of RT-LAMP and microfluidic technology for detection of SARS-CoV-2 in wastewater as an advanced point-of-care platform. Food and Environmental Virology. 14, 364-373 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。