A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فرز الخلية الواحدة للخلايا الجذعية الوسيطة المناعية من الأسنان اللبنية المقشرة البشرية
In This Article
Summary
يصف هذا البروتوكول استخدام فرز الخلايا المنشطة بالتألق للخلايا الجذعية الوسيطة البشرية باستخدام طريقة فرز الخلية الواحدة. على وجه التحديد ، يمكن أن يحقق استخدام الفرز أحادي الخلية نقاء 99٪ من الخلايا المناعية من مجموعة غير متجانسة عند دمجها مع نهج قائم على قياس التدفق الخلوي متعدد المعلمات.
Abstract
تمتلك الخلايا الجذعية الوسيطة (MSCs) للكائن الحي قدرة غير عادية على التمايز إلى سلالات متعددة من الخلايا البالغة في الجسم وهي معروفة بخصائصها المناعية والمضادة للالتهابات. يعد استخدام هذه الخلايا الجذعية نعمة لمجال البيولوجيا التجديدية ، ولكنه في الوقت نفسه لعنة على الطب التجديدي والعلاجات بسبب الغموض الخلوي المتعدد المرتبط بها. قد ينشأ هذا الغموض من التنوع في مصدر هذه الخلايا الجذعية ومن ظروف نموها في المختبر ، وكلاهما ينعكس على عدم تجانسها الوظيفي.
وهذا يستدعي منهجيات لتوفير مجموعات نقية ومتجانسة من MSCs للتطبيقات العلاجية. مكن التقدم في مجال قياس التدفق الخلوي من اكتشاف مجموعات الخلية المفردة باستخدام نهج متعدد المعلمات. يحدد هذا البروتوكول طريقة لتحديد وتنقية الخلايا الجذعية من الأسنان اللبنية المقشرة البشرية (SHEDs) من خلال فرز الخلية المفردة بمساعدة الفلورة. حدد التعبير المتزامن للعلامات السطحية ، وهي CD90-fluorescein isothiocyanate (FITC) ، CD73-peridinin-chlorophyll-protein (PerCP-Cy5.5) ، CD105-allophycocyanin (APC) ، و CD44-V450 ، التعبيرات الإيجابية "الساطعة" ل MSCs باستخدام قياس التدفق الخلوي متعدد المعلمات. ومع ذلك ، لوحظ انخفاض كبير في النسب المئوية للتعبيرات الرباعية لهذه العلامات الموجبة من المقطع 7 فصاعدا إلى المقاطع اللاحقة.
تم فرز المجموعات السكانية الفرعية ذات النمط المناعي باستخدام وضع الفرز أحادي الخلية حيث شكلت علامتان موجبتان وعلامة سلبية واحدة فقط معايير التضمين. ضمنت هذه المنهجية صلاحية الخلية للسكان الذين تم فرزهم وحافظت على تكاثر الخلايا بعد الفرز. يمكن استخدام تطبيق المصب لمثل هذا الفرز لتقييم التمايز الخاص بالنسب للمجموعات السكانية الفرعية المسورة. يمكن تطبيق هذا النهج على أنظمة الخلية المفردة الأخرى لتحسين ظروف العزل والحصول على معلومات علامات سطح الخلية المتعددة.
Introduction
يمكن اعتبار الخلايا الجذعية الوسيطة (MSCs) مصدرا قابلا للتطوير للخلايا المناسبة للعلاجات القائمة على الخلايا ويمكن اعتبارها نظاما قياسيا ذهبيا في الطب التجديدي. يمكن عزل هذه الخلايا من مجموعة متنوعة من المصادر في الجسم بأصول أنسجة مختلفة1. اعتمادا على أنسجة المصدر ، يعرض كل نوع من أنواع MSC سلوكا غامضا في المختبر 2. ويلاحظ هذا بشكل جيد في خصائصها المورفولوجية والوظيفية3. أظهرت دراسات متعددة تباينا داخل النسيل في الأبعاد ، بما في ذلك تمايز الأنسجة البالغة ، والحالة الجينومية ، والبنية الأيضية والخلوية ل MSCs 2,4.
كان التنميط المناعي للخلايا تطبيقا شائعا لقياس التدفق الخلوي لتحديد الخلايا الجذعية ، وقد تم استخدام ذلك من قبل الجمعية الدولية للعلاج بالخلايا والجينات (ISCT) في عام 2006 لوصف قائمة بالمعايير الدنيا لتحديد الخلايا على أنها MSCs. وذكر أنه إلى جانب الالتصاق البلاستيك والقدرة على التمايز إلى ثلاث سلالات (عظمية المنشأ ، غضروفية ، ودهنية) في المختبر ، يجب أن يعبر ≥95٪ من سكان الخلايا عن CD105 و CD73 و CD90 ، ويجب أن تفتقر هذه الخلايا إلى التعبير (≤2٪ إيجابي) ل CD34 و CD45 و CD11b و CD14 و HLA-DR ، كما تم قياسها بواسطة قياس التدفقالخلوي 5. على الرغم من أن MSCs تم تعريفها بواسطة مجموعة من المؤشرات الحيوية بموجب الحد الأدنى من معايير ISCT ، إلا أنه لا يمكن قياس خصائصها المناعية باستخدام هذه المؤشرات الحيوية وكانت هناك حاجة إلى المزيد من هذه المعايير لجعل المقارنات عبر الدراسة والاختلافات النسيلية أسهل في القياس الكمي2.
على الرغم من المبادئ التوجيهية التي وضعتها ISCT ، فقد أظهرت الأبحاث المكثفة حول MSCs أن عدم التجانس موجود في هذه الفئة من السكان ، والذي يمكن أن ينشأ بسبب العديد من العوامل ، ويرجع ذلك أساسا إلى الطبيعة المنتشرة في كل مكان لعدم التجانس الذي ينشأ بين الجهات المانحة MSC6 ، ومصادر الأنسجة7 ، والخلايا الفردية داخل السكان النسيلي8 ، وظروف الثقافة 2,9 ، 10. يعد توصيف وتنقية هذه الخلايا الأولية من مجموعة متنوعة من مصادر الأنسجة لضمان الجودة ومصير الخلايا خطوات أساسية في إنتاجها. تتطلب الحاجة إلى فهم الاختلافات المعروضة بين السكان طريقة فعالة لحلها إلى مجموعات فرعية يمكن تقسيمها وجمعها بشكل منفصل11. تساعد تحليلات مستوى الخلية الواحدة في التغلب على تحديات الاختلاف بين الخلية والخلية ، وتقليل الضوضاء البيولوجية الناشئة عن مجموعة غير متجانسة ، وتوفر القدرة على التحقيق في الخلايا النادرة وتوصيفها12.
بناء على الغرض والمعلمات المختارة ، يمكن استخدام عدة طرق لفرز وإثراء المجموعات السكانية المختارة. يمكن أن تشتمل تقنيات فرز الخلايا على طرق فرز بالجملة وفرز خلية واحدة. في حين أن الفرز بالجملة يمكن أن يثري السكان المستهدفين من خلال فرز الخلايا المنشطة مغناطيسيا (MACS) 13 ، والتجزئة 14 ، والتطهير 15 ، فإن الفرز أحادي الخلية يمكن أن يثري مجموعات أكثر تجانسا عن طريق فرز الخلايا المنشط بالفلورة (FACS) 11. ويسلط الجدول 1 الضوء على التحليلات المقارنة لكل طريقة من هذه الطرق مع مجموعة المزايا والعيوب الخاصة بها.
الجدول 1: تحليلات مقارنة للتقنيات المختلفة: MACS ، والتجزئة ، والتطهير ، و FACS مع إبراز الاختلافات في مبدأها ومزايا وعيوب اختيار تقنية معينة على أخرى. الاختصارات: MACS = فرز الخلايا المنشط مغناطيسيا ؛ FACS = فرز الخلايا المنشط بالتألق. الرجاء الضغط هنا لتنزيل هذا الجدول.
منذ ظهور هذه التقنية ، لعب قياس التدفق الخلوي أحادي الخلية دورا رئيسيا في التعداد16 ، والكشف ، وتوصيف مجموعة خلايا معينة في عينة غير متجانسة17. وضع هيويت وآخرون في عام 2006 الأساس لمنهجية فرز الخلايا الآلية لتعزيز عزل المجمعات المتجانسة للخلايا الجذعية الجنينية البشرية المتمايزة (hESCs)18. أدى الفرز أحادي الخلية إلى إثراء مجموعة hESCs المحولة بواسطة GFP مما يسهل عزل المستنسخة المعدلة وراثيا ، مما فتح بعدا جديدا في البحث السريري. لتحسين كفاءة الفرز ، تم اتباع نهجين بشكل عام ؛ إما أن يتم تعديل وسائط جمع المجموعات السكانية التي تم فرزها للحفاظ على صلاحية وتكاثر الخلايا بعد الفرز19 أو يتم تعديل خوارزمية / برنامج فرز الخلايا بشكل مناسب12.
مع تقدم التكنولوجيا ، تمكنت أجهزة قياس التدفق الخلوي التجارية وأجهزة فرز الخلايا من المساعدة في مواجهة التحديات التي تمت مواجهتها أثناء فرز مجموعات الخلايا الهشة والنادرة بشكل معقم ، وخاصة الخلايا الجذعية من أصول مختلفة. كان أحد التحديات الرئيسية لعلماء بيولوجيا الخلايا الجذعية هو العزلة النسيلية للخلايا الجذعية البشرية متعددة القدرات باتباع بروتوكولات النقل المطلوبة في دراسات تحرير الجينات19. تمت معالجة ذلك عن طريق فرز الخلايا المفردة إلى 96 لوحة جيدة تم تغليفها بالخلايا الليفية الجنينية للفأر (MEFs) جنبا إلى جنب مع المكملات الغذائية ومثبطات ROCK التجارية الصغيرة. ومع ذلك ، يمكن تحسين استراتيجيات عزل الخلايا إلى حد كبير باستخدام فرز المؤشر ، وهي سمة من سمات خوارزمية الفرز التي تحدد النمط المناعي للخلايا الفردية التي تم فرزها12. ساعدت هذه الطريقة المكررة في فرز الخلية الواحدة ليس فقط في تعزيز كفاءة الفرز للخلايا الجذعية ، خاصة فيما يتعلق بمجموعات الخلايا الجذعية المكونة للدم النادرة ، ولكن أيضا ربط المستنسخة أحادية الخلية بكفاءة بمقايساتها الوظيفيةالنهائية 20.
تركز هذه الورقة على فرز الخلايا الجذعية أحادية الخلية للخلايا الجذعية المناعية من الأسنان اللبنية المقشرة البشرية (SHEDs) لإثراء المجموعات الفرعية لدراسة قدراتها على التمايز الوظيفي. باستخدام مزيج من علامتين إيجابيتين ل MSC ، CD90 و CD73 ، وعلامة مكونة للدم سلبية CD45 ، تم تحديد MSCs ذات النمط المناعي وتم تحديد التعبيرات الخافتة والصفرية. بناء على النمط المناعي الخاص بهم ، تم تحديد المجموعات السكانية الفرعية على أنها MSCs نقية ، مجموعات إيجابية واحدة وسلبية مزدوجة. تم فرزها باستخدام وضع الفرز أحادي الخلية للحصول على مجموعات فرعية نقية وغنية لمزيد من الدراسات الوظيفية لتحديد ما إذا كان التعبير التفاضلي للعلامات هو قطعة أثرية لظروف الاستزراع في المختبر أو ما إذا كان له أي تأثير على الخصائص الوظيفية أيضا. تم فرز الخلايا التي لم تكن معبرات متجانسة من "علامات MSC الإيجابية" لدراسة خصائصها الوظيفية.
Protocol
الموافقة الأخلاقية والموافقة على المشاركة: تم استلام عينات لب الأسنان المتساقطة المقشرة البشرية بعد الحصول على الموافقة المستنيرة والموافقة الأخلاقية الكاملة من قبل كلية ومستشفى سري راجيف غاندي لطب الأسنان (SRGCDS) قسم الفم والوجه والفكين ، بنغالورو ، وفقا للمعايير التي وضعتها لجنة التخليص الأخلاقي بالمستشفى ، SRGCDS. بعد ذلك تمت الموافقة على عزل وثقافة وصيانة وتطبيق SHEDs من قبل وامتثالا للإرشادات التي أوصت بها اللجنة المؤسسية لأبحاث الخلايا الجذعية (IC-SCR) في معهد مانيبال للطب التجديدي ، MAHE - بنغالورو. راجع جدول المواد للحصول على تفاصيل حول جميع المواد والكواشف المستخدمة في هذا البروتوكول.
1. إعداد الكواشف والمخازن المؤقتة
- للحفاظ على الثقافة
- تحضير وسائط زراعة الخلايا MSC (10٪) باستخدام الوسط القاعدي ل hESCs غير المتمايزة ، 10٪ مصل بقري جنيني (FBS) ، 1٪ L-glutamine ، و 1٪ بنسلين-ستربتومايسين (Pen-strep) (الجدول 2).
- تحضير وسائط زراعة الخلايا MSC (20٪) باستخدام الوسط القاعدي ل hESCs غير المتمايزة ، 20٪ FBS ، 1٪ L-glutamine ، و 1٪ Pen-strep (الجدول 2).
- تحضير الوسائط المعادلة باستخدام الوسط القاعدي ل hESCs غير المتمايزة ، 1٪ L-glutamine ، و 1٪ مضاد حيوي مضاد حيوي (مضاد للطخار) (الجدول 2).
- لتحليل التدفق الخلوي والفرز
- تحضير محلول التلوين باستخدام 2٪ FBS في محلول ملحي مخزن بالفوسفات (PBS).
- قم بإعداد محلول مخزون من 4 ′ ، 6-دياميدينو -2-فينيليندول (DAPI) (1 ميكروغرام / مل) عن طريق إضافة 1 ميكرولتر في 1 مل من PBS
- للتمايز الخاص بالنسب ل MSCs
- تحضير وسائط التمايز للتمايز العظمي ، الغضروفي ، والأديبوجيني وفقا للتكوين الموصوف في الجدول 3. قم بتخزين الحصص المحضرة في درجة حرارة 4 درجات مئوية طوال مدة التجربة.
- تحضير الوسائط المتعطشة للمصل (2٪ وسط) باستخدام الوسط القاعدي ل hESCs غير المتمايزة ، 2٪ FBS ، 1٪ L-glutamine ، و 1٪ Pen-strep (الجدول 2).
| نوع الوسائط | الغرض من وسائل الإعلام | تكوين ل 50 مل | ||||||||
| إف بي إس | قلم بكتيريا | إل-جلوتامين | الوسط القاعدي ل hESCs غير المتمايزة | |||||||
| 10٪ وسائط | ثقافة MSC وصيانتها | 5 مل | 500 ميكرولتر | 500 ميكرولتر | 44 مل | |||||
| 20٪ وسائط | مقايسة CFU-F | 10 مل | 500 ميكرولتر | 500 ميكرولتر | 39 مل | |||||
| مصل جائع (2٪) وسائل الإعلام | وسائط لآبار التحكم في بروتوكول التمايز | 1 مل | 500 ميكرولتر | 500 ميكرولتر | 48 مل | |||||
| تحييد الوسائط | وسائل الإعلام لتحييد تعليق الخلية بعد التربسين | - | 500 ميكرولتر | 500 ميكرولتر | 49 مل | |||||
الجدول 2: وسائط زراعة الخلايا لصيانة الثقافة ومقايساتها. الاختصارات: MSC = الخلايا الجذعية الوسيطة. CFU-F = وحدة تشكيل مستعمرة الخلايا الليفية.
| مكونات | الوسائط العظمية المنشأ | وسائل الإعلام الغضروفية | الوسائط الأديبوجينية |
| وسائل الإعلام القاعدية | 90 مل | 90 مل | 90 مل |
| الوسائط التعريفية | 10 مل | 10 مل | 10 مل |
| الحجم الكلي | 100 مل | 100 مل | 100 مل |
الجدول 3: وسائط التمايز لتمايز النسب الثلاثية ل SHEDs.
2. ثقافة وصيانة الحظائر
- الحفاظ على الخلايا في وسائط ثقافة MSC 10٪ وإجراء تغييرات الوسائط كل 2 أيام أو حسب الحاجة.
- خلايا التربسين عند التقاء 95٪ باستخدام 0.25٪ تربسين-EDTA.
- تحييد الخلايا بعد التربسين باستخدام وسائط التحييد.
- جهاز طرد مركزي الأنبوب عند 300 × جم لمدة 6 دقائق في درجة حرارة الغرفة للحصول على حبيبات خلوية.
- صب المادة الطافية وإعادة تعليق بيليه الخلية في 10٪ وسائط ثقافة MSC.
- خلايا البذور في أطباق زراعة الخلايا الطازجة التي تحتوي على 10٪ وسائط زراعة MSC لمزيد من التجارب أو الزراعة الفرعية.
ملاحظة: كثافة البذر المثلى للحظائر هي 0.2 × 10 6 خلايا في طبق 100 مم و 0.8 × 10 6 خلايا في دورق T-75 ، للحصول على 1.5 × 10 6 خلايا و 4 × 10 6 خلايا ، على التوالي ، عند التقاء 90-100٪.
3. توصيف MSCs
- مقايسة نمو الخلايا على المدى القصير
- البذور 4 × 104 خلايا / بئر في ثلاث نسخ إلى ألواح 6 آبار في وسائط ثقافة MSC بنسبة 10٪.
- احتضان لوحات لمدة 7 أيام في 37 درجة مئوية، وإجراء تغييرات وسائل الإعلام كل 2 أيام.
- احصد الخلايا في الأيام 2 و 4 و 8 باستخدام علاج التربسين بنسبة 0.25٪ واغسلها بوسائط الثقافة.
- أجهزة الطرد المركزي الخلايا في 300 غرام لمدة 6 دقائق في درجة حرارة الغرفة وإعادة تعليق بيليه في 1 مل من الوسائط.
- عد الخلايا باستخدام مقياس الدم وحدد صلاحيتها بطريقة استبعاد التريبان الأزرق.
- احسب معدل الانتشار باستخدام المعادلة (1):
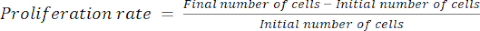 (1)
(1)
- مقايسة الخلايا الليفية المكونة للمستعمرة (CFU-F)
- بذر 10000 خلية في طبق 100 مم واستزراعها في 20٪ من وسائط زراعة MSC.
- احتضان الأطباق لمدة 14 يوما عند 37 درجة مئوية ، وقم بإجراء تغييرات الوسائط كل 3 أيام.
- بعد 14 يوما ، شطف المستعمرات مع PBS ، وتثبيتها بصبغة الكريستال البنفسجي في الميثانول ، وشطف مرة أخرى مع PBS لإزالة وصمة عار المتبقية.
- عد وصور المستعمرات.
ملاحظة: عد المستعمرات التي تحتوي على >50 خلية. يتم حساب كفاءة تشكيل المستعمرة كأرقام وحدات تشكيل مستعمرة.
- مقايسة التألق المناعي
- بذر MSCs على أطباق 35 مم واتركها تنمو حتى التقاء 80-90٪.
- قم بإزالة الوسائط وشطف الأطباق باستخدام برنامج تلفزيوني مرة واحدة.
- ثبت الخلايا ب 1 مل من 4٪ بارافورمالدهايد (PFA) إما عن طريق الحضانة لمدة ساعة واحدة في درجة حرارة الغرفة أو طوال الليل عند 4 درجات مئوية.
- بعد التثبيت ، اغسل الآبار باستخدام PBST لمدة 3 × 5 دقائق على الروك.
- أضف 0.3٪ Triton X-100 في PBST (0.05٪ محلول Tween 20 في PBS) لتخلل الخلايا. احتفظ بها على الروك لمدة 15 دقيقة في درجة حرارة الغرفة.
- اغسل الآبار باستخدام PBST لمدة 3 × 5 دقائق على الروك.
- أضف 3٪ من ألبومين مصل الأبقار (BSA) للحجب واحتفظ به على الروك لمدة 1 ساعة في درجة حرارة الغرفة.
- اغسل الآبار باستخدام PBST لمدة 3 × 5 دقائق على الروك.
- أضف 800 ميكرولتر من تخفيف 1: 500 من مضاد الفأر ، واحتفظ به على الروك لمدة ساعة واحدة في درجة حرارة الغرفة ، وانقل اللوحة إلى 4 درجات مئوية للحضانة طوال الليل.
- في اليوم التالي ، قم بإزالة الجسم المضاد الأساسي وغسل الآبار باستخدام PBST لمدة 3 × 5 دقائق على الروك.
- أضف 800 ميكرولتر من تخفيف 1: 1,000 من الجسم المضاد الثانوي المتقاطع IgG (H + L) المضاد للفأر ، Alexa Fluor 555 ، واحتفظ به لمدة 3 ساعات في درجة حرارة الغرفة على الروك.
- اغسل الآبار باستخدام PBST لمدة 3 × 5 دقائق على الروك.
- أضف Alexa fluor 488 Phalloidin Probes 240 μL في 1000 ميكرولتر من PBS واحتضانها في درجة حرارة الغرفة لمدة 60 دقيقة على الروك.
- اغسل الآبار باستخدام PBST لمدة 3 × 5 دقائق على الروك.
- أضف 700 ميكرولتر من مركب DAPI وراقب الخلايا تحت المجهر.
- التمايز الخاص بالنسب
- التمايز بعد ثقافة 2D
- خذ لوحين من 48 بئرا وقم بتسميتهما على أنهما سلالات عظمية ودهنية المنشأ ، على التوالي.
- قم بزرع 15000 خلية / بئر في أربعة آبار من كل لوحة واستزراعها في 10٪ من وسائط الاستزراع MSC.
- بمجرد أن تصل الطبقة الأحادية للخلايا إلى التقاء 90٪ ، قم بتسمية أول بئرين على أنهما "تحكم" واستبدل الوسائط الحالية بوسائط متعطشة للمصل (2٪ وسائط). في البئرين الأخيرين المسمى "اختبار" ، أضف وسائط تمايز لأي من السلالتين ، دهنية المنشأ أو عظمية. ضع علامة على هذا على أنه اليوم 0.
- استبدل الوسائط برفق كل ثلاثة أيام للتحايل على التقشير وكن حذرا لتجنب التلوث.
- الحفاظ على هذه الشروط حتى اليوم الحادي والعشرين ؛ ثم عملية لتجربة تلطيخ.
- التمايز بعد ثقافة 3D
- خذ أنبوبين سعة 15 مل لأداء التمايز الغضروفي باستخدام ثقافة الحبيبات ثلاثية الأبعاد.
- نقل 1 × 10 6 خلايا إلى كل أنبوب وأجهزة الطرد المركزي في 300 × غرام لمدة6 دقائق لتشكيل بيليه. قم بتسمية أنبوب واحد على أنه "تحكم" وأضف 10٪ من وسائط ثقافة MSC إليه ؛ قم بتسمية الأنبوب الآخر باسم "اختبار" وأضف وسائط تمايز غضروفية المنشأ. ضع الأنابيب بعناية في الحاضنة مع أغطيةها مشدودة بشكل فضفاض. ضع علامة على هذا على أنه اليوم 0.
- قم بتغيير الوسائط كل ثلاثة أيام بعناية ، حتى لا يتم إزاحة / تفكك الحبيبات أثناء تغييرات الوسائط.
- حافظ على هذه الظروف حتى اليوم الحادي والعشرين ثم قم بمعالجة الخلايا لمزيد من التجارب.
- التمايز بعد ثقافة 2D
- تلطيخ كيميائي خلوي خاص بالنسب
- بالنسبة للثقافات ثنائية الأبعاد ، استخدم لوحات MSCs (التحكم) المتباينة (الاختبار) وغير المتمايزة (من الخطوة 3.4.1.5.) للتلطيخ ، وأولا ، قم بإزالة الوسائط واغسلها مرتين باستخدام PBS. ثبت الخلايا باستخدام 4٪ PFA لمدة 30 دقيقة في درجة حرارة الغرفة ، وقم بإزالة المادة الطافية ، واغسلها مرة واحدة باستخدام برنامج تلفزيوني. أداء تلطيخ لكل سلالة على النحو التالي.
- بالنسبة لنسب الخلايا الشحمية ، أضف محلول النفاذية من المجموعة واحتضان اللوحة لمدة 5 دقائق في درجة حرارة الغرفة. تحضير وإضافة 1 مل من محلول عمل Oil red O والاحتفاظ به لمدة 10 دقائق. إزالة وصمة عار وإعطاء خمس غسلات بالماء المقطر.
- بالنسبة لنسب الخلايا العظمية ، أضف 5٪ من نترات الفضة الطازجة (في الماء المقطر) إلى كل بئر واحتفظ باللوحة تحت الأشعة فوق البنفسجية لمدة 1 ساعة. إزالة الحل وإضافة 2.5 ٪ من ثيوسلفات الصوديوم لإزالة الفضة غير المتفاعلة. احتفظ بها لمدة 5 دقائق. إزالة وصمة عار ، وغسل مرتين بالماء المقطر ، ومراقبة الخلايا الملطخة تحت المجهر.
- بالنسبة للمزارع ثلاثية الأبعاد ، اجمع الحبيبات بعد نهاية فترة التمايز من الخطوة 3.4.2.3 واحصل على عمليات الاستئصال المبرد للأنسجة المتمايزة في شكل الحبيبات. اترك الشرائح تجف في الهواء وتكون في درجة حرارة الغرفة قبل الشروع في التلطيخ.
- بالنسبة لسلالة الخلايا الغضروفية ، اتبع إرشادات مجموعة التلوين لإضافة كمية كافية من محلول الغسيل ، وإزالته ، وإضافة محلول التثبيت ، واحتضانه لمدة 30 دقيقة. يغسل بالماء المقطر ، ويضاف محلول التلوين ، ويحتضن لمدة 30 دقيقة. اغسل ثلاث مرات بحمض الهيدروكلوريك 0.1 نيوتن ؛ أضف الماء المقطر لتحييد الحموضة. مراقبة الخلايا الملطخة تحت المجهر برايتفيلد.
- بالنسبة للثقافات ثنائية الأبعاد ، استخدم لوحات MSCs (التحكم) المتباينة (الاختبار) وغير المتمايزة (من الخطوة 3.4.1.5.) للتلطيخ ، وأولا ، قم بإزالة الوسائط واغسلها مرتين باستخدام PBS. ثبت الخلايا باستخدام 4٪ PFA لمدة 30 دقيقة في درجة حرارة الغرفة ، وقم بإزالة المادة الطافية ، واغسلها مرة واحدة باستخدام برنامج تلفزيوني. أداء تلطيخ لكل سلالة على النحو التالي.
4. تلطيخ سطح الخلية للتنميط المناعي
ملاحظة: لوحات زراعة الخلايا الموصى بها للحصول على العدد الأمثل من الخلايا في الخطوات 4.2-4.5 هي أطباق 100 مم أو قوارير T75.
- تحضير الخلايا لتجارب قياس التدفق الخلوي
- التربسين وجمع الخلايا من طبق / قارورة متقاربة وأجهزة طرد مركزي في 300 × غرام لمدة 6 دقائق للحصول على بيليه الخلية.
- أعد تعليق الحبيبات في 1 مل من الوسائط وحدد عدد الخلايا القابلة للحياة باستخدام مقياس الدم باتباع طريقة استبعاد التريبان الأزرق.
- أجهزة الطرد المركزي تعليق الخلية مرة أخرى بعد العد وإعطاء غسلتين أخريين للحبيبات مع 1 مل من العازلة تلطيخ.
- تخلص من المادة الطافية وأعد تعليق الحبيبات أخيرا في حجم مناسب من المخزن المؤقت للتلطيخ اعتمادا على البروتوكول (انظر الخطوات من 4.2 إلى 4.5).
- إعداد ضوابط التعويض
- خذ سبعة أنابيب FACS وقم بتسميتها على أنها غير ملوثة و DAPI و V450 و FITC و PE و PerCP-Cy 5.5 و APC.
- أعد تعليق الحبيبات النهائية في المخزن المؤقت للتلطيخ (انظر الخطوة 4.1.) مع الحفاظ على كثافة خلية 0.5 × 106 خلايا لكل 50 ميكرولتر لكل أنبوب لأنابيب غير ملوثة و DAPI.
- تحضير الأنابيب أحادية اللون للتعويض كما هو موضح في الجدول 4.
- دوامة بلطف كل أنبوب بعد التحضير واحتضانها في الظلام لمدة 30 دقيقة.
- بعد الحضانة ، أعط غسلتين بإضافة 1 مل من محلول التلوين إلى كل أنبوب ، متبوعا بدوامة قصيرة وطرد مركزي عند 200 جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية ، وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت للتلطيخ ، وضعها جانبا حتى عملية الاستحواذ.
- بالنسبة لأنبوب DAPI ، قم بإجراء معالجة الصدمة الحرارية عن طريق احتضانه في حمام مائي بدرجة حرارة 60 درجة مئوية لمدة 5 دقائق متبوعا ب 15 دقيقة على الجليد. أضف 5 ميكرولتر من DAPI إلى التعليق واحتفظ به في الظلام حتى الاستحواذ على التشغيل.
- تحضير عناصر التحكم الفلورية ناقص واحد (FMO)
- أعد تعليق الحبيبات النهائية في محلول تلطيخ (انظر الخطوة 4.1) مع الحفاظ على كثافة خلية تبلغ 0.5 × 106 خلايا لكل 50 ميكرولتر لكل أنبوب.
- خذ خمسة أنابيب FACS ، وقم بتسميتها على أنها النمط المتماثل CD44-V450 ، CD90-FITC ، CD45-PE ، النمط المتماثل CD73-PerCP Cy5.5 ، والنمط المتماثل CD105-APC.
- تحضير تعليق الخلية والأجسام المضادة وفقا للجدول 5.
- دوامة الأنابيب بلطف واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام.
- بعد الحضانة ، أعط غسلتين مع 1 مل من محلول التلوين لكل أنبوب متبوعا بدوامة قصيرة وطرد مركزي عند 200 جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية ، وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت للتلطيخ ، وضعها جانبا حتى يتم الحصول عليها.
- تحضير العينات للتحليل
- أعد تعليق الحبيبات النهائية في المخزن المؤقت للتلطيخ (انظر الخطوة 4.1) مع الحفاظ على كثافة خلية 0.5 × 106 خلايا لكل 50 ميكرولتر لكل أنبوب.
- خذ أنبوبين FACS وقم بتسميتهما على أنهما أنبوبان مختلطان 1 و 2.
- تحضير تعليق الخلية والأجسام المضادة وفقا للجدول 6.
- دوامة الأنابيب بلطف واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام.
- بعد الحضانة ، أعط غسلتين مع 1 مل من محلول التلوين لكل أنبوب متبوعا بدوامة قصيرة وطرد مركزي عند 200 جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية ، وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت للتلطيخ ، واتركها جانبا حتى يتم الحصول عليها.
- تحضير العينات للفرز أحادي الخلية
- خذ أنبوبين FACS ، أضف 1 مل من FBS ، ولف الأنبوب حتى تتشكل طبقة متساوية من FBS داخل كل أنبوب. احتضان هذا لمدة 1-2 ساعات أثناء معالجة العينة للتلطيخ. قم بتسمية هذه الأنابيب على أنها أنابيب مختلطة 1 و 2.
- أعد تعليق الحبيبات النهائية في المخزن المؤقت للتلطيخ (انظر الخطوة 4.1) مع الحفاظ على كثافة خلية من 2-3 × 106 خلايا لكل 50 ميكرولتر لكل أنبوب.
- تحضير تعليق الخلية والأجسام المضادة في الأنابيب المختلطة 1 و 2 وفقا للجدول 7.
- دوامة الأنابيب بلطف واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام.
- بعد الحضانة ، أعط غسلتين مع 1 مل من محلول التلوين لكل أنبوب متبوعا بدوامة قصيرة وطرد مركزي عند 200 جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية ، وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت للتلطيخ ، واتركها جانبا. أضف 5 ميكرولتر من DAPI قبل 15 دقيقة من الفرز.
ملاحظة: لاحظ أنه بالنسبة لتجارب الفرز ، يوصى بكثافة خلايا أعلى لكل أنبوب.
| نوع الأنبوب | حبات شركات إيجابية * | حبات شركات سلبية * | خلايا | وأضاف الجسم المضاد | |
| أنبوب FITC | 1 قطرة | 1 قطرة | – | CD90-FITC المضاد للإنسان (2 ميكرولتر) | |
| أنبوب V450 | 1 قطرة | 1 قطرة | – | CD44-V450 المضاد للإنسان (2 ميكرولتر) | |
| أنبوب PerCP-Cy 5.5 | 1 قطرة | 1 قطرة | – | مضاد للإنسان CD73-PerCP Cy 5.5 (2 ميكرولتر) | |
| أنبوب PE | 1 قطرة | 1 قطرة | – | CD45-PE المضاد للإنسان (2 ميكرولتر) | |
| أنبوب APC | 1 قطرة | 1 قطرة | – | CD105-APC المضاد للإنسان (2 ميكرولتر) | |
| أنبوب دابي | – | – | 50 ميكرولتر | – | |
| أنبوب غير ملوث | – | – | 50 ميكرولتر | – | |
| * 1 قطرة = 60 ميكرولتر من تعليق حبة | |||||
الجدول 4: عينات مراقبة التعويض. الاختصارات: شركات = تعويض; DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ APC = الوفيكوسيانين ؛ PE = فيكوريثرين. PerCP = بروتين بيريدينين كلوروفيل.
| نوع الأنبوب | الأجسام المضادة ضد علامة إيجابية (2 ميكرولتر) | الأجسام المضادة ضد علامة سلبية (2 ميكرولتر) | الأجسام المضادة للنمط المتماثل المضافة (2 ميكرولتر) | الحجم الكلي للأجسام المضادة | حجم تعليق الخلية المضافة | حجم تلطيخ العازلة المضافة | ||
| CD90-FITC FMO أنبوب | - مكافحة الإنسان CD44-V450 | مكافحة الإنسان CD45-PE | النمط المتماثل FITC IgG1 | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | ||
| -- مكافحة الإنسان CD73 PerCP Cy 5.5 | ||||||||
| - مكافحة الإنسان CD105-APC | ||||||||
| CD73-PerCP Cy5.5 FMO أنبوب | - مكافحة الإنسان CD44-V450 | مكافحة الإنسان CD45-PE | PerCP Cy 5.5 IgG1 isotype | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | ||
| - مكافحة الإنسان CD90-FITC | ||||||||
| - مكافحة الإنسان CD105-APC | ||||||||
| CD44-V450 FMO أنبوب | - مكافحة الإنسان CD90-FITC | مكافحة الإنسان CD45-PE | النمط المتماثل V450 IgG1 | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | ||
| -- مكافحة الإنسان CD73 - بيرCP سي 5.5 | ||||||||
| - مكافحة الإنسان CD105-APC | ||||||||
| أنبوب FMO CD105-APC | - مكافحة الإنسان CD44-V450 | مكافحة الإنسان CD45-PE | النمط المتماثل APC IgG1 | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | ||
| - مكافحة الإنسان CD90-FITC | ||||||||
| -- مكافحة الإنسان CD73 - بيرCP سي 5.5 | ||||||||
| أنبوب CD45-PE FMO | - مكافحة الإنسان CD44-V450 | - | النمط المتماثل PE IgG1 | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | ||
| - مكافحة الإنسان CD90-FITC | ||||||||
| -- مكافحة الإنسان CD73 - بيرCP سي 5.5 | ||||||||
| - مكافحة الإنسان CD105-APC | ||||||||
الجدول 5: عينات مراقبة FMO. الاختصارات: FMO = مضان ناقص واحد ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ APC = الوفيكوسيانين ؛ PE = فيكوريثرين. PerCP = بروتين بيريدينين كلوروفيل.
| نوع الأنبوب | الأجسام المضادة ضد علامة إيجابية (2 ميكرولتر) | الأجسام المضادة ضد علامة سلبية (2 ميكرولتر) | الحجم الكلي للأجسام المضادة | حجم تعليق الخلية المضافة | حجم تلطيخ العازلة المضافة | |
| أنبوب مختلط 1 | - مكافحة الإنسان CD44-V450 | مكافحة الإنسان CD45-PE | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | |
| - مكافحة الإنسان CD90-FITC | ||||||
| -- مكافحة الإنسان CD73 - بيرCP Cy5.5 | ||||||
| - مكافحة الإنسان CD105-APC | ||||||
| أنبوب مختلط 2 | - مكافحة الإنسان CD44-V450 | مكافحة الإنسان CD45-PE | 10 ميكرولتر | 50 ميكرولتر | 40 ميكرولتر | |
| - مكافحة الإنسان CD90-FITC | ||||||
| -- مكافحة الإنسان CD73 - بيرCP Cy5.5 | ||||||
| - مكافحة الإنسان CD105-APC | ||||||
الجدول 6: أنابيب عينة للتنميط المناعي متعدد الألوان ل SHEDs. الاختصارات: SHEDs = الخلايا الجذعية من الأسنان اللبنية المقشرة البشرية. PE = فيكوريثرين.
| نوع الأنبوب | الأجسام المضادة ضد علامة إيجابية (3 ميكرولتر) | الأجسام المضادة ضد علامة سلبية (3 ميكرولتر) | الحجم الكلي للأجسام المضادة | حجم تعليق الخلية المضافة | حجم المخزن المؤقت للبقع المضافة | |
| أنبوب مختلط 1 | - مكافحة الإنسان CD90-FITC | مكافحة الإنسان CD45-PE | 9 ميكرولتر | 50 ميكرولتر | 41 ميكرولتر | |
| -- مكافحة الإنسان CD73 - بيرCP Cy5.5 | ||||||
| أنبوب مختلط 2 | - مكافحة الإنسان CD90-FITC | مكافحة الإنسان CD45-PE | 9 ميكرولتر | 50 ميكرولتر | 41 ميكرولتر | |
| -- مكافحة الإنسان CD73 - بيرCP Cy5.5 | ||||||
الجدول 7: أنابيب تفاعل الفرز أحادية الخلية. الاختصارات: FITC = فلوريسئين إيزوثيوسيانات. PE = فيكوريثرين. PerCP = بروتين بيريدينين كلوروفيل.
5. فرز الخلية الواحدة
- إعداد فارز الخلية
- قم بتركيب فوهة 100 ميكرومتر في الفارز.
ملاحظة: الفوهة المناسبة لا يقل عن خمسة أضعاف قطر الجسيم المراد فرزه. يجب تحديد سائل الغمد الذي سيتم استخدامه للفرز بناء على نوع العينة وحساسية التجربة ؛ لهذه التجربة ، تم استخدام سائل غمد الملكية. - قم بإجراء فحص جودة الأداة اليومي (QC) وقم بإعداد فارز التجربة. ارجع إلى دليل الأجهزة للحصول على دليل مفصل لإعداد الجهاز.
- قم بتركيب فوهة 100 ميكرومتر في الفارز.
- إعداد مصفوفة التعويض
- اضبط مصفوفة التعويض باستخدام أنابيب تعويض أحادية البقعة من الخطوة 4.2.
- في البرنامج الاحتكاري ، حدد تجربة من شريط الأدوات وانقر فوق إعداد التعويض. افتح إنشاء عناصر تحكم في التعويض.
- تحقق من العلامات وقم بالتأكيد. تمت إضافة عينة جديدة تسمى "التعويض" والتي بموجبها يتم إضافة أنابيب جديدة تسمى عناصر التحكم في العلامة تلقائيا بواسطة البرنامج.
- حدد الأنبوب غير الملوث وقم بتشغيله لتسجيل 5000 حدث. اسحب البوابة إلى مجتمع الخلايا وقم بتطبيقها على جميع عناصر التحكم في التعويض. هذا لضبط الفولتية والبوابة السالبة لكل معلمة فلورسنت.
- وبالمثل ، قم بتحميل أنابيب التعويض أحادية البقعة بشكل منفصل ، وقم بتسجيل البيانات وحفظها. حدد البوابة التي تحدد السكان المعنيين وتنطبق على جميع ضوابط التعويض. هذا لتعيين البوابات الموجبة لكل معلمة فلورسنت.
- حدد تجربة من شريط الأدوات وانقر على حساب قيم التعويض | رابط وحفظ.
ملاحظة: بمجرد إنشاء مصفوفة auto-comp باستخدام البرنامج ، لا يمكن تغيير معلمات الجهد للفلوروكرومات لأي من القنوات في الأنابيب المختلطة.
- الحصول على البيانات
- سجل 10000 خلية في كل أنبوب من الخطوة 4.3. و 4.4 لجمع البيانات لتحليل النمط المناعي للخلايا.
- تحضير أجهزة التجميع
- اعتمادا على الغرض من مجموعات الخلايا التي تم فرزها ، اختر بين 6 آبار أو 24 بئرا أو 48 بئرا أو 96 بئرا.
- قم بتغطية الآبار ب 200-500 ميكرولتر من FBS وحافظ على الألواح دون إزعاج لمدة 2 ساعة.
- بعد 2 ساعة ، قم بإزالة FBS المتبقي وإضافة 200-500 ميكرولتر من وسائط ثقافة MSC بنسبة 10٪.
- فرز الخلايا في وضع فرز الخلية الواحدة
- قم بتشغيل الأنبوب المختلط 1 (من الخطوة 4.5) ، وسجل 10000 حدث لتعيين البوابات على السكان المهمين ليتم فرزهم ، باستخدام استراتيجية البوابة المناسبة.
- قم بتحميل لوحة تجميع وقم بتعيين أرقام الخلايا المستهدفة بين 2500 و 5000 خلية / بئر وحدد قناع نقاء الفرز أحادي الخلية.
- اجمع المجموعات التي تم فرزها في جهاز التجميع واحتفظ بها على الجليد حتى نهاية تجربة الفرز.
- بمجرد الانتهاء من ذلك ، انقل الألواح إلى حاضنة CO2 بنسبة 5٪ للحفاظ على الثقافات عند 37 درجة مئوية.
ملاحظة: بعد الحصول ، تم تصدير ملفات البيانات الأولية بتنسيق ملف .fcs (الإصدار 3.0. وما بعده). سجلت تقارير الفرز التي تم إنشاؤها بعد كل تجربة عدد الأحداث / الخلايا التي تم فرزها لكل بئر معين وأشارت إلى عدد التعارضات التي تم إجهاضها.
النتائج
تميزت SHEDs بمقايسات التألق المناعي القياسية التي تظهر التعبير عن vimentin (خيوط وسيطة من النوع الثالث) ، وخيوط الأكتين (Alexa fluor 488 Phalloidin Probes) ، والنوى الملطخة ب DAPI (الشكل 1 أ). لتقدير قدراتها التكاثرية وتشكيل المستعمرات ، تم إجراء فحوصات نمو الخلايا القياسية على المدى القصير. وقد تب?...
Discussion
في مجال هندسة الأنسجة والطب التجديدي ، من بين مصادر ما بعد الولادة ، جذبت MSCs المشتقة من الأنسجة الفموية اهتماما عميقا بسبب الحد الأدنى من التزاماتها الأخلاقية وإمكانية التمايز الملحوظة متعددة السلالات21. حازت الخلايا الجذعية لب الأسنان (DPSCs) من الضرس الثالث المتأثر و SHEDs على أ?...
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بنشر هذه الورقة.
Acknowledgements
نشكر مرفق خلايا التدفق في مركز جواهر لال نهرو للبحوث العلمية المتقدمة ، بنغالورو ، الهند ، على استخدام المرفق الأساسي لقياس التدفق الخلوي. تم إجراء التقسيم بالتبريد لثقافة الحبيبات للخلايا المتمايزة في مختبر نيوبيرج أناند المرجعي ، بنغالورو ، الهند. تم دعم هذا العمل من خلال التمويل الداخلي لجامعة كاليفورنيا من أكاديمية مانيبال للتعليم العالي (MAHE) ، الهند. AG ممتنة لدعم منحة الدكتور T. M. A. PAI من MAHE.
Materials
| Name | Company | Catalog Number | Comments |
| Alcian Blue Stain | HiMedia | CCK029-1KT | |
| Antibiotic-Antimycotic (100x) | Gibco by ThermoFisher | 15240062 | |
| BD CompBead Plus Anti-Mouse Ig, κ/Negative Control (BSA) Compensation Plus (7.5 µm) Particles Set | BD Biosciences | 560497 | |
| BD FACS Accudrop Beads | BD Biosciences | 345249 | Used to set up the Laser delay when the sort module opens. |
| BD FACS Aria Fusion Flow cytometer | BD Biosciences | --- | |
| BD FACS Diva 9.4 | BD Biosciences | --- | |
| BD FACS Sheath Fluid | BD Biosciences | 342003 | Used as sheath fluid for both analysis and sorting experiments in the BD FACSAria Fusion |
| BD FACSDiva CS&T Research Beads | BD Biosciences | 655050 | Used for Instrument configuration depending on the nozzle size. |
| BD Horizon V450 Mouse Anti-Human CD44 | BD Biosciences | 561292 | |
| BD Horizon V450 Mouse IgG2b, κ Isotype Control | BD Biosciences | 560374 | CD44-V450 isotype |
| BD Pharmingen APC Mouse Anti-Human CD105 | BD Biosciences | 562408 | |
| BD Pharmingen APC Mouse IgG1, κ Isotype Control | BD Biosciences | 555751 | CD105-APC isotype |
| BD Pharmingen DAPI Solution | BD Biosciences | 564907 | DAPI Stock solution of 1 mg/mL |
| BD Pharmingen FITC Mouse Anti-Human CD90 | BD Biosciences | 555595 | |
| BD Pharmingen FITC Mouse IgG1, κ Isotype Control | BD Biosciences | 555748 | CD90-FITC isotype |
| BD Pharmingen PE Mouse Anti-Human CD45 | BD Biosciences | 555483 | |
| BD Pharmingen PE Mouse IgG1, κ Isotype Control | BD Biosciences | 555749 | CD45-PE isotype |
| BD Pharmingen PerCP-Cy 5.5 Mouse Anti-Human CD73 | BD Biosciences | 561260 | |
| BD Pharmingen PerCP-Cy 5.5 Mouse IgG1, κ Isotype Control | BD Biosciences | 550795 | CD73-PerCP-Cy 5.5 isotype |
| BD Pharmingen Purified Mouse Anti-Vimentin | BD Biosciences | 550513 | |
| Bovine serum albumin | Hi-Media | TC548-5G | |
| Crystal violet | Nice chemical pvt ltd | C33809 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-aldrich | D5652-50L | dPBS used for culture work and maintenance. |
| Ethanol | --- | --- | Used for general sterlization. |
| Fetal Bovine Serum | Gibco by ThermoFisher | 10270-106 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | ThermoFisher Scientific | A-21422 | |
| KO-DMEM | Gibco by ThermoFisher | 10829018 | Basal medium for undifferentiated hESCs, used in the preparation of culture media |
| L-Glutamine 200mM (100x) | Gibco by ThermoFisher | 25030-081 | |
| Methanol, for Molecular Biology | Hi-Media | MB113 | |
| Oil red O | HiMedia | CCK013-1KT | |
| Paraformaldehyde | loba chemie | 30525-89-4 | |
| Penicillin Streptomycin (100x) | Gibco by ThermoFisher | 15140- 122 | |
| Phalloidin (ActinGreen 488 ReadyProbes reagent) | Invitrogen | R37110 | |
| Silver Nitrate | HiMedia | MB156-25G | |
| Sodium Thiosulphate pentahydrate | Chemport | 10102-17-7 | |
| Sphero Rainbow Fluorescent Particles, 3.0 - 3.4 µm | BD Biosciences | 556291 | |
| Staining buffer | Prepared in MIRM | ---- | It was prepared using 2% FBS in PBS |
| StemPro Adipogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10410-01 | Basal media for Adipogenic media |
| StemPro Adipogenesis Supplement | Gibco by ThermoFisher | A10065-01 | Induction media for Adipogenic media |
| StemPro Chondrogenesis Supplement | Gibco by ThermoFisher | A10064-01 | Induction media for Chondrogenic media |
| StemPro Osteogenesis Supplement | Gibco by ThermoFisher | A10066-01 | Induction media for Osteoogenic media |
| StemPro Osteogenesis/Chondrogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10069-01 | Basal media for both Ostegenic and Chondrogenic media |
| Triton-X-100 | Hi-Media | MB031 | |
| Trypan Blue | Gibco by life technologies | 15250-061 | |
| Trypsin - EDTA Solution 1x | Hi-media | TCL049 | |
| Tween-20 | MERCK | 9005-64-5 |
References
- Kobolak, J., Dinnyes, A., Memic, A., Khademhosseini, A., Mobasheri, A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods. 99, 62-68 (2016).
- Wilson, A., Hodgson-Garms, M., Frith, J. E., Genever, P. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Frontiers in Immunology. 10, 1112 (2019).
- Li, J., et al. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Molecular Medicine Reports. 18 (6), 4969-4977 (2018).
- McLeod, C. M., Mauck, R. L. On the origin and impact of mesenchymal stem cell heterogeneity: new insights and emerging tools for single cell analysis. European Cells & Materials. 34, 217-231 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Wang, J., Liao, L., Wang, S., Tan, J. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations. Cytotherapy. 15 (8), 893-904 (2013).
- Kern, S., Eichler, H., Stoeve, J., Kluter, H., Bieback, K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 24 (5), 1294-1301 (2006).
- Dunn, C. M., Kameishi, S., Grainger, D. W., Okano, T. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell-based therapies. Acta Biomaterialia. 133, 114-125 (2021).
- Yang, Y. K., Ogando, C. R., Wang See, C., Chang, T. Y., Barabino, G. A. Changes in phenotype and differentiation potential of human mesenchymal stem cells aging in vitro. Stem Cell Research & Therapy. 9 (1), 131 (2018).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences. 78 (2), 447-467 (2021).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Review of Scientific Instruments. 43 (3), 404-409 (1972).
- Schulte, R., et al. Index sorting resolves heterogeneous murine hematopoietic stem cell populations. Experimental Hematology. 43 (9), 803-811 (2015).
- Liao, X., Makris, M., Luo, X. M. Fluorescence-activated cell sorting for purification of plasmacytoid dendritic cells from the mouse bone marrow. Journal of Visualized Experiments. (117), (2016).
- Roda, B., et al. A novel stem cell tag-less sorting method. Stem Cell Reviews and Reports. 5 (4), 420-427 (2009).
- Hall, S. R., et al. Identification and isolation of small CD44-negative mesenchymal stem/progenitor cells from human bone marrow using elutriation and polychromatic flow cytometry. Stem Cells Translational Medicine. 2 (8), 567-578 (2013).
- Eggleton, M. J., Sharp, A. A. Platelet counting using the Coulter electronic counter. Journal of Clinical Pathology. 16 (2), 164-167 (1963).
- Porwit-Ksiazek, A., Aman, P., Ksiazek, T., Biberfeld, P. Leu 7+ (HNK-1+) cells. II. Characterization of blood Leu 7+ cells with respect to immunophenotype and cell density. Scandinavian Journal of Immunology. 18 (6), 495-449 (1983).
- Hewitt, Z., et al. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning and Stem Cells. 8 (3), 225-234 (2006).
- Singh, A. M. An efficient protocol for single-cell cloning human pluripotent stem cells. Frontiers in Cell and Developmental Biology. 7, 11 (2019).
- Wilson, N. K., et al. Combined single-cell functional and gene expression analysis resolves heterogeneity within stem cell populations. Cell Stem Cell. 16 (6), 712-724 (2015).
- Zhou, L. L., et al. Oral mesenchymal stem/progenitor cells: the immunomodulatory masters. Stem Cells Inernational. 2020, 1327405 (2020).
- Fawzy El-Sayed, K. M., et al. Adult mesenchymal stem cells explored in the dental field. Advances in Biochemical Engineering/Biotechnology. 130, 89-103 (2013).
- Hardy, W. R., et al. Transcriptional networks in single perivascular cells sorted from human adipose tissue reveal a hierarchy of mesenchymal stem cells. Stem Cells. 35 (5), 1273-1289 (2017).
- . . FACSAria Fusion User's Guide. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved