このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト剥離乳歯由来の免疫表現型間葉系幹細胞の単一細胞選別
要約
このプロトコルは単一セルの分類方法を使用して人間のmesenchymal幹細胞の蛍光活動化させたセル分類の使用を記述する。具体的には、シングルセルソーティングの使用は、マルチパラメトリックフローサイトメトリーベースのアプローチと組み合わせることで、不均一な集団から免疫表現型細胞の99%の純度を達成することができます。
要約
生物の間葉系幹細胞(MSC)は、体内の成体細胞の複数の系統に分化する並外れた能力を持ち、免疫調節および抗炎症特性で知られています。これらの幹細胞の使用は、再生生物学の分野に恩恵をもたらしますが、同時に、それらに関連する複数の細胞の曖昧さのために、再生医療や治療薬にとって悩みの種でもあります。これらの曖昧さは、これらの幹細胞の供給源の多様性とin vitro での増殖条件から生じる可能性があり、どちらも機能的な不均一性を反映しています。
これにより、治療用途のために精製された均質なMSC集団を提供する方法論が保証されます。フローサイトメトリーの分野の進歩により、マルチパラメトリックアプローチを用いた単一細胞集団の検出が可能になりました。このプロトコルは蛍光助けられた単一セルの分類によって人間のexfoliated乳歯の(小屋)からの幹細胞を識別し、浄化する方法を概説する。表面マーカー、すなわちCD90-フルオレセインイソチオシアネート(FITC)、CD73-ペリジニン-クロロフィルタンパク質(PerCP-Cy5.5)、CD105-アロフィコシアニン(APC)、およびCD44-V450の同時発現により、マルチパラメトリックフローサイトメトリーを用いてMSCの「明るい」陽性発現因子が同定されました。しかし、これらの陽性マーカーの四重発現者の割合は、継代7以降から後の継代にかけて有意な低下が観察された。
免疫表現型サブポピュレーションは、2つの陽性マーカーと1つの陰性マーカーのみが選択基準を構成する単一細胞ソートモードを使用してソートされました。この方法論により、選別した集団の細胞生存率が保証され、選別後の細胞増殖が維持されました。このようなソーティングの下流アプリケーションは、ゲーテッド亜集団の系統特異的な分化を評価するために使用できます。このアプローチは、他のシングルセルシステムに適用して、単離条件を改善し、複数の細胞表面マーカー情報を取得することができます。
概要
間葉系幹細胞(MSC)は、細胞ベースの治療に適したスケーラブルな細胞供給源と見なすことができ、再生医療のゴールドスタンダードシステムと見なすことができます。これらの細胞は、異なる組織起源を有する体内のさまざまな供給源から単離することができる1。MSCの各タイプは、その発生源組織に応じて、曖昧なin vitro挙動を示します2。これは、それらの形態学的および機能的特性によく見られます3。複数の研究により、成体組織の分化、ゲノム状態、MSCの代謝および細胞構造など、寸法のクローン内変動が示されています2,4。
細胞のイムノフェノタイピングは、幹細胞の同定のためのフローサイトメトリーの一般的なアプリケーションであり、これは2006年に国際細胞遺伝子治療学会(ISCT)によって利用され、細胞をMSCとして識別するための最小限の基準のリストを規定しました。それは、プラスチック接着とin vitroで3つの系統(骨形成性、軟骨形成性、脂肪形成性)に分化する能力に加えて、細胞集団の≥95%がCD105、CD73、CD90を発現しなければならず、これらの細胞はフローサイトメトリーで測定されたCD34、CD45、CD11b、CD14、およびHLA-DRの発現(≤2%陽性)を欠いている必要があると述べています5.MSCはISCTの最小限の基準の下で一連のバイオマーカーによって定義されましたが、それらの免疫特性はこれらのバイオマーカーでベンチマークすることができず、研究間の比較とクローン変異の定量化を容易にするために、これらの基準を超えるものが必要でした2。
ISCTによって設定されたガイドラインにもかかわらず、MSCに関する広範な研究により、MSCには不均一性が存在することが示されており、これは主にMSCドナー6、組織源7、クローン集団8内の個々の細胞、および培養条件2,9の間に生じる不均一性の遍在性のために、多くの要因によって発生する可能性があります。10.品質と細胞の運命を確保するための、さまざまな組織源からのこれらの初代細胞の特性評価と精製は、それらの生産における重要なステップです。母集団間の表示された変動を理解する必要性は、それを分割して個別に収集できる部分母集団に解決するための効率的な方法を必要とします11。単一細胞レベルの分析は、細胞間変異の課題を克服し、不均一な集団から生じる生物学的ノイズを低減し、希少細胞の調査と特性評価を行う能力を提供するのに役立ちます12。
目的と選択したパラメータに基づいて、いくつかの方法を使用して、選択した母集団を並べ替えて強化できます。細胞選別技術には、バルクソーティング法と単一細胞ソーティング法の両方があります。バルクソーティングは、磁気活性化セルソーティング(MACS)13、フラクショネーション14、および水簸15によってターゲット集団を濃縮できますが、シングルセルソーティングは、蛍光活性化セルソーティング(FACS)11によって、より均質な集団を濃縮できます。表1に、これらの各方法と独自の長所と短所の比較分析を示します。
表1:MACS、分画、水簸、FACSなどのさまざまな手法の比較分析では、その原理の違いと、特定の手法を他の手法よりも選択することの長所と短所を強調しています。 略語:MACS = Magnetic-activated cell sorting;FACS = 蛍光活性化セルソーティング。 この表をダウンロードするには、ここをクリックしてください。
この技術の出現以来、単一細胞フローサイトメトリーは、不均一なサンプル中の特定の細胞集団の列挙16、検出、および特性評価において主要な役割を果たしてきました17。2006年、Hewittらは、分化したヒト胚性幹細胞(hESC)の均質なプールの単離を強化するための自動細胞選別法の基礎を築いた18。シングルセルソーティングにより、GFP形質導入ヒトES細胞の集団が濃縮され、遺伝子改変クローンの単離が容易になり、臨床研究に新たな局面が開かれました。ソート効率を向上させるために、一般的に2つのアプローチが取られてきました。選別された集団の収集培地は、選別後の細胞の生存率および増殖を維持するように改変されるか19 、または細胞選別アルゴリズム/ソフトウェアが適切に改変される12。
技術の進歩により、市販のフローサイトメーターやセルソーターは、脆弱で希少な細胞集団、特に異なる起源の幹細胞を無菌的に選別する際に解決された課題に対処するのに役立っています。幹細胞生物学者の主な課題の1つは、遺伝子編集研究に必要なトランスフェクションプロトコルに従ったヒト多能性幹細胞のクローン分離でした19。これに対処するには、単一細胞を96ウェルプレートに分類し、マウス胚性線維芽細胞(MEF)とサプリメントおよび市販の低分子ROCK阻害剤でコーティングしました。しかし、細胞単離戦略は、ソーティングされた個々の細胞の免疫表現型を同定するソーティングアルゴリズムの特徴であるインデックスソーティングを使用することで大幅に改良することができる12。シングルセルソーティングにおけるこの洗練されたモダリティは、特に希少な造血幹細胞集団に関して、幹細胞のソーティング効率を高めるのに役立っただけでなく、シングルセルクローンを下流の機能アッセイに効率的にリンクさせることにも役立ちました20。
この論文は、ヒト剥離乳歯(SHED)から採取した免疫表現型幹細胞の単一細胞選別に焦点を当て、サブポピュレーションを濃縮して機能分化能力を研究します。2つのMSC陽性マーカー、CD90およびCD73、および陰性造血マーカーCD45の組み合わせを使用して、MSCを免疫表現型決定し、dimおよびnull発現因子を同定した。免疫表現型に基づいて、亜集団は純粋なMSC、単一陽性および二重陰性の集団として識別されました。これらは、シングルセルソーティングモードを使用してソーティングし、マーカーの発現差が in vitro 培養条件のアーティファクトであるかどうか、または機能特性にも影響を与えるかどうかを特定するためのさらなる機能研究のために、純粋で濃縮された亜集団を取得しました。「陽性MSCマーカー」の均一な発現因子ではない細胞を選別し、その機能的特性を調べました。
プロトコル
倫理的承認と参加への同意: ヒト剥離乳歯髄サンプルは、インフォームド コンセントと完全な倫理的承認を取得した後、バンガロールの Sri Rajiv Gandhi Dental College and Hospital (SRGCDS) 口腔顎顔面部門によって、病院倫理クリアランス委員会、SRGCDS によって確立された基準に従って受け取られました。その後、SHEDの分離、培養、維持、および適用が、MAHE-バンガロールのManipal Institute of Regenerative MedicineのInstitutional Committee for Stem Cell Research(IC-SCR)によって推奨されたガイドラインによって承認され、これに準拠しました。このプロトコルで使用されるすべての材料および試薬の詳細については、 材料表 を参照してください。
1. 試薬・緩衝液の調製
- 培養維持に
- 未分化ヒトES細胞の基礎培地、10%ウシ胎児血清(FBS)、1%L-グルタミン、および1%ペニシリン-ストレプトマイシン(Pen-strep)を使用してMSC細胞培養培地(10%)を調製します(表2)。
- 未分化ヒトES細胞用基礎培地、20%FBS、1%L-グルタミン、および1%ペン連鎖球菌を用いてMSC細胞培養培地(20%)を調製します(表2)。
- 未分化ヒトES細胞の基礎培地、1%L-グルタミン、および1%抗生物質-抗真菌性(抗抗)を使用して中和培地を調製します(表2)。
- フローサイトメトリー解析およびソーティング用
- リン酸緩衝生理食塩水(PBS)中の2%FBSを使用して染色緩衝液を調製します。
- 1 mLのPBSに1 μLを添加して、4',6-ジアミジノ-2-フェニルインドール(DAPI)(1 μg/mL)のストック溶液を調製します
- 間葉系幹細胞の系統特異的分化
- 骨形成分化、軟骨形成分化、および脂肪分化用の分化培地を、 表3に記載の組成に従って調製する。調製したアリコートは、実験期間中4°Cで保管してください。
- 未分化ヒトES細胞、2%FBS、1%L-グルタミン、および1%ペン連鎖球菌用の基礎培地を使用して、血清欠乏培地(2%培地)を調製します(表2)。
| メディアの種類 | メディアの目的 | 組成物: 50 mL | ||||||||
| FBSの | ペン連鎖球菌 | L-グルタミン | 未分化ヒトES細胞の基礎培地 | |||||||
| メディア 10% | MSCの培養とメンテナンス | 5 mLの | 500μL | 500μL | 44 mLの | |||||
| 20%メディア | CFU-Fアッセイ | 10 mLの | 500μL | 500μL | 39 mLの | |||||
| 血清飢餓(2%)培地 | 微分プロトコルの制御井戸のための媒体 | 1 mLの | 500μL | 500μL | 48 mLの | |||||
| 中和媒体 | トリプシン処理後の細胞懸濁液を中和するための培地 | - | 500μL | 500μL | 49 mLの | |||||
表2:培養維持およびアッセイ用の細胞培養培地。 略語:MSC =間葉系幹細胞;CFU-F = コロニー形成単位 - 線維芽細胞。
| コンポーネント | オステオジェニック培地 | 軟骨形成培地 | アジポジェニックメディア |
| 基礎培地 | 90 mLの | 90 mLの | 90 mLの |
| 誘導媒体 | 10 mLの | 10 mLの | 10 mLの |
| 総ボリューム | 100 mLの | 100 mLの | 100 mLの |
表3:SHEDのトリリネージ分化のための分化培地。
2. SHEDの培養と維持
- 細胞を10%MSC培養培地で維持し、2日ごとまたは必要に応じて培地交換を行います。
- 0.25%トリプシン-EDTAを使用して、95%のコンフルエントで細胞をトリプシン化します。
- トリプシン処理後、中和培地を用いて細胞を中和します。
- チューブを室温で300×gで6分間遠心分離し、細胞ペレットを得る。
- 上清をデカントし、細胞ペレットを10%MSC培地に再懸濁します。
- 10%MSC培地を含む新しく調製した細胞培養皿に細胞を播種し、さらなる実験または継代培養を行います。
注:SHEDの最適な播種密度は、100 mmディッシュで0.2 × 10 6セル、T-75フラスコで0.8 × 10 6セルであり、90〜100%のコンフルエントでそれぞれ1.5 × 10 6セルおよび4 × 10 6セルが得られます。
3. 間葉系幹細胞の特性評価
- 短期細胞増殖アッセイ
- 4×104 細胞/ウェルを3回に播種し、10%MSC培地中の6ウェルプレートに入れます。
- プレートを37°Cで7日間インキュベートし、2日ごとに培地交換を行います。
- 2日目、4日目、8日目に0.25%トリプシン処理を用いて細胞を回収し、培地で洗浄します。
- 細胞を室温で300gで6分間遠心分離し、ペレットを1mLの培地に再懸濁します。
- 血球計算盤を使用して細胞をカウントし、トリパンブルー除外法によってそれらの生存率を決定します。
- 式(1)を使用して増殖率を計算します。
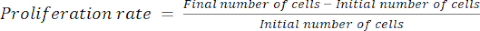 (1)
(1)
- コロニー形成ユニット線維芽細胞(CFU-F)アッセイ
- 100 mmのディッシュに10,000個の細胞を播種し、20%MSC培地で培養します。
- プレートを37°Cで14日間インキュベートし、3日ごとに培地交換を行います。
- 14日後、PBSでコロニーをすすぎ、メタノール中のクリスタルバイオレット色素で固定し、再度PBSですすぎ、残留汚れを除去します。
- コロニーを数えて画像化します。
注:>50セルのコロニーをカウントします。コロニー形成効率は、コロニー形成ユニット番号として計算されます。
- 免疫蛍光アッセイ
- MSCを35 mmの皿に播種し、80〜90%のコンフルエントになるまで増殖させます。
- 培地を取り除き、PBSで一度皿をすすぎます。
- 1 mLの4%パラホルムアルデヒド(PFA)で、室温で1時間インキュベートするか、4°Cで一晩インキュベートして、細胞を固定します。
- 固定後、ロッカー上でPBSTで3 x 5分間ウェルを洗浄します。
- 0.3% Triton X-100 in PBST (0.05% Tween 20 solution in PBS)を添加して細胞を透過処理します。室温で15分間ロッカーに保管してください。
- ロッカー上でPBSTで3 x 5分間ウェルを洗浄します。
- ブロッキング用に3%ウシ血清アルブミン(BSA)を加え、室温で1時間ロッカー上に保持します。
- ロッカー上でPBSTで3 x 5分間ウェルを洗浄します。
- 800 μL の 1:500 希釈マウス抗ビメンチンを添加し、ロッカー上に室温で 1 時間保持し、プレートを 4 °C に移して一晩インキュベートします。
- 翌日、一次抗体を除去し、ロッカー上でPBSTで5分×3分間ウェルを洗浄します。
- 希釈率1:1,000のヤギ抗マウスIgG(H+L)交差吸着二次抗体Alexa Fluor 555を800μL添加し、ロッカー上で室温で3時間保持します。
- ロッカー上でPBSTで3 x 5分間ウェルを洗浄します。
- Alexa fluor 488 Phalloidin Probes 240 μLを1,000 μLのPBSに添加し、ロッカー上で室温で60分間インキュベートします。
- ロッカー上でPBSTで3 x 5分間ウェルを洗浄します。
- 700 μLのDAPI封入剤を添加し、顕微鏡で細胞を観察します。
- 系統特異的な分化
- 2D培養後の分化
- 2枚の48ウェルプレートを採取し、それぞれ骨形成系統と脂肪形成系統としてラベル付けします。
- 各プレートの4つのウェルに15,000個の細胞/ウェルを播種し、10%MSC培地で培養します。
- 細胞の単層が90%のコンフルエントに達したら、最初の2つのウェルに「コントロール」とラベルを付け、既存の培地を血清欠乏培地(2%培地)に置き換えます。「Test」とラベル付けされた最後の2つのウェルに、脂肪形成性または骨形成性の2つの系統のいずれかの分化培地を追加します。これを 0 日目としてマークします。
- 剥がれを避けるために、3日ごとにメディアを静かに交換し、汚染しないように注意してください。
- これらの条件を21日目まで維持する。その後、染色実験を行います。
- 3D培養後の分化
- 15 mLチューブを2本用意し、3Dペレット培養を用いて軟骨形成分化を行います。
- 1×106個の細胞を各チューブに移し、300 × g で6分間遠心分離してペレットを形成します。1本のチューブに「コントロール」とラベルを付け、10%MSC培地を添加します。もう一方のチューブに「テスト」とラベルを付け、軟骨形成分化培地を添加します。チューブをインキュベーターに慎重に置き、キャップを緩くねじ込みます。これを 0 日目としてマークします。
- 培地交換中にペレットが外れたり崩壊したりしないように、3日ごとに培地を慎重に交換してください。
- これらの条件を21日目まで維持し、その後、さらなる実験のために細胞を処理します。
- 2D培養後の分化
- 系統特異的細胞化学染色
- 2D培養の場合は、分化型MSC(試験用)および未分化型MSC(コントロール)プレート(ステップ3.4.1.5以降)を使用して染色し、まず培地を取り除き、PBSで2回洗浄します。4% PFAで室温で30分間細胞を固定し、上清を除去し、PBSで1回洗浄します。以下のように系統ごとに染色を行います。
- 脂肪細胞系統の場合は、キットから透過処理液を添加し、プレートを室温で5分間インキュベートします。1 mLのオイルレッドOワーキング溶液を調製して加え、10分間保持します。汚れを取り除き、蒸留水で5回洗います。
- 骨細胞系統の場合は、調製したばかりの硝酸銀(蒸留水)の5%を各ウェルに加え、プレートを1時間UV下に保ちます。溶液を取り除き、2.5%のチオ硫酸ナトリウムを加えて未反応の銀を除去します。5分間保管します。汚れを取り除き、蒸留水で2回洗浄し、染色された細胞を顕微鏡で観察します。
- 3D培養の場合は、ステップ3.4.2.3の分化期間終了後にペレットを採取し、分化した組織の凍結切片をペレットの形で取得します。スライドを風乾させ、室温に戻してから染色に進みます。
- 軟骨細胞系統の場合は、染色キットの指示に従って十分な量の洗浄液を添加し、それを除去し、固定液を加えて30分間インキュベートします。蒸留水で洗浄し、染色液を加え、30分間インキュベートします。0.1Nの塩酸で3回洗浄します。蒸留水を加えて酸性度を中和します。染色した細胞を明視野顕微鏡で観察します。
- 2D培養の場合は、分化型MSC(試験用)および未分化型MSC(コントロール)プレート(ステップ3.4.1.5以降)を使用して染色し、まず培地を取り除き、PBSで2回洗浄します。4% PFAで室温で30分間細胞を固定し、上清を除去し、PBSで1回洗浄します。以下のように系統ごとに染色を行います。
4. イムノフェノタイピングのための細胞表面染色
注:ステップ 4.2-4.5 で最適な数の細胞を得るための推奨細胞培養プレートは、100 mm ディッシュまたは T75 フラスコです。
- フローサイトメトリー実験のための細胞調製
- コンフルエントディッシュ/フラスコから細胞をトリプシン化して回収し、300 × g で6分間遠心分離して細胞ペレットを得ます。
- ペレットを1 mLの培地に再懸濁し、トリパンブルー排除法に従って血球計算盤を使用して生細胞数を決定します。
- 計数後に細胞懸濁液を再度遠心分離し、1 mLの染色バッファーでペレットをさらに2回洗浄します。
- 上清を廃棄し、最後にプロトコルに応じて適切な量の染色バッファーにペレットを再懸濁します(ステップ4.2〜4.5を参照)。
- 報酬管理の準備
- 7本のFACSチューブを採取し、Unstained、DAPI、V450、FITC、PE、PerCP-Cy 5.5、およびAPCとラベル付けします。
- 最終ペレットを染色バッファー(ステップ4.1を参照)に再懸濁し、細胞密度を0.5×10 6細胞/50 μL/チューブ(未染色チューブおよびDAPIチューブ)に保ちます。
- 表4に記載のとおり、補正のためにシングルステインチューブを準備します。
- 調製後、各チューブを静かにボルテックスし、暗所で30分間インキュベートします。
- インキュベーション後、各チューブに染色バッファー1 mLを添加して2回洗浄し、その後、室温で200 g で10分間、短時間のボルテックスと遠心分離を行います。
- 上清を廃棄し、ペレットを500 μLの染色緩衝液に再懸濁し、取り込みまで置いておきます。
- DAPIチューブは、60°Cのウォーターバス中で5分間インキュベートした後、氷上で15分間インキュベートしてヒートショック処理を行ってください。懸濁液に 5 μL の DAPI を添加し、泳動が取り込まれるまで暗所に保管します。
- 蛍光マイナス1(FMO)コントロールの調製
- 最終ペレットを染色バッファーに再懸濁し(ステップ4.1を参照)、細胞密度を0.5×10、各チューブ50 μLあたり6 細胞に保ちます。
- 5本のFACSチューブを採取し、CD44-V450アイソタイプ、CD90-FITC、CD45-PE、CD73-PerCP Cy5.5アイソタイプ、およびCD105-APCアイソタイプとしてラベル付けします。
- 表5に従って細胞および抗体懸濁液を調製する。
- チューブを静かにボルテックスし、暗所で室温で30分間インキュベートします。
- インキュベーション後、各チューブに1 mLの染色バッファーで2回洗浄し、その後、室温で200 g で10分間、短時間のボルテックスと遠心分離を行います。
- 上清を廃棄し、ペレットを500 μLの染色緩衝液に再懸濁し、取り込むまで置いておきます。
- 分析用サンプルの調製
- 最終ペレットを染色バッファーに再懸濁し(ステップ4.1を参照)、細胞密度を0.5×10、各チューブ50 μLあたり6 細胞に保ちます。
- 2本のFACSチューブを用意し、混合チューブ1と2のラベルを付けます。
- 表6に従って細胞および抗体懸濁液を調製する。
- チューブを静かにボルテックスし、暗所で室温で30分間インキュベートします。
- インキュベーション後、各チューブに1 mLの染色バッファーで2回洗浄し、その後、室温で200 g で10分間、短時間のボルテックスと遠心分離を行います。
- 上清を廃棄し、ペレットを500 μLの染色緩衝液に再懸濁し、取り込むまで置いておきます。
- シングルセルソーティング用サンプルの調製
- 2本のFACSチューブを用意し、1mLのFBSを加え、各チューブの内側にFBSの均一な層が形成されるまでチューブを転がします。これを1〜2時間インキュベートし、染色用のサンプルを処理します。これらのチューブに「混合チューブ 1 と 2」というラベルを付けます。
- 最終ペレットを染色バッファーに再懸濁し(ステップ4.1を参照)、各チューブの細胞密度を2〜3×10〜6 細胞/50μLに保ちます。
- 細胞および抗体懸濁液を 表7に従って混合チューブ1および2に調製する。
- チューブを静かにボルテックスし、暗所で室温で30分間インキュベートします。
- インキュベーション後、各チューブに1 mLの染色バッファーで2回洗浄し、その後、室温で200 g で10分間、短時間のボルテックスと遠心分離を行います。
- 上清を廃棄し、ペレットを500 μLの染色バッファーに再懸濁し、取っておきます。選別15分前に5 μLのDAPIを添加します。
注:ソーティング実験では、チューブあたりの細胞密度を高くすることが推奨されます。
| チューブタイプ | ポジティブコンプビーズ* | ネガティブコンプビーズ* | 細胞 | 抗体添加 | |
| FITCチューブ | 1滴 | 1滴 | – | 抗ヒトCD90-FITCの(2 μL) | |
| V450チューブ | 1滴 | 1滴 | – | 抗ヒトCD44-V450(2μL) | |
| PerCP-Cy 5.5チューブ | 1滴 | 1滴 | – | 抗ヒト CD73-PerCP Cy 5.5 (2 μL) | |
| PEチューブ | 1滴 | 1滴 | – | 抗ヒトCD45-PE(2μL) | |
| APCチューブ | 1滴 | 1滴 | – | 抗ヒトCD105-APC(2μL) | |
| DAPIチューブ | – | – | 50 μL | – | |
| 未染色チューブ | – | – | 50 μL | – | |
| *1滴=ビーズ懸濁液60μL | |||||
表4:補償制御サンプル。 略語:Comp =補償;DAPI = 4',6-ジアミジノ-2-フェニルインドール;FITC = フルオレセインイソチオシアネート;APC = アロフィコシアニン;PE = フィコエリトリン;PerCP = ペリジニン - クロロフィル - タンパク質。
| チューブタイプ | 陽性マーカーに対する抗体(2 μL) | 陰性マーカーに対する抗体 (2 μL) | アイソタイプ抗体添加(2 μL) | 抗体の総量 | 添加した細胞懸濁液の量 | 添加した染色緩衝液の量 | ||
| CD90-FITC FMOチューブ | - 抗ヒトCD44-V450 | 抗ヒトCD45-PE | FITC IgG1アイソタイプ | 10 μL | 50 μL | 40 μL | ||
| - 抗ヒトCD73 PerCP Cy 5.5 | ||||||||
| - 抗ヒトCD105-APC | ||||||||
| CD73-PerCP Cy5.5 FMOチューブ | - 抗ヒトCD44-V450 | 抗ヒトCD45-PE | PerCP Cy 5.5 IgG1 アイソタイプ | 10 μL | 50 μL | 40 μL | ||
| - 抗ヒトCD90-FITC | ||||||||
| - 抗ヒトCD105-APC | ||||||||
| CD44-V450 FMOチューブ | - 抗ヒトCD90-FITC | 抗ヒトCD45-PE | V450 IgG1 アイソタイプ | 10 μL | 50 μL | 40 μL | ||
| - 抗ヒトCD73-PerCP Cy 5.5 | ||||||||
| - 抗ヒトCD105-APC | ||||||||
| CD105-APC FMOチューブ | - 抗ヒトCD44-V450 | 抗ヒトCD45-PE | APC IgG1アイソタイプ | 10 μL | 50 μL | 40 μL | ||
| - 抗ヒトCD90-FITC | ||||||||
| - 抗ヒトCD73-PerCP Cy 5.5 | ||||||||
| CD45-PE FMOチューブ | - 抗ヒトCD44-V450 | - | PE IgG1アイソタイプ | 10 μL | 50 μL | 40 μL | ||
| - 抗ヒトCD90-FITC | ||||||||
| - 抗ヒトCD73-PerCP Cy 5.5 | ||||||||
| - 抗ヒトCD105-APC | ||||||||
表5:FMOコントロールサンプル。 略語:FMO =蛍光マイナス1;FITC = フルオレセインイソチオシアネート;APC = アロフィコシアニン;PE = フィコエリトリン;PerCP = ペリジニン - クロロフィル - タンパク質。
| チューブタイプ | 陽性マーカーに対する抗体(2 μL) | 陰性マーカーに対する抗体 (2 μL) | 抗体の総量 | 添加した細胞懸濁液の量 | 添加した染色緩衝液の量 | |
| 混合チューブ1 | - 抗ヒトCD44-V450 | 抗ヒトCD45-PE | 10 μL | 50 μL | 40 μL | |
| - 抗ヒトCD90-FITC | ||||||
| - 抗ヒトCD73-PerCP Cy5.5 | ||||||
| - 抗ヒトCD105-APC | ||||||
| 混合チューブ2 | - 抗ヒトCD44-V450 | 抗ヒトCD45-PE | 10 μL | 50 μL | 40 μL | |
| - 抗ヒトCD90-FITC | ||||||
| - 抗ヒトCD73-PerCP Cy5.5 | ||||||
| - 抗ヒトCD105-APC | ||||||
表6:SHEDのマルチカラーイムノフェノタイピング用のサンプルチューブ。 略語:SHEDs =ヒトの剥離乳歯からの幹細胞。PE = フィコエリトリン。
| チューブタイプ | 陽性マーカーに対する抗体 (3 μL) | 陰性マーカーに対する抗体(3 μL) | 抗体の総量 | 添加した細胞懸濁液の量 | 添加した染色バッファーの量 | |
| 混合チューブ1 | - 抗ヒトCD90-FITC | 抗ヒトCD45-PE | 9 μL | 50 μL | 41 μL | |
| - 抗ヒトCD73-PerCP Cy5.5 | ||||||
| 混合チューブ2 | - 抗ヒトCD90-FITC | 抗ヒトCD45-PE | 9 μL | 50 μL | 41 μL | |
| - 抗ヒトCD73-PerCP Cy5.5 | ||||||
表7:シングルセルソーティング反応チューブ。 略語:FITC =フルオレセインイソチオシアネート;PE = フィコエリトリン;PerCP = ペリジニン - クロロフィル - タンパク質。
5. シングルセルソーティング
- セルソーターの作製
- 選別機に100μmのノズルを取り付けます。
注意: 適切なノズルは、選別する粒子の直径の少なくとも5倍です。選別に使用するシース液は、サンプルの種類と実験の感度に基づいて決定する必要があります。この実験では、独自のシース液が使用されました。 - 毎日の機器品質チェック(QC)を行い、実験用のソーターをセットアップします。機器のセットアップに関する詳細なガイドについては、機器のマニュアルを参照してください。
- 選別機に100μmのノズルを取り付けます。
- 報酬マトリクスの設定
- ステップ4.2の単一染色補正チューブを使用して補正マトリックスを設定します。
- プロプライエタリなソフトウェアで、ツールバーから 「実験 」を選択し、「 補正設定」をクリックします。 報酬コントロールの作成 を開きます。
- マーカーを確認して確定します。「Compensation」という名前の新しい試験片が追加され、その下にマーカーコントロールという名前の新しいチューブがソフトウェアによって自動的に追加されます。
- Unstained チューブを選択して実行し、5,000 のイベントを記録します。ゲートをセルの母集団にドラッグし、すべての補正コントロールに適用します。これは、蛍光パラメータごとに電圧と負のゲートを設定するためです。
- 同様に、単一染色補正チューブを別々にロードし、データを記録して保存します。対象の母集団を区切るゲートを選択し、すべての補正コントロールに適用します。これは、各蛍光パラメータの正のゲートを設定するためです。
- ツールバーから [実験 ] を選択し、[ 報酬値の計算] リンクをクリックして保存します。
注:ソフトウェアを使用してオートコンプマトリックスを生成すると、混合チューブのどのチャンネルでも蛍光色素の電圧パラメータを変更することはできません。
- データ・アクイジション
- ステップ 4.3 から各チューブに 10,000 個の細胞を記録します。4.4細胞の免疫表現型を分析するためのデータを収集する。
- 回収装置の準備
- 選別した細胞集団の目的に応じて、6ウェル、24ウェル、48ウェル、または96ウェルプレートから選択します。
- ウェルを200〜500μLのFBSでコーティングし、プレートを2時間そのままにします。
- 2時間後、残留FBSを除去し、200〜500μLの10%MSC培養培地を添加します。
- 単一セルソートモードでのセルソート
- 混合チューブ1(ステップ4.5から)を実行し、10,000イベントを記録して、適切なゲーティング戦略を使用して、ソートする対象母集団のゲートを設定します。
- コレクションプレートをロードし、ターゲット細胞数を 2,500 〜 5,000細胞/ウェル に設定し、 シングルセルソート純度マスクを選択します。
- 選別された個体群を収集装置に集め、選別実験が終了するまで氷上に保管します。
- 完了したら、プレートを5%CO2 インキュベーターに移し、培養を37°Cに維持します。
注:取得後、生データファイルは.fcsファイル形式(v.3.0以降)としてエクスポートされました。各実験後に生成されたソートレポートには、割り当てられたウェルごとにソートされたイベント/セルの数が記録され、中止された競合の数が示されました。
結果
SHEDは、ビメンチン(赤色、III型中間フィラメント)、アクチンフィラメント(Alexa fluor 488 Phalloidin Probes)、およびDAPIで染色した核の発現を示す標準的な免疫蛍光アッセイで特性評価しました(図1A)。それらの増殖能力およびコロニー形成能力を推定するために、標準的な短期細胞増殖アッセイを実施しました。2日目から8日目にかけて増殖率が14.3倍に増加したことが図
ディスカッション
組織工学および再生医療の分野では、出生後の情報源の中で、口腔組織由来のMSCは、その最小限の倫理的義務と顕著な多系統分化の可能性のために、深い関心を集めています21。影響を受けた第3大臼歯由来の歯髄幹細胞(DPSC)とSHEDは、神経変性疾患および外傷性疾患における治療の可能性について、歯科間幹細胞の中で最も注目を集めています22。この原稿?...
開示事項
著者らは、この論文の出版に関して利益相反がないことを宣言します。
謝辞
インドのバンガロールにあるジャワハルラール・ネルー先端科学研究センターのフローセル施設には、フローサイトメトリーのコア施設をご利用いただき、感謝いたします。分化細胞のペレット培養の凍結切片は、インドのバンガロールにあるNeuberg Anand Reference Laboratoryで実施されました。この研究は、インドのマニパル高等教育アカデミー(MAHE)からのUCの学内資金によって支援されました。AGは、MAHEからのDr. T. M. A. Pai Scholarshipの支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Alcian Blue Stain | HiMedia | CCK029-1KT | |
| Antibiotic-Antimycotic (100x) | Gibco by ThermoFisher | 15240062 | |
| BD CompBead Plus Anti-Mouse Ig, κ/Negative Control (BSA) Compensation Plus (7.5 µm) Particles Set | BD Biosciences | 560497 | |
| BD FACS Accudrop Beads | BD Biosciences | 345249 | Used to set up the Laser delay when the sort module opens. |
| BD FACS Aria Fusion Flow cytometer | BD Biosciences | --- | |
| BD FACS Diva 9.4 | BD Biosciences | --- | |
| BD FACS Sheath Fluid | BD Biosciences | 342003 | Used as sheath fluid for both analysis and sorting experiments in the BD FACSAria Fusion |
| BD FACSDiva CS&T Research Beads | BD Biosciences | 655050 | Used for Instrument configuration depending on the nozzle size. |
| BD Horizon V450 Mouse Anti-Human CD44 | BD Biosciences | 561292 | |
| BD Horizon V450 Mouse IgG2b, κ Isotype Control | BD Biosciences | 560374 | CD44-V450 isotype |
| BD Pharmingen APC Mouse Anti-Human CD105 | BD Biosciences | 562408 | |
| BD Pharmingen APC Mouse IgG1, κ Isotype Control | BD Biosciences | 555751 | CD105-APC isotype |
| BD Pharmingen DAPI Solution | BD Biosciences | 564907 | DAPI Stock solution of 1 mg/mL |
| BD Pharmingen FITC Mouse Anti-Human CD90 | BD Biosciences | 555595 | |
| BD Pharmingen FITC Mouse IgG1, κ Isotype Control | BD Biosciences | 555748 | CD90-FITC isotype |
| BD Pharmingen PE Mouse Anti-Human CD45 | BD Biosciences | 555483 | |
| BD Pharmingen PE Mouse IgG1, κ Isotype Control | BD Biosciences | 555749 | CD45-PE isotype |
| BD Pharmingen PerCP-Cy 5.5 Mouse Anti-Human CD73 | BD Biosciences | 561260 | |
| BD Pharmingen PerCP-Cy 5.5 Mouse IgG1, κ Isotype Control | BD Biosciences | 550795 | CD73-PerCP-Cy 5.5 isotype |
| BD Pharmingen Purified Mouse Anti-Vimentin | BD Biosciences | 550513 | |
| Bovine serum albumin | Hi-Media | TC548-5G | |
| Crystal violet | Nice chemical pvt ltd | C33809 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-aldrich | D5652-50L | dPBS used for culture work and maintenance. |
| Ethanol | --- | --- | Used for general sterlization. |
| Fetal Bovine Serum | Gibco by ThermoFisher | 10270-106 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | ThermoFisher Scientific | A-21422 | |
| KO-DMEM | Gibco by ThermoFisher | 10829018 | Basal medium for undifferentiated hESCs, used in the preparation of culture media |
| L-Glutamine 200mM (100x) | Gibco by ThermoFisher | 25030-081 | |
| Methanol, for Molecular Biology | Hi-Media | MB113 | |
| Oil red O | HiMedia | CCK013-1KT | |
| Paraformaldehyde | loba chemie | 30525-89-4 | |
| Penicillin Streptomycin (100x) | Gibco by ThermoFisher | 15140- 122 | |
| Phalloidin (ActinGreen 488 ReadyProbes reagent) | Invitrogen | R37110 | |
| Silver Nitrate | HiMedia | MB156-25G | |
| Sodium Thiosulphate pentahydrate | Chemport | 10102-17-7 | |
| Sphero Rainbow Fluorescent Particles, 3.0 - 3.4 µm | BD Biosciences | 556291 | |
| Staining buffer | Prepared in MIRM | ---- | It was prepared using 2% FBS in PBS |
| StemPro Adipogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10410-01 | Basal media for Adipogenic media |
| StemPro Adipogenesis Supplement | Gibco by ThermoFisher | A10065-01 | Induction media for Adipogenic media |
| StemPro Chondrogenesis Supplement | Gibco by ThermoFisher | A10064-01 | Induction media for Chondrogenic media |
| StemPro Osteogenesis Supplement | Gibco by ThermoFisher | A10066-01 | Induction media for Osteoogenic media |
| StemPro Osteogenesis/Chondrogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10069-01 | Basal media for both Ostegenic and Chondrogenic media |
| Triton-X-100 | Hi-Media | MB031 | |
| Trypan Blue | Gibco by life technologies | 15250-061 | |
| Trypsin - EDTA Solution 1x | Hi-media | TCL049 | |
| Tween-20 | MERCK | 9005-64-5 |
参考文献
- Kobolak, J., Dinnyes, A., Memic, A., Khademhosseini, A., Mobasheri, A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods. 99, 62-68 (2016).
- Wilson, A., Hodgson-Garms, M., Frith, J. E., Genever, P. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Frontiers in Immunology. 10, 1112 (2019).
- Li, J., et al. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Molecular Medicine Reports. 18 (6), 4969-4977 (2018).
- McLeod, C. M., Mauck, R. L. On the origin and impact of mesenchymal stem cell heterogeneity: new insights and emerging tools for single cell analysis. European Cells & Materials. 34, 217-231 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Wang, J., Liao, L., Wang, S., Tan, J. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations. Cytotherapy. 15 (8), 893-904 (2013).
- Kern, S., Eichler, H., Stoeve, J., Kluter, H., Bieback, K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 24 (5), 1294-1301 (2006).
- Dunn, C. M., Kameishi, S., Grainger, D. W., Okano, T. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell-based therapies. Acta Biomaterialia. 133, 114-125 (2021).
- Yang, Y. K., Ogando, C. R., Wang See, C., Chang, T. Y., Barabino, G. A. Changes in phenotype and differentiation potential of human mesenchymal stem cells aging in vitro. Stem Cell Research & Therapy. 9 (1), 131 (2018).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences. 78 (2), 447-467 (2021).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Review of Scientific Instruments. 43 (3), 404-409 (1972).
- Schulte, R., et al. Index sorting resolves heterogeneous murine hematopoietic stem cell populations. Experimental Hematology. 43 (9), 803-811 (2015).
- Liao, X., Makris, M., Luo, X. M. Fluorescence-activated cell sorting for purification of plasmacytoid dendritic cells from the mouse bone marrow. Journal of Visualized Experiments. (117), (2016).
- Roda, B., et al. A novel stem cell tag-less sorting method. Stem Cell Reviews and Reports. 5 (4), 420-427 (2009).
- Hall, S. R., et al. Identification and isolation of small CD44-negative mesenchymal stem/progenitor cells from human bone marrow using elutriation and polychromatic flow cytometry. Stem Cells Translational Medicine. 2 (8), 567-578 (2013).
- Eggleton, M. J., Sharp, A. A. Platelet counting using the Coulter electronic counter. Journal of Clinical Pathology. 16 (2), 164-167 (1963).
- Porwit-Ksiazek, A., Aman, P., Ksiazek, T., Biberfeld, P. Leu 7+ (HNK-1+) cells. II. Characterization of blood Leu 7+ cells with respect to immunophenotype and cell density. Scandinavian Journal of Immunology. 18 (6), 495-449 (1983).
- Hewitt, Z., et al. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning and Stem Cells. 8 (3), 225-234 (2006).
- Singh, A. M. An efficient protocol for single-cell cloning human pluripotent stem cells. Frontiers in Cell and Developmental Biology. 7, 11 (2019).
- Wilson, N. K., et al. Combined single-cell functional and gene expression analysis resolves heterogeneity within stem cell populations. Cell Stem Cell. 16 (6), 712-724 (2015).
- Zhou, L. L., et al. Oral mesenchymal stem/progenitor cells: the immunomodulatory masters. Stem Cells Inernational. 2020, 1327405 (2020).
- Fawzy El-Sayed, K. M., et al. Adult mesenchymal stem cells explored in the dental field. Advances in Biochemical Engineering/Biotechnology. 130, 89-103 (2013).
- Hardy, W. R., et al. Transcriptional networks in single perivascular cells sorted from human adipose tissue reveal a hierarchy of mesenchymal stem cells. Stem Cells. 35 (5), 1273-1289 (2017).
- . . FACSAria Fusion User's Guide. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved