A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיון חד-תאי של תאי גזע מזנכימליים אימונופנוטיפיים משיניים נשירות שעברו קילוף אנושי
In This Article
Summary
פרוטוקול זה מתאר את השימוש במיון תאים המופעלים על ידי פלואורסצנטיות של תאי גזע מזנכימליים אנושיים בשיטת המיון של תא יחיד. באופן ספציפי, השימוש במיון תא בודד יכול להשיג טוהר של 99% של התאים האימונופנוטיפיים מאוכלוסייה הטרוגנית בשילוב עם גישה מבוססת ציטומטריית זרימה מולטי-פרמטרית.
Abstract
תאי הגזע המזנכימליים (MSCs) של אורגניזם הם בעלי יכולת יוצאת דופן להתמיין לשושלות מרובות של תאים בוגרים בגוף וידועים בתכונותיהם האימונומודולטוריות והאנטי דלקתיות. השימוש בתאי גזע אלה הוא ברכה לתחום הביולוגיה הרגנרטיבית, אך בה בעת, פגע ברפואה רגנרטיבית ובטיפולים בשל העמימות התאית המרובים הקשורים אליהם. עמימות זו עשויה לנבוע מהמגוון במקור של תאי גזע אלה ומתנאי הגידול שלהם במבחנה , שניהם משקפים את ההטרוגניות התפקודית שלהם.
זה מצדיק מתודולוגיות לספק אוכלוסיות מטוהרות והומוגניות של MSCs ליישומים טיפוליים. ההתקדמות בתחום ציטומטריית הזרימה אפשרה זיהוי אוכלוסיות חד-תאיות בגישה רב-פרמטרית. פרוטוקול זה מתווה דרך לזהות ולטהר תאי גזע משיני נשירים אנושיים (SHEDs) באמצעות מיון חד-תאי בסיוע פלואורסצנטי. ביטוי סימולטני של סמנים על פני השטח, כלומר, CD90-fluorescein isothiocyanate (FITC), CD73-peridinin-chlorophyll-protein (PerCP-Cy5.5), CD105-allophycocyanin (APC), ו- CD44-V450, זיהה את הביטויים החיוביים "הבהירים" של MSCs באמצעות ציטומטריית זרימה רב-פרמטרית. עם זאת, נצפתה ירידה משמעותית באחוזים של מבטאים מרובעים של סמנים חיוביים אלה מקטע 7 ואילך לקטעים המאוחרים יותר.
תת-האוכלוסיות האימונופנוטיפיות מוינו באמצעות מצב מיון של תא בודד, שבו רק שני סמן חיובי וסמן שלילי אחד היוו את קריטריוני ההכללה. מתודולוגיה זו הבטיחה את יכולת הקיום של התאים של האוכלוסיות הממוינות ושמרה על התפשטות תאים לאחר המיון. היישום במורד הזרם עבור מיון כזה יכול לשמש להערכת הבחנה ספציפית לשושלת עבור תת-אוכלוסיות מגודרות. גישה זו יכולה להיות מיושמת במערכות חד-תאיות אחרות כדי לשפר את תנאי הבידוד ולהשיג מידע על סמנים מרובים של פני התא.
Introduction
תאי גזע מזנכימליים (MSCs) יכולים להיחשב כמקור מדרגי של תאים המתאימים לטיפולים מבוססי תאים ועשויים להיחשב למערכת תקן זהב ברפואה רגנרטיבית. תאים אלה יכולים להיות מבודדים ממגוון מקורות בגוף עם מקורות רקמה שונים1. בהתאם לרקמת המקור שלהם, כל סוג של MSC מציג התנהגות חוץ גופית מעורפלת2. זה נצפה היטב בתכונות המורפולוגיות והפונקציונליות שלהם3. מחקרים רבים הראו שונות תוך-שבטית במימדים, כולל התמיינות רקמות בוגרות, מצב גנומי וארכיטקטורה מטבולית ותאית של MSCs 2,4.
אימונופנוטיפ של תאים היה יישום נפוץ של ציטומטריית זרימה לזיהוי תאי גזע וזה נוצל על ידי האגודה הבינלאומית לתרפיה תאית וגנטית (ISCT) בשנת 2006 כדי לקבוע רשימה של קריטריונים מינימליים לזיהוי תאים כ- MSC. הוא קבע כי יחד עם היצמדות פלסטית והיכולת להתמיין לשלוש שושלות (אוסטאוגנית, כונדרוגנית ואדיפוגנית) במבחנה, ≥95% מאוכלוסיית התאים חייבת לבטא CD105, CD73, CD90, ותאים אלה חייבים להיות חסרים את הביטוי (≤2% חיובי) של CD34, CD45, CD11b, CD14 ו- HLA-DR, כפי שנמדד על ידי ציטומטריית זרימה5. אף על פי שה-MSCs הוגדרו על ידי קבוצה של סמנים ביולוגיים תחת הקריטריונים המינימליים של ISCT, לא ניתן היה למדוד את התכונות החיסוניות שלהם עם סמנים ביולוגיים אלה והיה צורך ביותר מעבר לקריטריונים אלה כדי להקל על השוואות צולבות ושינויים שבטיים לכימות2.
למרות ההנחיות שנקבעו על ידי ISCT, מחקר מקיף על MSCs הראה כי הטרוגניות קיימת באוכלוסייה זו, אשר יכולה לנבוע ממספר רב של גורמים, בעיקר בשל האופי הנפוץ של הטרוגניות המתעוררת בין תורמי MSC6, מקורות רקמות7, תאים בודדים בתוך אוכלוסיית שבטים8, ותנאי תרבית2,9, 10. אפיון וטיהור של תאים ראשוניים אלה ממגוון מקורות רקמה כדי להבטיח איכות וגורל התא הם שלבי מפתח בייצורם. הצורך להבין את השונות המוצגת באוכלוסייה מחייב שיטה יעילה כדי לפתור אותה לתת-אוכלוסיות שניתן לחלק ולאסוף בנפרד11. אנליזות ברמת התא הבודד מסייעות להתגבר על האתגרים של שונות תא-תא, להפחית רעש ביולוגי הנובע מאוכלוסייה הטרוגנית, ולהציע את היכולת לחקור ולאפיין תאים נדירים12.
בהתאם למטרה ולפרמטרים שנבחרו, ניתן להשתמש במספר שיטות כדי למיין ולהעשיר את האוכלוסיות שנבחרו. טכניקות מיון תאים יכולות לכלול הן מיון בתפזורת והן שיטות מיון של תא יחיד. בעוד שמיון בתפזורת יכול להעשיר אוכלוסיות יעד באמצעות מיון תאים המופעלים מגנטית (MACS)13, שבר 14 ואלוטריציה 15, מיון תא בודד יכול להעשיר אוכלוסיות הומוגניות יותר באמצעות מיון תאים המופעלים על ידי פלואורסצנטיות (FACS)11. ניתוח השוואתי של כל אחת משיטות אלה עם מערך יתרונות וחסרונות משלה מודגש בטבלה 1.
טבלה 1: ניתוחים השוואתיים של טכניקות שונות: MACS, Fractionation, Elutriation ו-FACS המדגישים את ההבדלים בעיקרון שלהם ואת היתרונות והחסרונות של בחירת טכניקה מסוימת על פני אחרת. קיצורים: MACS = מיון תאים המופעל באמצעות מגנטית; FACS = מיון תאים המופעל על ידי פלואורסצנטיות. אנא לחץ כאן כדי להוריד טבלה זו.
מאז הופעת הטכניקה, ציטומטריית זרימה של תא בודד מילאה תפקיד מרכזי בספירה16, גילוי ואפיון של אוכלוסיית תאים ספציפית במדגם הטרוגני17. יואיט ועמיתיו הניחו בשנת 2006 את הבסיס למתודולוגיית מיון תאים אוטומטית כדי לשפר את הבידוד של מאגרים הומוגניים של תאי גזע עובריים אנושיים ממוינים (hESCs)18. מיון חד-תאי העשיר את אוכלוסיית תאי גזע עוברי גזע עוברי GFP והקל על בידוד שיבוטים מהונדסים גנטית, מה שפתח ממד חדש במחקר הקליני. כדי לשפר את יעילות המיון, ננקטו בדרך כלל שתי גישות; או שמדיית האיסוף של האוכלוסיות הממוינות משתנה כדי לקיים את הקיום וההתרבות של תאים לאחר מיון19 או שהאלגוריתם/התוכנה למיון תאים משתנים כראוי12.
עם התקדמות הטכנולוגיה, ציטומטרים מסחריים של זרימה וממייני תאים הצליחו לסייע בהתמודדות עם אתגרים שנענו תוך מיון אספטי של אוכלוסיות תאים שבריריות ונדירות, במיוחד תאי גזע ממקורות שונים. אחד האתגרים העיקריים של ביולוגים של תאי גזע היה בידוד השבט של תאי גזע פלוריפוטנטיים אנושיים בעקבות פרוטוקולי טרנספקציה הנדרשים במחקרי עריכת גנים19. זה טופל על ידי מיון תאים בודדים ללוחות של 96 בארות שצופו בפיברובלסטים עובריים של עכברים (MEFs) יחד עם תוספי מזון ומעכבי ROCK מסחריים של מולקולות קטנות. עם זאת, אסטרטגיות בידוד תאים יכולות להיות מעודנות במידה רבה באמצעות שימוש במיון אינדקסים, תכונה של אלגוריתם המיון המזהה את האימונופנוטיפ של תאים בודדים ממוינים12. שיטה מעודנת זו במיון תאים בודדים סייעה לא רק בשיפור יעילות המיון של תאי גזע, במיוחד ביחס לאוכלוסיות נדירות של תאי גזע המטופויטיים, אלא גם קישרה ביעילות שיבוטים של תאים בודדים למבחני התפקוד שלהם במורד הזרם20.
מאמר זה מתמקד במיון חד-תאי של תאי גזע אימונופנוטיפיים משיניים נשירות מתקלפות אנושיות (SHEDs) להעשרת תת-אוכלוסיות כדי לחקור את יכולות ההתמיינות התפקודית שלהן. באמצעות שילוב של שני סמנים חיוביים ל-MSC, CD90 ו-CD73, וסמן המטופויטי שלילי CD45, ה-MSCs עברו אימונופנוטיפ וזוהו המבטאים העמומים והאפסיים. בהתבסס על האימונופנוטיפ שלהם, תת-האוכלוסיות זוהו כ-MSCs טהורים, אוכלוסיות חיוביות בודדות ושליליות כפולות. הם מוינו באמצעות מצב מיון של תא בודד כדי לקבל תת-אוכלוסיות טהורות ומועשרות למחקרים פונקציונליים נוספים כדי לזהות אם הביטוי הדיפרנציאלי של סמנים היה תוצר של תנאי תרבית חוץ גופית או אם יש לו השפעה כלשהי גם על התכונות הפונקציונליות. תאים שלא היו מבטאים הומוגניים של "סמני MSC חיוביים" מוינו כדי לחקור את התכונות התפקודיות שלהם.
Protocol
אישור אתיקה והסכמה להשתתף: דגימות מוך שיניים נשיר פילינג אנושי התקבלו לאחר קבלת הסכמה מדעת ואישור אתי מלא על ידי מכללת סרי רג'יב גנדי לרפואת שיניים ובית החולים (SRGCDS) מחלקת הפה והלסת בבנגלור, בהתאם לסטנדרטים שנקבעו על ידי הוועדה לאישור אתי של בית החולים, SRGCDS. לאחר מכן הבידוד, התרבית, התחזוקה והיישום של סככות אושרו על ידי ובהתאם להנחיות המומלצות על ידי הוועדה המוסדית לחקר תאי גזע (IC-SCR) במכון מניפל לרפואה רגנרטיבית, MAHE - בנגלור. עיין בטבלת החומרים לקבלת פרטים על כל החומרים והריאגנטים המשמשים בפרוטוקול זה.
1. הכנת ריאגנטים ומאגרים
- לתחזוקת התרבות
- הכן מדיה של תרביות תאי MSC (10%) באמצעות מדיום בסיסי עבור תאי גזע עובריים עובריים (HSC) לא ממוינים, 10% סרום בקר עוברי (FBS), 1% L-גלוטמין ו-1% פניצילין-סטרפטומיצין (Pen-strep) (טבלה 2).
- הכן מדיה של תרבית תאי MSC (20%) באמצעות מדיום בסיסי עבור תאי גזע עובריים בלתי ממוינים, 20% FBS, 1% L-גלוטמין ו-1% Pen-strep (טבלה 2).
- הכינו חומר מנטרל באמצעות מדיום בסיסי עבור תאי גזע עובריים עובריים בלתי ממוינים, 1% L-גלוטמין ו-1% אנטיביוטי-אנטי-מיקוטי (אנטי-אנטי) (טבלה 2).
- לניתוח ומיון ציטומטרי של זרימה
- הכן חיץ צביעה באמצעות 2% FBS במי מלח חוצצי פוספט (PBS).
- הכן תמיסת מלאי של 4′,6-diamidino-2-phenylindole (DAPI) (1 מיקרוגרם / מ"ל) על ידי הוספת 1 μL ב 1 מ"ל של PBS
- עבור הבחנה ספציפית לשושלת של MSCs
- הכינו אמצעי התמיינות להתמיינות אוסטאוגנית, כונדרוגנית ואדיפוגנית בהתאם להרכב המתואר בטבלה 3. אחסנו את האליציטוטים המוכנים בטמפרטורה של 4°C למשך הניסוי.
- הכינו חומרי הדפסה מורעבים לסרום (2% חומרי הדפסה) באמצעות מדיום בסיסי עבור תאי גזע עובריים עובריים בלתי מובחנים, 2% FBS, 1% L-גלוטמין ו-1% Pen-strep (טבלה 2).
| סוג המדיה | מטרת המדיה | הרכב עבור 50 מ"ל | ||||||||
| פ.ב.ס. | Pen-Strep | ל-גלוטמין | מדיום בסיסי עבור תאי גזע עובריים בלתי מובחנים | |||||||
| 10% מדיה | התרבות והתחזוקה של MSC | 5 מ"ל | 500 μL | 500 μL | 44 מ"ל | |||||
| 20% מדיה | בדיקת CFU-F | 10 מ"ל | 500 μL | 500 μL | 39 מ"ל | |||||
| סרום מורעב (2%) מדיה | מדיה לבארות בקרה בפרוטוקול בידול | 1 מ"ל | 500 μL | 500 μL | 48 מ"ל | |||||
| נטרול מדיה | מדיה לנטרול תרחיף התא לאחר טריפסיניזציה | - | 500 μL | 500 μL | 49 מ"ל | |||||
טבלה 2: מדיה של תרביות תאים לצורך תחזוקת תרביות ומבדקים. קיצורים: MSC = תא גזע מזנכימלי; CFU-F = יחידה יוצרת מושבה-פיברובלסט.
| רכיבים | מדיה אוסטאוגנית | מדיה כונדרוגנית | מדיה אדיפוגנית |
| בזל מדיה | 90 מ"ל | 90 מ"ל | 90 מ"ל |
| מדיה אינדוקציה | 10 מ"ל | 10 מ"ל | 10 מ"ל |
| נפח כולל | 100 מ"ל | 100 מ"ל | 100 מ"ל |
טבלה 3: מדיית בידול עבור התמיינות תלת-שושלת של SHEDs.
2. תרבות ותחזוקת סככות
- לשמור על תאים במדיית תרבית MSC של 10% ולבצע שינויי מדיה כל יומיים או לפי הצורך.
- טריפסיניזציה של תאים במפגש של 95% באמצעות 0.25% טריפסין-EDTA.
- נטרול תאים לאחר טריפסיניזציה באמצעות מדיה מנטרלת.
- צנטריפוגה את הצינור ב 300 × גרם במשך 6 דקות בטמפרטורת החדר כדי לקבל גלולה התא.
- דקנט את הסופרנאטנט והשהה מחדש את גלולת התא במדיה תרבית MSC של 10%.
- זרעו תאים לתוך צלחות תרבית תאים טריות המכילות 10% תרבית MSC מדיה לניסויים נוספים או תרבית משנה.
הערה: צפיפות הזריעה האופטימלית עבור סככות היא 0.2 × 10 6 תאים בצלחת 100 מ"מ ו 0.8 × 10 6 תאים בצלוחית T-75, כדי לקבל 1.5 × 106 תאים ו 4 × 10 6 תאים, בהתאמה, במפגש של 90-100%.
3. אפיון MSCs
- בדיקת צמיחת תאים לטווח קצר
- זרעים 4 × 104 תאים/באר בטריפליקט לצלחות 6 בארות ב-10% תרבית MSC.
- לדגור את הצלחות במשך 7 ימים ב 37 ° C, ולבצע שינויי מדיה כל 2 ימים.
- קצרו את התאים בימים 2, 4 ו-8 באמצעות טיפול של 0.25% טריפסין ושטפו בתרבית.
- צנטריפוגות את התאים ב 300 גרם במשך 6 דקות בטמפרטורת החדר להשעות מחדש את הגלולה ב 1 מ"ל של מדיה.
- ספרו את התאים באמצעות המוציטומטר וקבעו את הכדאיות שלהם בשיטת ההדרה הכחולה של טריפאן.
- חשב את קצב ההתפשטות באמצעות משוואה (1):
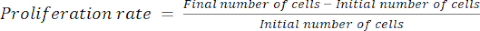 (1)
(1)
- בדיקת יחידה-פיברובלסט יוצרת-מושבה (CFU-F)
- זרעו 10,000 תאים בצלחת של 100 מ"מ ותרבו אותם בתרבית של 20% MSC.
- לדגור את הצלחות במשך 14 ימים ב 37 ° C, ולבצע שינויי מדיה כל 3 ימים.
- לאחר 14 יום, שטפו את המושבות עם PBS, תקנו אותן בצבע סגול קריסטלי במתנול, ושטפו שוב עם PBS כדי להסיר את שאריות הכתם.
- ספרו ודמיינו את המושבות.
הערה: ספירת מושבות עם >50 תאים. יעילות יצירת מושבות מחושבת כמספרי יחידות יוצרות מושבה.
- בדיקת Immunofluorescence
- זרעו את MSCs על כלים 35 מ"מ ולתת להם לגדול עד 80-90% מפגש.
- הסר את המדיה ושטוף את הכלים עם PBS פעם אחת.
- תקן את התאים עם 1 מ"ל של 4% paraformaldehyde (PFA) על ידי דגירה במשך 1 שעה בטמפרטורת החדר או לילה ב 4 ° C.
- לאחר הקיבוע, לשטוף את הבארות עם PBST במשך 3 x 5 דקות על נדנדה.
- הוסף 0.3% Triton X-100 ב- PBST (0.05% תמיסת Tween 20 ב- PBS) לחדירת התאים. שמור אותו על הנדנדה במשך 15 דקות בטמפרטורת החדר.
- לשטוף את הבארות עם PBST במשך 3 x 5 דקות על נדנדה.
- הוסיפו אלבומין בסרום בקר 3% (BSA) לחסימה ושמרו אותו על הנדנדה למשך שעה אחת בטמפרטורת החדר.
- לשטוף את הבארות עם PBST במשך 3 x 5 דקות על נדנדה.
- מוסיפים 800 μL של דילול 1:500 של עכבר אנטי וימנטין (anti-vimentin), שומרים אותו על הנדנדה למשך שעה אחת בטמפרטורת החדר, ומעבירים את הצלחת ל-4°C לדגירת לילה.
- למחרת, להסיר את הנוגדן העיקרי ולשטוף את הבארות עם PBST במשך 3 x 5 דקות על נדנדה.
- הוסף 800 μL של דילול 1:1,000 של נוגדן משני מסוג IgG (H+L) נגד עכבר עז, Alexa Fluor 555, ושמור אותו למשך 3 שעות בטמפרטורת החדר על הנדנדה.
- לשטוף את הבארות עם PBST במשך 3 x 5 דקות על נדנדה.
- הוסף את Alexa fluor 488 Phalloidin Probes 240 μL ב- 1,000 μL של PBS ודגור בטמפרטורת החדר במשך 60 דקות על הנדנדה.
- לשטוף את הבארות עם PBST במשך 3 x 5 דקות על נדנדה.
- הוסף 700 μL של DAPI mountant והתבונן בתאים תחת מיקרוסקופ.
- הבחנה ספציפית לשושלת
- בידול בעקבות תרבות דו-ממדית
- קחו שתי צלחות בנות 48 בארות ותייגו אותן כשושלות אוסטאוגניות ואדיפוגניות, בהתאמה.
- זרעו 15,000 תאים/באר בארבע בארות של כל צלחת ותרבו אותם ב-10% תרבית MSC.
- לאחר ששכבת התאים החד-שכבתית הגיעה למפגש של 90%, תייגו את שתי הבארות הראשונות כ"בקרה" והחליפו את המדיה הקיימת במדיה מורעבת בסרום (2% מדיה). בשתי הבארות האחרונות המסומנות כ'מבחן', הוסף אמצעי בידול של אחת משתי השושלות, אדיפוגנית או אוסטאוגנית. סמן זאת כיום 0.
- החליפו בעדינות את המדיה כל שלושה ימים כדי לעקוף את הקילוף והיזהרו כדי למנוע זיהום.
- לשמור על תנאים אלה עד היום העשרים ואחד; לאחר מכן תהליך לניסוי הצביעה.
- בידול בעקבות תרבות תלת ממדית
- קח שתי שפופרות 15 מ"ל לביצוע התמיינות כונדרוגנית באמצעות תרבית גלולות תלת מימד.
- מעבירים 1 × 106 תאים לכל צינור וצנטריפוגה ב 300 × גרם במשך 6 דקות כדי ליצור כדור. תייגו שפופרת אחת כ'שליטה' והוסיפו לה 10% מדיה תרבותית של MSC; תייגו את הצינור השני כ'בדיקה' והוסיפו אמצעי התמיינות כונדרוגניים. הניחו את הצינורות בזהירות באינקובטור כשהמכסים שלהם מוברגים באופן רופף. סמן זאת כיום 0.
- החליפו את המדיה כל שלושה ימים בזהירות, כדי לא לעקור/לפורר את הגלולה במהלך חילופי מדיה.
- שמור על תנאים אלה עד היום העשרים ואחד ולאחר מכן, לעבד את התאים לניסויים נוספים.
- בידול בעקבות תרבות דו-ממדית
- צביעה ציטוכימית ספציפית לשושלת
- עבור תרביות דו-ממדיות, השתמש בלוחות MSC (בקרה) מובחנים ולא מובחנים (משלב 3.4.1.5.) עבור צביעה, ותחילה, הסר את המדיה ושטוף פעמיים עם PBS. תקן את התאים באמצעות 4% PFA במשך 30 דקות בטמפרטורת החדר, להסיר את supernatant, ולשטוף פעם אחת עם PBS. בצע צביעה עבור כל שושלת באופן הבא.
- לשושלת אדיפוציטים, מוסיפים תמיסת חדירה מהערכה ודגרים על הצלחת במשך 5 דקות בטמפרטורת החדר. הכינו והוסיפו 1 מ"ל של תמיסת עבודה O אדום שמן ושמרו אותה למשך 10 דקות. הסירו את הכתם ותנו חמש שטיפות במים מזוקקים.
- לשושלת אוסטיאוציטים, הוסיפו 5% חנקת כסף טרייה (במים מזוקקים) לכל באר ושמרו את הצלחת תחת UV למשך שעה אחת. הסר את הפתרון ולהוסיף 2.5% של thiosulphate נתרן כדי להסיר את הכסף unreacted; שמור אותו למשך 5 דקות. הסירו את הכתם, שטפו פעמיים במים מזוקקים והתבוננו בתאים המוכתמים תחת מיקרוסקופ.
- עבור תרביות תלת ממדיות, לאסוף את הגלולה לאחר תום תקופת ההבחנה משלב 3.4.2.3 ולקבל cryosections של הרקמה המובחנת בצורה של הכדור. הניחו למגלשות להתייבש באוויר והיו בטמפרטורת החדר לפני שתמשיכו להכתמה.
- עבור שושלת כונדרוציטים, עקוב אחר ההוראות של ערכת הצביעה כדי להוסיף נפח מספיק של תמיסת כביסה, להסיר אותו, להוסיף את תמיסת הקיבוע, ולדגור במשך 30 דקות. יש לשטוף במים מזוקקים, להוסיף את תמיסת הכתמים ולדגור במשך 30 דקות. לשטוף שלוש פעמים עם 0.1 N חומצה הידרוכלורית; מוסיפים מים מזוקקים לנטרול החומציות. התבוננו בתאים המוכתמים תחת מיקרוסקופ שדה בהיר.
- עבור תרביות דו-ממדיות, השתמש בלוחות MSC (בקרה) מובחנים ולא מובחנים (משלב 3.4.1.5.) עבור צביעה, ותחילה, הסר את המדיה ושטוף פעמיים עם PBS. תקן את התאים באמצעות 4% PFA במשך 30 דקות בטמפרטורת החדר, להסיר את supernatant, ולשטוף פעם אחת עם PBS. בצע צביעה עבור כל שושלת באופן הבא.
4. צביעת פני התא לאימונופנוטיפ
הערה: לוחות תרבית תאים מומלצים לקבלת מספר אופטימלי של תאים בשלבים 4.2-4.5 הם צלחות 100 מ"מ או צלוחיות T75.
- הכנת תאים לניסויים ציטומטריים של זרימה
- טריפסינזציה ואיסוף התאים מצלחת/בקבוק וצנטריפוגה ב-300 × גרם למשך 6 דקות כדי לקבל את כדורית התא.
- השהה מחדש את הגלולה ב 1 מ"ל של מדיה ולקבוע את ספירת התאים קיימא באמצעות hemocytometer בעקבות שיטת הרחקה כחול trypan.
- צנטריפוגה את מתלה התא שוב לאחר ספירה ולתת שתי שטיפות נוספות לגלולה עם 1 מ"ל של חיץ צביעה.
- השליכו את הסופרנאטנט ולבסוף השהו מחדש את הגלולה בנפח מתאים של חיץ הצביעה בהתאם לפרוטוקול (ראו שלבים 4.2 עד 4.5).
- הכנת בקרות פיצוי
- קח שבעה צינורות FACS ותייג אותם כ- Unstained, DAPI, V450, FITC, PE, PerCP-Cy 5.5 ו- APC.
- השהה מחדש את הגלולה הסופית במאגר הצביעה (ראה שלב 4.1.) תוך שמירה על צפיפות תאים של 0.5 × 106 תאים לכל 50 מיקרוליטר לצינור עבור צינורות לא מוכתמים ו- DAPI.
- הכינו את הצינורות המוכתמים הבודדים לפיצוי כמתואר בטבלה 4.
- מערבלים בעדינות כל צינור לאחר ההכנה ודגרים בחושך במשך 30 דקות.
- לאחר הדגירה, יש לבצע שתי שטיפות על ידי הוספת 1 מ"ל של חיץ מכתים לכל צינור, ולאחר מכן מערבולות קצרות וצנטריפוגה ב-200 גרם למשך 10 דקות בטמפרטורת החדר.
- השליכו את הסופרנטנט, השעו מחדש את הגלולה ב-500 מיקרוליטר של חיץ מכתים, והניחו אותה בצד עד לרכישה.
- עבור צינור DAPI, בצע טיפול בהלם חום על ידי דגירה באמבט מים של 60 מעלות צלזיוס למשך 5 דקות ואחריו 15 דקות על קרח. הוסף 5 μL של DAPI למתלים ושמור אותו בחושך עד לרכישת הריצה.
- הכנת פקדים פלואורסצנטיים פחות אחד (FMO)
- השהה מחדש את הגלולה הסופית במאגר צביעה (ראה שלב 4.1) תוך שמירה על צפיפות תאים של 0.5 × 106 תאים לכל 50 מיקרוליטר לכל צינור.
- קח חמש שפופרות FACS ותייג אותן כאיזוטיפ CD44-V450, CD90-FITC, CD45-PE, איזוטיפ CD73-PerCP Cy5.5 ואיזוטיפ CD105-APC.
- הכינו את תרחיף התא והנוגדנים לפי טבלה 5.
- מערבבים את הצינורות בעדינות ודגרים עליהם במשך 30 דקות בטמפרטורת החדר בחושך.
- לאחר הדגירה, יש לתת שתי שטיפות עם 1 מ"ל של חיץ מכתים לכל צינור ולאחר מכן מערבולות קצרות וצנטריפוגה ב 200 גרם למשך 10 דקות בטמפרטורת החדר.
- השליכו את הסופרנטנט, השהו מחדש את הגלולה ב-500 מיקרוליטר של חיץ הכתמה, והניחו אותה בצד עד לרכישה.
- הכנת דגימות לניתוח
- השהה מחדש את הגלולה הסופית במאגר הצביעה (ראה שלב 4.1) תוך שמירה על צפיפות תאים של 0.5 × 106 תאים לכל 50 מיקרוליטר לכל צינור.
- קח שתי שפופרות FACS ותייג אותן כשפופרות מעורבות 1 ו- 2.
- הכינו את תרחיף התא והנוגדנים לפי טבלה 6.
- מערבבים את הצינורות בעדינות ודגרים עליהם במשך 30 דקות בטמפרטורת החדר בחושך.
- לאחר הדגירה, יש לתת שתי שטיפות עם 1 מ"ל של חיץ מכתים לכל צינור ולאחר מכן מערבולות קצרות וצנטריפוגה ב 200 גרם למשך 10 דקות בטמפרטורת החדר.
- השליכו את הסופרנטנט, השעו מחדש את הגלולה ב-500 מיקרוליטר של חיץ הכתמה, והניחו בצד עד לרכישה.
- הכנת דגימות למיון תא בודד
- קח שני צינורות FACS, הוסף 1mL של FBS, וגלגל את הצינור סביב עד שכבה שווה של FBS נוצר בחלק הפנימי של כל צינור. לדגור על זה במשך 1-2 שעות תוך עיבוד הדגימה עבור צביעה. תייגו צינורות אלה כשפופרות מעורבות 1 ו-2.
- השהה מחדש את הגלולה האחרונה במאגר הצביעה (ראה שלב 4.1) תוך שמירה על צפיפות תאים של 2-3 × 106 תאים לכל 50 מיקרוליטר לכל צינור.
- הכינו את תרחיף התא והנוגדנים בצינורות מעורבים 1 ו-2 לפי טבלה 7.
- מערבבים את הצינורות בעדינות ודגרים עליהם במשך 30 דקות בטמפרטורת החדר בחושך.
- לאחר הדגירה, יש לתת שתי שטיפות עם 1 מ"ל של חיץ מכתים לכל צינור ולאחר מכן מערבולות קצרות וצנטריפוגה ב 200 גרם למשך 10 דקות בטמפרטורת החדר.
- יש להשליך את הסופרנטנט, להשהות מחדש את הגלולה ב-500 מיקרוליטר של חיץ מכתים, ולהניח בצד. הוסף 5 μL של DAPI 15 דקות לפני המיון.
הערה: שים לב שעבור ניסויי מיון מומלצת צפיפות תאים גבוהה יותר לכל צינור.
| סוג צינור | חרוזי Comp חיוביים* | חרוזי Comp שליליים* | תאים | הוספת נוגדנים | |
| צינור FITC | 1 טיפה | 1 טיפה | – | CD90-FITC אנטי-אנושי (2 מיקרוליטר) | |
| צינור V450 | 1 טיפה | 1 טיפה | – | CD44-V450 אנטי-אנושי (2 מיקרוליטר) | |
| צינור PerCP-Cy 5.5 | 1 טיפה | 1 טיפה | – | CD73-PerCP Cy 5.5 אנטי-אנושי (2 μL) | |
| צינור PE | 1 טיפה | 1 טיפה | – | CD45-PE אנטי-אנושי (2 מיקרוליטר) | |
| צינור APC | 1 טיפה | 1 טיפה | – | CD105-APC אנטי-אנושי (2 מיקרוליטר) | |
| צינור DAPI | – | – | 50 מיקרוליטר | – | |
| צינור לא מוכתם | – | – | 50 מיקרוליטר | – | |
| *טיפה אחת = 60 מיקרוליטר של תרחיף חרוזים | |||||
טבלה 4: דגימות בקרת פיצוי. קיצורים: Comp = פיצוי; DAPI = 4',6-diamidino-2-phenylindole; FITC = isothiocyanate fluorescein; APC = allophycocyanin; PE = phycoerythrin; PerCP = פרידינין-כלורופיל-חלבון.
| סוג צינור | נוגדן נגד סמן חיובי (2 מיקרוליטר) | נוגדן נגד סמן שלילי (2 מיקרוליטר) | הוספת נוגדני איזוטיפ (2 מיקרוליטר) | נפח כולל של נוגדנים | נפח מתלה התא נוסף | נפח חיץ הצביעה נוסף | ||
| צינור FMO CD90-FITC | - CD44-V450 אנטי-אנושי | CD45-PE אנטי-אנושי | איזוטיפ FITC IgG1 | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | ||
| - CD73 אנטי-אנושי PerCP Cy 5.5 | ||||||||
| - CD105-APC אנטי-אנושי | ||||||||
| CD73-PerCP Cy5.5 FMO צינור | - CD44-V450 אנטי-אנושי | CD45-PE אנטי-אנושי | איזוטיפ PerCP Cy 5.5 IgG1 | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | ||
| - CD90-FITC אנטי-אנושי | ||||||||
| - CD105-APC אנטי-אנושי | ||||||||
| צינור FMO CD44-V450 | - CD90-FITC אנטי-אנושי | CD45-PE אנטי-אנושי | איזוטיפ V450 IgG1 | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | ||
| - CD73-PerCP Cy 5.5 אנטי-אנושי | ||||||||
| - CD105-APC אנטי-אנושי | ||||||||
| צינור FMO CD105-APC | - CD44-V450 אנטי-אנושי | CD45-PE אנטי-אנושי | איזוטיפ APC IgG1 | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | ||
| - CD90-FITC אנטי-אנושי | ||||||||
| - CD73-PerCP Cy 5.5 אנטי-אנושי | ||||||||
| צינור FMO CD45-PE | - CD44-V450 אנטי-אנושי | - | איזוטיפ PE IgG1 | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | ||
| - CD90-FITC אנטי-אנושי | ||||||||
| - CD73-PerCP Cy 5.5 אנטי-אנושי | ||||||||
| - CD105-APC אנטי-אנושי | ||||||||
טבלה 5: דגימות בקרת FMO. קיצורים: FMO = פלואורסצנטיות פחות אחת; FITC = isothiocyanate fluorescein; APC = allophycocyanin; PE = phycoerythrin; PerCP = פרידינין-כלורופיל-חלבון.
| סוג צינור | נוגדן נגד סמן חיובי (2 מיקרוליטר) | נוגדן נגד סמן שלילי (2 מיקרוליטר) | נפח כולל של נוגדנים | נפח מתלה התא נוסף | נפח חיץ הצביעה נוסף | |
| צינור מעורב 1 | - CD44-V450 אנטי-אנושי | CD45-PE אנטי-אנושי | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | |
| - CD90-FITC אנטי-אנושי | ||||||
| - CD73-PerCP Cy5.5 אנטי-אנושי | ||||||
| - CD105-APC אנטי-אנושי | ||||||
| צינור מעורב 2 | - CD44-V450 אנטי-אנושי | CD45-PE אנטי-אנושי | 10 מיקרוליטר | 50 מיקרוליטר | 40 מיקרוליטר | |
| - CD90-FITC אנטי-אנושי | ||||||
| - CD73-PerCP Cy5.5 אנטי-אנושי | ||||||
| - CD105-APC אנטי-אנושי | ||||||
טבלה 6: מבחנות לדוגמה לאימונופנוטיפ צבעוני של SHEDs. קיצורים: SHEDs = תאי גזע משיניים נשירות אנושיות שעברו קילוף; PE = phycoerythrin.
| סוג צינור | נוגדן נגד סמן חיובי (3 מיקרוליטר) | נוגדן נגד סמן שלילי (3 מיקרוליטר) | נפח כולל של נוגדנים | נפח מתלה התא נוסף | נפח חיץ הכתמים נוסף | |
| צינור מעורב 1 | - CD90-FITC אנטי-אנושי | CD45-PE אנטי-אנושי | 9 מיקרוליטר | 50 מיקרוליטר | 41 מיקרוליטר | |
| - CD73-PerCP Cy5.5 אנטי-אנושי | ||||||
| צינור מעורב 2 | - CD90-FITC אנטי-אנושי | CD45-PE אנטי-אנושי | 9 מיקרוליטר | 50 מיקרוליטר | 41 מיקרוליטר | |
| - CD73-PerCP Cy5.5 אנטי-אנושי | ||||||
טבלה 7: צינורות תגובת מיון חד-תאיים. קיצורים: FITC = isothiocyanate fluorescein; PE = phycoerythrin; PerCP = פרידינין-כלורופיל-חלבון.
5. מיון תא בודד
- הכנת ממיין תאים
- התקן פייה של 100 מיקרומטר במיון.
הערה: קוטר הזרבובית המתאימה הוא לפחות פי חמישה מקוטר החלקיק שיש למיין. נוזל הנדן שישמש למיון צריך להיות מוכרע על סמך סוג הדגימה ורגישות הניסוי; עבור ניסוי זה, נוזל נדן קנייני שימש. - בצע את בדיקת איכות המכשיר היומית (QC) והגדר את הממיין לניסוי. עיין במדריך לוח המחוונים לקבלת מדריך מפורט להגדרת המכשירים.
- התקן פייה של 100 מיקרומטר במיון.
- הגדרת מטריצת הפיצוי
- הגדר את מטריצת הפיצוי באמצעות צינורות פיצוי עם כתם יחיד משלב 4.2.
- בתוכנה הקניינית, בחר ניסוי מסרגל הכלים ולחץ על הגדרת פיצוי. פתח את צור פקדי פיצוי.
- בדוק את הסמנים ואשר. דגימה חדשה מתווספת בשם "פיצוי" ומתחתיה צינורות חדשים בשם פקדי הסמן מתווספים אוטומטית על ידי התוכנה.
- בחר את הצינור Unstained והפעל אותו, כדי להקליט 5,000 אירועים. גרור את השער לאוכלוסיית התאים והחל אותו על כל בקרות הפיצוי. זה כדי להגדיר את המתחים ואת השער השלילי עבור כל פרמטר פלואורסצנטי.
- באופן דומה, טען את צינורות הפיצוי של כתם יחיד בנפרד, ורשום ושמור את הנתונים. בחר את השער התוחם את האוכלוסייה המעניינת והחל על כל בקרות הפיצוי. זאת כדי לקבוע את השערים החיוביים עבור כל פרמטר פלואורסצנטי.
- בחר ניסוי מסרגל הכלים ולחץ על חישוב ערכי פיצוי | קישור ושמירה.
הערה: לאחר יצירת מטריצת הקומפוזיציה האוטומטית באמצעות התוכנה, לא ניתן לשנות את פרמטרי המתח של הפלואורוכרומים עבור אף אחד מהתעלות בצינורות המעורבים.
- איסוף נתונים
- רשום 10,000 תאים בכל צינור משלב 4.3. ו-4.4 לאסוף נתונים לניתוח האימונופנוטיפ של התאים.
- הכנת מכשירי האיסוף
- בהתאם למטרה של אוכלוסיות התאים הממוינות, בחר בין לוחות 6-well, 24-well, 48-well, או 96-well.
- מצפים את הבארות עם 200-500 μL של FBS ולשמור את הצלחות ללא הפרעה במשך 2 שעות.
- לאחר 2 שעות, להסיר את FBS השיורי ולהוסיף 200-500 μL של 10% MSC תרבית מדיה.
- מיון תאים במצב מיון של תא בודד
- הפעל צינור מעורב 1 (משלב 4.5), ורשום 10,000 אירועים כדי להציב את השערים על האוכלוסייה המעניינת שיש למיין, תוך שימוש באסטרטגיית ה- gating המתאימה.
- טען לוחית איסוף והגדר מספרי תאי יעד בין 2,500 ל- 5,000 תאים/באר ובחר את מסיכת טוהר המיון של תא יחיד.
- אספו את האוכלוסיות הממוינות במכשיר האיסוף ושמרו אותן על קרח עד סוף ניסוי המיון.
- לאחר שתסיים, העבר את הצלחות לחממה 5% CO2 כדי לשמור על התרביות ב 37 ° C.
הערה: לאחר הרכישה, קובצי נתונים גולמיים יוצאו כתבנית קובץ .fcs (v.3.0. ואילך). דוחות המיון שנוצרו לאחר כל ניסוי תיעדו את מספר האירועים/תאים שמוינו לכל באר שהוקצתה והצביעו על מספר הקונפליקטים שבוטלו.
תוצאות
ה-SHEDs התאפיינו במבחני אימונופלואורסנציה סטנדרטיים שהראו ביטוי של וימנטין (אדום, חוטי ביניים מסוג III), חוטי אקטין (Alexa fluor 488 Phalloidin Probes) וגרעינים מוכתמים ב-DAPI (איור 1A). כדי להעריך את יכולות ההתרבות ויצירת המושבות שלהם, בוצעו בדיקות סטנדרטיות לגידול תאים לטווח קצר. עלייה של פי 14.3 ?...
Discussion
בתחום הנדסת רקמות ורפואה רגנרטיבית, בין המקורות שלאחר הלידה, MSCs שמקורם ברקמת הפה משכו עניין רב בגלל מחויבויותיהם האתיות המינימליות ופוטנציאל התמיינות רב-שושלתי בולט21. תאי גזע של מוך השן (DPSCs) מהטוחנת השלישית שנפגעה זכו לתשומת הלב הרבה ביותר בקרב MSCs דנטליים בשל הפוטנציאל הטיפו...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים בנוגע לפרסום מאמר זה.
Acknowledgements
אנו מודים למתקן תאי הזרימה במרכז ג'וואהרלל נהרו למחקר מדעי מתקדם, בנגלור, הודו, על השימוש במתקן ליבת ציטומטריית הזרימה. החתך הקריו-חתך של תרבית הכדוריות של תאים ממוינים בוצע במעבדת הייחוס של נויברג אנאנד, בנגלור, הודו. עבודה זו נתמכה על ידי מימון פנימי של UC מהאקדמיה להשכלה גבוהה Manipal (MAHE), הודו. AG אסירת תודה על תמיכתה במלגת ד"ר T. M. A. Pai מ- MAHE.
Materials
| Name | Company | Catalog Number | Comments |
| Alcian Blue Stain | HiMedia | CCK029-1KT | |
| Antibiotic-Antimycotic (100x) | Gibco by ThermoFisher | 15240062 | |
| BD CompBead Plus Anti-Mouse Ig, κ/Negative Control (BSA) Compensation Plus (7.5 µm) Particles Set | BD Biosciences | 560497 | |
| BD FACS Accudrop Beads | BD Biosciences | 345249 | Used to set up the Laser delay when the sort module opens. |
| BD FACS Aria Fusion Flow cytometer | BD Biosciences | --- | |
| BD FACS Diva 9.4 | BD Biosciences | --- | |
| BD FACS Sheath Fluid | BD Biosciences | 342003 | Used as sheath fluid for both analysis and sorting experiments in the BD FACSAria Fusion |
| BD FACSDiva CS&T Research Beads | BD Biosciences | 655050 | Used for Instrument configuration depending on the nozzle size. |
| BD Horizon V450 Mouse Anti-Human CD44 | BD Biosciences | 561292 | |
| BD Horizon V450 Mouse IgG2b, κ Isotype Control | BD Biosciences | 560374 | CD44-V450 isotype |
| BD Pharmingen APC Mouse Anti-Human CD105 | BD Biosciences | 562408 | |
| BD Pharmingen APC Mouse IgG1, κ Isotype Control | BD Biosciences | 555751 | CD105-APC isotype |
| BD Pharmingen DAPI Solution | BD Biosciences | 564907 | DAPI Stock solution of 1 mg/mL |
| BD Pharmingen FITC Mouse Anti-Human CD90 | BD Biosciences | 555595 | |
| BD Pharmingen FITC Mouse IgG1, κ Isotype Control | BD Biosciences | 555748 | CD90-FITC isotype |
| BD Pharmingen PE Mouse Anti-Human CD45 | BD Biosciences | 555483 | |
| BD Pharmingen PE Mouse IgG1, κ Isotype Control | BD Biosciences | 555749 | CD45-PE isotype |
| BD Pharmingen PerCP-Cy 5.5 Mouse Anti-Human CD73 | BD Biosciences | 561260 | |
| BD Pharmingen PerCP-Cy 5.5 Mouse IgG1, κ Isotype Control | BD Biosciences | 550795 | CD73-PerCP-Cy 5.5 isotype |
| BD Pharmingen Purified Mouse Anti-Vimentin | BD Biosciences | 550513 | |
| Bovine serum albumin | Hi-Media | TC548-5G | |
| Crystal violet | Nice chemical pvt ltd | C33809 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-aldrich | D5652-50L | dPBS used for culture work and maintenance. |
| Ethanol | --- | --- | Used for general sterlization. |
| Fetal Bovine Serum | Gibco by ThermoFisher | 10270-106 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | ThermoFisher Scientific | A-21422 | |
| KO-DMEM | Gibco by ThermoFisher | 10829018 | Basal medium for undifferentiated hESCs, used in the preparation of culture media |
| L-Glutamine 200mM (100x) | Gibco by ThermoFisher | 25030-081 | |
| Methanol, for Molecular Biology | Hi-Media | MB113 | |
| Oil red O | HiMedia | CCK013-1KT | |
| Paraformaldehyde | loba chemie | 30525-89-4 | |
| Penicillin Streptomycin (100x) | Gibco by ThermoFisher | 15140- 122 | |
| Phalloidin (ActinGreen 488 ReadyProbes reagent) | Invitrogen | R37110 | |
| Silver Nitrate | HiMedia | MB156-25G | |
| Sodium Thiosulphate pentahydrate | Chemport | 10102-17-7 | |
| Sphero Rainbow Fluorescent Particles, 3.0 - 3.4 µm | BD Biosciences | 556291 | |
| Staining buffer | Prepared in MIRM | ---- | It was prepared using 2% FBS in PBS |
| StemPro Adipogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10410-01 | Basal media for Adipogenic media |
| StemPro Adipogenesis Supplement | Gibco by ThermoFisher | A10065-01 | Induction media for Adipogenic media |
| StemPro Chondrogenesis Supplement | Gibco by ThermoFisher | A10064-01 | Induction media for Chondrogenic media |
| StemPro Osteogenesis Supplement | Gibco by ThermoFisher | A10066-01 | Induction media for Osteoogenic media |
| StemPro Osteogenesis/Chondrogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10069-01 | Basal media for both Ostegenic and Chondrogenic media |
| Triton-X-100 | Hi-Media | MB031 | |
| Trypan Blue | Gibco by life technologies | 15250-061 | |
| Trypsin - EDTA Solution 1x | Hi-media | TCL049 | |
| Tween-20 | MERCK | 9005-64-5 |
References
- Kobolak, J., Dinnyes, A., Memic, A., Khademhosseini, A., Mobasheri, A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods. 99, 62-68 (2016).
- Wilson, A., Hodgson-Garms, M., Frith, J. E., Genever, P. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Frontiers in Immunology. 10, 1112 (2019).
- Li, J., et al. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Molecular Medicine Reports. 18 (6), 4969-4977 (2018).
- McLeod, C. M., Mauck, R. L. On the origin and impact of mesenchymal stem cell heterogeneity: new insights and emerging tools for single cell analysis. European Cells & Materials. 34, 217-231 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Wang, J., Liao, L., Wang, S., Tan, J. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations. Cytotherapy. 15 (8), 893-904 (2013).
- Kern, S., Eichler, H., Stoeve, J., Kluter, H., Bieback, K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 24 (5), 1294-1301 (2006).
- Dunn, C. M., Kameishi, S., Grainger, D. W., Okano, T. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell-based therapies. Acta Biomaterialia. 133, 114-125 (2021).
- Yang, Y. K., Ogando, C. R., Wang See, C., Chang, T. Y., Barabino, G. A. Changes in phenotype and differentiation potential of human mesenchymal stem cells aging in vitro. Stem Cell Research & Therapy. 9 (1), 131 (2018).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences. 78 (2), 447-467 (2021).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Review of Scientific Instruments. 43 (3), 404-409 (1972).
- Schulte, R., et al. Index sorting resolves heterogeneous murine hematopoietic stem cell populations. Experimental Hematology. 43 (9), 803-811 (2015).
- Liao, X., Makris, M., Luo, X. M. Fluorescence-activated cell sorting for purification of plasmacytoid dendritic cells from the mouse bone marrow. Journal of Visualized Experiments. (117), (2016).
- Roda, B., et al. A novel stem cell tag-less sorting method. Stem Cell Reviews and Reports. 5 (4), 420-427 (2009).
- Hall, S. R., et al. Identification and isolation of small CD44-negative mesenchymal stem/progenitor cells from human bone marrow using elutriation and polychromatic flow cytometry. Stem Cells Translational Medicine. 2 (8), 567-578 (2013).
- Eggleton, M. J., Sharp, A. A. Platelet counting using the Coulter electronic counter. Journal of Clinical Pathology. 16 (2), 164-167 (1963).
- Porwit-Ksiazek, A., Aman, P., Ksiazek, T., Biberfeld, P. Leu 7+ (HNK-1+) cells. II. Characterization of blood Leu 7+ cells with respect to immunophenotype and cell density. Scandinavian Journal of Immunology. 18 (6), 495-449 (1983).
- Hewitt, Z., et al. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning and Stem Cells. 8 (3), 225-234 (2006).
- Singh, A. M. An efficient protocol for single-cell cloning human pluripotent stem cells. Frontiers in Cell and Developmental Biology. 7, 11 (2019).
- Wilson, N. K., et al. Combined single-cell functional and gene expression analysis resolves heterogeneity within stem cell populations. Cell Stem Cell. 16 (6), 712-724 (2015).
- Zhou, L. L., et al. Oral mesenchymal stem/progenitor cells: the immunomodulatory masters. Stem Cells Inernational. 2020, 1327405 (2020).
- Fawzy El-Sayed, K. M., et al. Adult mesenchymal stem cells explored in the dental field. Advances in Biochemical Engineering/Biotechnology. 130, 89-103 (2013).
- Hardy, W. R., et al. Transcriptional networks in single perivascular cells sorted from human adipose tissue reveal a hierarchy of mesenchymal stem cells. Stem Cells. 35 (5), 1273-1289 (2017).
- . . FACSAria Fusion User's Guide. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved