需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人脱落乳牙免疫表型间充质干细胞的单细胞分选
摘要
该协议描述了使用单细胞分选方法对人间充质干细胞进行荧光激活细胞分选的使用。具体而言,当与基于多参数流式细胞术的方法相结合时,使用单细胞分选可以实现来自异质群体的免疫表型细胞的 99% 纯度。
摘要
生物体的间充质干细胞 (MSC) 具有非凡的能力,可以在体内分化成多种成体细胞谱系,并以其免疫调节和抗炎特性而闻名。这些干细胞的使用对再生生物学领域来说是一个福音,但同时也是再生医学和治疗学的祸根,因为与它们相关的多种细胞模糊性。这些模糊性可能源于这些干细胞来源的多样性和它们的 体外 生长条件,这两者都反映了它们的功能异质性。
这就需要为治疗应用提供纯化、均质的间充质干细胞群体的方法。流式细胞术领域的进步使得使用多参数方法检测单细胞群成为可能。该协议概述了一种通过荧光辅助单细胞分选从人脱落乳牙(SHED)中鉴定和纯化干细胞的方法。同时表达表面标志物,即 CD90-异硫氰酸荧光素 (FITC)、CD73-peridinin-叶绿素蛋白 (PerCP-Cy5.5)、CD105-别藻蓝蛋白 (APC) 和 CD44-V450,使用多参数流式细胞术鉴定了 MSC 的“明亮”阳性表达基因。然而,从第 7 次传代到后来的传代,观察到这些阳性标志物的四重表达者的百分比显着下降。
使用单细胞分型模式对免疫表型亚群进行分选,其中只有两个阳性标记物和一个阴性标记物构成纳入标准。该方法确保了分选群体的细胞活力,并在分选后保持细胞增殖。这种分选的下游应用可用于评估门控亚群的谱系特异性分化。该方法可以应用于其他单细胞系统,以改善分离条件并获取多个细胞表面标记物信息。
引言
间充质干细胞(MSCs)可以被视为适用于细胞疗法的可扩展细胞来源,可以被认为是再生医学的金标准系统。这些细胞可以从体内具有不同组织来源的各种来源中分离出来1.根据其来源组织,每种类型的间充质干细胞都表现出模棱两可的体外行为2。这在它们的形态和功能特性中得到了很好的观察3.多项研究表明,间充质干细胞的克隆内变异,包括成体组织分化、基因组状态以及代谢和细胞结构 2,4。
细胞免疫表型分析一直是流式细胞术鉴定干细胞的常见应用,国际细胞和基因治疗学会 (ISCT) 于 2006 年利用它来规定将细胞识别为 MSC 的最低标准列表。它指出,除了可塑性粘附和在体外分化为三个谱系(成骨性、成软骨性和产脂性)的能力外,≥95% 的细胞群必须表达 CD105、CD73、CD90,并且这些细胞必须缺乏 CD34、CD45、CD11b、CD14 和 HLA-DR 的表达(≤2% 阳性),如流式细胞术测量的那样5.尽管间充质干细胞是在ISCT的最低标准下由一组生物标志物定义的,但它们的免疫特性无法与这些生物标志物进行基准测试,并且需要超越这些标准,以使交叉研究比较和克隆变异更容易量化2。
尽管 ISCT 制定了指南,但对 MSC 的广泛研究表明,该群体中存在异质性,这可能是由于多种因素造成的,主要是由于 MSC 供体6、组织来源7、克隆群体中的单个细胞8 和培养条件2,9 之间出现的异质性无处不在,10.从各种组织来源中表征和纯化这些原代细胞,以确保质量和细胞命运是其生产的关键步骤。需要了解种群中显示的变异,需要一种有效的方法将其分解为可以单独划分和收集的亚种群11。单细胞水平分析有助于克服细胞间变异的挑战,减少异质性群体产生的生物噪声,并提供研究和表征稀有细胞的能力12。
根据目的和选择的参数,可以采用几种方法来对选定的种群进行排序和富集。细胞分选技术可以包括批量分选和单细胞分选方法。批量分选可以通过磁激活细胞分选 (MACS)13、分馏 14 和洗脱15 富集靶细胞群,而单细胞分选可以通过荧光激活细胞分选 (FACS)11 富集更均匀的细胞群。表1重点介绍了每种方法及其优缺点的比较分析。
表1:不同技术的比较分析:MACS、分馏、洗脱和FACS,突出了其原理的差异以及选择特定技术优于另一种技术的优缺点。 缩写:MACS = 磁活化细胞分选;FACS = 荧光激活的细胞分选。 请按此下载此表格。
自该技术问世以来,单细胞流式细胞术在异质样品17中特定细胞群的计数16、检测和表征中发挥了重要作用。Hewitt 等人于 2006 年奠定了自动细胞分选方法的基础,以增强分化人胚胎干细胞 (hESC) 的均质池的分离18。单细胞分选富集了GFP转导的hESCs群体,促进了转基因克隆的分离,为临床研究开辟了新的维度。为了提高分拣效率,一般采取两种方法;要么修改分选群体的收集培养基以维持分选后细胞的活力和增殖19,要么适当修改细胞分选算法/软件12。
随着技术的进步,商用流式细胞仪和细胞分选仪已经能够帮助解决在无菌分选脆弱和稀有细胞群(尤其是不同来源的干细胞)时遇到的挑战。干细胞生物学家面临的主要挑战之一是按照基因编辑研究所需的转染方案克隆分离人类多能干细胞19。通过将单细胞分选到涂有小鼠胚胎成纤维细胞 (MEF) 以及补充剂和商业小分子 ROCK 抑制剂的 96 孔板中来解决此问题。然而,细胞分离策略可以通过使用索引分选来在很大程度上改进,索引分选是分选算法的一个特征,用于识别分选的单个细胞的免疫表型12。这种改进的单细胞分选方式不仅有助于提高干细胞的分选效率,特别是在罕见的造血干细胞群方面,而且还有效地将单细胞克隆与其下游功能测定联系起来20。
本文重点研究对人脱落乳牙(SHEDs)的免疫表型干细胞进行单细胞分选,以富集亚群,研究其功能分化能力。使用两种 MSC 阳性标志物 CD90 和 CD73 以及阴性造血标志物 CD45 的组合,对 MSC 进行免疫表型分析,并鉴定出暗表达子和无效表达子。根据其免疫表型,将亚群鉴定为纯间充质干细胞、单阳性和双阴性群体。使用单细胞分选模式对它们进行分选,以获得纯度和富集的亚群,用于进一步的功能研究,以确定标记物的差异表达是否是 体外 培养条件的产物,或者它是否对功能特性也有任何影响。对不是“阳性MSC标志物”的均质表达者的细胞进行分类,以研究其功能特性。
研究方案
伦理批准和参与同意:根据医院伦理审查委员会制定的标准,在获得班加罗尔斯里拉吉夫甘地牙科学院和医院 (SRGCDS) 口腔颌面科的知情同意和完全伦理批准后,收到了人类脱落的乳牙髓样本SRGCDS。之后,SHED 的分离、培养、维护和应用得到了班加罗尔马尼帕尔再生医学研究所干细胞研究机构委员会 (IC-SCR) 的批准并符合其推荐的指南。有关本协议中使用的所有材料和试剂的详细信息,请参阅 材料表 。
1. 试剂和缓冲液的制备
- 用于培养维持
- 使用未分化hESC的基础培养基,10%胎牛血清(FBS),1%L-谷氨酰胺和1%青霉素 - 链霉素(Pen-strep)制备MSC细胞培养基(10%)(表2)。
- 使用未分化hESC的基础培养基,20%FBS,1%L-谷氨酰胺和1%Pen-链球菌制备MSC细胞培养基(20%)(表2)。
- 使用未分化 hESC 的基础培养基、1% L-谷氨酰胺和 1% 抗生素 - 抗真菌药(抗抗)制备中和培养基(表 2)。
- 用于流式细胞术分析和分选
- 在磷酸盐缓冲盐水(PBS)中使用2%FBS制备染色缓冲液。
- 通过在 1 mL PBS 中加入 1 μL 来制备 4′,6-二脒基-2-苯基吲哚 (DAPI) (1 μg/mL) 的储备溶液
- 用于间充质干细胞的谱系特异性分化
- 根据 表3中描述的组成制备用于成骨,软骨和脂肪分化的分化培养基。在实验期间将制备的等分试样储存在4°C。
- 使用用于未分化 hESC 的基础培养基、2% FBS、1% L-谷氨酰胺和 1% Pen-链球菌制备血清饥饿培养基(2% 培养基)(表 2)。
| 介质类型 | 媒体目的 | 50 mL 的组合物 | ||||||||
| 胎牛血清 (FBS) | Pen-链球菌 | L-谷氨酰胺 | 用于未分化 hESC 的基础培养基 | |||||||
| 10% 媒体 | MSC培养和维护 | 5毫升 | 500微升 | 500微升 | 44毫升 | |||||
| 20% 媒体 | CFU-F测定 | 10毫升 | 500微升 | 500微升 | 39毫升 | |||||
| 血清饥饿 (2%) 培养基 | 分化方案中对照孔的培养基 | 1毫升 | 500微升 | 500微升 | 48毫升 | |||||
| 中和介质 | 胰蛋白酶消化后用于中和细胞悬液的培养基 | - | 500微升 | 500微升 | 49毫升 | |||||
表2:用于培养维持和检测的细胞培养基。 缩写:MSC=间充质干细胞;CFU-F = 集落形成单位-成纤维细胞。
| 组件 | 成骨培养基 | 软骨形成介质 | 成脂培养基 |
| 基础培养基 | 90毫升 | 90毫升 | 90毫升 |
| 感应介质 | 10毫升 | 10毫升 | 10毫升 |
| 总体积 | 100毫升 | 100毫升 | 100毫升 |
表3:用于SHED三系分化的分化培养基。
2. 棚屋的培养和维护
- 将细胞维持在 10% MSC 培养基中,每 2 天或根据需要更换培养基。
- 使用0.25%胰蛋白酶-EDTA以95%汇合度对细胞进行胰蛋白酶消化。
- 使用中和培养基中和胰蛋白酶消化后的细胞。
- 在室温下以300× g 离心管6分钟以获得细胞沉淀。
- 倒出上清液并将细胞沉淀重悬于10%MSC培养基中。
- 将细胞接种到含有10%MSC培养基的新鲜制备的细胞培养皿中,用于进一步实验或传代培养。
注:SHED 的最佳接种密度是 100 mm 培养皿中 0.2 × 10 6 个细胞,T-75 烧瓶中 0.8 × 10 6 个细胞,分别获得 1.5 × 10 6 个细胞和 4 × 10 6 个细胞,汇合度为 90-100%。
3. 间充质干细胞的表征
- 短期细胞生长试验
- 将 4 个× 10个 细胞/孔接种,一式三份,放入 10% MSC 培养基中的 6 孔板中。
- 将板在37°C孵育7天,每2天更换一次培养基。
- 在第2,4和8天使用0.25%胰蛋白酶处理收获细胞,并用培养基洗涤。
- 在室温下以 300 g 离心细胞 6 分钟,并将沉淀重悬于 1 mL 培养基中。
- 使用血细胞计数器对细胞进行计数,并通过台盼蓝排除法确定其活力。
- 使用公式(1)计算增殖速率:
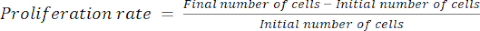 (一)
(一)
- 集落形成单位成纤维细胞 (CFU-F) 测定
- 将 10,000 个细胞接种在 100 mm 培养皿中,并在 20% MSC 培养基中培养。
- 将板在37°C孵育14天,每3天更换一次培养基。
- 14天后,用PBS冲洗菌落,用结晶紫染料在甲醇中固定,然后再次用PBS冲洗以除去残留污渍。
- 对菌落进行计数和成像。
注意:计数具有 >50 个细胞的菌落。菌落形成效率计算为菌落形成单位数。
- 免疫荧光检测
- 将MSC播种在35毫米的培养皿上,让它们生长至80-90%汇合。
- 取出介质并用PBS冲洗一次餐具。
- 用1mL 4%多聚甲醛(PFA)固定细胞,在室温下孵育1小时或在4°C下孵育过夜。
- 固定后,在摇杆上用PBST清洗孔3 x 5分钟。
- 在PBST中加入0.3%Triton X-100(PBS中的0.05%吐温20溶液)以透化细胞。在室温下将其放在摇杆上15分钟。
- 在摇杆上用PBST清洗孔3 x 5分钟。
- 加入3%牛血清白蛋白(BSA)进行封闭,并在室温下将其保持在摇床上1小时。
- 在摇杆上用PBST清洗孔3 x 5分钟。
- 加入800μL1:500稀释的小鼠抗波形蛋白,在室温下将其保持在摇床上1小时,并将板转移至4°C孵育过夜。
- 第二天,除去一抗,在摇床上用PBST洗涤孔3 x 5分钟。
- 加入 800 μL 1:1,000 稀释的山羊抗小鼠 IgG (H+L) 交叉吸附的二抗 Alexa Fluor 555,并在室温下在摇床上保持 3 小时。
- 在摇杆上用PBST清洗孔3 x 5分钟。
- 在 1,000 μL PBS 中加入 Alexa fluor 488 鬼笔环肽探针 240 μL,并在室温下在摇床上孵育 60 分钟。
- 在摇杆上用PBST清洗孔3 x 5分钟。
- 加入700μLDAPI封片剂,并在显微镜下观察细胞。
- 谱系特异性分化
- 2D培养后的分化
- 取两个 48 孔板并将它们分别标记为成骨谱系和成脂谱系。
- 在每个板的四个孔中接种 15,000 个细胞/孔,并在 10% MSC 培养基中培养。
- 一旦单层细胞达到 90% 汇合度,将前两个孔标记为“对照”,并用血清饥饿培养基(2% 培养基)替换现有培养基。在标记为“测试”的最后两个孔中,添加两个谱系(成脂或成骨)中任一的分化培养基。将此标记为第 0 天。
- 每三天轻轻更换一次培养基以避免剥落,并注意避免污染。
- 保持这些条件直到第二十一天;然后进行染色实验。
- 3D培养后的差异化
- 取两支 15 mL 试管,使用 3D 沉淀培养进行软骨分化。
- 将 1 × 106 个细胞转移到每个试管中,并以 300 × g 离心 6 分钟以形成沉淀。将一个试管标记为“对照”,并向其中加入10%MSC培养基;将另一根试管标记为“测试”,并添加软骨分化培养基。小心地将试管放入培养箱中,盖子松动。将此标记为第 0 天。
- 每三天小心更换一次培养基,以免在更换培养基期间使颗粒脱落/分解。
- 将这些条件维持到第21天,然后处理细胞进行进一步的实验。
- 2D培养后的分化
- 谱系特异性细胞化学染色
- 对于2D培养物,使用分化(测试)和未分化的MSC(对照)板(来自步骤3.4.1.5)进行染色,首先,除去培养基并用PBS洗涤两次。在室温下用4%PFA固定细胞30分钟,除去上清液,并用PBS洗涤一次。对每个谱系进行染色,如下所示。
- 对于 脂肪细胞谱系,从试剂盒中加入透化溶液,并在室温下孵育板5分钟。准备并加入 1 mL 油红 O 工作溶液并保持 10 分钟。去除污渍,用蒸馏水洗涤五次。
- 对于 骨细胞谱系,向每个孔中加入5%新鲜制备的硝酸银(在蒸馏水中),并将板保持在紫外线下1小时。除去溶液,加入2.5%的硫代硫酸钠,除去未反应的银;保持 5 分钟。除去污渍,用蒸馏水洗涤两次,并在显微镜下观察染色的细胞。
- 对于3D培养物,在步骤3.4.2.3的分化期结束后收集沉淀,并以沉淀的形式获得分化组织的冷冻切片。在进行染色之前,让载玻片风干并在室温下。
- 对于 软骨细胞谱系,按照染色试剂盒的说明加入足够体积的洗涤液,将其取出,加入固定液,孵育30分钟。用蒸馏水洗涤,加入染色液,孵育30分钟。用0.1N盐酸洗涤三次;加入蒸馏水以中和酸度。在明场显微镜下观察染色的细胞。
- 对于2D培养物,使用分化(测试)和未分化的MSC(对照)板(来自步骤3.4.1.5)进行染色,首先,除去培养基并用PBS洗涤两次。在室温下用4%PFA固定细胞30分钟,除去上清液,并用PBS洗涤一次。对每个谱系进行染色,如下所示。
4. 细胞表面染色用于免疫表型
注:在步骤4.2-4.5中获得最佳细胞数的推荐细胞培养板是100mm培养皿或T75烧瓶。
- 用于流式细胞术实验的细胞制备
- 胰蛋白酶消化并从汇合的培养皿/烧瓶中收集细胞,并以 300 × g 离心 6 分钟以获得细胞沉淀。
- 将沉淀重悬于1mL培养基中,并按照台盼蓝排除法使用血细胞计数器测定活细胞计数。
- 计数后再次离心细胞悬液,并用 1 mL 染色缓冲液对沉淀再洗涤两次。
- 弃去上清液,最后根据方案将沉淀重悬于适当体积的染色缓冲液中(参见步骤4.2至4.5)。
- 准备补偿控制
- 取七支 FACS 管并将它们标记为未染色、DAPI、V450、FITC、PE、PerCP-Cy 5.5 和 APC。
- 将最终沉淀重悬于染色缓冲液中(参见步骤4.1.),对于未染色和DAPI管,每管每50μL保持0.5×10 6 个细胞的细胞密度。
- 如 表4所述准备单染色管进行补偿。
- 制备后轻轻涡旋每个试管,并在黑暗中孵育30分钟。
- 孵育后,通过向每个试管中加入 1 mL 染色缓冲液进行两次洗涤,然后在室温下以 200 g 短暂涡旋和离心 10 分钟。
- 弃去上清液,将沉淀重悬于500μL染色缓冲液中,并将其放在一边直至采集。
- 对于DAPI管,通过在60°C水浴中孵育5分钟,然后在冰上孵育15分钟进行热休克治疗。向悬浮液中加入 5 μL DAPI,并将其置于黑暗中,直到采集运行。
- 荧光负一 (FMO) 对照的制备
- 将最终沉淀重悬于染色缓冲液中(参见步骤4.1),保持每个管每50μL的细胞密度为0.5×10,6 个细胞。
- 取五支 FACS 管,并将它们标记为 CD44-V450 同种型、CD90-FITC、CD45-PE、CD73-PerCP Cy5.5 同种型和 CD105-APC 同种型。
- 根据 表5制备细胞和抗体悬浮液。
- 轻轻涡旋试管,并在室温下在黑暗中孵育30分钟。
- 孵育后,用 1 mL 染色缓冲液对每个试管进行两次洗涤,然后在室温下以 200 g 短暂涡旋和离心 10 分钟。
- 弃去上清液,将沉淀重悬于500μL染色缓冲液中,并将其放在一边直至采集。
- 分析样品的制备
- 将最终沉淀重悬于染色缓冲液中(参见步骤4.1),保持每管每50μL0.5×10,6 个细胞的细胞密度。
- 取两根 FACS 管并将它们标记为混合管 1 和 2。
- 根据 表6制备细胞和抗体悬浮液。
- 轻轻涡旋试管,并在室温下在黑暗中孵育30分钟。
- 孵育后,用 1 mL 染色缓冲液对每个试管进行两次洗涤,然后在室温下以 200 g 短暂涡旋和离心 10 分钟。
- 弃去上清液,将沉淀重悬于500μL染色缓冲液中,并放在一边直至采集。
- 制备用于单细胞分选的样品
- 取两根FACS管,加入1mL FBS,然后滚动管,直到每个管内侧形成均匀的FBS层。将其孵育1-2小时,同时处理样品进行染色。将这些试管标记为混合试管 1 和 2。
- 将最终沉淀重悬于染色缓冲液中(参见步骤4.1),每管每50μL保持2-3×10,6个细胞的细胞密度。
- 根据 表7在混合管1和2中制备细胞和抗体悬浮液。
- 轻轻涡旋试管,并在室温下在黑暗中孵育30分钟。
- 孵育后,用 1 mL 染色缓冲液对每个试管进行两次洗涤,然后在室温下以 200 g 短暂涡旋和离心 10 分钟。
- 弃去上清液,将沉淀重悬于500μL染色缓冲液中,并放在一边。分选前 15 分钟加入 5 μL DAPI。
注意:请注意,对于分选实验,建议每管使用更高的细胞密度。
| 管型 | 正复合微珠* | 负复合磁珠* | 细胞 | 添加抗体 | |
| FITC管 | 1滴 | 1滴 | – | 抗人 CD90-FITC (2 μL) | |
| V450灯管 | 1滴 | 1滴 | – | 抗人 CD44-V450 (2 μL) | |
| PerCP-Cy 5.5 管 | 1滴 | 1滴 | – | 抗人 CD73-PerCP Cy 5.5 (2 μL) | |
| PE管 | 1滴 | 1滴 | – | 抗人 CD45-PE (2 μL) | |
| APC管 | 1滴 | 1滴 | – | 抗人 CD105-APC (2 μL) | |
| DAPI管 | – | – | 50微升 | – | |
| 未染色的管子 | – | – | 50微升 | – | |
| *1 滴 = 60 μL 微珠悬浮液 | |||||
表 4:补偿对照样品。 缩写:comp = 补偿;DAPI = 4',6-二脒基-2-苯基吲哚;FITC = 异硫氰酸荧光素;APC = 别藻蓝蛋白;PE = 藻红蛋白;PerCP = peridinin-叶绿素-蛋白质。
| 管型 | 针对阳性标记物的抗体 (2 ΜL) | 阴性标记物抗体 (2 ΜL) | 添加同型抗体 (2 ΜL) | 抗体总体积 | 添加的细胞悬液体积 | 添加的染色缓冲液体积 | ||
| CD90-FITC FMO管 | - 抗人CD44-V450 | 抗人CD45-PE | 异硫氰酸荧光素 IgG1 同种型 | 10微升 | 50微升 | 40微升 | ||
| - 抗人CD73 PerCP Cy 5.5 | ||||||||
| - 抗人CD105-APC | ||||||||
| CD73-PerCP Cy5.5 FMO 管 | - 抗人CD44-V450 | 抗人CD45-PE | PerCP Cy 5.5 IgG1 同种型 | 10微升 | 50微升 | 40微升 | ||
| - 抗人CD90-FITC | ||||||||
| - 抗人CD105-APC | ||||||||
| CD44-V450 FMO管 | - 抗人CD90-FITC | 抗人CD45-PE | V450 IgG1 同种型 | 10微升 | 50微升 | 40微升 | ||
| - 抗人CD73-PerCP Cy 5.5 | ||||||||
| - 抗人CD105-APC | ||||||||
| CD105-APC FMO管 | - 抗人CD44-V450 | 抗人CD45-PE | APC IgG1 同种型 | 10微升 | 50微升 | 40微升 | ||
| - 抗人CD90-FITC | ||||||||
| - 抗人CD73-PerCP Cy 5.5 | ||||||||
| CD45-PE FMO管 | - 抗人CD44-V450 | - | PE IgG1 同种型 | 10微升 | 50微升 | 40微升 | ||
| - 抗人CD90-FITC | ||||||||
| - 抗人CD73-PerCP Cy 5.5 | ||||||||
| - 抗人CD105-APC | ||||||||
表 5:FMO 对照样品。 缩写:FMO = 荧光减 1;FITC = 异硫氰酸荧光素;APC = 别藻蓝蛋白;PE = 藻红蛋白;PerCP = peridinin-叶绿素-蛋白质。
| 管型 | 针对阳性标记物的抗体 (2 ΜL) | 阴性标记物抗体 (2 ΜL) | 抗体总体积 | 添加的细胞悬液体积 | 添加的染色缓冲液体积 | |
| 混合管1 | - 抗人CD44-V450 | 抗人CD45-PE | 10微升 | 50微升 | 40微升 | |
| - 抗人CD90-FITC | ||||||
| - 抗人CD73-PerCP Cy5.5 | ||||||
| - 抗人CD105-APC | ||||||
| 混合管2 | - 抗人CD44-V450 | 抗人CD45-PE | 10微升 | 50微升 | 40微升 | |
| - 抗人CD90-FITC | ||||||
| - 抗人CD73-PerCP Cy5.5 | ||||||
| - 抗人CD105-APC | ||||||
表 6:用于 SHED 多色免疫表型分析的样品管。 缩写:SHEDs = 来自人类脱落乳牙的干细胞;PE = 藻红蛋白。
| 管型 | 针对阳性标记物的抗体 (3 ΜL) | 阴性标记物抗体 (3 ΜL) | 抗体总体积 | 添加的细胞悬液体积 | 添加的染色缓冲液体积 | |
| 混合管1 | - 抗人CD90-FITC | 抗人CD45-PE | 9微升 | 50微升 | 41微升 | |
| - 抗人CD73-PerCP Cy5.5 | ||||||
| 混合管2 | - 抗人CD90-FITC | 抗人CD45-PE | 9微升 | 50微升 | 41微升 | |
| - 抗人CD73-PerCP Cy5.5 | ||||||
表7:单细胞分选反应管。 缩写:FITC=异硫氰酸荧光素;PE = 藻红蛋白;PerCP = peridinin-叶绿素-蛋白质。
5. 单细胞分选
- 细胞分选仪的制备
- 在分拣机中安装一个 100 μm 喷嘴。
注意:适当的喷嘴至少是要分拣的颗粒直径的五倍。用于分选的鞘液需要根据样品类型和实验的灵敏度来决定;在本实验中,使用了专有的鞘液。 - 执行每日仪器质量检查(QC)并设置实验分选机。有关仪器设置的详细指南,请参阅仪器手册。
- 在分拣机中安装一个 100 μm 喷嘴。
- 设置补偿矩阵
- 使用步骤 4.2 中的单染色补偿管设置补偿矩阵。
- 在专有软件中,从工具栏中选择 “实验 ”,然后单击“ 补偿设置”。打开 创建薪酬控制。
- 检查标记并确认。添加了一个名为“补偿”的新试样,在该试样下,软件会自动添加名为标记对照的新试管。
- 选择未染色的试管并运行它,以记录 5,000 个事件。将门拖动到细胞群中,并将其应用于所有补偿控件。这是为了设置每个荧光参数的电压和负栅极。
- 同样,单独加载单色补偿管,并记录并保存数据。选择划分感兴趣群体的门并应用于所有补偿控制。这是为每个荧光参数设置正门。
- 从工具栏中选择“ 实验 ”,然后单击“ 计算薪酬值”|“链接并保存。
注意:一旦使用软件生成自动合成矩阵,就不能更改混合管中任何通道的荧光染料的电压参数。
- 数据采集
- 从步骤4.3中记录每个管中的10,000个细胞。4.4 收集数据以分析细胞的免疫表型。
- 收集装置的准备
- 根据分选细胞群的目的,在 6 孔、24 孔、48 孔或 96 孔板之间进行选择。
- 用200-500μL的FBS涂覆孔,并保持板不受干扰2小时。
- 2小时后,除去残留的FBS,加入200-500μL的10%MSC培养基。
- 单细胞分选模式下的细胞分选
- 运行混合管 1(从步骤 4.5 开始),并使用适当的门控策略记录 10,000 个事件,以设置要排序的感兴趣群体的门。
- 加载收集板,将目标细胞数设置在 2,500 至 5,000 个细胞/孔之间, 然后选择 单细胞分选纯度掩膜。
- 在收集装置中收集分类的种群,并将它们保持在冰上,直到分选实验结束。
- 完成后,将板转移到5%CO2 培养箱中以将培养物保持在37°C。
注意:采集后,原始数据文件导出为 .fcs 文件格式(v.3.0 及更高版本)。每次实验后生成的排序报告记录了每个分配孔排序的事件/单元数,并指示已中止的冲突数。
结果
SHED通过标准免疫荧光测定法表征波形蛋白(红色,III型中间丝),肌动蛋白丝(Alexa fluor 488鬼笔环肽探针)和用DAPI染色的细胞核的表达(图1A)。为了估计它们的增殖和集落形成能力,进行了标准的短期细胞生长测定。从第2天到第8天,增殖速率增加了14.3倍,如图1B所示。SHED的克隆发生特性是通过图1C-E所示的C...
讨论
在组织工程和再生医学领域,在出生后来源中,口腔组织来源的间充质干细胞因其最小的伦理义务和显着的多谱系分化潜力而引起了人们的极大兴趣21。来自受影响的第三磨牙和 SHED 的牙髓干细胞 (DPSC) 因其在神经退行性疾病和创伤性疾病中的治疗潜力而在牙科间充质干细胞中获得了最多的关注22.本手稿中描述的方案有助于使用多参数方法表征 SHED,并使用单...
披露声明
作者声明,本文的发表不存在利益冲突。
致谢
我们感谢位于印度班加罗尔的贾瓦哈拉尔·尼赫鲁高级科学研究中心的流通池设施使用流式细胞术核心设施。分化细胞沉淀培养物的冷冻切片在印度班加罗尔的 Neuberg Anand 参考实验室进行。这项工作得到了印度马尼帕尔高等教育学院(MAHE)的UC校内资助。AG感谢MAHE的T. M. A. Pai博士奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Alcian Blue Stain | HiMedia | CCK029-1KT | |
| Antibiotic-Antimycotic (100x) | Gibco by ThermoFisher | 15240062 | |
| BD CompBead Plus Anti-Mouse Ig, κ/Negative Control (BSA) Compensation Plus (7.5 µm) Particles Set | BD Biosciences | 560497 | |
| BD FACS Accudrop Beads | BD Biosciences | 345249 | Used to set up the Laser delay when the sort module opens. |
| BD FACS Aria Fusion Flow cytometer | BD Biosciences | --- | |
| BD FACS Diva 9.4 | BD Biosciences | --- | |
| BD FACS Sheath Fluid | BD Biosciences | 342003 | Used as sheath fluid for both analysis and sorting experiments in the BD FACSAria Fusion |
| BD FACSDiva CS&T Research Beads | BD Biosciences | 655050 | Used for Instrument configuration depending on the nozzle size. |
| BD Horizon V450 Mouse Anti-Human CD44 | BD Biosciences | 561292 | |
| BD Horizon V450 Mouse IgG2b, κ Isotype Control | BD Biosciences | 560374 | CD44-V450 isotype |
| BD Pharmingen APC Mouse Anti-Human CD105 | BD Biosciences | 562408 | |
| BD Pharmingen APC Mouse IgG1, κ Isotype Control | BD Biosciences | 555751 | CD105-APC isotype |
| BD Pharmingen DAPI Solution | BD Biosciences | 564907 | DAPI Stock solution of 1 mg/mL |
| BD Pharmingen FITC Mouse Anti-Human CD90 | BD Biosciences | 555595 | |
| BD Pharmingen FITC Mouse IgG1, κ Isotype Control | BD Biosciences | 555748 | CD90-FITC isotype |
| BD Pharmingen PE Mouse Anti-Human CD45 | BD Biosciences | 555483 | |
| BD Pharmingen PE Mouse IgG1, κ Isotype Control | BD Biosciences | 555749 | CD45-PE isotype |
| BD Pharmingen PerCP-Cy 5.5 Mouse Anti-Human CD73 | BD Biosciences | 561260 | |
| BD Pharmingen PerCP-Cy 5.5 Mouse IgG1, κ Isotype Control | BD Biosciences | 550795 | CD73-PerCP-Cy 5.5 isotype |
| BD Pharmingen Purified Mouse Anti-Vimentin | BD Biosciences | 550513 | |
| Bovine serum albumin | Hi-Media | TC548-5G | |
| Crystal violet | Nice chemical pvt ltd | C33809 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-aldrich | D5652-50L | dPBS used for culture work and maintenance. |
| Ethanol | --- | --- | Used for general sterlization. |
| Fetal Bovine Serum | Gibco by ThermoFisher | 10270-106 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | ThermoFisher Scientific | A-21422 | |
| KO-DMEM | Gibco by ThermoFisher | 10829018 | Basal medium for undifferentiated hESCs, used in the preparation of culture media |
| L-Glutamine 200mM (100x) | Gibco by ThermoFisher | 25030-081 | |
| Methanol, for Molecular Biology | Hi-Media | MB113 | |
| Oil red O | HiMedia | CCK013-1KT | |
| Paraformaldehyde | loba chemie | 30525-89-4 | |
| Penicillin Streptomycin (100x) | Gibco by ThermoFisher | 15140- 122 | |
| Phalloidin (ActinGreen 488 ReadyProbes reagent) | Invitrogen | R37110 | |
| Silver Nitrate | HiMedia | MB156-25G | |
| Sodium Thiosulphate pentahydrate | Chemport | 10102-17-7 | |
| Sphero Rainbow Fluorescent Particles, 3.0 - 3.4 µm | BD Biosciences | 556291 | |
| Staining buffer | Prepared in MIRM | ---- | It was prepared using 2% FBS in PBS |
| StemPro Adipogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10410-01 | Basal media for Adipogenic media |
| StemPro Adipogenesis Supplement | Gibco by ThermoFisher | A10065-01 | Induction media for Adipogenic media |
| StemPro Chondrogenesis Supplement | Gibco by ThermoFisher | A10064-01 | Induction media for Chondrogenic media |
| StemPro Osteogenesis Supplement | Gibco by ThermoFisher | A10066-01 | Induction media for Osteoogenic media |
| StemPro Osteogenesis/Chondrogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10069-01 | Basal media for both Ostegenic and Chondrogenic media |
| Triton-X-100 | Hi-Media | MB031 | |
| Trypan Blue | Gibco by life technologies | 15250-061 | |
| Trypsin - EDTA Solution 1x | Hi-media | TCL049 | |
| Tween-20 | MERCK | 9005-64-5 |
参考文献
- Kobolak, J., Dinnyes, A., Memic, A., Khademhosseini, A., Mobasheri, A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods. 99, 62-68 (2016).
- Wilson, A., Hodgson-Garms, M., Frith, J. E., Genever, P. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Frontiers in Immunology. 10, 1112 (2019).
- Li, J., et al. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Molecular Medicine Reports. 18 (6), 4969-4977 (2018).
- McLeod, C. M., Mauck, R. L. On the origin and impact of mesenchymal stem cell heterogeneity: new insights and emerging tools for single cell analysis. European Cells & Materials. 34, 217-231 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Wang, J., Liao, L., Wang, S., Tan, J. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations. Cytotherapy. 15 (8), 893-904 (2013).
- Kern, S., Eichler, H., Stoeve, J., Kluter, H., Bieback, K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 24 (5), 1294-1301 (2006).
- Dunn, C. M., Kameishi, S., Grainger, D. W., Okano, T. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell-based therapies. Acta Biomaterialia. 133, 114-125 (2021).
- Yang, Y. K., Ogando, C. R., Wang See, C., Chang, T. Y., Barabino, G. A. Changes in phenotype and differentiation potential of human mesenchymal stem cells aging in vitro. Stem Cell Research & Therapy. 9 (1), 131 (2018).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences. 78 (2), 447-467 (2021).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Review of Scientific Instruments. 43 (3), 404-409 (1972).
- Schulte, R., et al. Index sorting resolves heterogeneous murine hematopoietic stem cell populations. Experimental Hematology. 43 (9), 803-811 (2015).
- Liao, X., Makris, M., Luo, X. M. Fluorescence-activated cell sorting for purification of plasmacytoid dendritic cells from the mouse bone marrow. Journal of Visualized Experiments. (117), (2016).
- Roda, B., et al. A novel stem cell tag-less sorting method. Stem Cell Reviews and Reports. 5 (4), 420-427 (2009).
- Hall, S. R., et al. Identification and isolation of small CD44-negative mesenchymal stem/progenitor cells from human bone marrow using elutriation and polychromatic flow cytometry. Stem Cells Translational Medicine. 2 (8), 567-578 (2013).
- Eggleton, M. J., Sharp, A. A. Platelet counting using the Coulter electronic counter. Journal of Clinical Pathology. 16 (2), 164-167 (1963).
- Porwit-Ksiazek, A., Aman, P., Ksiazek, T., Biberfeld, P. Leu 7+ (HNK-1+) cells. II. Characterization of blood Leu 7+ cells with respect to immunophenotype and cell density. Scandinavian Journal of Immunology. 18 (6), 495-449 (1983).
- Hewitt, Z., et al. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning and Stem Cells. 8 (3), 225-234 (2006).
- Singh, A. M. An efficient protocol for single-cell cloning human pluripotent stem cells. Frontiers in Cell and Developmental Biology. 7, 11 (2019).
- Wilson, N. K., et al. Combined single-cell functional and gene expression analysis resolves heterogeneity within stem cell populations. Cell Stem Cell. 16 (6), 712-724 (2015).
- Zhou, L. L., et al. Oral mesenchymal stem/progenitor cells: the immunomodulatory masters. Stem Cells Inernational. 2020, 1327405 (2020).
- Fawzy El-Sayed, K. M., et al. Adult mesenchymal stem cells explored in the dental field. Advances in Biochemical Engineering/Biotechnology. 130, 89-103 (2013).
- Hardy, W. R., et al. Transcriptional networks in single perivascular cells sorted from human adipose tissue reveal a hierarchy of mesenchymal stem cells. Stem Cells. 35 (5), 1273-1289 (2017).
- . . FACSAria Fusion User's Guide. , (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。