Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одноклеточная сортировка иммунофенотипированных мезенхимальных стволовых клеток отслоившихся молочных зубов человека
В этой статье
Резюме
Данный протокол описывает использование флуоресцентно-активированной сортировки мезенхимальных стволовых клеток человека методом одноклеточной сортировки. В частности, использование сортировки отдельных клеток позволяет достичь 99% чистоты иммунофенотипированных клеток из гетерогенной популяции в сочетании с многопараметрическим подходом, основанным на проточной цитометрии.
Аннотация
Мезенхимальные стволовые клетки (МСК) организма обладают необычайной способностью дифференцироваться в несколько линий взрослых клеток в организме и известны своими иммуномодулирующими и противовоспалительными свойствами. Использование этих стволовых клеток является благом для области регенеративной биологии, но в то же время проклятием для регенеративной медицины и терапии из-за многочисленных клеточных двусмысленностей, связанных с ними. Эти неясности могут возникать из-за разнообразия в источнике этих стволовых клеток и условий их роста in vitro , что отражается на их функциональной гетерогенности.
Это обуславливает необходимость разработки методик получения очищенных, однородных популяций МСК для терапевтического применения. Достижения в области проточной цитометрии позволили обнаружить популяции одиночных клеток с использованием многопараметрического подхода. В этом протоколе описывается способ идентификации и очистки стволовых клеток отслоившихся молочных зубов человека (SHED) с помощью флуоресцентной сортировки отдельных клеток. Одновременная экспрессия поверхностных маркеров, а именно CD90-флуоресцеина изотиоцианата (FITC), CD73-перидинин-хлорофилла-белка (PerCP-Cy5.5), CD105-аллофикоцианина (APC) и CD44-V450, позволила идентифицировать «яркие» положительные экспрессоры МСК с помощью мультипараметрической проточной цитометрии. Тем не менее, наблюдалось значительное снижение процентного соотношения четырехкратных экспрессоров этих положительных маркеров, начиная с пассажа 7 и далее.
Иммунофенотипированные субпопуляции сортировали с использованием режима одноклеточной сортировки, где только два положительных и один отрицательный маркер составляли критерии включения. Эта методология обеспечивала жизнеспособность клеток отсортированных популяций и поддерживала пролиферацию клеток после сортировки. Нисходящее приложение для такой сортировки может быть использовано для оценки линейно-специфической дифференциации для закрытых субпопуляций. Этот подход может быть применен к другим одноклеточным системам для улучшения условий изоляции и получения информации о множественных маркерах клеточной поверхности.
Введение
Мезенхимальные стволовые клетки (МСК) можно рассматривать как масштабируемый источник клеток, пригодных для клеточной терапии, и можно считать золотым стандартом системы в регенеративной медицине. Эти клетки могут быть выделены из различных источников в организме с различным тканевым происхождением1. В зависимости от исходной ткани каждый тип МСК демонстрирует неоднозначное поведение in vitro 2. Это хорошо видно по их морфологическим и функциональнымсвойствам 3. Многочисленные исследования показали внутриклональную изменчивость размеров, включая дифференцировку тканей взрослого человека, состояние генома, метаболическую и клеточную архитектуру МСК 2,4.
Иммунофенотипирование клеток является распространенным применением проточной цитометрии для идентификации стволовых клеток, и это было использовано Международным обществом клеточной и генной терапии (ISCT) в 2006 году для назначения списка минимальных критериев для идентификации клеток как МСК. Было установлено, что наряду с пластической приверженностью и способностью дифференцироваться на три линии (остеогенную, хондрогенную и адипогенную) in vitro, ≥95% клеточной популяции должны экспрессировать CD105, CD73, CD90, и эти клетки должны отсутствовать экспрессия (≤2% положительная) CD34, CD45, CD11b, CD14 и HLA-DR, измеренная с помощью проточной цитометрии5. Несмотря на то, что МСК определялись набором биомаркеров в соответствии с минимальными критериями ISCT, их иммунные свойства не могли быть сопоставлены с этими биомаркерами, и возникла необходимость в большем, чем эти критерии, чтобы облегчить количественнуюоценку перекрестных сравнений и клональных вариаций.
Несмотря на руководящие принципы, установленные ISCT, обширные исследования МСК показали, что в этой популяции существует гетерогенность, которая может возникнуть из-за множества факторов, в основном из-за повсеместного характера гетерогенности, возникающей между донорами МСК6, тканевыми источниками7, отдельными клетками в клональной популяции8 и условиями культивирования 2,9. 10. См. Характеристика и очистка этих первичных клеток из различных тканевых источников для обеспечения качества и судьбы клеток являются ключевыми этапами их производства. Необходимость понимания отображаемых вариаций среди генеральной совокупности требует эффективного метода разложения ее на субпопуляции, которые могут быть разделены и собраны по отдельности11. Анализ на уровне отдельных клеток помогает преодолеть проблемы, связанные с межклеточной изменчивостью, уменьшить биологический шум, возникающий в гетерогенной популяции, и дает возможность исследовать и характеризовать редкие клетки12.
В зависимости от цели и выбранных параметров можно использовать несколько методов сортировки и обогащения выбранных популяций. Методы сортировки клеток могут включать в себя как массовую сортировку, так и сортировку отдельных клеток. В то время как массовая сортировка может обогатить целевые популяции с помощью магнитно-активированной сортировки клеток (MACS)13, фракционирования14 и элютриации 15, сортировка отдельных клеток может обогатить более однородные популяции с помощью флуоресцентно-активированной сортировки клеток (FACS)11. Сравнительный анализ каждого из этих методов со своим набором преимуществ и недостатков выделен в таблице 1.
Таблица 1: Сравнительный анализ различных методов: MACS, фракционирование, элютриация и FACS, подчеркивающий различия в их принципе, а также преимущества и недостатки выбора одного метода по сравнению с другим. Сокращения: MACS = Magnetic-activated cell sorting; FACS = флуоресцентно-активированная сортировка клеток. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
С момента появления этого метода одноклеточная проточная цитометрия играла важную роль в перечислении16, обнаружении и характеристике специфической клеточной популяции в гетерогенной выборке17. В 2006 году Hewitt et al. заложили основу методологии автоматизированной сортировки клеток для улучшения выделения гомогенных пулов дифференцированных эмбриональных стволовых клеток человека (ЭСК)18. Одноклеточная сортировка обогатила популяцию трансдуцированных GFP чЭСК, способствуя выделению генетически модифицированных клонов, что открыло новое измерение в клинических исследованиях. Для повышения эффективности сортировки обычно используются два подхода; Либо среда для сбора отсортированных популяций модифицируется для поддержания жизнеспособности и пролиферации постсортированных клеток19 , либо алгоритм/программное обеспечение сортировки клеток соответствующим образом модифицируется12.
С развитием технологий коммерческие проточные цитометры и сортировщики клеток смогли помочь решить проблемы, которые были решены при асептической сортировке хрупких и редких клеточных популяций, особенно стволовых клеток различного происхождения. Одной из основных проблем, стоящих перед биологами стволовых клеток, является клональная изоляция плюрипотентных стволовых клеток человека в соответствии с протоколами трансфекции, требуемымив исследованиях редактирования генов. Эта проблема была решена путем сортировки отдельных клеток по 96-луночным планшетам, которые были покрыты мышиными эмбриональными фибробластами (MEF) вместе с добавками и коммерческими низкомолекулярными ингибиторами ROCK. Тем не менее, стратегии выделения клеток могут быть в значительной степени усовершенствованы с использованием индексной сортировки, функции алгоритма сортировки, которая идентифицирует иммунофенотип отдельныхотсортированных клеток. Этот усовершенствованный метод сортировки отдельных клеток помог не только повысить эффективность сортировки стволовых клеток, особенно в отношении редких популяций гемопоэтических стволовых клеток, но и эффективно связать одноклеточные клоны с их последующими функциональными анализами20.
Данная работа посвящена одноклеточной сортировке иммунофенотипированных стволовых клеток из отслоившихся молочных зубов человека (SHEDs) для обогащения субпопуляций с целью изучения их функциональной дифференцировочной способности. Используя комбинацию двух МСК-положительных маркеров, CD90 и CD73, и отрицательного гемопоэтического маркера CD45, МСК были иммунофенотипированы и идентифицированы тусклые и нулевые экспрессоры. На основании иммунофенотипа субпопуляции были идентифицированы как чистые МСК, одиночные положительные и двойные отрицательные популяции. Они были отсортированы с использованием режима одноклеточной сортировки для получения чистых и обогащенных субпопуляций для дальнейших функциональных исследований, чтобы определить, является ли дифференциальная экспрессия маркеров артефактом условий культивирования in vitro или она также оказывает какое-либо влияние на функциональные свойства. Клетки, которые не были однородными экспрессорами «положительных маркеров МСК», были отсортированы для изучения их функциональных свойств.
протокол
Этическое одобрение и согласие на участие: Образцы отслоившейся пульпы молочных зубов были получены после получения информированного согласия и полного этического одобрения Стоматологического колледжа и больницы Шри Раджива Ганди (SRGCDS) отделения полости рта и челюстно-лицевой области, Бангалор, в соответствии со стандартами, установленными Комитетом по этическому разрешению больниц, SRGCDS. После этого выделение, культивирование, поддержание и применение SHED были одобрены и в соответствии с рекомендациями, рекомендованными Институциональным комитетом по исследованию стволовых клеток (IC-SCR) при Институте регенеративной медицины Манипала, МАЭ - Бангалор. Подробную информацию обо всех материалах и реагентах, используемых в этом протоколе, см. в таблице материалов .
1. Приготовление реагентов и буферов
- Для поддержания культуры
- Готовят питательные среды для клеток МСК (10%), используя базальную среду для недифференцированных ЭСК, 10% фетальную бычью сыворотку (FBS), 1% L-глютамин и 1% пенициллин-стрептомицин (Пен-стрептококк) (табл. 2).
- Готовят питательные среды для клеток МСК (20%), используя базальную среду для недифференцированных ЭСК, 20% FBS, 1% L-глютамина и 1% стрептококка (табл. 2).
- Готовят нейтрализующие среды, используя базальную среду для недифференцированных чЭСК, 1% L-глютамина и 1% антибиотик-антимикотик (Анти-Анти) (табл. 2).
- Для проточного цитометрического анализа и сортировки
- Приготовьте буфер для окрашивания, используя 2% FBS в фосфатно-солевом буфере (PBS).
- Приготовьте исходный раствор 4',6-диамидино-2-фенилиндола (DAPI) (1 мкг/мл), добавив 1 мкл в 1 мл PBS
- Для линейной дифференциации МСК
- Готовят дифференцировочные среды для остеогенной, хондрогенной и адипогенной дифференцировки в соответствии с составом, описанным в таблице 3. Приготовленные аликвоты хранят при температуре 4 °C в течение всего эксперимента.
- Готовят среде с сывороточным голоданием (2% среды), используя базальную среду для недифференцированных ЭСК, 2% FBS, 1% L-глютамина и 1% стрептококка (табл. 2).
| ТИП НОСИТЕЛЯ | НАЗНАЧЕНИЕ СМИ | СОСТАВ НА 50 мл | ||||||||
| ФБС | Стрептококк | L-глютамин | БАЗАЛЬНАЯ СРЕДА ДЛЯ НЕДИФФЕРЕНЦИРОВАННЫХ ЧЭСК | |||||||
| 10% СМИ | Культура и обслуживание MSC | 5 мл | 500 мкл | 500 мкл | 44 мл | |||||
| 20% медиа | Анализ КОЕ-Ф | 10 мл | 500 мкл | 500 мкл | 39 мл | |||||
| Сывороточный голодание (2%) СМИ | Среды для контрольных скважин в протоколе дифференциации | 1 мл | 500 мкл | 500 мкл | 48 мл | |||||
| Нейтрализующая среда | Среда для нейтрализации клеточной суспензии после трипсинизации | - | 500 мкл | 500 мкл | 49 мл | |||||
Таблица 2: Питательные среды для культивирования и анализа культур. Сокращения: МСК = мезенхимальная стволовая клетка; КОЕ-F = колониеобразующая единица-фибробласт.
| КОМПОНЕНТЫ | ОСТЕОГЕННЫЕ СРЕДЫ | ХОНДРОГЕННАЯ СРЕДА | АДИПОГЕННЫЕ СРЕДЫ |
| Базальная среда | 90 мл | 90 мл | 90 мл |
| Индукционные среды | 10 мл | 10 мл | 10 мл |
| Общий объем | 100 мл | 100 мл | 100 мл |
Таблица 3: Дифференциационные среды для трилинейной дифференциации SHEDs.
2. Культивирование и уход за сараями
- Поддерживайте клетки в 10% питательной среде МСК и меняйте среду каждые 2 дня или по мере необходимости.
- Трипсинизация клеток при слиянии 95% с использованием 0,25% трипсина-ЭДТА.
- Нейтрализуют клетки после трипсинизации с помощью нейтрализующей среды.
- Центрифугируют пробирку при 300 × г в течение 6 мин при комнатной температуре до получения клеточной гранулы.
- Декантируют надосадочную жидкость и ресуспендируют клеточную гранулу в 10% питательной среде МСК.
- Высевают клетки в свежеприготовленные чашки для клеточных культур, содержащие 10% питательных сред МСК для дальнейших экспериментов или субкультивирования.
ПРИМЕЧАНИЕ: Оптимальная плотность высева для SHED составляет 0,2 × 10 6 ячеек в чашке 100 мм и 0,8 × 10 6 ячеек в колбе Т-75, для получения 1,5 × 10 6 ячеек и 4 × 10 6 ячеек соответственно при слиянии 90-100%.
3. Характеристика МСК
- Краткосрочный анализ роста клеток
- Посев 4 × 10по 4 клетки/лунка в трех экземплярах в 6-луночные планшеты в 10% питательной среде МСК.
- Инкубируйте планшеты в течение 7 дней при температуре 37 °C и меняйте среду каждые 2 дня.
- Собирают клетки на 2-й, 4-й и 8-й день, используя 0,25% трипсин, и промывают питательной средой.
- Центрифугируют клетки при 300 г в течение 6 мин при комнатной температуре и ресуспендируют гранулы в 1 мл среды.
- Подсчитывают клетки с помощью гемоцитометра и определяют их жизнеспособность методом исключения трипанового синего.
- Рассчитайте скорость пролиферации, используя уравнение (1):
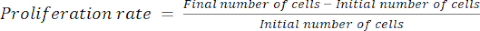 (1)
(1)
- Анализ колониеобразующей единицы фибробластов (КОЕ-F)
- Высевают 10 000 клеток в 100-миллиметровую чашку и культивируют их в 20% питательных средах МСК.
- Инкубируйте планшеты в течение 14 дней при температуре 37 °C и меняйте среду каждые 3 дня.
- Через 14 дней промойте колонии ПБС, зафиксируйте их кристаллическим фиолетовым красителем в метаноле и снова промойте ПБС, чтобы удалить остаточное пятно.
- Подсчитывайте и изображайте колонии.
ПРИМЕЧАНИЕ: Подсчитывайте колонии с >50 клеток. Эффективность колониеобразования рассчитывается как количество колониеобразующих единиц.
- Иммунофлуоресцентный анализ
- Высевают МСК на посуду диаметром 35 мм и дают им вырасти до слияния 80-90%.
- Удалите фильтрующий материал и ополосните посуду PBS один раз.
- Зафиксируйте клетки 1 мл 4% параформальдегида (PFA) путем инкубации в течение 1 ч при комнатной температуре или в течение ночи при 4 °C.
- После фиксации промыть лунки ПБСТ в течение 3 х 5 мин на коромысле.
- Добавьте 0,3% Triton X-100 в PBST (0,05% раствор Tween 20 в PBS) для пермеабилизации клеток. Держите его на коромысле в течение 15 минут при комнатной температуре.
- Промыть лунки ПБСТ в течение 3 х 5 мин на коромысле.
- Добавьте 3% бычий сывороточный альбумин (БСА) для блокировки и держите на коромысле в течение 1 ч при комнатной температуре.
- Промыть лунки ПБСТ в течение 3 х 5 мин на коромысле.
- Добавьте 800 мкл раствора 1:500 мышиного антивиментина, подержите на коромысле в течение 1 ч при комнатной температуре и перенесите планшет на 4 °C для ночной инкубации.
- На следующий день удалить первичные антитела и промыть лунки ПБСТ в течение 3 х 5 мин на коромысле.
- Добавьте 800 мкл разведения 1:1000 козьего вторичного антитела антимышиного IgG (H+L), Alexa Fluor 555, и держите его в течение 3 часов при комнатной температуре на коромысле.
- Промыть лунки ПБСТ в течение 3 х 5 мин на коромысле.
- Добавьте фаллоидиновые зонды Alexa fluor 488 240 мкл в 1 000 мкл PBS и инкубируйте при комнатной температуре в течение 60 минут на коромысле.
- Промыть лунки ПБСТ в течение 3 х 5 мин на коромысле.
- Добавьте 700 мкл монтанта DAPI и понаблюдайте за клетками под микроскопом.
- Дифференциация по линии
- Дифференциация в соответствии с культурой 2D
- Возьмите две 48-луночные пластины и обозначьте их как остеогенную и адипогенную линии соответственно.
- Высевают 15 000 клеток на лунку в четыре лунки каждой пластины и культивируют их в 10% питательных средах МСК.
- После того, как монослой клеток достигнет 90% слияния, пометьте первые две лунки как «Контрольные» и замените существующую среду средой с нехваткой сыворотки (2% среды). В последних двух лунках, помеченных как «Тест», добавьте дифференцирующую среду любой из двух линий, адипогенной или остеогенной. Отметьте это как День 0.
- Аккуратно заменяйте фильтрующий материал каждые три дня, чтобы избежать отслаивания, и будьте осторожны, чтобы избежать загрязнения.
- Поддерживайте эти условия до двадцать первого дня; Затем обработайте для эксперимента по окрашиванию.
- Дифференциация в соответствии с 3D-культурой
- Возьмите две пробирки по 15 мл для проведения хондрогенной дифференцировки с помощью 3D пеллетной культуры.
- Переложите 1 × 106 клеток в каждую пробирку и центрифугируйте при 300 × г в течение 6 мин до образования гранулы. Пометьте одну пробирку как «Контрольная» и добавьте в нее 10% питательной среды МСК; Другую пробирку обозначьте как «Тест» и добавьте хондрогенную дифференцировочную среду. Аккуратно поместите пробирки в инкубатор, неплотно закрутив крышки. Отметьте это как День 0.
- Осторожно меняйте фильтрующий материал каждые три дня, чтобы не сместить/не разрушить гранулы во время смены среды.
- Поддерживайте эти условия до двадцати первого дня, а затем обработайте клетки для дальнейших экспериментов.
- Дифференциация в соответствии с культурой 2D
- Цитохимическое окрашивание по линии
- Для 2D-культур используйте дифференцированные (тестовые) и недифференцированные МСК (контрольные) планшеты (из шага 3.4.1.5.) для окрашивания, а сначала удалите среду и дважды промойте PBS. Зафиксируйте клетки с помощью 4% PFA в течение 30 минут при комнатной температуре, удалите надосадочную жидкость и промойте один раз PBS. Выполните окрашивание для каждой линии следующим образом.
- Для получения линии адипоцитов добавьте раствор пермеабилизации из набора и инкубируйте планшет в течение 5 минут при комнатной температуре. Приготовьте и добавьте 1 мл рабочего раствора Oil red O и выдержите 10 минут. Удалите пятно и дайте пять стирок дистиллированной воде.
- Для получения остеоцитов добавьте 5% свежеприготовленной селитры серебра (в дистиллированной воде) в каждую лунку и держите планшет под ультрафиолетовым излучением в течение 1 ч. Удалите раствор и добавьте 2,5% тиосульфата натрия для удаления непрореагировавшего серебра; Держать 5 минут. Удалите пятно, дважды промойте дистиллированной водой и осмотрите окрашенные клетки под микроскопом.
- Для 3D-культур собирают гранулу после окончания периода дифференцировки с шага 3.4.2.3 и получают криосрезы дифференцированной ткани в виде гранулы. Дайте предметным стеклам высохнуть на воздухе и нагреться до комнатной температуры, прежде чем приступать к окрашиванию.
- Для хондроцитарной линии следуйте указаниям набора для окрашивания, чтобы добавить достаточное количество промывочного раствора, удалить его, добавить фиксирующий раствор и инкубировать в течение 30 минут. Промыть дистиллированной водой, добавить красящий раствор и выдержать 30 мин. Трижды промыть 0,1 Н соляной кислотой; Добавьте дистиллированную воду, чтобы нейтрализовать кислотность. Понаблюдайте за окрашенными клетками под светлопольным микроскопом.
- Для 2D-культур используйте дифференцированные (тестовые) и недифференцированные МСК (контрольные) планшеты (из шага 3.4.1.5.) для окрашивания, а сначала удалите среду и дважды промойте PBS. Зафиксируйте клетки с помощью 4% PFA в течение 30 минут при комнатной температуре, удалите надосадочную жидкость и промойте один раз PBS. Выполните окрашивание для каждой линии следующим образом.
4. Окрашивание клеточной поверхности для иммунофенотипирования
ПРИМЕЧАНИЕ: Рекомендуемыми планшетами для клеточных культур для получения оптимального количества клеток на шагах 4.2-4.5 являются чашки диаметром 100 мм или колбы Т75.
- Подготовка клеток к проточным цитометрическим экспериментам
- Трипсинизацию и сбор клеток из протекающей чашки/колбы и центрифуги при 300 × г в течение 6 мин до получения клеточной гранулы.
- Ресуспендируйте гранулу в 1 мл среды и определите количество жизнеспособных клеток с помощью гемоцитометра по методу исключения трипанового синего.
- После подсчета снова центрифугируют клеточную суспензию и дают грануле еще две промывки 1 мл окрашивающего буфера.
- Выбросьте надосадочную жидкость и, наконец, повторно суспендируйте гранулу в соответствующем объеме буфера для окрашивания в зависимости от протокола (см. шаги 4.2–4.5).
- Подготовка компенсационных контролей
- Возьмите семь пробирок FACS и пометьте их как Unstained, DAPI, V450, FITC, PE, PerCP-Cy 5.5 и APC.
- Ресуспендируйте готовую гранулу в буфере для окрашивания (см. шаг 4.1.), сохраняя плотность клеток 0,5 × 106 клеток на 50 мкл на пробирку для пробирок Unstained и DAPI.
- Подготовьте одноокрашенные трубки к компенсации, как описано в таблице 4.
- После подготовки аккуратно встряхните каждую пробирку и инкубируйте в темноте в течение 30 минут.
- После инкубации проводят две промывки, добавляя в каждую пробирку по 1 мл окрашивающего буфера, после чего проводят кратковременное вихрирование и центрифугирование при 200 г в течение 10 мин при комнатной температуре.
- Выбросьте надосадочную жидкость, повторно суспендируйте гранулу в 500 мкл окрашивающего буфера и отложите ее в сторону до получения.
- Для пробирки DAPI выполните обработку тепловым шоком, инкубируя ее на водяной бане с температурой 60 °C в течение 5 минут, а затем 15 минут на льду. Добавьте 5 мкл DAPI в суспензию и держите ее в темноте до получения результата.
- Подготовка контроля флуоресценции минус один (FMO)
- Суспендант готовой гранулы помещают в буфер для окрашивания (см. шаг 4.1), сохраняя плотность клеток 0,5 × 10,6 клеток на 50 мкл для каждой пробирки.
- Возьмите пять пробирок FACS и обозначьте их как изотип CD44-V450, CD90-FITC, CD45-PE, изотип CD73-PerCP Cy5.5 и изотип CD105-APC.
- Приготовьте суспензию клеток и антител в соответствии с таблицей 5.
- Осторожно вкрутите пробирки и инкубируйте их в течение 30 минут при комнатной температуре в темноте.
- После инкубации проводят две промывки с добавлением 1 мл окрашивающего буфера в каждую пробирку с последующим кратковременным вихрянием и центрифугированием при 200 г в течение 10 мин при комнатной температуре.
- Выбросьте надосадочную жидкость, повторно суспендируйте гранулу в 500 мкл окрашивающего буфера и отложите ее до получения.
- Подготовка образцов к анализу
- Ресуспендант готовой гранулы в буфере для окрашивания (см. шаг 4.1), поддерживая плотность клеток 0,5 × 10,6 клеток на 50 мкл для каждой пробирки.
- Возьмите две пробирки FACS и обозначьте их как Смешанные пробирки 1 и 2.
- Готовят клеточную и антителовую суспензию в соответствии с таблицей 6.
- Осторожно вкрутите пробирки и инкубируйте их в течение 30 минут при комнатной температуре в темноте.
- После инкубации проводят две промывки с добавлением 1 мл окрашивающего буфера в каждую пробирку с последующим кратковременным вихрянием и центрифугированием при 200 г в течение 10 мин при комнатной температуре.
- Выбросьте надосадочную жидкость, повторно суспендируйте гранулу в 500 мкл окрашивающего буфера и отложите до получения.
- Подготовка образцов для одноклеточной сортировки
- Возьмите две пробирки FACS, добавьте 1 мл FBS и раскатайте пробирку до образования ровного слоя FBS на внутренней стороне каждой пробирки. Выдерживают его в течение 1-2 ч, одновременно обрабатывая образец для окрашивания. Обозначьте эти пробирки как Смешанные трубки 1 и 2.
- Ресуспендант готовой гранулы в буфере для окрашивания (см. шаг 4.1), сохраняя плотность клеток 2-3 × 10,6 клеток на 50 мкл для каждой пробирки.
- Готовят суспензию клеток и антител в смешанных пробирках 1 и 2 в соответствии с таблицей 7.
- Осторожно вкрутите пробирки и инкубируйте их в течение 30 минут при комнатной температуре в темноте.
- После инкубации проводят две промывки с добавлением 1 мл окрашивающего буфера в каждую пробирку с последующим кратковременным вихрянием и центрифугированием при 200 г в течение 10 мин при комнатной температуре.
- Выбросьте надосадочную жидкость, повторно суспендируйте гранулу в 500 мкл буфера для окрашивания и отложите в сторону. Добавьте 5 мкл DAPI за 15 минут до сортировки.
ПРИМЕЧАНИЕ: Обратите внимание, что для экспериментов по сортировке рекомендуется более высокая плотность клеток на пробирку.
| Тип трубки | Бусины Positive Comp* | Отрицательные бусины* | Клетки | Добавлены антитела | |
| Трубка FITC | 1 капля | 1 капля | – | Античеловеческий CD90-FITC (2 мкл) | |
| Трубка V450 | 1 капля | 1 капля | – | Античеловеческий CD44-V450 (2 мкл) | |
| Трубка PerCP-Cy 5.5 | 1 капля | 1 капля | – | Античеловеческий CD73-PerCP Cy 5,5 (2 мкл) | |
| Полиэтиленовая трубка | 1 капля | 1 капля | – | Античеловеческий CD45-PE (2 мкл) | |
| Трубка APC | 1 капля | 1 капля | – | Античеловеческий CD105-APC (2 мкл) | |
| Трубка DAPI | – | – | 50 мкл | – | |
| Неокрашенная трубка | – | – | 50 мкл | – | |
| *1 капля = 60 мкл суспензии шарика | |||||
Таблица 4: Компенсационные контрольные выборки. Аббревиатуры: Comp = компенсация; DAPI = 4',6-диамидино-2-фенилиндол; FITC = флуоресцеин изотиоцианат; APC = аллофикоцианин; ПЭ = фикоэритрин; PerCP = перидинин-хлорофилл-белок.
| ТИП ТРУБКИ | АНТИТЕЛА К ПОЛОЖИТЕЛЬНОМУ МАРКЕРУ (2 мкл) | АНТИТЕЛА К ОТРИЦАТЕЛЬНОМУ МАРКЕРУ (2 мкл) | ДОБАВЛЕНЫ ИЗОТИПНЫЕ АНТИТЕЛА (2 мкл) | ОБЩИЙ ОБЪЕМ АНТИТЕЛ | ДОБАВЛЕН ОБЪЕМ КЛЕТОЧНОЙ СУСПЕНЗИИ | ДОБАВЛЕН ОБЪЕМ БУФЕРА ДЛЯ ОКРАШИВАНИЯ | ||
| Трубка CD90-FITC FMO | - Античеловеческий CD44-V450 | Античеловеческий CD45-PE | Изотип IgG1 FITC | 10 мкл | 50 мкл | 40 мкл | ||
| - Античеловеческий CD73 PerCP Cy 5.5 | ||||||||
| - Античеловеческий CD105-APC | ||||||||
| Трубка CD73-PerCP Cy5.5 FMO | - Античеловеческий CD44-V450 | Античеловеческий CD45-PE | Изотип PerCP Cy 5.5 IgG1 | 10 мкл | 50 мкл | 40 мкл | ||
| - Античеловеческий CD90-FITC | ||||||||
| - Античеловеческий CD105-APC | ||||||||
| Лампа CD44-V450 FMO | - Античеловеческий CD90-FITC | Античеловеческий CD45-PE | Изотип V450 IgG1 | 10 мкл | 50 мкл | 40 мкл | ||
| - Античеловеческий CD73-PerCP Cy 5.5 | ||||||||
| - Античеловеческий CD105-APC | ||||||||
| FMO-лампа CD105-APC | - Античеловеческий CD44-V450 | Античеловеческий CD45-PE | Изотип APC IgG1 | 10 мкл | 50 мкл | 40 мкл | ||
| - Античеловеческий CD90-FITC | ||||||||
| - Античеловеческий CD73-PerCP Cy 5.5 | ||||||||
| Трубка CD45-PE FMO | - Античеловеческий CD44-V450 | - | Изотип PE IgG1 | 10 мкл | 50 мкл | 40 мкл | ||
| - Античеловеческий CD90-FITC | ||||||||
| - Античеловеческий CD73-PerCP Cy 5.5 | ||||||||
| - Античеловеческий CD105-APC | ||||||||
Таблица 5: Контрольные образцы ФМО. Сокращения: FMO = флуоресценция минус единица; FITC = флуоресцеин изотиоцианат; APC = аллофикоцианин; ПЭ = фикоэритрин; PerCP = перидинин-хлорофилл-белок.
| ТИП ТРУБКИ | АНТИТЕЛА К ПОЛОЖИТЕЛЬНОМУ МАРКЕРУ (2 мкл) | АНТИТЕЛА К ОТРИЦАТЕЛЬНОМУ МАРКЕРУ (2 мкл) | ОБЩИЙ ОБЪЕМ АНТИТЕЛ | ДОБАВЛЕН ОБЪЕМ КЛЕТОЧНОЙ СУСПЕНЗИИ | ДОБАВЛЕН ОБЪЕМ БУФЕРА ДЛЯ ОКРАШИВАНИЯ | |
| Смешанная трубка 1 | - Античеловеческий CD44-V450 | Античеловеческий CD45-PE | 10 мкл | 50 мкл | 40 мкл | |
| - Античеловеческий CD90-FITC | ||||||
| - Античеловеческий CD73-PerCP Cy5.5 | ||||||
| - Античеловеческий CD105-APC | ||||||
| Смешанная трубка 2 | - Античеловеческий CD44-V450 | Античеловеческий CD45-PE | 10 мкл | 50 мкл | 40 мкл | |
| - Античеловеческий CD90-FITC | ||||||
| - Античеловеческий CD73-PerCP Cy5.5 | ||||||
| - Античеловеческий CD105-APC | ||||||
Таблица 6: Пробирки для многоцветного иммунофенотипирования SHEDs. Сокращения: SHEDs = стволовые клетки отслоившихся молочных зубов человека; ПЭ = фикоэритрин.
| ТИП ТРУБКИ | АНТИТЕЛА К ПОЛОЖИТЕЛЬНОМУ МАРКЕРУ (3 мкл) | АНТИТЕЛА К ОТРИЦАТЕЛЬНОМУ МАРКЕРУ (3 МКЛ) | ОБЩИЙ ОБЪЕМ АНТИТЕЛ | ДОБАВЛЕН ОБЪЕМ КЛЕТОЧНОЙ СУСПЕНЗИИ | ДОБАВЛЕН ОБЪЕМ БУФЕРА ДЛЯ ПЯТЕН | |
| Смешанная трубка 1 | - Античеловеческий CD90-FITC | Античеловеческий CD45-PE | 9 мкл | 50 мкл | 41 мкл | |
| - Античеловеческий CD73-PerCP Cy5.5 | ||||||
| Смешанная трубка 2 | - Античеловеческий CD90-FITC | Античеловеческий CD45-PE | 9 мкл | 50 мкл | 41 мкл | |
| - Античеловеческий CD73-PerCP Cy5.5 | ||||||
Таблица 7: Одноклеточные реакционные пробирки для сортировки. Сокращения: FITC = флуоресцеин изотиоцианат; ПЭ = фикоэритрин; PerCP = перидинин-хлорофилл-белок.
5. Одноячеечная сортировка
- Подготовка клеточного сортировщика
- Установите в сортировщик сопло 100 мкм.
ПРИМЕЧАНИЕ: Диаметр соответствующего сопла должен быть как минимум в пять раз больше диаметра сортируемой частицы. Жидкость оболочки, которая будет использоваться для сортировки, должна быть определена в зависимости от типа образца и чувствительности эксперимента; Для этого эксперимента была использована запатентованная жидкость для оболочки. - Выполняйте ежедневную проверку качества прибора (QC) и настраивайте сортировщик для эксперимента. Обратитесь к руководству по прибору для получения подробного руководства по настройке прибора.
- Установите в сортировщик сопло 100 мкм.
- Настройка матрицы компенсаций
- Установите компенсационную матрицу с помощью компенсационных трубок с одним пятном, как показано в шаге 4.2.
- В проприетарном программном обеспечении выберите «Эксперимент» на панели инструментов и нажмите «Настройка компенсации». Откройте Создание элементов управления компенсациями.
- Проверьте маркеры и подтвердите. Добавляется новый образец с именем «Компенсация», при котором программное обеспечение автоматически добавляет новые пробирки, называемые маркерными элементами управления.
- Выберите трубку Unstained и запустите ее, чтобы записать 5 000 событий. Перетащите гейт на заполнение ячеек и примените его ко всем элементам управления компенсацией. Это необходимо для установки напряжений и отрицательного затвора для каждого флуоресцентного параметра.
- Точно так же загрузите трубки для компенсации одиночных пятен отдельно, а также запишите и сохраните данные. Выберите ворота, разграничивающие интересующую совокупность, и примените их ко всем элементам управления компенсациями. Это необходимо для установки положительных вентилей для каждого флуоресцентного параметра.
- Выберите «Эксперимент» на панели инструментов и нажмите «Рассчитать значения компенсации | ссылка и сохранить».
ПРИМЕЧАНИЕ: После того, как матрица автокомпозиции сгенерирована с помощью программного обеспечения, параметры напряжения флуорохромов не могут быть изменены ни для одного из каналов в смешанных лампах.
- Сбор данных
- Запишите 10 000 клеток в каждую пробирку, начиная с шага 4.3. 4.4 для сбора данных для анализа иммунофенотипа клеток.
- Подготовка устройств для сбора
- В зависимости от назначения отсортированных клеточных популяций можно выбрать 6-луночные, 24-луночные, 48-луночные или 96-луночные планшеты.
- Смажьте лунки 200-500 мкл FBS и держите планшеты нетронутыми в течение 2 ч.
- Через 2 ч удаляют остатки ФБС и добавляют 200-500 мкл 10% питательных сред МСК.
- Сортировка ячеек в режиме сортировки по одной ячейке
- Запустите смешанную трубку 1 (начиная с шага 4.5) и запишите 10 000 событий, чтобы установить шлюзы для интересующей нас популяции для сортировки, используя соответствующую стратегию стробирования.
- Загрузите сборную пластину и установите целевые номера ячеек в диапазоне от 2 500 до 5 000 ячеек на лунку и выберите маску чистоты сортировки одной ячейки.
- Соберите отсортированные популяции в устройство сбора и держите их на льду до конца эксперимента по сортировке.
- После этого перенесите планшеты в инкубатор с 5%CO2 для поддержания культуры при температуре 37 °C.
ПРИМЕЧАНИЕ: После сбора необработанные файлы данных экспортировались в формате .fcs (v.3.0. и выше). Отчеты о сортировке, создаваемые после каждого эксперимента, записывали количество событий/ячеек, отсортированных по заданной скважине, и указывали количество конфликтов, которые были прерваны.
Результаты
SHED были охарактеризованы стандартными иммунофлуоресцентными анализами, показывающими экспрессию виментина (красные, промежуточные нити III типа), актиновых филаментов (фаллоидиновые зонды Alexa fluor 488) и ядер, окрашенных DAPI (рис. 1A). Для оценки их пролиферативной и колониеоб...
Обсуждение
В области тканевой инженерии и регенеративной медицины, среди постнатальных источников, МСК, полученные из пероральных тканей, вызвали глубокий интерес из-за их минимальных этических обязательств и значительного многолинейного дифференциального потенциала21. Стволовые ?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Благодарности
Мы благодарим Центр проточных ячеек в Центре передовых научных исследований им. Джавахарлала Неру (Бангалор, Индия) за использование основной установки проточной цитометрии. Криосекционирование гранульной культуры дифференцированных клеток проводили в референс-лаборатории Neuberg Anand, Бангалор, Индия. Эта работа была поддержана Академией высшего образования Манипала (MAHE), Индия. AG благодарит за поддержку стипендию доктора Т. М. А. Пая от MAHE.
Материалы
| Name | Company | Catalog Number | Comments |
| Alcian Blue Stain | HiMedia | CCK029-1KT | |
| Antibiotic-Antimycotic (100x) | Gibco by ThermoFisher | 15240062 | |
| BD CompBead Plus Anti-Mouse Ig, κ/Negative Control (BSA) Compensation Plus (7.5 µm) Particles Set | BD Biosciences | 560497 | |
| BD FACS Accudrop Beads | BD Biosciences | 345249 | Used to set up the Laser delay when the sort module opens. |
| BD FACS Aria Fusion Flow cytometer | BD Biosciences | --- | |
| BD FACS Diva 9.4 | BD Biosciences | --- | |
| BD FACS Sheath Fluid | BD Biosciences | 342003 | Used as sheath fluid for both analysis and sorting experiments in the BD FACSAria Fusion |
| BD FACSDiva CS&T Research Beads | BD Biosciences | 655050 | Used for Instrument configuration depending on the nozzle size. |
| BD Horizon V450 Mouse Anti-Human CD44 | BD Biosciences | 561292 | |
| BD Horizon V450 Mouse IgG2b, κ Isotype Control | BD Biosciences | 560374 | CD44-V450 isotype |
| BD Pharmingen APC Mouse Anti-Human CD105 | BD Biosciences | 562408 | |
| BD Pharmingen APC Mouse IgG1, κ Isotype Control | BD Biosciences | 555751 | CD105-APC isotype |
| BD Pharmingen DAPI Solution | BD Biosciences | 564907 | DAPI Stock solution of 1 mg/mL |
| BD Pharmingen FITC Mouse Anti-Human CD90 | BD Biosciences | 555595 | |
| BD Pharmingen FITC Mouse IgG1, κ Isotype Control | BD Biosciences | 555748 | CD90-FITC isotype |
| BD Pharmingen PE Mouse Anti-Human CD45 | BD Biosciences | 555483 | |
| BD Pharmingen PE Mouse IgG1, κ Isotype Control | BD Biosciences | 555749 | CD45-PE isotype |
| BD Pharmingen PerCP-Cy 5.5 Mouse Anti-Human CD73 | BD Biosciences | 561260 | |
| BD Pharmingen PerCP-Cy 5.5 Mouse IgG1, κ Isotype Control | BD Biosciences | 550795 | CD73-PerCP-Cy 5.5 isotype |
| BD Pharmingen Purified Mouse Anti-Vimentin | BD Biosciences | 550513 | |
| Bovine serum albumin | Hi-Media | TC548-5G | |
| Crystal violet | Nice chemical pvt ltd | C33809 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-aldrich | D5652-50L | dPBS used for culture work and maintenance. |
| Ethanol | --- | --- | Used for general sterlization. |
| Fetal Bovine Serum | Gibco by ThermoFisher | 10270-106 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | ThermoFisher Scientific | A-21422 | |
| KO-DMEM | Gibco by ThermoFisher | 10829018 | Basal medium for undifferentiated hESCs, used in the preparation of culture media |
| L-Glutamine 200mM (100x) | Gibco by ThermoFisher | 25030-081 | |
| Methanol, for Molecular Biology | Hi-Media | MB113 | |
| Oil red O | HiMedia | CCK013-1KT | |
| Paraformaldehyde | loba chemie | 30525-89-4 | |
| Penicillin Streptomycin (100x) | Gibco by ThermoFisher | 15140- 122 | |
| Phalloidin (ActinGreen 488 ReadyProbes reagent) | Invitrogen | R37110 | |
| Silver Nitrate | HiMedia | MB156-25G | |
| Sodium Thiosulphate pentahydrate | Chemport | 10102-17-7 | |
| Sphero Rainbow Fluorescent Particles, 3.0 - 3.4 µm | BD Biosciences | 556291 | |
| Staining buffer | Prepared in MIRM | ---- | It was prepared using 2% FBS in PBS |
| StemPro Adipogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10410-01 | Basal media for Adipogenic media |
| StemPro Adipogenesis Supplement | Gibco by ThermoFisher | A10065-01 | Induction media for Adipogenic media |
| StemPro Chondrogenesis Supplement | Gibco by ThermoFisher | A10064-01 | Induction media for Chondrogenic media |
| StemPro Osteogenesis Supplement | Gibco by ThermoFisher | A10066-01 | Induction media for Osteoogenic media |
| StemPro Osteogenesis/Chondrogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10069-01 | Basal media for both Ostegenic and Chondrogenic media |
| Triton-X-100 | Hi-Media | MB031 | |
| Trypan Blue | Gibco by life technologies | 15250-061 | |
| Trypsin - EDTA Solution 1x | Hi-media | TCL049 | |
| Tween-20 | MERCK | 9005-64-5 |
Ссылки
- Kobolak, J., Dinnyes, A., Memic, A., Khademhosseini, A., Mobasheri, A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods. 99, 62-68 (2016).
- Wilson, A., Hodgson-Garms, M., Frith, J. E., Genever, P. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Frontiers in Immunology. 10, 1112 (2019).
- Li, J., et al. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Molecular Medicine Reports. 18 (6), 4969-4977 (2018).
- McLeod, C. M., Mauck, R. L. On the origin and impact of mesenchymal stem cell heterogeneity: new insights and emerging tools for single cell analysis. European Cells & Materials. 34, 217-231 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Wang, J., Liao, L., Wang, S., Tan, J. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations. Cytotherapy. 15 (8), 893-904 (2013).
- Kern, S., Eichler, H., Stoeve, J., Kluter, H., Bieback, K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 24 (5), 1294-1301 (2006).
- Dunn, C. M., Kameishi, S., Grainger, D. W., Okano, T. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell-based therapies. Acta Biomaterialia. 133, 114-125 (2021).
- Yang, Y. K., Ogando, C. R., Wang See, C., Chang, T. Y., Barabino, G. A. Changes in phenotype and differentiation potential of human mesenchymal stem cells aging in vitro. Stem Cell Research & Therapy. 9 (1), 131 (2018).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences. 78 (2), 447-467 (2021).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Review of Scientific Instruments. 43 (3), 404-409 (1972).
- Schulte, R., et al. Index sorting resolves heterogeneous murine hematopoietic stem cell populations. Experimental Hematology. 43 (9), 803-811 (2015).
- Liao, X., Makris, M., Luo, X. M. Fluorescence-activated cell sorting for purification of plasmacytoid dendritic cells from the mouse bone marrow. Journal of Visualized Experiments. (117), (2016).
- Roda, B., et al. A novel stem cell tag-less sorting method. Stem Cell Reviews and Reports. 5 (4), 420-427 (2009).
- Hall, S. R., et al. Identification and isolation of small CD44-negative mesenchymal stem/progenitor cells from human bone marrow using elutriation and polychromatic flow cytometry. Stem Cells Translational Medicine. 2 (8), 567-578 (2013).
- Eggleton, M. J., Sharp, A. A. Platelet counting using the Coulter electronic counter. Journal of Clinical Pathology. 16 (2), 164-167 (1963).
- Porwit-Ksiazek, A., Aman, P., Ksiazek, T., Biberfeld, P. Leu 7+ (HNK-1+) cells. II. Characterization of blood Leu 7+ cells with respect to immunophenotype and cell density. Scandinavian Journal of Immunology. 18 (6), 495-449 (1983).
- Hewitt, Z., et al. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning and Stem Cells. 8 (3), 225-234 (2006).
- Singh, A. M. An efficient protocol for single-cell cloning human pluripotent stem cells. Frontiers in Cell and Developmental Biology. 7, 11 (2019).
- Wilson, N. K., et al. Combined single-cell functional and gene expression analysis resolves heterogeneity within stem cell populations. Cell Stem Cell. 16 (6), 712-724 (2015).
- Zhou, L. L., et al. Oral mesenchymal stem/progenitor cells: the immunomodulatory masters. Stem Cells Inernational. 2020, 1327405 (2020).
- Fawzy El-Sayed, K. M., et al. Adult mesenchymal stem cells explored in the dental field. Advances in Biochemical Engineering/Biotechnology. 130, 89-103 (2013).
- Hardy, W. R., et al. Transcriptional networks in single perivascular cells sorted from human adipose tissue reveal a hierarchy of mesenchymal stem cells. Stem Cells. 35 (5), 1273-1289 (2017).
- . . FACSAria Fusion User's Guide. , (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены