Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tri unicellulaire de cellules souches mésenchymateuses immunophénotypées à partir de dents de lait exfoliées humaines
Dans cet article
Résumé
Ce protocole décrit l’utilisation du tri cellulaire activé par fluorescence des cellules souches mésenchymateuses humaines à l’aide de la méthode de tri unicellulaire. Plus précisément, l’utilisation du tri unicellulaire permet d’atteindre une pureté de 99 % des cellules immunophénotypées d’une population hétérogène lorsqu’elle est associée à une approche multiparamétrique basée sur la cytométrie en flux.
Résumé
Les cellules souches mésenchymateuses (CSM) d’un organisme possèdent une capacité extraordinaire à se différencier en plusieurs lignées de cellules adultes dans le corps et sont connues pour leurs propriétés immunomodulatrices et anti-inflammatoires. L’utilisation de ces cellules souches est une aubaine pour le domaine de la biologie régénérative, mais en même temps, un fléau pour la médecine régénérative et la thérapeutique en raison des multiples ambiguïtés cellulaires qui leur sont associées. Ces ambiguïtés peuvent provenir de la diversité de la source de ces cellules souches et de leurs conditions de croissance in vitro , qui reflètent toutes deux leur hétérogénéité fonctionnelle.
Cela justifie des méthodologies pour fournir des populations purifiées et homogènes de CSM pour des applications thérapeutiques. Les progrès dans le domaine de la cytométrie en flux ont permis la détection de populations unicellulaires à l’aide d’une approche multiparamétrique. Ce protocole décrit un moyen d’identifier et de purifier les cellules souches des dents de lait exfoliées humaines (SHED) par le biais d’un tri unicellulaire assisté par fluorescence. L’expression simultanée de marqueurs de surface, à savoir l’isothiocyanate de fluorescéine CD90 (FITC), la protéine CD73-péridinine-chlorophylle (PerCP-Cy5.5), l’allophycocyanine CD105 (APC) et CD44-V450, a permis d’identifier les expresseurs positifs « brillants » des CSM à l’aide de la cytométrie en flux multiparamétrique. Cependant, une baisse significative a été observée dans les pourcentages de quadruples expresseurs de ces marqueurs positifs à partir du passage 7 jusqu’aux passages ultérieurs.
Les sous-populations immunophénotypées ont été triées en utilisant le mode de tri unicellulaire où seulement deux marqueurs positifs et un marqueur négatif constituaient les critères d’inclusion. Cette méthodologie a permis d’assurer la viabilité cellulaire des populations triées et de maintenir la prolifération cellulaire après le tri. L’application en aval d’un tel tri peut être utilisée pour évaluer la différenciation spécifique à la lignée pour les sous-populations fermées. Cette approche peut être appliquée à d’autres systèmes à cellule unique afin d’améliorer les conditions d’isolement et d’acquérir des informations sur les marqueurs de surface de plusieurs cellules.
Introduction
Les cellules souches mésenchymateuses (CSM) peuvent être considérées comme une source évolutive de cellules adaptées aux thérapies cellulaires et peuvent être considérées comme un système de référence en médecine régénérative. Ces cellules peuvent être isolées à partir d’une variété de sources dans le corps avec des origines tissulaires différentes1. En fonction de leur tissu source, chaque type de CSM présente un comportement in vitro ambigu2. Ceci est bien observé dans leurs propriétés morphologiques et fonctionnelles3. De nombreuses études ont montré une variation intra-clonale des dimensions, y compris la différenciation des tissus adultes, l’état génomique et l’architecture métabolique et cellulaire des CSM 2,4.
L’immunophénotypage des cellules a été une application courante de la cytométrie en flux pour l’identification des cellules souches et cela a été utilisé par la Société internationale de thérapie cellulaire et génique (ISCT) en 2006 pour prescrire une liste de critères minimaux pour identifier les cellules comme des CSM. Il a déclaré qu’en plus de l’adhérence plastique et de la capacité de se différencier en trois lignées (ostéogène, chondrogénique et adipogénique) in vitro, ≥95% de la population cellulaire doit exprimer CD105, CD73, CD90, et ces cellules doivent manquer l’expression (≤2% positive) de CD34, CD45, CD11b, CD14 et HLA-DR, tel que mesuré par cytométrie en flux5. Bien que les CSM aient été définies par un ensemble de biomarqueurs selon les critères minimaux de l’ISCT, leurs propriétés immunitaires n’ont pas pu être comparées à ces biomarqueurs et il était nécessaire d’aller au-delà de ces critères pour faciliter les comparaisons entre études et les variations clonales2.
Malgré les lignes directrices établies par l’ISCT, des recherches approfondies sur les CSM ont montré qu’il existe une hétérogénéité dans cette population, qui pourrait résulter d’une multitude de facteurs, principalement en raison de la nature omniprésente de l’hétérogénéité qui se produit entre les donneurs de CSM6, les sources tissulaires7, les cellules individuelles au sein d’une population clonale8 et les conditions de culture2,9, 10. Le Chapitre 10. La caractérisation et la purification de ces cellules primaires à partir d’une variété de sources tissulaires afin d’assurer la qualité et le devenir cellulaire sont des étapes clés de leur production. La nécessité de comprendre les variations affichées au sein de la population nécessite une méthode efficace pour la résoudre en sous-populations qui peuvent être divisées et collectées séparément11. Les analyses au niveau d’une seule cellule permettent de surmonter les défis de la variation de cellule à cellule, de réduire le bruit biologique résultant d’une population hétérogène et d’offrir la possibilité d’étudier et de caractériser les cellules rares12.
En fonction de l’objectif et des paramètres choisis, plusieurs méthodes peuvent être utilisées pour trier et enrichir les populations sélectionnées. Les techniques de tri cellulaire peuvent comprendre à la fois des méthodes de tri en vrac et des méthodes de tri à cellule unique. Alors que le tri en vrac peut enrichir les populations cibles grâce au tri cellulaire activé par le magnétisme (MACS)13, au fractionnement14 et à l’élutriation 15, le tri unicellulaire peut enrichir des populations plus homogènes au moyen du tri cellulaire activé par fluorescence (FACS)11. Le tableau 1 présente une analyse comparative de chacune de ces méthodes, avec ses propres avantages et inconvénients.
Tableau 1 : Analyses comparatives de différentes techniques : MACS, Fractionnement, Elutriation et FACS mettant en évidence les différences dans leur principe et les avantages et inconvénients du choix d’une technique particulière par rapport à une autre. Abréviations : MACS = Tri des cellules activées par magnétisme ; FACS = Tri cellulaire activé par fluorescence. Veuillez cliquer ici pour télécharger ce tableau.
Depuis l’avènement de la technique, la cytométrie en flux unicellulaire a joué un rôle majeur dans le dénombrement16, la détection et la caractérisation d’une population cellulaire spécifique dans un échantillon hétérogène17. En 2006, Hewitt et al. ont jeté les bases d’une méthodologie de tri cellulaire automatisé pour améliorer l’isolement de pools homogènes de cellules souches embryonnaires humaines différenciées (CSEh)18. Le tri unicellulaire a enrichi la population de CSEh transduites par GFP, facilitant l’isolement de clones génétiquement modifiés, ce qui a ouvert une nouvelle dimension à la recherche clinique. Pour améliorer l’efficacité du tri, deux approches ont généralement été adoptées ; Soit les milieux de collecte des populations triées sont modifiés pour maintenir la viabilité et la prolifération des cellules post-triées19 , soit l’algorithme/logiciel de tri cellulaire est modifié de manière appropriée12.
Grâce aux progrès de la technologie, les cytomètres en flux et les trieurs cellulaires commerciaux ont été en mesure d’aider à relever les défis qui ont été relevés lors du tri aseptique des populations de cellules fragiles et rares, en particulier des cellules souches d’origines différentes. L’un des principaux défis des biologistes des cellules souches a été l’isolement clonal de cellules souches pluripotentes humaines selon les protocoles de transfection requis dans les études d’édition de gènes19. Ce problème a été résolu en triant des cellules individuelles dans des plaques de 96 puits qui ont été recouvertes de fibroblastes embryonnaires de souris (MEF) ainsi que de suppléments et d’inhibiteurs commerciaux de petites molécules ROCK. Cependant, les stratégies d’isolement cellulaire pourraient être largement affinées avec l’utilisation du tri par index, une caractéristique de l’algorithme de tri qui identifie l’immunophénotype des cellules individuelles triées12. Cette modalité raffinée de tri unicellulaire a permis non seulement d’améliorer l’efficacité du tri des cellules souches, en particulier en ce qui concerne les populations rares de cellules souches hématopoïétiques, mais aussi de relier efficacement les clones unicellulaires à leurs tests fonctionnels en aval20.
Cet article se concentre sur le tri unicellulaire de cellules souches immunophénotypées à partir de dents de lait exfoliées humaines (SHEDs) pour l’enrichissement de sous-populations afin d’étudier leurs capacités de différenciation fonctionnelle. À l’aide d’une combinaison de deux marqueurs MSC positifs, CD90 et CD73, et d’un marqueur hématopoïétique négatif CD45, les CSM ont été immunophénotypées et les exprimeurs faibles et nuls ont été identifiés. Sur la base de leur immunophénotype, les sous-populations ont été identifiées comme des CSM pures, des populations positives simples et des populations négatives doubles. Ils ont été triés à l’aide du mode de tri sur cellule unique afin d’obtenir des sous-populations pures et enrichies pour d’autres études fonctionnelles afin d’identifier si l’expression différentielle des marqueurs était un artefact des conditions de culture in vitro ou si elle avait également un effet sur les propriétés fonctionnelles. Les cellules qui n’étaient pas des exprimeurs homogènes des « marqueurs positifs des CSM » ont été triées pour étudier leurs propriétés fonctionnelles.
Protocole
Approbation éthique et consentement à participer : Des échantillons de pulpe dentaire à feuilles caduques exfoliés humains ont été reçus après avoir obtenu un consentement éclairé et une approbation éthique complète par le département buccal et maxillo-facial du Sri Rajiv Gandhi Dental College and Hospital (SRGCDS), à Bangalore, conformément aux normes établies par le Comité d’approbation éthique de l’hôpital, SRGCDS. À la suite de quoi, l’isolement, la culture, l’entretien et l’application des SHED ont été approuvés et conformes aux directives recommandées par le Comité institutionnel pour la recherche sur les cellules souches (IC-SCR) de l’Institut de médecine régénérative de Manipal, MAHE - Bangalore. Reportez-vous au tableau des matériaux pour plus de détails sur tous les matériaux et réactifs utilisés dans ce protocole.
1. Préparation des réactifs et des tampons
- Pour l’entretien de la culture
- Préparer les milieux de culture cellulaire CSM (10 %) à l’aide d’un milieu basal pour les CSEh indifférenciées, de 10 % de sérum de veau fœtal (FBS), de 1 % de L-glutamine et de 1 % de pénicilline-streptomycine (Pen-streptocycine) (tableau 2).
- Préparer les milieux de culture cellulaire CSM (20 %) à l’aide d’un milieu basal pour les CSEh indifférenciées, 20 % de FBS, 1 % de L-glutamine et 1 % de Pen-strep (tableau 2).
- Préparer un milieu neutralisant à l’aide d’un milieu basal pour les CSEh indifférenciées, 1 % de L-glutamine et 1 % d’antibiotique-antimycosique (anti-anti) (tableau 2).
- Pour l’analyse et le tri par cytométrie en flux
- Préparer le tampon de coloration en utilisant 2 % de FBS dans une solution saline tamponnée au phosphate (PBS).
- Préparer une solution mère de 4′,6-diamidino-2-phénylindole (DAPI) (1 μg/mL) en ajoutant 1 μL dans 1 mL de PBS
- Pour la différenciation des CSM en fonction de la lignée
- Préparer les milieux de différenciation pour la différenciation ostéogène, chondrogénique et adipogénique selon la composition décrite dans le tableau 3. Conserver les aliquotes préparées à 4 °C pendant toute la durée de l’expérience.
- Préparer les milieux affamés de sérum (2 % de milieu) à l’aide d’un milieu basal pour les CSEh indifférenciées, 2 % de FBS, 1 % de L-glutamine et 1 % de Pen-strep (tableau 2).
| TYPE DE SUPPORT | OBJECTIF DU MÉDIA | COMPOSITION POUR 50 mL | ||||||||
| FBS (en anglais seulement) | Sclétocoque stylo | L-Glutamine | MILIEU BASAL POUR HESC INDIFFÉRENCIÉS | |||||||
| 10 % de médias | Culture et entretien du MSC | 5 ml | 500 μL | 500 μL | 44 mL | |||||
| 20 % de médias | Dosage CFU-F | 10 ml | 500 μL | 500 μL | 39 ml | |||||
| Milieux affamés de sérum (2 %) | Milieux pour puits de contrôle dans le protocole de différenciation | 1 ml | 500 μL | 500 μL | 48 ml | |||||
| Médias neutralisants | Milieux de neutralisation de la suspension cellulaire après trypsinisation | - | 500 μL | 500 μL | 49 ml | |||||
Tableau 2 : Milieux de culture cellulaire pour l’entretien des cultures et les dosages. Abréviations : MSC = cellule souche mésenchymateuse ; CFU-F = fibroblaste unitaire formant colonie.
| COMPOSANTS | MILIEUX OSTÉOGÈNES | MILIEUX CHONDROGÈNES | MILIEUX ADIPOGÉNIQUES |
| Milieux de base | 90 ml | 90 ml | 90 ml |
| Milieu d’induction | 10 ml | 10 ml | 10 ml |
| Total Volume | 100 ml | 100 ml | 100 ml |
Tableau 3 : Milieux de différenciation pour la différenciation trilinéaire des SHED.
2. Culture et entretien des SHED
- Maintenir les cellules dans un milieu de culture MSC à 10 % et effectuer des changements de milieu tous les 2 jours ou au besoin.
- Trypsiniser les cellules à 95 % de confluence en utilisant 0,25 % de trypsine-EDTA.
- Neutraliser les cellules après trypsinisation à l’aide d’un milieu neutralisant.
- Centrifuger le tube à 300 × g pendant 6 min à température ambiante pour obtenir une pastille cellulaire.
- Décanter le surnageant et remettre en suspension la pastille cellulaire dans un milieu de culture à 10 % de CSM.
- Semez les cellules dans des boîtes de culture cellulaire fraîchement préparées contenant 10 % de milieux de culture MSC pour d’autres expériences ou une sous-culture.
NOTA : La densité de semis optimale pour les SHED est de 0,2 × 10 6 cellules dans une boîte de 100 mm et de 0,8 × 10 6 cellules dans une fiole T-75, pour obtenir 1,5 × 10 6 cellules et 4 × 10 6 cellules, respectivement, à 90-100 % de confluence.
3. Caractérisation des CSM
- Test de croissance cellulaire à court terme
- Semences 4 × 104 cellules/puits en trois exemplaires dans des plaques de 6 puits dans un milieu de culture MSC à 10 %.
- Incuber les plaques pendant 7 jours à 37 °C et effectuer des changements de milieux tous les 2 jours.
- Récoltez les cellules aux jours 2, 4 et 8 en utilisant un traitement à la trypsine à 0,25 % et lavez-les avec un milieu de culture.
- Centrifuger les cellules à 300 g pendant 6 min à température ambiante et remettre la pastille en suspension dans 1 mL de milieu.
- Comptez les cellules à l’aide d’un hémocytomètre et déterminez leur viabilité par la méthode d’exclusion du bleu de trypan.
- Calculer le taux de prolifération à l’aide de l’équation (1) :
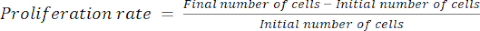 (1)
(1)
- Dosage des fibroblastes unitaires formant colonies (CFU-F)
- Semez 10 000 cellules dans une boîte de 100 mm et cultivez-les dans un milieu de culture MSC à 20 %.
- Incuber les plaques pendant 14 jours à 37 °C et changer de milieu tous les 3 jours.
- Après 14 jours, rincez les colonies avec du PBS, fixez-les avec un colorant violet cristallin dans du méthanol et rincez à nouveau avec du PBS pour éliminer la tache résiduelle.
- Comptez et imagez les colonies.
REMARQUE : Compter les colonies de >50 cellules. L’efficacité de la formation de colonies est calculée en tant que nombres d’unités formant des colonies.
- Test d’immunofluorescence
- Semez les CSM sur des boîtes de 35 mm et laissez-les pousser jusqu’à 80-90% de confluence.
- Retirez le support et rincez la vaisselle avec du PBS une fois.
- Fixez les cellules avec 1 mL de paraformaldéhyde (PFA) à 4 % en incubant pendant 1 h à température ambiante ou toute la nuit à 4 °C.
- Après fixation, laver les puits avec du PBST pendant 3 x 5 min sur la bascule.
- Ajouter 0,3 % de Triton X-100 dans le PBST (0,05 % de solution Tween 20 dans le PBS) pour perméabiliser les cellules. Gardez-le sur la bascule pendant 15 min à température ambiante.
- Lavez les puits avec du PBST pendant 3 x 5 min sur la bascule.
- Ajoutez 3 % d’albumine sérique bovine (BSA) pour le blocage et maintenez-le sur la bascule pendant 1 h à température ambiante.
- Lavez les puits avec du PBST pendant 3 x 5 min sur la bascule.
- Ajouter 800 μL d’anti-vimentine de souris d’une dilution de 1 :500, le maintenir sur la bascule pendant 1 h à température ambiante et transférer la plaque à 4 °C pour une incubation nocturne.
- Le lendemain, retirez l’anticorps primaire et lavez les puits avec PBST pendant 3 x 5 min sur la bascule.
- Ajouter 800 μL d’anticorps secondaire à adsorption croisée Alexa Fluor 555 d’anticorps IgG anti-souris de chèvre (H+L) dilué 1 :1 000 et le conserver pendant 3 h à température ambiante sur la bascule.
- Lavez les puits avec du PBST pendant 3 x 5 min sur la bascule.
- Ajouter les sondes de phalloïdine Alexa fluor 488 240 μL dans 1 000 μL de PBS et incuber à température ambiante pendant 60 min sur la bascule.
- Lavez les puits avec du PBST pendant 3 x 5 min sur la bascule.
- Ajoutez 700 μL de produit de montage DAPI et observez les cellules au microscope.
- Différenciation spécifique à la lignée
- Différenciation suite à la culture 2D
- Prenez deux plaques à 48 puits et étiquetez-les comme des lignées ostéogéniques et adipogéniques, respectivement.
- Ensemencer 15 000 cellules/puits dans quatre puits de chaque plaque et les cultiver dans un milieu de culture MSC à 10 %.
- Une fois que la monocouche de cellules a atteint 90 % de confluence, étiquetez les deux premiers puits comme « Témoin » et remplacez le milieu existant par un milieu affamé de sérum (2 % de milieu). Dans les deux derniers puits étiquetés comme « Test », ajoutez les milieux de différenciation de l’une ou l’autre des deux lignées, adipogénique ou ostéogène. Marquez-le comme le jour 0.
- Remplacez délicatement le substrat tous les trois jours pour éviter l’écaillage et veillez à éviter toute contamination.
- Maintenez ces conditions jusqu’au vingt et unième jour ; puis processus pour l’expérience de coloration.
- Différenciation suite à la culture 3D
- Prenez deux tubes de 15 mL pour effectuer une différenciation chondrogénique à l’aide d’une culture de granulés 3D.
- Transvaser 1 × 106 cellules dans chaque tube et centrifuger à 300 × g pendant 6 min pour former une pastille. Étiquetez un tube comme « Témoin » et ajoutez-y 10 % de milieu de culture MSC ; étiquetez l’autre tube comme « Test » et ajoutez un milieu de différenciation chondrogène. Placez soigneusement les tubes dans l’incubateur avec leurs bouchons vissés sans serrer. Marquez-le comme le jour 0.
- Changez soigneusement le substrat tous les trois jours, afin de ne pas déloger/désintégrer la pastille lors des changements de milieu.
- Maintenez ces conditions jusqu’au vingt-et-unième jour, puis traitez les cellules pour d’autres expériences.
- Différenciation suite à la culture 2D
- Coloration cytochimique spécifique à la lignée
- Pour les cultures 2D, utilisez les plaques MSC (test) et indifférenciées (témoins) (de l’étape 3.4.1.5.) pour la coloration, puis retirez d’abord le milieu et lavez-le deux fois avec du PBS. Fixez les cellules à l’aide de PFA à 4 % pendant 30 minutes à température ambiante, retirez le surnageant et lavez une fois avec du PBS. Effectuez la coloration pour chaque lignée comme suit.
- Pour la lignée des adipocytes, ajoutez la solution de perméabilisation du kit et incubez la plaque pendant 5 min à température ambiante. Préparez et ajoutez 1 mL de solution de travail Oil red O et conservez-la pendant 10 min. Enlevez la tache et lavez cinq fois avec de l’eau distillée.
- Pour la lignée des ostéocytes, ajoutez 5% de nitrate d’argent fraîchement préparé (dans de l’eau distillée) dans chaque puits et maintenez la plaque sous UV pendant 1 h. Retirer la solution et ajouter 2,5 % de thiosulfate de sodium pour éliminer l’argent qui n’a pas réagi ; Gardez-le pendant 5 min. Enlevez la tache, lavez deux fois à l’eau distillée et observez les cellules colorées au microscope.
- Pour les cultures 3D, prélever la pastille après la fin de la période de différenciation de l’étape 3.4.2.3 et obtenir des cryocoupes du tissu différencié sous forme de pastille. Laissez les lames sécher à l’air libre et à température ambiante avant de procéder à la coloration.
- Pour la lignée des chondrocytes, suivez les instructions du kit de coloration pour ajouter un volume suffisant de solution de lavage, retirez-le, ajoutez la solution de fixation et incubez pendant 30 min. Laver à l’eau distillée, ajouter la solution colorante et incuber pendant 30 min. Laver trois fois avec de l’acide chlorhydrique 0,1 N ; Ajoutez de l’eau distillée pour neutraliser l’acidité. Observez les cellules colorées sous un microscope à fond clair.
- Pour les cultures 2D, utilisez les plaques MSC (test) et indifférenciées (témoins) (de l’étape 3.4.1.5.) pour la coloration, puis retirez d’abord le milieu et lavez-le deux fois avec du PBS. Fixez les cellules à l’aide de PFA à 4 % pendant 30 minutes à température ambiante, retirez le surnageant et lavez une fois avec du PBS. Effectuez la coloration pour chaque lignée comme suit.
4. Coloration de la surface cellulaire pour l’immunophénotypage
REMARQUE : Les plaques de culture cellulaire recommandées pour obtenir un nombre optimal de cellules aux étapes 4.2 à 4.5 sont des boîtes de 100 mm ou des flacons T75.
- Préparation cellulaire pour des expériences de cytométrie en flux
- Trypsiniser et prélever les cellules d’une boîte confluente et d’une centrifugeuse à 300 × g pendant 6 min pour obtenir la pastille cellulaire.
- Remettre la pastille en suspension dans 1 mL de milieu et déterminer la numération cellulaire viable à l’aide d’un hémocytomètre en suivant la méthode d’exclusion du bleu de trypan.
- Centrifugez à nouveau la suspension cellulaire après le comptage et lavez encore deux fois la pastille avec 1 mL de tampon de coloration.
- Jeter le surnageant et enfin remettre la pastille en suspension dans un volume approprié du tampon de coloration en fonction du protocole (voir les étapes 4.2 à 4.5).
- Préparation des contrôles de rémunération
- Prenez sept tubes FACS et étiquetez-les comme non colorés, DAPI, V450, FITC, PE, PerCP-Cy 5.5 et APC.
- Remettre en suspension la pastille finale dans le tampon de coloration (voir étape 4.1.) en conservant une densité cellulaire de 0,5 × 106 cellules par 50 μL par tube pour les tubes non colorés et DAPI.
- Préparez les tubes monocolores pour la compensation comme décrit dans le tableau 4.
- Agiter doucement chaque tube après la préparation et incuber dans l’obscurité pendant 30 min.
- Après l’incubation, effectuer deux lavages en ajoutant 1 mL de tampon colorant dans chaque tube, suivi d’un bref vortex et d’une centrifugation à 200 g pendant 10 min à température ambiante.
- Jeter le surnageant, remettre la pastille en suspension dans 500 μL de tampon de coloration et la mettre de côté jusqu’à l’acquisition.
- Pour le tube DAPI, effectuer un traitement de choc thermique en l’incubant dans un bain-marie à 60 °C pendant 5 min suivi de 15 min sur glace. Ajoutez 5 μL de DAPI à la suspension et gardez-la dans l’obscurité jusqu’à l’acquisition de la course.
- Préparation des contrôles de fluorescence moins un (FMO)
- Remettre en suspension la pastille finale dans un tampon de coloration (voir étape 4.1) en conservant une densité cellulaire de 0,5 × 106 cellules par 50 μL pour chaque tube.
- Prenez cinq tubes FACS et étiquetez-les comme étant l’isotype CD44-V450, l’isotype CD90-FITC, le CD45-PE, l’isotype CD73-PerCP Cy5.5 et l’isotype CD105-APC.
- Préparez la suspension de cellules et d’anticorps conformément au tableau 5.
- Faire vortex doucement les tubes et les incuber pendant 30 min à température ambiante dans l’obscurité.
- Après l’incubation, donner deux lavages avec 1 mL de tampon colorant dans chaque tube, suivis d’un bref vortex et d’une centrifugation à 200 g pendant 10 min à température ambiante.
- Jeter le surnageant, remettre la pastille en suspension dans 500 μL de tampon colorant et la mettre de côté jusqu’à l’acquisition.
- Préparation des échantillons pour l’analyse
- Remettre en suspension la pastille finale dans le tampon de coloration (voir étape 4.1) en conservant une densité cellulaire de 0,5 × 106 cellules par 50 μL pour chaque tube.
- Prenez deux tubes FACS et étiquetez-les comme Tubes mixtes 1 et 2.
- Préparez la suspension de cellules et d’anticorps conformément au tableau 6.
- Faire vortex doucement les tubes et les incuber pendant 30 min à température ambiante dans l’obscurité.
- Après l’incubation, donner deux lavages avec 1 mL de tampon colorant dans chaque tube, suivis d’un bref vortex et d’une centrifugation à 200 g pendant 10 min à température ambiante.
- Jeter le surnageant, remettre la pastille en suspension dans 500 μL de tampon colorant et réserver jusqu’à l’acquisition.
- Préparation d’échantillons pour le tri de cellules individuelles
- Prenez deux tubes FACS, ajoutez 1 ml de FBS et roulez le tube jusqu’à ce qu’une couche uniforme de FBS se forme à l’intérieur de chaque tube. Incubez-le pendant 1 à 2 h pendant que vous traitez l’échantillon pour le colorer. Étiquetez ces tubes comme Tubes mixtes 1 et 2.
- Remettre en suspension la pastille finale dans le tampon de coloration (voir étape 4.1) en conservant une densité cellulaire de 2-3 × 106 cellules par 50 μL pour chaque tube.
- Préparer la cellule et la suspension d’anticorps dans les tubes mixtes 1 et 2 selon le tableau 7.
- Faire vortex doucement les tubes et les incuber pendant 30 min à température ambiante dans l’obscurité.
- Après l’incubation, donner deux lavages avec 1 mL de tampon colorant dans chaque tube, suivis d’un bref vortex et d’une centrifugation à 200 g pendant 10 min à température ambiante.
- Jeter le surnageant, remettre la pastille en suspension dans 500 μL de tampon colorant et réserver. Ajouter 5 μL de DAPI 15 min avant le tri.
REMARQUE : Notez que pour les expériences de tri, une densité cellulaire plus élevée est recommandée par tube.
| Type de tube | Perles de comp positives* | Perles de comp négatives* | Cellules | Anticorps ajoutés | |
| Tube FITC | 1 goutte | 1 goutte | – | Anti-humain CD90-FITC (2 μL) | |
| Chambre à air V450 | 1 goutte | 1 goutte | – | Anti-humain CD44-V450 (2 μL) | |
| Chambre à air PerCP-Cy 5.5 | 1 goutte | 1 goutte | – | Anti-humain CD73-PerCP Cy 5.5 (2 μL) | |
| Tube en PE | 1 goutte | 1 goutte | – | Anti-CD45-PE humain (2 μL) | |
| Tube APC | 1 goutte | 1 goutte | – | Anti-humain CD105-APC (2 μL) | |
| Tube DAPI | – | – | 50 μL | – | |
| Tube non taché | – | – | 50 μL | – | |
| *1 goutte = 60 μL de suspension de billes | |||||
Tableau 4 : Échantillons de contrôle de la rémunération. Abréviations : Comp = compensation ; DAPI = 4',6-diamidino-2-phénylindole ; FITC = isothiocyanate de fluorescéine ; APC = allophycocyanine ; PE = phycoérythrine ; PerCP = protéine de péridinine-chlorophylle.
| TUBE TYPE | ANTICORPS CONTRE UN MARQUEUR POSITIF (2 μL) | ANTICORPS CONTRE LE MARQUEUR NÉGATIF (2 μL) | ANTICORPS ISOTYPES AJOUTÉS (2 μL) | VOLUME TOTAL D’ANTICORPS | AJOUT D’UN VOLUME DE SUSPENSION CELLULAIRE | AJOUT D’UN VOLUME DE TAMPON DE COLORATION | ||
| Tube FMO CD90-FITC | - Anti-humain CD44-V450 | Anti-humain CD45-PE | Isotype IgG1 du FITC | 10 μL | 50 μL | 40 μL | ||
| - Anti-humain CD73 PerCP Cy 5.5 | ||||||||
| - CD105-APC anti-humain | ||||||||
| Tube FMO CD73-PerCP Cy5.5 | - Anti-humain CD44-V450 | Anti-humain CD45-PE | Isotype PerCP Cy 5.5 IgG1 | 10 μL | 50 μL | 40 μL | ||
| - Anti-humain CD90-FITC | ||||||||
| - CD105-APC anti-humain | ||||||||
| CD44-V450 Tube FMO | - Anti-humain CD90-FITC | Anti-humain CD45-PE | Isotype V450 IgG1 | 10 μL | 50 μL | 40 μL | ||
| - Anti-humain CD73-PerCP Cy 5.5 | ||||||||
| - CD105-APC anti-humain | ||||||||
| Tube FMO CD105-APC | - Anti-humain CD44-V450 | Anti-humain CD45-PE | Isotype IgG1 de l’APC | 10 μL | 50 μL | 40 μL | ||
| - Anti-humain CD90-FITC | ||||||||
| - Anti-humain CD73-PerCP Cy 5.5 | ||||||||
| Tube FMO CD45-PE | - Anti-humain CD44-V450 | - | Isotype PE IgG1 | 10 μL | 50 μL | 40 μL | ||
| - Anti-humain CD90-FITC | ||||||||
| - Anti-humain CD73-PerCP Cy 5.5 | ||||||||
| - CD105-APC anti-humain | ||||||||
Tableau 5 : Échantillons témoins de l’OGF. Abréviations : FMO = fluorescence moins un ; FITC = isothiocyanate de fluorescéine ; APC = allophycocyanine ; PE = phycoérythrine ; PerCP = protéine de péridinine-chlorophylle.
| TUBE TYPE | ANTICORPS CONTRE UN MARQUEUR POSITIF (2 μL) | ANTICORPS CONTRE LE MARQUEUR NÉGATIF (2 μL) | VOLUME TOTAL D’ANTICORPS | AJOUT D’UN VOLUME DE SUSPENSION CELLULAIRE | AJOUT D’UN VOLUME DE TAMPON DE COLORATION | |
| Tube mixte 1 | - Anti-humain CD44-V450 | Anti-humain CD45-PE | 10 μL | 50 μL | 40 μL | |
| - Anti-humain CD90-FITC | ||||||
| - Anti-humain CD73-PerCP Cy5.5 | ||||||
| - CD105-APC anti-humain | ||||||
| Tube mixte 2 | - Anti-humain CD44-V450 | Anti-humain CD45-PE | 10 μL | 50 μL | 40 μL | |
| - Anti-humain CD90-FITC | ||||||
| - Anti-humain CD73-PerCP Cy5.5 | ||||||
| - CD105-APC anti-humain | ||||||
Tableau 6 : Tubes d’échantillons pour l’immunophénotypage multicolore des SHEDs. Abréviations : SHEDs = cellules souches de dents de lait exfoliées humaines ; PE = phycoérythrine.
| TUBE TYPE | ANTICORPS CONTRE UN MARQUEUR POSITIF (3 μL) | ANTICORPS CONTRE LE MARQUEUR NÉGATIF (3 μL) | VOLUME TOTAL D’ANTICORPS | AJOUT D’UN VOLUME DE SUSPENSION CELLULAIRE | AJOUT D’UN VOLUME DE TAMPON ANTI-TACHES | |
| Tube mixte 1 | - Anti-humain CD90-FITC | Anti-humain CD45-PE | 9 μL | 50 μL | 41 μL | |
| - Anti-humain CD73-PerCP Cy5.5 | ||||||
| Tube mixte 2 | - Anti-humain CD90-FITC | Anti-humain CD45-PE | 9 μL | 50 μL | 41 μL | |
| - Anti-humain CD73-PerCP Cy5.5 | ||||||
Tableau 7 : Tubes de réaction de tri à cellule unique. Abréviations : FITC = isothiocyanate de fluorescéine ; PE = phycoérythrine ; PerCP = protéine de péridinine-chlorophylle.
5. Tri unicellulaire
- Préparation du trieur de cellules
- Installez une buse de 100 μm dans le trieur.
REMARQUE : La buse appropriée est d’au moins cinq fois le diamètre de la particule à trier. Le fluide de gaine à utiliser pour le tri doit être décidé en fonction du type d’échantillon et de la sensibilité de l’expérience ; Pour cette expérience, un fluide de gaine exclusif a été utilisé. - Effectuez le contrôle qualité quotidien de l’instrument (CQ) et configurez le trieur pour l’expérience. Reportez-vous au manuel de l’instrument pour obtenir un guide détaillé de la configuration de l’instrument.
- Installez une buse de 100 μm dans le trieur.
- Mise en place de la matrice de rémunération
- Réglez la matrice de compensation à l’aide de tubes de compensation de taches uniques de l’étape 4.2.
- Dans le logiciel propriétaire, sélectionnez Expérimenter dans la barre d’outils et cliquez sur Configuration de la compensation. Ouvrez Créer des contrôles de compensation.
- Vérifiez les marqueurs et confirmez. Un nouvel échantillon est ajouté nommé « Compensation » sous lequel de nouveaux tubes nommés les contrôles de marquage sont ajoutés automatiquement par le logiciel.
- Sélectionnez le tube non coloré et exécutez-le pour enregistrer 5 000 événements. Faites glisser la porte jusqu’à la population de cellules et appliquez-la à tous les contrôles de compensation. Il s’agit de régler les tensions et la grille négative pour chaque paramètre fluorescent.
- De même, chargez séparément les tubes de compensation de taches simples, puis enregistrez et sauvegardez les données. Sélectionnez la porte délimitant la population d’intérêt et appliquez-la à tous les contrôles de rémunération. Il s’agit de définir les portes positives pour chaque paramètre fluorescent.
- Sélectionnez Expérimenter dans la barre d’outils et cliquez sur le lien Calculer les valeurs de compensation | et enregistrez.
REMARQUE : Une fois que la matrice d’auto-comp est générée à l’aide du logiciel, les paramètres de tension des fluorochromes ne peuvent être modifiés pour aucun des canaux des tubes mixtes.
- Acquisition de données
- Enregistrez 10 000 cellules dans chaque tube à partir des étapes 4.3. et 4.4 collecter des données pour l’analyse de l’immunophénotype des cellules.
- Préparation des dispositifs de collecte
- En fonction de l’objectif des populations de cellules triées, choisissez entre des plaques à 6 puits, 24 puits, 48 puits ou 96 puits.
- Enduisez les puits de 200 à 500 μL de FBS et gardez les plaques intactes pendant 2 h.
- Au bout de 2 h, retirer le FBS résiduel et ajouter 200 à 500 μL de milieu de culture MSC à 10 %.
- Tri des cellules en mode de tri à cellule unique
- Exécutez le tube mixte 1 (à partir de l’étape 4.5) et enregistrez 10 000 événements pour définir les portes de la population d’intérêt à trier, à l’aide de la stratégie de contrôle appropriée.
- Chargez une plaque de collecte et définissez le nombre de cellules cibles entre 2 500 et 5 000 cellules/puits, puis sélectionnez le masque de pureté de tri à cellule unique.
- Collectez les populations triées dans le dispositif de collecte et conservez-les sur glace jusqu’à la fin de l’expérience de tri.
- Une fois cela fait, transvasez les plaques dans l’incubateur à 5% de CO2 pour maintenir les cultures à 37 °C.
REMARQUE : Après l’acquisition, les fichiers de données brutes ont été exportés au format de fichier .fcs (v.3.0 et suivantes). Les rapports de tri générés après chaque expérience enregistraient le nombre d’événements/cellules triés par puits attribué et indiquaient le nombre de conflits abandonnés.
Résultats
Les SHED ont été caractérisés à l’aide de tests d’immunofluorescence standard montrant l’expression de vimentine (filaments intermédiaires rouges de type III), de filaments d’actine (sondes de phalloïdine Alexa fluor 488) et de noyaux colorés au DAPI (Figure 1A). Pour estimer leurs capacités de prolifération et de formation de colonies, des tests standard de croissance cellulaire à court terme ont été effectués. Une augmentation de 14,3 fois du taux de prolifération en...
Discussion
Dans le domaine de l’ingénierie tissulaire et de la médecine régénérative, parmi les sources postnatales, les CSM dérivées de tissus oraux ont suscité un vif intérêt en raison de leurs obligations éthiques minimales et de leur potentiel de différenciation multilignage notable21. Les cellules souches de la pulpe dentaire (CSPD) de la troisième molaire et des CSH touchées ont attiré le plus d’attention parmi les CSM dentaires pour leur potentiel thérapeutique dans les maladies ne...
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts concernant la publication de cet article.
Remerciements
Nous remercions l’installation de cellules en flux du Centre Jawaharlal Nehru pour la recherche scientifique avancée, à Bangalore, en Inde, pour l’utilisation de l’installation centrale de cytométrie en flux. La cryo-section de la culture de pastilles de cellules différenciées a été réalisée au laboratoire de référence Neuberg Anand, à Bangalore, en Inde. Ce travail a été soutenu par le financement intra-muros de l’UC de la Manipal Academy of Higher Education (MAHE), en Inde. AG est reconnaissant du soutien de la bourse Dr. T. M. A. Pai de MAHE.
matériels
| Name | Company | Catalog Number | Comments |
| Alcian Blue Stain | HiMedia | CCK029-1KT | |
| Antibiotic-Antimycotic (100x) | Gibco by ThermoFisher | 15240062 | |
| BD CompBead Plus Anti-Mouse Ig, κ/Negative Control (BSA) Compensation Plus (7.5 µm) Particles Set | BD Biosciences | 560497 | |
| BD FACS Accudrop Beads | BD Biosciences | 345249 | Used to set up the Laser delay when the sort module opens. |
| BD FACS Aria Fusion Flow cytometer | BD Biosciences | --- | |
| BD FACS Diva 9.4 | BD Biosciences | --- | |
| BD FACS Sheath Fluid | BD Biosciences | 342003 | Used as sheath fluid for both analysis and sorting experiments in the BD FACSAria Fusion |
| BD FACSDiva CS&T Research Beads | BD Biosciences | 655050 | Used for Instrument configuration depending on the nozzle size. |
| BD Horizon V450 Mouse Anti-Human CD44 | BD Biosciences | 561292 | |
| BD Horizon V450 Mouse IgG2b, κ Isotype Control | BD Biosciences | 560374 | CD44-V450 isotype |
| BD Pharmingen APC Mouse Anti-Human CD105 | BD Biosciences | 562408 | |
| BD Pharmingen APC Mouse IgG1, κ Isotype Control | BD Biosciences | 555751 | CD105-APC isotype |
| BD Pharmingen DAPI Solution | BD Biosciences | 564907 | DAPI Stock solution of 1 mg/mL |
| BD Pharmingen FITC Mouse Anti-Human CD90 | BD Biosciences | 555595 | |
| BD Pharmingen FITC Mouse IgG1, κ Isotype Control | BD Biosciences | 555748 | CD90-FITC isotype |
| BD Pharmingen PE Mouse Anti-Human CD45 | BD Biosciences | 555483 | |
| BD Pharmingen PE Mouse IgG1, κ Isotype Control | BD Biosciences | 555749 | CD45-PE isotype |
| BD Pharmingen PerCP-Cy 5.5 Mouse Anti-Human CD73 | BD Biosciences | 561260 | |
| BD Pharmingen PerCP-Cy 5.5 Mouse IgG1, κ Isotype Control | BD Biosciences | 550795 | CD73-PerCP-Cy 5.5 isotype |
| BD Pharmingen Purified Mouse Anti-Vimentin | BD Biosciences | 550513 | |
| Bovine serum albumin | Hi-Media | TC548-5G | |
| Crystal violet | Nice chemical pvt ltd | C33809 | |
| Dulbecco's Phosphate Buffered Saline | Sigma-aldrich | D5652-50L | dPBS used for culture work and maintenance. |
| Ethanol | --- | --- | Used for general sterlization. |
| Fetal Bovine Serum | Gibco by ThermoFisher | 10270-106 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | ThermoFisher Scientific | A-21422 | |
| KO-DMEM | Gibco by ThermoFisher | 10829018 | Basal medium for undifferentiated hESCs, used in the preparation of culture media |
| L-Glutamine 200mM (100x) | Gibco by ThermoFisher | 25030-081 | |
| Methanol, for Molecular Biology | Hi-Media | MB113 | |
| Oil red O | HiMedia | CCK013-1KT | |
| Paraformaldehyde | loba chemie | 30525-89-4 | |
| Penicillin Streptomycin (100x) | Gibco by ThermoFisher | 15140- 122 | |
| Phalloidin (ActinGreen 488 ReadyProbes reagent) | Invitrogen | R37110 | |
| Silver Nitrate | HiMedia | MB156-25G | |
| Sodium Thiosulphate pentahydrate | Chemport | 10102-17-7 | |
| Sphero Rainbow Fluorescent Particles, 3.0 - 3.4 µm | BD Biosciences | 556291 | |
| Staining buffer | Prepared in MIRM | ---- | It was prepared using 2% FBS in PBS |
| StemPro Adipogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10410-01 | Basal media for Adipogenic media |
| StemPro Adipogenesis Supplement | Gibco by ThermoFisher | A10065-01 | Induction media for Adipogenic media |
| StemPro Chondrogenesis Supplement | Gibco by ThermoFisher | A10064-01 | Induction media for Chondrogenic media |
| StemPro Osteogenesis Supplement | Gibco by ThermoFisher | A10066-01 | Induction media for Osteoogenic media |
| StemPro Osteogenesis/Chondrogenesis Differentiation Basal Media | Gibco by ThermoFisher | A10069-01 | Basal media for both Ostegenic and Chondrogenic media |
| Triton-X-100 | Hi-Media | MB031 | |
| Trypan Blue | Gibco by life technologies | 15250-061 | |
| Trypsin - EDTA Solution 1x | Hi-media | TCL049 | |
| Tween-20 | MERCK | 9005-64-5 |
Références
- Kobolak, J., Dinnyes, A., Memic, A., Khademhosseini, A., Mobasheri, A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods. 99, 62-68 (2016).
- Wilson, A., Hodgson-Garms, M., Frith, J. E., Genever, P. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Frontiers in Immunology. 10, 1112 (2019).
- Li, J., et al. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Molecular Medicine Reports. 18 (6), 4969-4977 (2018).
- McLeod, C. M., Mauck, R. L. On the origin and impact of mesenchymal stem cell heterogeneity: new insights and emerging tools for single cell analysis. European Cells & Materials. 34, 217-231 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Wang, J., Liao, L., Wang, S., Tan, J. Cell therapy with autologous mesenchymal stem cells-how the disease process impacts clinical considerations. Cytotherapy. 15 (8), 893-904 (2013).
- Kern, S., Eichler, H., Stoeve, J., Kluter, H., Bieback, K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 24 (5), 1294-1301 (2006).
- Dunn, C. M., Kameishi, S., Grainger, D. W., Okano, T. Strategies to address mesenchymal stem/stromal cell heterogeneity in immunomodulatory profiles to improve cell-based therapies. Acta Biomaterialia. 133, 114-125 (2021).
- Yang, Y. K., Ogando, C. R., Wang See, C., Chang, T. Y., Barabino, G. A. Changes in phenotype and differentiation potential of human mesenchymal stem cells aging in vitro. Stem Cell Research & Therapy. 9 (1), 131 (2018).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences. 78 (2), 447-467 (2021).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Review of Scientific Instruments. 43 (3), 404-409 (1972).
- Schulte, R., et al. Index sorting resolves heterogeneous murine hematopoietic stem cell populations. Experimental Hematology. 43 (9), 803-811 (2015).
- Liao, X., Makris, M., Luo, X. M. Fluorescence-activated cell sorting for purification of plasmacytoid dendritic cells from the mouse bone marrow. Journal of Visualized Experiments. (117), (2016).
- Roda, B., et al. A novel stem cell tag-less sorting method. Stem Cell Reviews and Reports. 5 (4), 420-427 (2009).
- Hall, S. R., et al. Identification and isolation of small CD44-negative mesenchymal stem/progenitor cells from human bone marrow using elutriation and polychromatic flow cytometry. Stem Cells Translational Medicine. 2 (8), 567-578 (2013).
- Eggleton, M. J., Sharp, A. A. Platelet counting using the Coulter electronic counter. Journal of Clinical Pathology. 16 (2), 164-167 (1963).
- Porwit-Ksiazek, A., Aman, P., Ksiazek, T., Biberfeld, P. Leu 7+ (HNK-1+) cells. II. Characterization of blood Leu 7+ cells with respect to immunophenotype and cell density. Scandinavian Journal of Immunology. 18 (6), 495-449 (1983).
- Hewitt, Z., et al. Fluorescence-activated single cell sorting of human embryonic stem cells. Cloning and Stem Cells. 8 (3), 225-234 (2006).
- Singh, A. M. An efficient protocol for single-cell cloning human pluripotent stem cells. Frontiers in Cell and Developmental Biology. 7, 11 (2019).
- Wilson, N. K., et al. Combined single-cell functional and gene expression analysis resolves heterogeneity within stem cell populations. Cell Stem Cell. 16 (6), 712-724 (2015).
- Zhou, L. L., et al. Oral mesenchymal stem/progenitor cells: the immunomodulatory masters. Stem Cells Inernational. 2020, 1327405 (2020).
- Fawzy El-Sayed, K. M., et al. Adult mesenchymal stem cells explored in the dental field. Advances in Biochemical Engineering/Biotechnology. 130, 89-103 (2013).
- Hardy, W. R., et al. Transcriptional networks in single perivascular cells sorted from human adipose tissue reveal a hierarchy of mesenchymal stem cells. Stem Cells. 35 (5), 1273-1289 (2017).
- . . FACSAria Fusion User's Guide. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon