A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تفاعل البكتيريا T4 والإشريكية القولونية في أمعاء الفئران: نموذج نموذجي لدراسة ديناميكيات البكتيريا المضيفة في الجسم الحي
In This Article
Summary
البكتيريا (العاثيات) ، الفيروسات التي تصيب البكتيريا ، هي جزء لا يتجزأ من ميكروبيوم الأمعاء. على الرغم من أن هؤلاء السكان التكافليين يقودون اللياقة البكتيرية وديناميكيات السكان ، إلا أنه لا يفهم سوى القليل عن كيفية تأثيرها على توازن الأمعاء والمرض. يدرس هذا البروتوكول عاثيات T4 المعزولة داخل نموذج فأر ، قابلة للتكيف مع أزواج العاثيات البكتيرية الأخرى.
Abstract
البكتيريا (العاثيات) هي فيروسات تصيب البكتيريا بخصوصية على مستوى الأنواع والسلالة، وهي أكثر الكيانات البيولوجية وفرة في جميع النظم الإيكولوجية المعروفة. داخل المجتمعات البكتيرية ، مثل تلك الموجودة في ميكروبات الأمعاء ، فإن العاثيات متورطة في تنظيم ديناميكيات مجموعة الميكروبات ودفع التطور البكتيري. كان هناك اهتمام متجدد بأبحاث العاثيات في العقد الماضي ، ويرجع ذلك جزئيا إلى قدرات القتل الخاصة بالمضيف للعاثيات المحللة ، والتي توفر أداة واعدة لمواجهة التهديد المتزايد للبكتيريا المقاومة لمضادات الميكروبات. علاوة على ذلك ، تشير الدراسات الحديثة التي تثبت أن العاثيات تلتصق بالمخاط المعوي إلى أنها قد يكون لها دور وقائي في منع الغزو البكتيري للظهارة الأساسية. الأهم من ذلك ، مثل الميكروبات البكتيرية ، ارتبطت البلعوم المعطلة بنتائج متفاقمة في أمراض مثل مرض التهاب الأمعاء. أظهرت الدراسات السابقة أن العاثيات يمكن أن تعدل ميكروبيوم والبشر من خلال عمليات زرع الترشيح البرازي ، مما يفيد صحة المضيف. مع هذه الموجة الأخيرة من الأبحاث تأتي ضرورة إنشاء وتوحيد بروتوكولات لدراسة العاثيات في سياق ميكروبيوم الأمعاء. يوفر هذا البروتوكول مجموعة من الإجراءات لدراسة عاثيات T4 المعزولة ومضيفها البكتيري ، الإشريكية القولونية ، في سياق الجهاز الهضمي للفئران. توضح الطرق الموضحة هنا كيفية البدء من تحلل العاثيات ، وإدارتها للفئران وتقييم التأثيرات على مستويات المضيف البكتيري والعاثيات. يمكن تعديل هذا البروتوكول وتطبيقه على أزواج العاثيات البكتيرية الأخرى ويوفر نقطة انطلاق لدراسة ديناميكيات العاثية المضيفة في الجسم الحي.
Introduction
البكتيريا ، أو العاثيات ، هي فيروسات تصيب وتقتل البكتيريا بالأنواع وخصوصية مستوى السلالة1. تلعب العاثيات أدوارا مهمة داخل المجتمعات البكتيرية المعقدة مثل ميكروبيوتا الأمعاء ، حيث تورطت في تنظيم ديناميكيات السكان وقيادة اللياقة البكتيرية2. طوال العقد الماضي ، كان هناك اهتمام متجدد بأبحاث العاثيات بسبب ظهور مسببات الأمراض المقاومة لمضادات الميكروبات3 ، وإمكانية العلاج بالعاثيات كاستراتيجية علاج بديلة. في السنوات الأخيرة ، تم استخدام كوكتيلات العاثية lytic عن طريق الوريد مع بعض النجاح في الالتهابات الإنتانية البكتيرية الخطيرة المقاومة للمضادات الحيوية في البشر 3,4. كما تم اقتراح العلاج بالعاثيات عن طريق الفم كبديل محتمل للمضادات الحيوية لعلاج الالتهابات المعوية والالتهابات. علاوة على ذلك ، تورطت العاثيات في نجاح عمليات زرع الترشيح البرازي (FFT) ، وهي مستحضرات ميكروبيوتا برازية تم ترشيحها لإزالة البكتيريا ، في علاج عدوى المطثية العسيرة المتكررة (rCDI) 5,6 ، واضطرابات الأمعاء الالتهابية (IBD) 7,8 والتهاب الأمعاء والقولون الناخر في الخنازير قبل الأوان9. بالنظر إلى هذه النتائج ، من المهم النظر في التفاعلات بين كل من العاثيات وميكروبات الأمعاء ، والعاثيات ومضيف الثدييات ، لأن إضافة العاثيات الجديدة إلى مجتمع موجود مسبقا قد يكون له آثار غير مباشرة على المجتمع ككل ، وليس فقط البكتيريا المستهدفة2،10.
أثبتت دراسة تفاعلات العاثيات مع البكتيريا المستهدفة في المختبر أنها مفيدة لفهم آليات وتأثيرات تفاعلات العاثيات والبكتيريا في الأمعاء. في هذا الإعداد ، تبين أن العاثيات T4 الخاصة بالإشريكية القولونية من رتبة Caudovirales تتطلب مجالات شبيهة بالغلوبولين المناعي (Ig) تقع داخل بروتينات قفيصة خارجية عالية الاستضفاف (Hoc) على سطح virion للالتصاق بالمخاط المعوي11. بالإضافة إلى ذلك ، أظهرت فحوصات transwell أن العاثيات T4 قادرة على التفاعل مع ثقافات الخلايا الظهارية والانتقال عبر طبقات الخلايا عن طريق كثرة الخلايا الكبيرة12,13. تدعم هذه النتائج الفرضية القائلة بأن العاثيات يمكن أن تتفاعل مع مضيفها الميتازوان ، على الرغم من أنها غير قادرة على إصابة الخلايا حقيقية النواة. هذه النماذج ، على الرغم من فائدتها ، تفتقر إلى مجموعة كاملة من التفاعلات المعقدة التي تحدث في النظام البيئي للأمعاء المطلوبة لاستكشاف شامل للتفاعل الثلاثي بين العاثيات والبكتيريا ومضيف metazoan.
تعد نماذج الماوس أداة مهمة للتحقيق في العاثيات داخل البيئات المعقدة. التطبيق المرغوب فيه لإدارة العاثيات هو كاستراتيجية بديلة لعلاج الالتهابات المقاومة لمضادات الميكروبات أو الأمراض المرتبطة بالأمراض الالتهابية المزمنة ، بما في ذلك مرض التهاب الأمعاء. ومع ذلك ، تشير الأدبيات الناشئة إلى أن سلوك العاثيات في المختبر لا يمثل بشكل كامل وظائف الجسم الحي . أظهر Buttimer et al.14 أن كوكتيل العاثية كان قادرا على استنفاد البكتيريا المستهدفة في اتحاد ميكروبيوتا بشري مبسط في المختبر ، ولكن لا يمكن تكراره في الجسم الحي في الفئران gnotobiotic المستعمرة بنفس اتحاد البكتيريا والعاثيات. علاوة على ذلك ، في ميكروبيوم الفئران التقليدي ، أدت العاثية T7 إلى استنفاد انتقائي لبكتيريا الأمعاء المستهدفة ، على الرغم من ملاحظة الانتعاش التدريجي بمرور الوقت ، مما يدل على تطور المقاومة15. أظهرت دراسات أخرى تعايش العاثيات التي يتم تناولها عن طريق الفم والسلالات البكتيرية المستهدفة في الجسم الحي2،16. في الواقع ، بالإضافة إلى التعايش بين العاثيات والبكتيريا ، أدت إدارة العاثيات إلى تغييرات واسعة النطاق في التكوين العام لمجتمع الجراثيم ووظيفتها2،16. هذا مهم في إعدادات المرض حيث وجدت العديد من الدراسات ارتباطات بين زيادة الوفرة النسبية ل Caudovirales و IBD7،8،17 التي كانت مستقلة عن التغيرات في وفرة البكتيريا7. لا يزال من غير المعروف ما إذا كان هذا هو المحرك أو نتيجة لمرض المرض.
كان التركيز التاريخي للتحقيق في العاثيات حول العلاقة بين العاثية والبكتيريا المستهدفة. ومع ذلك ، من المهم أيضا مراعاة التفاعلات المحتملة بين العاثية والغشاء المخاطي والظهارة والجهاز المناعي لمضيف metazoan. تلعب جميع هذه التفاعلات دورا مهما في الاستجابة الشاملة لعدوى العاثيات المعوية. لإثبات ذلك ، تمت دراسة العاثيات باستخدام الفئران الخالية من الجراثيم (GF) لتوضيح تأثيرها على الجهاز المناعي دون تدخل من قبل الجراثيم8. في هذا النظام ، تم الكشف عن الأحماض النووية العاثية بواسطة مستقبلات تشبه الرسوم (TLRs) الموجودة داخل إندوسومات الخلايا المناعية البلعمية (الضامة والخلايا المتغصنة). أدى هذا إلى تنشيط إشارات المصب وتحفيز الإنتاج المعتمد على الخلايا التائية للإنترفيرون (IFN) -γ 8 أو IFNs من النوع الأول18. علاوة على ذلك ، تورط Fluckiger et al.19 خلايا الذاكرة CD8 + T في التعرف على المستضدات المشفرة بالعاثيات (prophage) ، مما أدى إلى تفاعل الخلايا التائية مع مستضدات الورم ، مما أدى إلى تقليل عبء الورم. أخيرا ، تم توثيق إنتاج الأجسام المضادة الخاصة بالعاثيات في دراسات الفئران حيث تم تسليم العاثيات إلى النماذج الحيوانية بطريقة مستمرة من خلال مياه الشرب 8,20 ، أو عن طريق التزويج الفموي المتكرر على مدى عدة أشهر20 ، مما يدل على قدرة بروتينات العاثيات على تعزيز الاستجابات المناعية الخلطية. على الرغم من أن هذه الأنماط من التلقيح بالعاثيات تسمح بالتحضير الأمثل والمستمر للجهاز المناعي ، إلا أنها قد لا تمثل التفاعلات التي تحدث بشكل طبيعي بين العاثيات والبيئة المعوية ، ولا حركية العلاج بالعاثيات المطبقة عن طريق الفم. حتى الآن ، فحص عدد محدود من الدراسات تفاعلات العاثية مع نوع بكتيري واحد في نماذج الفئران أحادية القولون21. ومع ذلك ، أثبتت الفئران أحادية القولون أهميتها في فك رموز التأثيرات الخاصة بالميكروبات للأنواع الفردية على الجهاز الهضمي (GI) وتطور المناعة22،23،24 ، وقد تثبت فائدتها في فهم التفاعلات الثلاثية بين العاثيات والبكتيريا المستهدفة ومضيف metazoan.
بشكل مثير ، لا يزال هناك الكثير لنتعلمه عن التفاعلات بين العاثية المعوية والبكتيريا المتعايشة مع الأمعاء ، بالإضافة إلى التفاعلات التي تحدث بين مضيف metazoan والعاثيات الموجودة داخله. يوفر هذا البروتوكول مجموعة من الإجراءات لدراسة عاثية T4 المعزولة ونظيرتها البكتيرية ، E. coli (K-12 ، BW25113) ، باستخدام نموذج فأر gnotobiotic. توفر هذه الإجراءات الموحدة أيضا أساسا لتحسين ثنائيات العاثيات / البكتيريا الأخرى من خلال تكييف معلمات النمو مع الأزواج ذات الاهتمام. توضح الطرق الموضحة هنا: (1) تحضير T4 phage و sysates المركبات للتزويج الفموي للفئران. (2) إعطاء العاثية T4 عن طريق الفم إلى الفئران gnotobiotic أحادية القولون E. ؛ (3) مراقبة مستويات العاثية T4 في براز وأنسجة الفئران بمرور الوقت.
بالنسبة للنتائج التمثيلية المعروضة هنا ، تم نشر محللات العاثية T4 المنقاة من مخزونات بنك العاثيات التي يحتفظ بها مختبر Rohwer. تم تكييف طريقة Phage-on-Tap لنشر العاثية T425 ، كما هو مشار إليه في هذا البروتوكول. تنتج هذه الطريقة مخزونا عاليا من العاثيات منخفضة العيار والسموم الداخلية في غضون ثلاثة أيام. باستخدام هذا النهج ، تم جمع 10 مل من ≥ 1010 وحدات تشكيل البلاك (pfu) / مل من العاثية T4 مع < 0.5 وحدة من السموم الداخلية (EU) / مل بشكل روتيني. مستويات السموم الداخلية الموصى بها للإعطاء عن طريق الفم أو الوريد في الفئران هي ≤ 20 EU / mL و ≤ 5 EU / kg / h (أو 0.1 EU تدار على مدار ساعة واحدة للفأر 20 جم) ، على التوالي ، مما يجعل هذه طريقة مناسبة لإعداد العاثيات للتلقيح في الجسم الحي . تم تخزين جميع مخزونات العاثيات عند 4 درجات مئوية في محلول عاثي المغنيسيوم الملحي (SM) (الوصفة المقدمة في الخطوة 1.1.5.1). تمت زراعة الإشريكية القولونية في وسائط LB. بالنسبة لأزواج البكتيريا العاثية المختلفة ، يمكن تكييف وسائط الثقافة المتنوعة وظروف النمو من هذا البروتوكول. يمكن أيضا الحصول على العاثيات من البيئة ، مثل مياه الصرف الصحي والمياه البحرية والتربة والمحتويات المعوية ويمكن عزلها وتنقيتها وفقا ل Sambrook و Russell26 قبل التحضير باستخدام ظروف النمو والانتشار المناسبة لكل زوج من العاثيات المضيفة25. بدلا من ذلك ، يمكن الحصول على العاثيات من مصادر تجارية (انظر جدول المواد) أو من بنوك العاثيات.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت جميع التجارب وفقا للمبادئ التوجيهية التي وضعتها لجنة رعاية في جامعة كولومبيا البريطانية والبروتوكولات المعتمدة من لجنة السلامة البيولوجية (A23-0113 ، B19-0038). تم إيواء الفئران في جامعة كولومبيا البريطانية في ظل ظروف خالية من مسببات الأمراض في مركز نمذجة الأمراض. تم تربية الفئران C57BL / 6 داخل المنشأة في عازل فيلم مرن معقم ، مزود بنظام غذائي معقم للفأر ، وماء ، وفراش ، ومواد تعشيش. تم الحفاظ على الفئران في دورة 12 ساعة ليلا ونهارا. تم مطابقة عمر فئران التجارب ، ذكورا وإناثا ، في كل تجربة ، تتراوح بين 6 إلى 12 أسبوعا من العمر وتزن 15-30 جم لجميع التجارب.
1. إعداد تحلل العاثيات والمركبات للتزويف الفموي في الفئران
- تنقية العاثيات وتوليد المخزون
ملاحظة: في هذه الدراسة ، تزرع عاثيات T4 وتعايرها عن طريق الطلاء على عشب من البكتيريا باستخدام طريقة طبقة الآجار المفردة ، الموضحة أدناه. تم وصف طريقة طبقة الآجار المزدوجة سابقا25,27ويمكن أيضا أن تستخدم مع فعالية مماثلة. تم اختيار طريقة طبقة الآجار المفردة لهذا البروتوكول لأنها توفر رؤية محسنة للوحة28.- تنمو الإشريكية القولونية في 5 مل من وسائط LB المعقمة في البوليسترين المعقم أو أنابيب الثقافة الزجاجية (مع أغطية). احتضان الأنابيب عند 37 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة طوال الليل ، حتى يتم الوصول إلى المرحلة الثابتة.
- قم بإعداد أجار ناعم في زجاجة وسائط زجاجية عن طريق تعقيم LB بنسبة 0.5٪ أجار والتبريد إلى 50 درجة مئوية أو أقل (مع الاحتفاظ بالسائل) قبل المكملات. تحضير ما يكفي من أجار لينة لمدة 15 مل لكل لوحة.
- مكمل أجار ناعم مع MgSO4 و CaCl2 إلى تركيز نهائي قدره 1 mM لكل منهما. أضف 100 ميكرولتر من مزرعة الإشريكية القولونية طوال الليل لكل 3 مل من الأجار الناعم. قلبي برفق باستخدام قضيب تحريك مغناطيسي لتجانس المكملات الغذائية والثقافة في الأجار الناعم.
ملاحظة: يعد الاتساق في حجم وكثافة الإشريكية القولونية المضافة إلى تحضير الآجار الناعم أمرا بالغ الأهمية (موضح في قسم النتائج التمثيلية). - أضف 15 مل من الآجار الطري + الإشريكية القولونية لكل طبق بتري (قطره 15 سم) باستخدام ماصة مصلية. اترك الأطباق في درجة حرارة الغرفة للاستخدام في نفس اليوم.
ملاحظة: سيتم ضبط الأطباق في حوالي 20 دقيقة مع فتح الأغطية. سيبقى الآجار طريا ولكنه لن يتحول عند قلب الألواح. - تحضير 8-10 تخفيفات تسلسلية من مصدر T4 phage في عوامل 10 عن طريق التخفيف في المخزن المؤقت SM. ضع 5 ميكرولتر من كل تخفيف على الألواح. اترك البقع تجف وقلبها واحتضانها عند 37 درجة مئوية طوال الليل.
- لتحضير محلول عاثية من المغنيسيوم الملحي (SM) ، في 1 لتر من H2O منزوع الأيونات ، قم بإذابة 100 mM NaCl ، و 8 mM MgSO4 · 7H2O ، و 50 mM Tris-HCl (درجة الحموضة 7.4). الأوتوكلاف وتخزينها في درجة حرارة الغرفة.
ملاحظة: في اليوم التالي ، كان من المفترض أن تنمو الإشريكية القولونية لتصبح عشبا في جميع أنحاء أجار LB الناعم. ستظهر اللويحات ، أو مناطق النمو التي تم تطهيرها في حديقة الإشريكية القولونية ، حيث حدث قتل العاثيات لمضيفات الإشريكية القولونية المصابة. تمثل كل لوحة وحدة تشكيل البلاك (pfu).
- لتحضير محلول عاثية من المغنيسيوم الملحي (SM) ، في 1 لتر من H2O منزوع الأيونات ، قم بإذابة 100 mM NaCl ، و 8 mM MgSO4 · 7H2O ، و 50 mM Tris-HCl (درجة الحموضة 7.4). الأوتوكلاف وتخزينها في درجة حرارة الغرفة.
- اختر لوحة واحدة من لوحة الآجار الناعمة عن طريق دفع طرف ماصة معقم في وسط اللوحة ، مما يؤدي إلى إنشاء سدادة أجار في نهاية الطرف. أعد تعليق قابس البلاك في 1 مل من المخزن المؤقت SM في أنبوب طرد مركزي دقيق سعة 1.7 مل. دوامة الأنبوب بأقصى سرعة لمدة 1 دقيقة للخلط.
- جهاز طرد مركزي الأنبوب عند 4000 × جم لمدة 5 دقائق في درجة حرارة الغرفة لإزالة أي حطام من المحلل. نقل المادة الطافية إلى أنبوب طرد مركزي دقيق جديد.
- لنشر العاثية المعزولة ، كرر الخطوات 1.1.1-1.1.3. أضف 100 ميكرولتر من العاثية المعزولة إلى 15 مل من القسمة من الآجار الناعم الذي يحتوي على الإشريكية القولونية في أنبوب مخروطي. اقلب الأنبوب ثلاث مرات لخلط وصب الآجار في طبق بتري.
- اترك الألواح تجف قبل قلبها واحتضانها طوال الليل على درجة حرارة 37 درجة مئوية. قم بإعداد لوحة تحكم في الحديقة بدون عاثية لتأكيد صلاحية الإشريكية القولونية .
ملاحظة: بعد الحضانة طوال الليل ، يجب أن تحتوي لوحة التحكم على عشب من الإشريكية القولونية بينما يجب تحليل اللوحة المحتوية على العاثيات تماما. - لاستخراج العاثية من اللوحة ، أضف 5 مل من المخزن المؤقت SM إلى سطح اللوحة التي تم تطهيرها من العاثيات ورجها عند 70 دورة في الدقيقة على هزاز لمدة 15 دقيقة في درجة حرارة الغرفة.
- اجمع المخزن المؤقت من اللوحة في أنبوب طرد مركزي مخروطي سعة 50 مل وجهاز طرد مركزي عند 4000 × جم لمدة 5 دقائق في درجة حرارة الغرفة لإخراج أي حطام من لوحة أجار.
- اجمع مخزون العاثيات T4 في أنبوب جديد واحفظه في درجة حرارة 4 درجات مئوية حتى المعايرة بالتحليل الحجمي والانتشار.
ملاحظة: العاثيات T4 مستقرة لأكثر من 10 سنوات25 ؛ ومع ذلك ، فإن الاستقرار يعتمد على نوع العاثية وظروف التخزين. سيختلف عيار العاثيات أيضا مع وقت التخزين. العاثيات حساسة للتجميد. لذلك ، يوصى بالحفظ بالتبريد في النيتروجين السائل وتجنب دورات التجميد والذوبان لأن ذلك قد يؤدي إلى إتلاف العاثيات ، مما يقلل من عيار العاثيات25. - قم بمعايرة محلول مخزون العاثيات T4 لتحديد التركيز في pfu / mL ، كما هو موضح سابقا25،29،30. سيحتوي مخزون العاثيات T4 عالي العيار على 108 pfu / mL أو أكثر.
- إعداد محللات العاثية التجريبية
- ثقافة الإشريكية القولونية في 5 مل من وسائط LB في البوليسترين المعقم أو أنابيب الثقافة الزجاجية (مع أغطية). احتضان الأنابيب طوال الليل عند 37 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة ، حتى يتم الوصول إلى المرحلة الثابتة.
- الاستزراع الفرعي لثقافة الإشريكية القولونية الليلية 1:50 في وسائط 100 مل رطل في دورق زجاجي مخروطي. احتضان عند 37 درجة مئوية مع الرج عند 200 دورة في الدقيقة حتى تصل البكتيريا إلى المرحلة الأسية المبكرة إلى المتوسطة (حوالي 1.5 ساعة).
ملاحظة: يمكن إجراء منحنى نمو أولي لتحديد الكثافة الضوئية عند نطاق 600 نانومتر (OD600) الذي تكون فيه الثقافة البكتيرية في المرحلة الأسية. يقترح الاستزراع في أنبوب مخروطي زجاجي حيث وجدت الأدلة الحديثة أن العاثيات قادرة على الالتصاق بالبلاستيك مثل البولي بروبلين31. - أضف 100 ميكرولتر من مخزون العاثية T4 عالي العيار من الخطوة 1.1 إلى مزرعة الإشريكية القولونية الفرعية واحتضانها عند 37 درجة مئوية مع الهز لمدة 3 ساعات ، أو حتى تختفي المحللة الجديدة غائمة. اجمع محللة العاثية T4 في أنابيب مخروطية سعة 50 مل وانتقل مباشرة إلى خطوات التنظيف أو ، إذا لزم الأمر ، قم بتخزينها في درجة حرارة 4 درجات مئوية حتى اليوم التالي.
ملاحظة: يتطلب حجم انفجار العاثيات الأكبر (مما يشير إلى ارتفاع متوسط عدد الفيروسات المنبعثة لكل دورة تكرار) فترة حضانة أطول للثقافة الفرعية البكتيرية في الخطوة 1.2.2. هذا يوفر زيادة كثافة البكتيريا قبل الارتفاع مع مخزون العاثيات. - يتحلل جهاز الطرد المركزي عند 4000 × جم لمدة 20 دقيقة في درجة حرارة الغرفة لتكسير أي بكتيريا متبقية وحطام خلوي. قم بتصفية وتعقيم المادة الطافية الناتجة باستخدام مرشح نايلون 0.22 ميكرومتر ونقل المرشح إلى أنابيب طرد مركزي مخروطية جديدة سعة 50 مل.
- أضف 0.1 حجم من الكلوروفورم إلى كل حجم من محللات العاثية T4 المفلترة لقتل أي بكتيريا متبقية ومنع نمو البكتيريا. دوامة لفترة وجيزة لخلط واحتضان في درجة حرارة الغرفة لمدة 10 دقائق.
ملاحظة: العاثيات المغلفة بالدهون حساسة للكلوروفورم ، مما قد يقلل من عيار العاثيات25. تخطي هذه الخطوة إذا لزم الأمر.
تنبيه: الكلوروفورم هو مذيب عضوي سام خطير عند استنشاقه أو تناوله أو امتصاصه من خلال الجلد. استخدم غطاء الدخان ومعدات الحماية الشخصية المناسبة (PPE) عند العمل مع الكلوروفورم. استخدم الزجاج بدلا من ماصات البوليسترين المصلية عند العمل مع الكلوروفورم ، لأنه غير متوافق مع معظم المواد البلاستيكية. يمكن وضع الكلوروفورم في أنابيب طرد مركزي مخروطية من مادة البولي بروبيلين للخطوات 1.2.5-1.2.6 ولكن لا ينبغي تخزينها على المدى الطويل في أنابيب بلاستيكية. - أجهزة الطرد المركزي المحللة عند 4000 × جم لمدة 5 دقائق في درجة حرارة الغرفة لفصل الكلوروفورم عن المحللة. استخدم ماصة مصلية لنقل طبقة المحللة العلوية بعناية إلى أنبوب مخروطي جديد سعة 50 مل دون الإخلال بطبقة الكلوروفورم الأساسية. تخلص من نفايات الكلوروفورم في حاوية النفايات السائلة الخطرة المناسبة. يخزن المحللات في درجة حرارة 4 درجات مئوية حتى يتم تبادل التركيز والمخزن المؤقت في اليوم التالي.
- قم بتركيز محللات العاثية في جهاز مرشح طرد مركزي 100 كيلو دالتون (انظر جدول المواد) عن طريق إضافة 13 مل من محلول العاثية إلى الخزان العلوي للجهاز والطرد المركزي عند 4000 × جم لمدة 5 دقائق ، أو حتى يمر معظم المحللة عبر المرشح إلى الخزان السفلي.
ملاحظة: تهدف إلى الحصول على ما يقرب من 2 مل من المحللة في نهاية وقت الدوران. مع زيادة تركيز العاثية في المرشح مع إضافة المحللة ، من المحتمل أن تزداد أوقات الدوران. تحتوي أجهزة تصفية الطرد المركزي على توقف مادي مسدود لمنعها من الدوران الجاف32. لا تدع غشاء المرشح يجف إذا كان الاستخدام المستمر مقصودا (أي عن طريق إزالة كل السائل من الخزان العلوي). قد تختلف أوقات الدوران بناء على نوع العاثية والعيار. - باستخدام ماصة P200 أو P1000 ، ماصة برفق ~ 2 مل المتبقية من المحللة لأعلى ولأسفل داخل الخزان العلوي لفك انسداد غشاء المرشح بعد كل دوران. تخلص من المرشح من الخزان السفلي في حاوية نفايات ، تاركا العاثية المركزة في الخزان العلوي.
- كرر الخطوات 1.2.7-1.2.8 حتى يتم تمرير الحجم الكامل لمحللات العاثية عبر جهاز المرشح ، مع الاحتفاظ ~ 2 مل من العاثية المركزة في الخزان العلوي بعد كل دوران.
- قم بفك انسداد غشاء المرشح بعد الدوران الأخير عن طريق سحب المحللة المتبقية (~ 2 مل) في الخزان العلوي لأعلى ولأسفل. اغسل العاثية (التبادل العازل) بإضافة 12 مل من المخزن المؤقت SM إلى الخزان العلوي وأجهزة الطرد المركزي عند 4000 × جم لمدة 10 دقائق ، أو حتى يمر معظم المخزن المؤقت عبر الفلتر.
- تخلص من المرشح وكرر خطوة الغسيل (الخطوة 1.2.10). أعد تعليق 2 مل المتبقية من المحللة في المخزن المؤقت SM إلى حجم نهائي يبلغ 10 مل (أو أقل) ، للتخزين طويل الأجل. انقل المحللة إلى أنبوب طرد مركزي مخروطي سعة 50 مل واحفظها في درجة حرارة 4 درجات مئوية حتى إزالة السموم الداخلية.
ملاحظة: من الاختياري معايرة العاثية في هذه المرحلة للتأكد من تركيز محلول العاثية (> 108 pfu / mL) ، ولتحديد فقدان العاثية أثناء عملية إزالة السموم الداخلية. - قم بإزالة السموم الداخلية الملوثة من محللات العاثية T4 بإضافة 0.4 حجم من 1-أوكتانول (انظر جدول المواد) إلى الحجم الكلي للمحللة.
ملاحظة: تتم إزالة السموم الداخلية لأنها عالية التحفيز المناعي ، وبالتالي قد يؤدي وجودها إلى تحريض استجابة مناعية فطرية مستقلة عن العاثيات25.
تنبيه: 1-أوكتانول مركب عطري وعضوي وقابل للاشتعال ذو رائحة قوية وهو مهيج للعين. ارتد معدات الوقاية الشخصية المناسبة عند العمل مع 1-أوكتانول. أداء جميع الأعمال في غطاء الدخان لتجنب استنشاق البخار. استخدم فيلم مانع للتسرب لمنع تسرب الأنابيب عند العمل خارج غطاء الدخان. - أغلق غطاء أنبوب الطرد المركزي المخروطي بغشاء مانع للتسرب لمنع التسرب. يهز عند 120 دورة في الدقيقة على منصة أو شاكر هزاز في درجة حرارة الغرفة لمدة ساعة واحدة ، تليها الحضانة عند 4 درجات مئوية لمدة 1.5 ساعة ، دون اهتزاز.
- جهاز طرد مركزي عند 4000 × جم لمدة 10 دقائق لفصل المحللة التي تم تطهيرها من السموم الداخلية عن 1-أوكتانول. سوف تطفو طبقة 1-أوكتانول فوق المحللة. استخدم ماصة P1000 لإزالة أكبر قدر ممكن من 1-أوكتانول بعناية والتخلص منها في حاوية النفايات السائلة الخطرة / القابلة للاشتعال المناسبة.
- استخدم إبرة 18 جم ومحقنة 10 مل لجمع محلول العاثية تحت طبقة 1-أوكتانول المتبقية ، مع الحرص على عدم جمع طبقة 1-أوكتانول. يخزن المحللة على حرارة 4 درجات مئوية حتى يتم تفريغ السرعة.
- نقل 1 مل من حصص T4 phage lysate إلى أنابيب طرد مركزي دقيقة معقمة سعة 1.5 مل. سرعة الفراغ مع فتح الأغطية عند 4000 × جم في درجة حرارة الغرفة لتبخر 1-أوكتانول المتبقي من المحلل. سرعة التفريغ لمدة 3 ساعات أو حتى يتم تقليل حجم محللات العاثية بنسبة 30٪ 25. يحفظ في درجة حرارة 4 درجات مئوية حتى المعايرة.
- قم بمعايرة تحلل العاثية لتحديد التركيز في pfu / mL. تمييع T4 phage المحللة الناتجة في المخزن المؤقت SM إلى التركيز المطلوب وإعادة عيار للتأكيد.
- قم بقياس السموم الداخلية الموجودة في محللات العاثية T4 باستخدام مجموعة تكميم السموم الداخلية الكروموجينية وفقا لتعليمات الشركة المصنعة (انظر جدول المواد). قارن مستويات السموم الداخلية في محللة العاثية النهائية مع عينة ما قبل إزالة السموم الداخلية ، وأدوات التحكم في السيارة ، والمخزن المؤقت ، ومياه شرب الفأر.
ملاحظة: يتم تعطيل مجموعة قياس كمية السموم الداخلية الكروموجينية بواسطة 1-أوكتانول25. قم بإجراء خطوات فراغ السرعة لإزالة 1-أوكتانول (الخطوة 1.2.16) قبل تحديد السموم الداخلية. يقدر محتوى الذيفان الداخلي للمياه المقطرة ب 20 وحدة حرارية أوروبية / مل25 ؛ ومع ذلك ، قد يختلف محتوى السموم الداخلية لمياه شرب الفئران بين المرافق. إذا تجاوزت مستويات السموم الداخلية في محلول العاثية الكمية الموجودة في مياه الشرب ، ففكر في تكرار خطوات إزالة السموم الداخلية (1.2.12-1.2.16). - قم بتخزين تحلل T4 phage المركز الذي تم تطهيره من السموم الداخلية في مخزن مؤقت SM عند 4 درجات مئوية.
- تحضير المحللة البكتيرية الخالية من العاثيات للتحكم في السيارة
ملاحظة: يمكن تحضير محللات بكتيرية خالية من العاثيات كوسيلة للتحكم في أي آثار ناتجة عن الملوثات البكتيرية (مثل الذيفان الداخلي) المتولدة في إنتاج محللات العاثيات في الخطوة 1.2 ، والتي يمكن أن تؤثر على النتائج التجريبية عند تلقيحها في الفئران.- من ثقافة بين عشية وضحاها من الإشريكية القولونية ، زراعة فرعية E. coli 1:50 إلى 100 مل من وسائط LB. بدون إضافة العاثية ، استمر في زراعة البكتيريا أثناء الاهتزاز عند 37 درجة مئوية لمدة 3 ساعات ، أو مطابقة وقت الحضانة لمحللات العاثية المنتجة في الخطوة 1.2.
- انقل مزرعة الإشريكية القولونية إلى أنابيب مخروطية سعة 50 مل وخلايا تحلل باستخدام مسبار صوتي (انظر جدول المواد) على الجليد عند 30 كيلو هرتز لنبضات 30 ثانية (3x) لتحلل الخلايا البكتيرية يدويا.
- اتبع بقية البروتوكول وفقا للخطوة 1.2 ، بدءا من الخطوة 1.2.4 ، بما في ذلك جميع خطوات التنظيف والغسيل وإزالة السموم الداخلية.
ملاحظة: أثناء التركيز باستخدام جهاز مرشح الطرد المركزي ، سوف تتدفق محللة السيارة عبر المرشح بسرعة أكبر من محللة العاثية ، بسبب عدم وجود العاثيات. لذلك ، قم بتقصير أوقات الطرد المركزي من 5 دقائق إلى 2-5 دقائق لضمان عدم جفاف غشاء المرشح الفائق أثناء الطرد المركزي لفترات طويلة. - قم بمعايرة السيارة لتأكيد أنها لا تحتوي على عاثيات.
- استخدم مجموعة تكميم السموم الداخلية الكروموجينية وفقا لتعليمات الشركة المصنعة لقياس مستويات السموم الداخلية في محللة السيارة. تمييع محللة السيارة في العازلة SM لتتناسب مع مستويات السموم الداخلية في محللة العاثيات.
- الضوابط التجريبية البديلة: تحضير محلول العاثية المعطل بالحرارة
ملاحظة: بديل للتحلل البكتيري الخالي من العاثيات هو محللة العاثية المعطلة بالحرارة. يؤدي تعطيل الحرارة إلى فصل فيروسات العاثيات ، في حين أن السموم الداخلية المتبقية مثل عديدات السكاريد الدهنية (LPS) مستقرة للحرارة 8,33. تم استخدام هذه الطريقة بواسطة Gogokhia et al.8 لتحديد ما إذا كانت فيروسات العاثيات السليمة والقابلة للحياة مطلوبة لتنشيط المناعة. يتم تشجيع الباحثين على اختبار كلتا الطريقتين (خالية من العاثيات مقابل معطلة بالحرارة) وتحديد التحكم الأكثر ملاءمة لاحتياجاتهم التجريبية. أيا كان ما يتم اختياره ، من المهم الاعتراف بأنه من غير المحتمل أن يكون التحكم في المخزن المؤقت مناسبا بسبب التلاعب الكبير المطلوب لتركيز وتنظيف مخزون العاثيات.- انقل الحجم المطلوب من محللات العاثية T4 النظيفة والمنقاة والمخففة من الخطوة 1.2 (100 ميكرولتر لكل ماوس) إلى أنابيب الطرد المركزي الدقيقة المعقمة المزودة بأقفال الغطاء.
- تتحلل الحرارة على كتلة حرارة عند 95 درجة مئوية لمدة 15 دقيقة16.
- اختياري: إذا كانت إزالة الأحماض النووية العاثية / البكتيرية مطلوبة ، فقم بإجراء علاج DNase I و RNase A وفقا ل Jakočiūnė و Moodley34. ايجاز:
- أضف 50 ميكرولتر DNase I 10x buffer و 1μL DNase I (1 U / μL) و 1 μL RNase A (10 مجم / مل) (انظر جدول المواد) إلى 450 ميكرولتر من محلول العاثيات المعطل بالحرارة.
- احتضان المحللة عند 37 درجة مئوية لمدة 1.5 ساعة في كتلة حرارية ، دون رج.
- قم بتعطيل DNase I و RNase A بإضافة 20 ميكرولتر 0.5 M حمض الإيثيلين ديامينيترايتيك (EDTA)34.
- امسك المحللة في درجة حرارة الغرفة لمدة 10 دقائق لتبرد وامزج المحللات إذا تم استخدام أنابيب متعددة. يحفظ في درجة حرارة 4 درجات مئوية حتى المعايرة.
- قم بإجراء عيار العاثية للتأكد من عدم وجود عاثية T4 قابلة للحياة في المحلل. قم بتخزين المحللات المعطلة بالحرارة عند 4 درجات مئوية.
- استخدم مجموعة تكميم السموم الداخلية الكروموجينية وفقا لتعليمات الشركة المصنعة لقياس مستويات السموم الداخلية في المحللة المعطلة بالحرارة. تمييع المحللة المعطلة بالحرارة في المخزن المؤقت SM وفقا لمستويات السموم الداخلية الموجودة في محللة العاثية المتطابقة.
2. إدارة ومراقبة T4 phage في الفئران أحادية الاستعمار E. coli
- أحادي الاستعمار للفئران مع الإشريكية القولونية
- قم بإعداد الإشريكية القولونية للإعطاء في الفئرانGF 8 عن طريق زراعة الإشريكية القولونية التي تم انتقاؤها من مستعمرة واحدة في وسائط LB بين عشية وضحاها.
- في ظل ظروف صارمة ومعقمة35 ، قم بإعطاء 200 ميكرولتر من استزراع الإشريكية القولونية لفئران GF الموجودة إما في عوازل فينيل معقمة أو أقفاص محكمة الإغلاق عن طريق التجويف الفموي. في حالة استخدام البكتيريا الهوائية ، يمكن أيضا استعمار الفئران عن طريق تطبيق 200 ميكرولتر من الثقافة البكتيرية على ظهر كل فأر.
ملاحظة: ستعتمد جرعة التلقيح على الإجهاد ، حيث تظهر البكتيريا المختلفة قدرة مختلفة على بقاء درجة الحموضة36,37. يوصي Zucoloto et al.35 بالتلقيح ب 1 × 108 cfu لكل. تم إنشاء النتائج التمثيلية الموضحة هنا من الفئران الملقحة بثقافة ليلية (لم يتم تحديد CFU). يمكن إجراء تجارب تجريبية لتحديد الجرعة التي تؤدي إلى استعمار موثوق لسلالة الفئران محل الاهتمام. قد يتأثر حجم البكتيريا التي تدار عن طريق التزويف الفموي بعمر ووزن الفئران. استشر المختبر الفردي أو بروتوكول أخلاقيات المؤسسي للحصول على الحد الأقصى المسموح به من الجرعات. يعتمد الحجم المقترح هنا على بدل تزويج بنسبة 10٪ من وزن جسم الفأر (على سبيل المثال ، 200 ميكرولتر كحد أقصى للفأر 20 جرام). بعض الأنواع البكتيرية لن تتسامح مع حموضة المعدة وتفشل في استعمار الأمعاء. ضع في اعتبارك التزويج الأول ب 100 ميكرولتر من 1 M NaHCO3 لتحييد أحماض المعدة2. في حالة استخدام لاهوائية صارمة للاستعمار ، سيحتاج الميكروب إلى النمو في ظل ظروف لاهوائية ونقله إلى منشأة gnotobiotic في حاويات محكمة الغلق معدة بشكل فردي (1 لكل فأر). قم بإجراء كل تجويف بسرعة بمجرد فتح الحاوية للحد من فقدان الصلاحية الميكروبية بسبب التعرض للأكسجين. - مراقبة الفئران بحثا عن الآثار الصحية الضارة.
ملاحظة: في حالة حدوث آثار صحية ضارة ، يرجى الرجوع إلى المعايير التي وضعتها منشأة رعاية ذات الصلة. تشمل الآثار الصحية الضارة المحتملة ، على سبيل المثال لا الحصر: (1) شفط سائل التطفل: تشمل الأعراض طرد الفقاعات عن طريق الأنف ، والتنفس / اللهاث "فتح الفم". (2) ثقب المريء: تشمل الأعراض اعتلال الصحة بسرعة ، والحدب ، والخمول ، مما يؤدي إلى وفاة في غضون 24 ساعة. (3) التهاب المريء بسبب التجاويف المتكررة: تشمل الأعراض صعوبة إدخال إبرة التزويج. (4) الإسهال بسبب التغيرات في الميكروبيوم. - تأكد من الاستعمار البكتيري في الكريات البرازية عن طريق الزراعة مرة واحدة على الأقل في الأسبوع و / أو عن طريق تسلسل 16S rRNA35.
ملاحظة: إذا استعمروا المربين داخل عازل gnotobiotic لإنتاج فئران التجارب ، فخطط قبل 9 أسابيع على الأقل لتوليد الجيل الأول من فئران التجارب (F1) البالغة من العمر 6 أسابيع. بدلا من ذلك ، يمكن أن تكون الفئران البالغة GF أحادية المستعمرة. في هذا النهج ، يوصى بالانتظار لمدة 7 أسابيع بعد الاستعمار قبل تلقيح العاثيات ، لأن هذا هو الوقت اللازم لاستقرار الغشاء المخاطي في الأمعاء بعد إدخال ميكروبات معقدة في الفئرانGF 38.
- التلقيح الفموي للعاثية T4 في الفئران أحادية القولون E. coli
- تمييع T4 تحلل العاثية وأدوات التحكم في السيارة إلى تركيز محدد مسبقا في المخزن المؤقت SM. وفقا ل Hsu et al.2 ، تحلل العاثية المخففة للسماح بإعطاء 2 × 106 pfu لكل فأر2.
ملاحظة: يمكن استخدام تركيز أعلى أو أقل من العاثية اعتمادا على استقرار العاثية في الجسم الحي. أدت جرعات 2 × 102 و 2 × 104 و 2 × 106 pfu من T4 phage لكل فأر إلى استعمار مستقر وطويل الأجل في القناة الهضمية لا يبدو أنه يعتمد على الجرعة (كما هو موضح في قسم النتائج التمثيلية). لذلك يجب تجريب حركية بكتيريا العاثيات في الجسم الحي قبل إجراء تجارب واسعة النطاق. - في ظل ظروف معقمة ، gnotobiotic ، قم بتزويج كل فأر ب 100 ميكرولتر من 1 M NaHCO3 لتحييد أحماض المعدة. انتظر 10 دقائق ، ثم تزعج مع 100 ميكرولتر من محللات العاثية T4 أو التحكم في السيارة.
- مراقبة الفئران بحثا عن الآثار الصحية الضارة.
- تمييع T4 تحلل العاثية وأدوات التحكم في السيارة إلى تركيز محدد مسبقا في المخزن المؤقت SM. وفقا ل Hsu et al.2 ، تحلل العاثية المخففة للسماح بإعطاء 2 × 106 pfu لكل فأر2.
3. مراقبة مستويات العاثية T4 في الجسم الحي
ملاحظة: بمجرد تلقيح الفئران بالعاثيات ، يمكن قياس تركيز كل من العاثيات والبكتيريا المستهدفة في عينات البراز أو الأنسجة. يوفر هذا معلومات عن حركية عدوى العاثية وديناميكيات الاستعمار لكلا الكائنين.
- بقعة الطلاء T4 phage لتحديد التركيز في الكريات البرازية
- اجمع الكريات البرازية من كل فأر في أنابيب طرد مركزي معقمة ووزنها مسبقا لقياس مستويات العاثية T4 والإشريكية القولونية . تخزين الأنابيب على الجليد حتى الطلاء.
ملاحظة: ضع العينات على الثلج في الفترة الفاصلة بين الجمع والطلاء لإبطاء نمو البكتيريا التي تتحمل التحمل. على مدى عدة ساعات ، قد لا يزال هناك نمو للبكتيريا الهوائية ، أو بعض موت البكتيريا اللاهوائية بسبب التعرض للأكسجين مما قد يؤدي إلى انحراف عدد البكتيريا. لذلك ، يجب إجراء طلاء البكتيريا والعاثيات في أقرب وقت ممكن بعد جمع العينات. إلزام البكتيريا اللاهوائية لن تتسامح مع التعرض للأكسجين. للحفاظ على العينة ، اجمع العينات في أنابيب محكمة الغلق وانقل الأنابيب إلى غرفة لاهوائية في أسرع وقت ممكن بعد جمعها. إذا لم يتم الكشف عن أي نمو في عينات البراز ، ففكر في بدائل مثل 16S rRNA qPCR للقياس الكمي للبكتيريا. - سجل الأوزان النهائية لكل أنبوب واحسب وزن العينة بطرح وزن الأنبوب الأولي. سيتم استخدام هذا لتطبيع تركيز T4 phage و E. coli لوزن العينة (pfu / g أو cfu / g ، على التوالي).
- أضف 1 مل من المخزن المؤقت SM المعقم إلى كل أنبوب ودوامة جيدا بأقصى سرعة (>1 دقيقة) لتجانس الكريات البرازية. إذا كانت العينة أقل من 15 مجم ، فيمكن إضافة حجم أصغر من المخزن المؤقت SM. سجل حجم المخزن المؤقت SM المضاف إلى كل عينة لإجراء حسابات cfu / g أو pfu / g للعينة.
- قم بإعداد سلسلة من 8 (أو أكثر اعتمادا على تركيز العاثيات المتوقع) من التخفيفات التسلسلية من 20 ميكرولتر من كل عينة في 180 ميكرولتر SM العازلة ، في عوامل 10. دوامة كل عينة متجانسة لفترة وجيزة لخلط قبل إضافتها إلى الأنبوب الأول / البئر. ماصة للخلط بين كل إضافة وتغيير الأطراف بين كل تخفيف لمنع تضخم عدد العاثيات أو البكتيريا عن طريق ترحيل العينة.
ملاحظة: إذا كانت الألياف والحطام الموجود في العينة يعيق السحب ، أضف حاجزا إضافيا إلى ملاط البراز لتخفيف عينة المخزون بشكل أكبر. - حدد 5 ميكرولتر من كل تخفيف على ألواح أجار ناعمة LB تحتوي على E. coli (لمقايسات لوحة العاثيات) أو ألواح أجار LB (1.5٪ أجار ، لمقايسات المستعمرات البكتيرية) لتحديد تركيز T4 phage و E. coli في كل عينة. للتأكد من دقتها، حدد كل عينة في ثلاث نسخ.
ملاحظة: في حالة تحضير التخفيفات التسلسلية في لوحة 96 بئرا ، يمكن استخدام ماصة متعددة القنوات P20 ذات 8 قنوات لسحب كل عمود من العينة المخففة بشكل متسلسل على الألواح. قم بتغيير الأطراف بين كل تخفيف ، حتى لو انتقلت من الأكثر تخفيفا إلى الأكثر تركيزا ، حيث قد تلتصق العاثية بجدران طرف الماصة وتغير كمية العاثية المضافة إلى كل بئر جديد31. - اترك كل بقعة تجف قبل قلب اللوحة ووضعها في الحاضنة. احتضان بين عشية وضحاها في 37 درجة مئوية.
- لكل عينة ، حدد التخفيف الذي يوجد فيه 3-30 لويحة قابلة للعد لكل بقعة. عد وسجل عدد اللويحات في البقعة والتخفيف المستخدم.
- احسب pfu / g للعينة بقسمة عدد اللويحات على الحجم المطلي في كل بقعة لإعطاء pfu / μL. اضرب هذا في عامل التخفيف وحجم المخزن المؤقت SM المضاف إلى كل عينة لإعطاء pfu / عينة. أخيرا ، اقسم على وزن العينة لإعطاء pfu / g30.

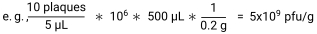
- اجمع الكريات البرازية من كل فأر في أنابيب طرد مركزي معقمة ووزنها مسبقا لقياس مستويات العاثية T4 والإشريكية القولونية . تخزين الأنابيب على الجليد حتى الطلاء.
- أخذ عينات الأنسجة في نقاط النهاية التجريبية
- في كل نقطة زمنية محددة ، القتل الرحيم للفئران وفقا لبروتوكول أخلاقيات المؤسسي المعتمد وجمع محتويات cecal ، ومحتويات الأمعاء الصغيرة والكبيرة ، وأي أنسجة ذات أهمية في أنابيب طرد مركزي دقيقة معقمة ووزنها مسبقا 2 مل مستديرة القاع.
- سجل الأوزان النهائية لكل أنبوب لحساب وزن العينة. قم بتخزين المناديل ومحتويات السيكال على الثلج حتى الطلاء في نفس اليوم.
- أضف مخزن مؤقت SM معقم إلى كل أنبوب وسجل الأحجام المضافة.
- بالنسبة للمحتويات المعوية والمعوية ، عينات دوامة بدقة (>1 دقيقة) وفقا للخطوة 3.1.3.
- بالنسبة لعينات الأنسجة ، أضف حبة معدنية معقمة واحدة إلى كل أنبوب. تجانس الأنسجة باستخدام محلل الأنسجة (انظر جدول المواد) عند 20 هرتز لمدة 5 دقائق أو حتى تتفكك الأنسجة ويصبح المعلق متجانسا.
ملاحظة: إذا لم تتجانس العينات جيدا ، ففكر في زيادة حجم المخزن المؤقت SM المضاف ، أو زيادة وقت التجانس ، أو زيادة تردد التجانس إلى 30 هرتز. يمكن أيضا استخدام خالط الأنسجة لفصل الأنسجة مع السماح باستعادة البكتيريا والعاثيات39,40. يتم تشغيل المجانسات بترددات أعلى من محللات الأنسجة مع الحفاظ على سلامة البكتيريا. - تحضير التخفيفات التسلسلية لكل عينة بعوامل 10 وإجراء الطلاء الموضعي لتحديد تركيزات العاثية E. coli و T4 في كل عينة ، كما هو موضح في الخطوة 3.1.4-3.1.841.
Access restricted. Please log in or start a trial to view this content.
النتائج
للتحقيق في التفاعلات بين T4 phage / E. coli dyad في أمعاء الفئران ، تم تحضير وتنظيف وتنقية العاثية T4 ومحللات المركبات (الشكل 1 أ). تم معايرة محللات العاثية T4 بواسطة مقايسة البلاك وتخفيفها إلى 2 × 107 pfu / mL (2 × 106 pfu / mouse) في المخزن المؤقت SM. كما تم معايرة محللات المركبات لتأ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تمثل دراسة العاثيات في الميكروبيوم تحديا كبيرا مقارنة بنظيراتها البكتيرية. على وجه التحديد ، لا تحتوي العاثيات على علامة تطورية محفوظة مشتركة بين جميع العاثيات المشابهة للوحدات الفرعية الريبوسومية 16S و 18S التي تسمح بسهولة تسلسل وتحديد الأنواع بدائية النواة وحقيقية النواة ، على التوالي
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يعترف المؤلفون بأن الأرض التي أجروا عليها هذا البحث هي الأراضي التقليدية والأجداد وغير المعترف بها لأمة xwməθkwəy̓əm (Musqueam). لطالما كانت الأرض التي تقع عليها مكانا للتعلم لشعب Musqueam ، الذين انتقلوا لآلاف السنين في ثقافتهم وتاريخهم وتقاليدهم من جيل إلى آخر في هذا الموقع. نحن نشجع الآخرين على معرفة المزيد عن الأراضي الأصلية التي يعيشون ويعملون فيها في https://native-land.ca. يقر المؤلفون بالدعم المقدم من مجلس العلوم الطبيعية والهندسة في كندا (NSERC) المنح الدراسية الكندية للخريجين - الماجستير (NP) ، جائزة مايكل سميث للبحوث الصحية BC للمتدربين (RT-2023-3174 ، إلى MH) ، برنامج المنح الاستكشافية لمجلس أبحاث العلوم الطبيعية والهندسة في كندا (NSERC) (RGPIN-2019-04591 إلى CT ، RGPIN-2016-04282 إلى LCO) ، المعهد الكندي للبحوث المتقدمة / البشر والميكروبيوم (FL-001253 Appt 3362 ، إلى CT) ، وجائزة مؤسسة مايكل سميث للباحثين في مجال البحوث الصحية (18239 ، إلى CT) ، والمعاهد الكندية للبحوث الصحية (PJT-159458 إلى LCO) والمؤسسة الكندية للابتكار (34673 إلى LCO و 38277 إلى CT). نحن ممتنون للدعم الفني من مركز UBC لنمذجة الأمراض و ubcFLOW ، الذي تدعمه مبادرة المرونة البيولوجية UBC GREx ، ولأعضاء مختبرات Osborne و Tropini للمناقشات النقدية وتقييم المخطوطة. تم إنشاء الشكل 1A والشكل 2A باستخدام Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1-octanol (99%) | Thermofisher | CAAAA15977-AP | |
| 50 ml PES Steriflip Sterile Disposable Vacuum Filter Units | Millipore Sigma | SCGP00525 | |
| Agarose (Low-EEO/Multi-Purpose/Molecular Biology Grade) | Fisher BioReagents | BP160-500 | |
| Amicon® 100kDa Ultra-15 centrifugal filter device, Ultracel-100 | Millipore Sigma | UFC910008 | |
| BD Microtainer® Tubes, SST | BD Medical | 365967 | |
| Bioexclusion airtight cages (ISO cages) | Techiplast | 1245ISOCAGE | |
| C1000 Touch™ Thermal Cycler with 96-Well Fast Reaction Module | BioRad | 1851196 | |
| Calcium Chloride Dihydrate (White Crystals to Powder) | Fisher BioReagents | BP510-500 | |
| Cap Locks For 1.5ML Tube 100/pk | Andwin Scientific | 16812612 | |
| Chloroform (Ethanol as Preservative/Certified ACS) | Fisher | C298-500 | |
| Copper coated steel beads (4.5 mm) | Crosman Corporation | 0767 | |
| DNeasy Blood & Tissue Kit (50) | Thermo Scientific | 69504 | |
| DreamTaq Green PCR Master Mix (2X) | Thermo Scientific | K1081 | |
| Ethylenediaminetetraacetic acid (EDTA) disodium salt solution, for molecular biology, 0.5 M in H2O | Sigma Aldrich | E7889 | |
| Fisher BioReagents™ Agar, Powder / Flakes, Fisher BioReagents™ | Fisher Bioreagents | BP1423-500 | |
| Fisher BioReagents™ Microbiology Media: LB Broth (Powder) - Lennox | Fisher Bioreagents | BP1427-500 | |
| GeneRuler 100 bp DNA Ladder | Thermo Scientific | SM0241 | |
| Green FastMix® qPCR mix, 1250 rxns | QuantaBio | 95072-012 | |
| HEPA filters for isocage lids, AUTOCLAVABLE H14 FILTERS FOR ISO LINE- IRRADIATED | Techiplast | UISOHEPAXTBOX-300 | |
| Magnesium sulfate heptahydrate | Fisher BioReagents | BP213-1 | |
| MaxQ 6000 Incubated Shaker | Thermo Scientific | 8354-30-0009 | |
| Microbiology Media: LB Broth (Powder) - Lennox | Fisher BioReagents | BP1427-500 | |
| Microcentrifuge Tubes with Locking Snap Cap, 2ml | Fisher | 14-666-315 | |
| Parafilm sealing film | Bemis | PM-996 | |
| Phage stocks | Carolina Biological Supply | n/a | |
| PicoLab® Mouse Diet 20 EXT | LabDiet | 5R58 | |
| Pierce™ Chromogenic Endotoxin Quant Kit | Thermo Scientific | A39552S | |
| RNase A (17,500 U) | Qiagen | 19101 | |
| RNase-free DNase Set | Qiagen | 79254 | |
| Sodium Bicarbonate (Fine White Powder) | Fisher Chemical | BP328-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Chemical | S271 | |
| Sonicator (probe model CL-18; power source model FB50) | Fisher scentific | n/a | |
| Sterile flexible film isolator | Class Biologically Clean | n/a | |
| SYBR™ Safe DNA Gel Stain | Invitrogen | S33102 | |
| T100 Thermal Cycler | BioRad | 1861096 | |
| T4 phage primer, forward (CCACACATAGCGCGAGTATAA) | IDT | n/a | |
| T4 phage primer, forward (GAAACTCGGTCAGGCTATCAA) | IDT | n/a | |
| TissueLyser II | Qiagen | 85300 | |
| Tris-HCl, 1M Solution, pH 8.0, Molecular Biology Grade, Ultrapure | Thermo Scientific | AAJ22638AE | |
| Water, (DNASE, RNASE free) | Fisher BioReagents | BP2484100 |
References
- Rohwer, F., Segall, A. M. A century of phage lessons. Nature. 528 (7580), 46-47 (2015).
- Hsu, B. B., et al. Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model. Cell Host & Microbe. 25 (6), 803-814.e5 (2019).
- Gordillo Altamirano, F. L., Barr, J. J. Phage Therapy in the postantibiotic era. Clinical Microbiology Reviews. 32 (2), (2019).
- Schooley, R. T., et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Ott, S. J., et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152 (4), 799-811.e7 (2017).
- Zuo, T., et al. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 67 (4), 634-643 (2018).
- Norman, J. M., et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 160 (3), 447-460 (2015).
- Gogokhia, L., et al. Expansion of bacteriophages is linked to aggravated intestinal inflammation and colitis. Cell Host & Microbe. 25 (2), 285-299.e8 (2019).
- Brunse, A., et al. Fecal filtrate transplantation protects against necrotizing enterocolitis. The ISME Journal. 16 (3), 686-694 (2022).
- Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. M., Hooper, L. V. A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17621-17626 (2012).
- Barr, J. J., et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proceedings of the National Academy of Sciences of the United States of America. 110 (26), 10771-10776 (2013).
- Nguyen, S., et al. Bacteriophage Transcytosis provides a mechanism to cross epithelial cell layers. mBio. 8 (6), (2017).
- Bichet, M. C., et al. Bacteriophage uptake by mammalian cell layers represents a potential sink that may impact phage therapy. iScience. 24 (4), 102287(2021).
- Buttimer, C., et al. Impact of a phage cocktail targeting Escherichia coli and Enterococcus faecalis as members of a gut bacterial consortium in vitro and in vivo. Frontiers in Microbiology. 13, 936083(2022).
- Li, Y., et al. Bacteriophages allow selective depletion of gut bacteria to produce a targeted-bacterium-depleted mouse model. Cell Reports Methods. 2 (11), 100324(2022).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20236-20241 (2013).
- Federici, S., et al. Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 185 (16), 2879-2898.e4 (2022).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science (New York, N.Y.). 363 (6434), (2019).
- Fluckiger, A., et al. Cross-reactivity between tumor MHC class I-restricted antigens and an enterococcal bacteriophage. Science (New York, N.Y.). 369 (6506), 936-942 (2020).
- Majewska, J., et al. Induction of Phage-Specific Antibodies by Two Therapeutic Staphylococcal Bacteriophages Administered per os. Frontiers in Immunology. 10, 2607(2019).
- Weiss, M., et al. In vivo replication of T4 and T7 bacteriophages in germ-free mice colonized with Escherichia coli. Virology. 393 (1), 16-23 (2009).
- Thomson, C. A., Morgan, S. C., Ohland, C., McCoy, K. D. From germ-free to wild: modulating microbiome complexity to understand mucosal immunology. Mucosal Immunology. 15 (6), 1085-1094 (2022).
- Al-Asmakh, M., Zadjali, F. Use of germ-free animal models in microbiota-related research. Journal of Microbiology and Biotechnology. 25 (10), 1583-1588 (2015).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Bonilla, N., et al. Phage on tap-a quick and efficient protocol for the preparation of bacteriophage laboratory stocks. PeerJ. 4, e2261(2016).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. 1, Cold Spring Harbor Laboratory Press. New York, NY. (2001).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology (Clifton, N.J). 501, 69-76 (2009).
- Manikantha, B., Karthika, R., Murugadas, V., Vishnuvinayagam, S., Rao, B. M. Comparison of the single agar and double agar layer methods for enumeration of bacteriophages. Fishery Technology. 59, 60-63 (2022).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, e3064(2012).
- Louten, J. Chapter 7 - Detection and diagnosis of viral infections. Essential Human Virology. , 111-132 (2016).
- Richter, Ł, et al. Adsorption of bacteriophages on polypropylene labware affects the reproducibility of phage research. Scientific Reports. 11 (1), 7387(2021).
- Merck KGaA. Amicon Ultra-15 Centrifugal Filter Devices. , Darmstadt, Germany. https://www.emdmillipore.com/CA/en/product/Amicon-Ultra-15-Centrifugal-Filter-Unit,MM_NF-UFC901024#documentation (2018).
- Hecker, W., Witthauer, D., Staerk, A. Validation of dry heat inactivation of bacterial endotoxins. PDA Journal of Pharmaceutical Science and Technology. 48 (4), 197-204 (1994).
- Jakočiūnė, D., Moodley, A. A Rapid bacteriophage DNA extraction method. Methods and Protocols. 1 (3), 27(2018).
- Zucoloto, A. Z., Yu, I. L., McCoy, K. D., McDonald, B. Generation, maintenance, and monitoring of gnotobiotic mice. STAR Protocols. 2 (2), 100536(2021).
- Ng, K. M., et al. Single-strain behavior predicts responses to environmental pH and osmolality in the gut microbiota. mBio. 14 (4), e0075323(2023).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nature Reviews. Microbiology. , (2023).
- Bergstrom, K., Xia, L. The barrier and beyond: Roles of intestinal mucus and mucin-type O-glycosylation in resistance and tolerance defense strategies guiding host-microbe symbiosis. Gut Microbes. 14 (1), 2052699(2022).
- Askar, M., Ashraf, W., Scammell, B., Bayston, R. Comparison of different human tissue processing methods for maximization of bacterial recovery. European Journal of Clinical Microbiology & Infectious Diseases. 38 (1), 149-155 (2019).
- Redanz, S., Podbielski, A., Warnke, P. Improved microbiological diagnostic due to utilization of a high-throughput homogenizer for routine tissue processing. Diagnostic Microbiology and Infectious Disease. 82 (3), 189-193 (2015).
- Bhinder, G., et al. The Citrobacter rodentium mouse model: studying pathogen and host contributions to infectious colitis. Journal of Visualized Experiments. 72, e50222(2013).
- Reyes, A., Semenkovich, N. P., Whiteson, K., Rohwer, F., Gordon, J. I. Going viral: next-generation sequencing applied to phage populations in the human gut. Nature Reviews Microbiology. 10 (9), 607-617 (2012).
- Camarillo-Guerrero, L. F., Almeida, A., Rangel-Pineros, G., Finn, R. D., Lawley, T. D. Massive expansion of human gut bacteriophage diversity. Cell. 184 (4), 1098-1109.e9 (2021).
- Reyes, A., et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466 (7304), 334-338 (2010).
- Bach, M. S., et al. Filamentous bacteriophage delays healing of Pseudomonas-infected wounds. Cell Reports. Medicine. 3 (6), 100656(2022).
- Filyk, H. A., Osborne, L. C. The multibiome: The intestinal ecosystem's influence on immune homeostasis, health, and disease. EBioMedicine. 13, 46-54 (2016).
- Rohwer, F., Merry, Y., Maughan, H., Hisakawa, N. Heather Life in Our Phage World: A Centennial Field Guide to the Earth's Most Diverse Inhabitants. Wholon. , San Diego. (2014).
- Glonti, T., Pirnay, J. P. In Vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 14 (7), 1490(2022).
- Fraser, J. S., Yu, Z., Maxwell, K. L., Davidson, A. R. Ig-like domains on bacteriophages: a tale of promiscuity and deceit. Journal of Molecular Biology. 359 (2), 496-507 (2006).
- Li, H., et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications. 6, 8292(2015).
- Bergström, A., et al. Nature of bacterial colonization influences transcription of mucin genes in mice during the first week of life. BMC Research Notes. 5, 402(2012).
- Adams, M. H. Bacteriophages. , Interscience Publishers. https://books.google.co.uk/books?id=3wVrAAAAMAAJ (1959).
- Kutter, E., Sulakvelidze, A. Bacteriophages: Biology and Applications. , CRC Press. https://books.google.co.uk/books?id=flHOvAEACAAJ (2004).
- Bao, H., et al. Dysbiosis and intestinal inflammation caused by Salmonella Typhimurium in mice can be alleviated by preadministration of a lytic phage. Microbiological Research. 260, 127020(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved