JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 장에서 T4 박테리오파지와 대장균 상호작용: 생체 내 숙주-박테리오파지 역학 연구를 위한 프로토타입 모델
요약
박테리아를 감염시키는 바이러스인 박테리오파지(파지)는 장내 마이크로바이옴의 필수 구성 요소입니다. 이러한 공생 생물이 박테리아 적합성과 개체군 역학을 주도하지만 장내 항상성과 질병에 미치는 영향에 대해서는 거의 알려져 있지 않습니다. 이 프로토콜은 마우스 모델 내에서 분리된 T4 파지를 연구하며, 다른 파지-박테리아 쌍에 적응할 수 있습니다.
초록
박테리오파지(파지)는 종 및 균주 수준의 특이성을 가진 박테리아를 감염시키는 바이러스이며 알려진 모든 생태계에서 가장 풍부한 생물학적 개체입니다. 장내 미생물군에서 발견되는 것과 같은 박테리아 군집 내에서 파지는 미생물군 개체군 역학을 조절하고 박테리아 진화를 주도하는 데 관여합니다. 지난 10년 동안 파지 연구에 대한 관심이 다시 높아졌는데, 이는 부분적으로 항생제 내성 박테리아의 증가하는 위협에 대응할 수 있는 유망한 도구를 제공하는 용해 파지의 숙주 특이적 살상 능력 때문입니다. 또한, 파지가 장 점액에 달라붙는다는 것을 입증한 최근 연구는 파지가 박테리아가 하부 상피로 침입하는 것을 방지하는 보호 역할을 할 수 있음을 시사합니다. 중요한 것은 박테리아 마이크로바이옴과 마찬가지로 파괴된 파지오메는 염증성 장 질환과 같은 질병의 악화된 결과와 관련이 있다는 것입니다. 이전 연구에서는 파지가 분변 여과액 이식을 통해 동물과 인간의 마이크로바이옴을 조절하여 숙주의 건강에 도움이 될 수 있음을 입증했습니다. 이러한 최근의 연구의 물결로 인해 장내 마이크로바이옴의 맥락에서 파지를 연구하기 위한 프로토콜을 수립하고 표준화해야 할 필요성이 대두되고 있습니다. 이 프로토콜은 쥐 위장관의 맥락에서 분리된 T4 파지와 박테리아 숙주인 대장균을 연구하기 위한 일련의 절차를 제공합니다. 여기에 설명된 방법은 파지 용해물에서 시작하여 마우스에 투여하고 박테리아 숙주 및 파지 수준에 대한 영향을 평가하는 방법을 간략하게 설명합니다. 이 프로토콜은 변형되어 다른 파지-박테리아 쌍에 적용될 수 있으며 생체 내에서 숙주-파지 역학을 연구하기 위한 출발점을 제공합니다.
서문
박테리오파지(Bacteriophage) 또는 파지(phage)는 종 및 균주 수준 특이성을 가진 박테리아를 감염시키고 죽이는 바이러스입니다1. 파지는 장내 미생물군(gut microbiota)과 같은 복잡한 박테리아 군집 내에서 중요한 역할을 하며, 개체군 역학을 조절하고 박테리아 적합성을 촉진하는 데 관여한다2. 지난 10년 동안 항생제 내성 병원체3의 증가와 대체 치료 전략으로서의 파지 요법의 잠재력으로 인해 파지 연구에 대한 관심이 다시 높아졌습니다. 최근 몇 년 동안 용해 파지 칵테일은 인간의 심각한 항생제 내성 세균 패혈증 감염에 어느 정도 성공을 거두면서 정맥 주사로 사용되었습니다 3,4. 경구 파지 요법은 또한 장 감염 및 염증을 치료하기 위한 항생제의 잠재적인 대안으로 제안되었습니다. 또한, 파지는 박테리아를 제거하기 위해 여과된 분변 미생물군 제제인 분변 여과물 이식(FFT)의 성공과 관련이 있으며, 재발성 클로스트리디오이데스 디피실 감염(rCDI)5,6, 염증성 장 질환(IBD)7,8 및 조산 돼지의 괴사성 장염 치료에 사용되었다9. 이러한 결과를 감안할 때, 기존 군집에 새로운 파지를 추가하면 표적 박테리아 2,10뿐만 아니라 군집 전체에 간접적인 영향을 미칠 수 있으므로 파지와 장내 미생물군, 파지와 포유류 숙주 사이의 상호 작용을 고려하는 것이 중요합니다.
체외에서 표적 박테리아와 파지 상호 작용에 대한 연구는 장에서 파지와 박테리아 상호 작용의 메커니즘과 영향을 이해하는 데 유용한 것으로 입증되었습니다. 이러한 설정에서, Caudovirales 목의 대장균 특이적 T4 파지는 장 점액에 부착하기 위해 비리온 표면의 항원성이 높은 외부 캡시드(Hoc) 단백질 내에 위치한 면역글로불린(Ig) 유사 도메인을 필요로 하는 것으로 나타났다11. 또한, 트랜스웰 분석은 T4 파지가 상피세포 배양과 상호 작용하고 마크로피노사이토시스(macropinocytosis)에 의해 세포층을 통해 전위될 수 있음을 보여주었습니다12,13. 이러한 결과는 파지가 진핵 세포를 감염시킬 수 없더라도 중생대 숙주와 상호 작용할 수 있다는 가설을 뒷받침합니다. 이러한 모델은 유용하기는 하지만, 파지, 박테리아 및 중생대 숙주 간의 삼자 상호 작용을 포괄적으로 탐구하는 데 필요한 장 생태계에서 발생하는 복잡한 상호 작용의 전체 범위가 부족합니다.
마우스 모델은 복잡한 환경 내에서 파지를 조사하는 데 중요한 도구입니다. 파지 투여의 바람직한 적용은 IBD를 포함한 만성 염증성 질환과 관련된 항생제 내성 감염 또는 병원체를 치료하기 위한 대체 전략입니다. 그러나 새로운 문헌에 따르면 체외에서의 파지 거동은 생체 내 기능을 완전히 나타내지 않습니다. Buttimer et al.14는 파지 칵테일이 단순화된 인간 미생물군 컨소시엄에서 표적 박테리아를 고갈시킬 수 있었지만 동일한 박테리아-파지 컨소시엄으로 식민지화된 gnotobiotic 마우스에서는 생체 내에서 복제할 수 없음을 입증했습니다. 또한, 기존의 마우스 마이크로바이옴에서 T7 파지는 표적 장내 세균의 선택적 고갈을 유도했지만, 시간이 지남에 따라 점진적인 회복이 관찰되어 내성이 진화했음을 나타냅니다15. 다른 연구에서는 생체 내경구 투여 파지와 표적 박테리아 균주의 공존을 입증했습니다 2,16. 실제로, 파지/박테리아 공존을 넘어서, 파지 투여는 전반적인 미생물군 군집 구성과 기능에 광범위한 변화를 가져왔다 2,16. 이는 여러 연구에서 Caudovirales의 상대적 풍부도 증가와 IBD 7,8,17 사이의 연관성을 발견했으며, 이는 박테리아 풍부도의 변화와 무관하게 발견되었기 때문에 질병 환경과 관련이 있다 7. 이것이 질병 발병의 원인인지 결과인지는 아직 밝혀지지 않았습니다.
파지 연구의 역사적 초점은 파지와 표적 박테리아 간의 관계에 관한 것이었습니다. 그러나 파지와 중생대 숙주의 점막, 상피 및 면역 체계 사이의 잠재적인 상호 작용을 고려하는 것도 중요합니다. 이러한 상호 작용은 모두 장 파지 감염에 대한 전반적인 반응에 중요한 역할을 합니다. 이를 입증하기 위해 파지는 무균(GF) 마우스를 사용하여 미생물총(microbiota)의 간섭 없이 면역 체계에 미치는 영향을 규명하기 위해 연구되었다8. 이 시스템에서, 파지 핵산은 식세포 면역세포(대식세포 및 수지상세포)의 엔도솜 내에 위치한 톨 유사 수용체(TLR)에 의해 검출되었습니다. 이는 다운스트림 신호전달을 활성화하고 인터페론(IFN)-γ8 또는 유형 I IFN의 T 세포 의존성 생성을 자극했다18. 더욱이, Fluckiger et al.19는 기억 CD8+ T 세포가 파지로 인코딩된(프로파지) 항원을 인식하는 데 관여하며, 이로 인해 T 세포가 종양 항원과 교차 반응하여 종양 부담을 감소시켰습니다. 마지막으로, 파지 특이적 항체 생산은 식수 8,20 또는 수개월에 걸쳐 반복적인 경구 개비지(20)를 통해 파지를 동물 모델에 지속적으로 전달한 마우스 연구에서 문서화되었으며, 이는 체액성 면역 반응을 촉진하는 파지 단백질의 능력을 입증했습니다. 이러한 파지 접종 방식은 면역 체계의 최적이고 지속적인 프라이밍을 허용하지만, 파지와 장내 환경 사이에서 자연적으로 발생하는 상호 작용이나 경구 적용 파지 요법의 역학을 나타내지 않을 수 있습니다. 지금까지, 제한된 수의 연구들이 단일군락화된 마우스 모델에서 단일 박테리아 종과 파지의 상호작용을 조사하였다21. 그러나, 단일군락화된 마우스는 위장관(GI) 및 면역 발달에 대한 개별 종의 미생물 특이적 효과를 해독하는 데 중요한 것으로 입증되었으며, 파지, 표적 박테리아 및 중생대 숙주 사이의 삼자 상호작용을 이해하는 데 유용할 수 있습니다.
흥미롭게도, 장내 파지와 장내 공생 박테리아 사이의 상호 작용뿐만 아니라 중생대 숙주와 그 안에 있는 파지 사이에서 발생하는 상호 작용에 대해 아직 배워야 할 것이 많습니다. 이 프로토콜은 gnotobiotic 마우스 모델을 사용하여 분리된 T4 파지와 박테리아 대응물인 E. coli (K-12, BW25113)를 연구하기 위한 일련의 절차를 제공합니다. 이러한 표준화된 절차는 또한 성장 파라미터를 관심 쌍에 맞게 조정하여 다른 파지/박테리아 다이아드를 최적화하기 위한 기반을 제공합니다. 여기에 기술된 방법들은 개략적으로 설명된다: (1) 마우스의 구강 위축을 위한 T4 파지 및 차량 용해물의 준비; (2) 대장균 단일집락화 gnotobiotic 마우스에 대한 T4 파지의 경구 투여; (3) 시간 경과에 따른 쥐의 대변 및 조직의 T4 파지 수준 모니터링.
여기에 제시된 대표적인 결과를 위해, 정제된 T4 파지 용해물은 Rohwer Lab에 의해 유지되는 파지 뱅크 스톡으로부터 전파되었다. T4 파지를 증식하기 위한 파지-온-탭(Phage-on-Tap) 방법은 이 프로토콜에서 참조된 바와 같이25에 적응되었다. 이 방법은 3일 이내에 높은 역가, 내독소가 적은 파지 스톡을 생성합니다. 이 접근법을 이용하여, 10 mL의 ≥10 10 플라크 형성 단위(pfu)/mL의 T4 파지와 < 0.5 내독소 단위(EU)/mL를 일상적으로 수집하였다. 마우스에 대한 경구 또는 정맥 투여에 대한 권장 내독소 수치는 각각 ≤ 20EU/mL 및 ≤ 5EU/kg/h(또는 20g 마우스의 경우 1시간 동안 0.1EU 투여)이며, 이는 생체 내 접종을 위한 파지 제제에 적합한 방법입니다. 모든 파지 스톡은 식염수 마그네슘(SM) 파지 완충액에 4°C에서 보관하였다(1.1.5.1단계에서 제공된 레시피). 대장균은 LB 배지에서 배양되었습니다. 다양한 파지-박테리아 쌍에 대해, 다양한 배양 배지 및 성장 조건이 이 프로토콜로부터 적응될 수 있다. 파지는 또한 폐수, 해수, 토양 및 장 내용물과 같은 환경으로부터 공급될 수 있으며, 관심 있는 각 파지-숙주 쌍(25)에 대한 적절한 성장 및 증식 조건을 사용하여 제조 전에 Sambrook 및 Russell26에 따라 분리 및 정제할 수 있다. 대안적으로, 파지는 상업적 공급원(재료 표 참조) 또는 파지 은행에서 얻을 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험은 UBC 동물 관리 위원회 및 생물 안전 위원회가 승인한 프로토콜(A23-0113, B19-0038)에 의해 설정된 지침에 따라 수행되었습니다. 생쥐는 브리티시 컬럼비아 대학의 질병 모델링 센터(Center for Disease Modelling)에서 병원체가 없는 조건에서 수용되었습니다. C57BL/6 마우스는 멸균 마우스 식단, 물, 침구 및 둥지 재료가 제공된 멸균 플렉시블 필름 아이솔레이터에서 시설 내에서 사육되었습니다. 마우스는 12시간 주야간 주기로 유지하였다. 실험용 마우스(수컷과 암컷 모두)는 각 실험 내에서 연령이 일치되었으며, 생후 6주에서 12주 사이이고 모든 실험에서 체중은 15-30g이었습니다.
1. 마우스로의 구강 개변을 위한 파지 및 차량 용해물의 제조
- 파지 정제 및 스톡 생성
참고: 이 연구에서 T4 파지는 아래에 설명된 단일 한천 층 방법을 사용하여 박테리아 잔디밭에 도금하여 성장하고 적정됩니다. 이중 한천층 방법은 이전에 설명했습니다25,27또한 유사한 효능으로 사용할 수 있습니다. 이 프로토콜에는 단일 한천층 분석법이 선택되었는데, 이는 플라크 가시성이 향상되었기 때문입니다28.- 멸균 폴리스티렌 또는 유리 배양 튜브(캡 포함)에 담긴 멸균 LB 배지 5mL에서 대장균 을 배양합니다. 37°C에서 200rpm으로 흔들면서 고정상에 도달할 때까지 튜브를 밤새 배양합니다.
- 보충하기 전에 LB를 0.5% 한천으로 고압멸균하고 50°C 이하로 냉각하여(액체로 유지한 상태에서) 유리 배지 병에 부드러운 한천을 준비합니다. 접시당 15mL의 부드러운 한천을 충분히 준비합니다.
- 연질 한천에 MgSO4 및 CaCl2를 각각 1mM의 최종 농도로 보충합니다. 연질 한천 3mL당 하룻밤 동안 대장균 배양액 100μL를 추가합니다. 자석 교반 막대를 사용하여 부드럽게 저어 보충제와 배양액을 부드러운 한천에 균질화합니다.
참고: 연질 한천 제제에 첨가되는 대장균의 부피와 밀도의 일관성은 매우 중요합니다(대표 결과 섹션에 요약되어 있음). - 혈청학적 피펫을 사용하여 페트리 접시(직경 15cm)당 연질 한천 + 대장균 15mL를 추가합니다. 당일 사용을 위해 접시를 실온에서 굳히십시오.
알림: 접시는 뚜껑을 연 상태에서 약 20분 후에 굳습니다. 한천은 부드러움을 유지하지만 플레이트가 뒤집힐 때 이동하지 않습니다. - 소스 T4 파지의 8-10 연속 희석액을 SM 완충액에 희석하여 10의 계수로 준비합니다. 각 희석액 5μL를 플레이트에 뿌립니다. 반점을 건조시키고 뒤집어 접시를 37°C에서 밤새 배양합니다.
- 식염수 마그네슘 (SM) 파지 완충액을 제조하기 위해 1 L의 탈 이온화 된 H2O에 100 mM NaCl, 8 mM MgSO4·7H2O 및 50 mM Tris-HCl (pH 7.4)을 용해시킵니다. 오토클레이브하고 실온에서 보관하십시오.
참고 : 다음날 대장균은 부드러운 LB 한천 전체에 잔디밭으로 자랐어야합니다. 감염된 대장균 숙주의 파지 사멸이 발생한 곳에는 대장균 잔디밭에서 볼 수 있는 플라크 또는 제거된 성장 영역이 나타납니다. 각 플라크는 플라크 형성 단위(pfu)를 나타냅니다.
- 식염수 마그네슘 (SM) 파지 완충액을 제조하기 위해 1 L의 탈 이온화 된 H2O에 100 mM NaCl, 8 mM MgSO4·7H2O 및 50 mM Tris-HCl (pH 7.4)을 용해시킵니다. 오토클레이브하고 실온에서 보관하십시오.
- 멸균 피펫 팁을 플라크 중앙으로 밀어 넣어 부드러운 한천 플레이트에서 단일 플라크를 선택하고 팁 끝에 한천 플러그를 만듭니다. 플라그 플러그를 1.7mL 미세 원심분리 튜브의 SM 완충액 1mL에 다시 현탁시킵니다. 튜브를 최대 속도로 1분 동안 소용돌이쳐 혼합합니다.
- 튜브를 실온에서 4000 x g 에서 5분 동안 원심분리하여 용해물에서 이물질을 제거합니다. 상층액을 새 마이크로 원심분리기 튜브로 옮깁니다.
- 격리된 파지를 전파하려면 1.1.1-1.1.3단계를 반복합니다. 분리된 파지 100μL를 원뿔형 튜브에 있는 대장균을 함유한 연질 한천 15mL 분취액에 첨가합니다. 튜브를 세 번 뒤집어 한천을 섞고 페트리 접시에 붓습니다.
- 접시를 건조시킨 후 뒤집고 37°C에서 밤새 배양합니다. 대장균 생존력을 확인하기 위해 파지가 없는 잔디 방제 플레이트를 준비합니다.
알림: 하룻밤 배양 후 컨트롤 플레이트에는 대장균 잔디가 있어야 하고 파지 함유 플레이트는 완전히 용해되어야 합니다. - 플레이트에서 파지를 추출하려면 파지 투명화 플레이트 표면에 5mL의 SM 완충액을 추가하고 실온에서 15분 동안 로커에서 70rpm으로 흔듭니다.
- 플레이트의 버퍼를 50mL 원뿔형 원심분리 튜브에 모으고 실온에서 4000 x g 에서 5분 동안 원심분리하여 한천 플레이트에서 파편을 펠트합니다.
- T4 파지 스톡 용해물을 새 튜브에 모으고 적정 및 증식할 때까지 4°C에서 보관합니다.
주: T4 파지는 10 년간이상 안정되어 있습니다25; 그러나 안정성은 파지의 유형과 보관 조건에 따라 달라집니다. 파지 역가도 보관 시간에 따라 달라집니다. 파지는 동결에 민감합니다. 그러므로, 동결보존은 액체 질소에서 권장되며, 동결-해동 주기는 파지를 손상시켜 파지 역가를 감소시킬 수 있으므로 피하는 것이 권장된다25. - T4 파지 스톡 용해물을 역가화하여 앞서 설명한 바와 같이 pfu/mL 단위의 농도를 측정합니다 25,29,30. 높은 titer T4 파지 스톡은 108 pfu/mL 이상을 함유합니다.
- 실험용 파지 용해물의 준비
- 멸균 폴리스티렌 또는 유리 배양 튜브(캡 포함)에 있는 LB 배지 5mL의 대장균 배양. 고정상에 도달할 때까지 200rpm에서 흔들면서 37°C에서 밤새 튜브를 배양합니다.
- 유리 원뿔형 플라스크에 100mL LB 배지에서 하룻밤 동안 대장균 배양 1:50. 박테리아가 초기 및 중간 지수 단계(약 1.5시간)에 도달할 때까지 200rpm에서 흔들면서 37°C에서 배양합니다.
참고: 박테리아 배양이 기하급수적인 단계에 있는 600nm(OD600) 범위에서 광학 밀도를 결정하기 위해 초기 성장 곡선을 수행할 수 있습니다. 유리 원뿔형 튜브에서의 배양은 파지가 폴리프로필렌31과 같은 플라스틱에 부착될 수 있다는 최근의 증거가 발견됨에 따라 제안됩니다. - 1.1 단계의 고역가 T4 파지 스톡 100μL를 대장균 하위 배양에 첨가하고 37°C에서 3시간 동안 또는 새로운 용해물이 더 이상 탁하지 않을 때까지 흔들면서 배양합니다. T4 파지 용해물을 50mL 코니컬 튜브에 모으고 세척 단계로 직접 진행하거나 필요한 경우 다음 날까지 4°C에서 보관합니다.
참고: 파지 버스트 크기가 클수록(복제 주기당 방출되는 평균 바이러스 수가 더 많음을 나타냄) 1.2.2단계에서 박테리아 하위 배양을 위한 더 긴 배양 기간이 필요합니다. 이것은 파지 스톡으로 스파이크하기 전에 증가된 박테리아 밀도를 제공합니다. - 원심분리기는 실온에서 4000 x g 에서 20분 동안 용해되어 남아 있는 박테리아와 세포 파편을 펠트화합니다. 0.22μm 나일론 필터를 사용하여 생성된 상층액을 필터 멸균하고 여과액을 새로운 50mL 원뿔형 원심분리 튜브로 옮깁니다.
- 여과된 T4 파지 용해물의 각 부피에 0.1부피의 클로로포름을 추가하여 남아 있는 박테리아를 죽이고 박테리아 성장을 방지합니다. 볼텍스를 잠깐 혼합하고 실온에서 10분 동안 배양합니다.
참고: 지질 외피 파지는 클로로포름에 민감하여 파지 역가25를 감소시킬 수 있습니다. 필요한 경우 이 단계를 건너뜁니다.
주의 : 클로로포름은 흡입, 섭취 또는 피부를 통해 흡수될 때 위험한 독성 유기 용매입니다. 클로로포름으로 작업할 때는 흄 후드와 적절한 개인 보호 장비(PPE)를 사용하십시오. 클로로포름으로 작업할 때는 폴리스티렌 혈청학적 피펫 대신 유리를 사용하십시오., 대부분의 플라스틱과 호환되지 않기 때문입니다. 클로로포름은 1.2.5-1.2.6 단계에서 폴리프로필렌 원추형 원심분리기 튜브에 넣을 수 있지만 플라스틱 튜브에 장기간 보관해서는 안 됩니다. - 용해물을 실온에서 4000 x g 에서 5분 동안 원심분리하여 용해물에서 클로로포름을 분리합니다. 혈청학적 피펫을 사용하여 하부 클로로포름 층을 건드리지 않고 상단 용해물 층을 새로운 50mL 코니컬 튜브로 조심스럽게 옮깁니다. 클로로포름 폐기물은 적절한 유해 액체 폐기물 용기에 버리십시오. 용해물을 농축하고 다음 날 완충액을 교환할 때까지 4°C에서 보관합니다.
- 13mL의 파지 용해물을 장치의 상부 저장소에 추가하고 4000 x g에서 5분 동안 또는 대부분의 용해물이 필터를 통해 하부 저장소로 통과할 때까지 원심분리하여 100kDa 원심 필터 장치(재료 표 참조)에 파지 용해물을 농축합니다.
참고: 스핀 시간이 끝날 때 약 2mL의 용해물을 섭취하는 것을 목표로 합니다. 용해물을 첨가하여 필터에서 파지 농도가 증가함에 따라 탈수 시간이 증가할 수 있습니다. 원심 필터 장치에는 회전이 건조되는 것을 방지하기 위해 물리적 데드 스톱이 있습니다32. 계속 사용하려는 경우(예: 상부 저장소에서 모든 액체를 제거하여) 필터 멤브레인이 건조되지 않도록 하십시오. 스핀 시간은 파지 유형 및 역가에 따라 달라질 수 있습니다. - P200 또는 P1000 피펫을 사용하여 상부 저장소 내에서 나머지 ~2mL의 용해물을 위아래로 부드럽게 피펫팅하여 각 회전 후 필터 멤브레인의 막힘을 제거합니다. 하부 저장소의 여과액을 폐기물 용기에 버리고 농축된 파지는 상부 저장소에 남겨 둡니다.
- 파지 용해물의 전체 부피가 필터 장치를 통과할 때까지 1.2.7-1.2.8단계를 반복하고 각 회전 후 ~2mL의 농축 파지가 상부 저장소에 유지됩니다.
- 마지막 회전 후 상부 저장소에 남아 있는 용해물(~2mL)을 위아래로 피펫팅하여 필터 멤브레인의 막힘을 풉니다. 상부 저장소에 SM 완충액 12mL를 첨가하고 4000 x g 에서 10분 동안 또는 완충액의 대부분이 필터를 통과할 때까지 원심분리하여 파지를 세척합니다(완충액 교환).
- 여과액을 버리고 세척 단계(1.2.10단계)를 반복합니다. 장기 보관을 위해 SM 완충액에 남아 있는 2mL의 용해물을 최종 부피 10mL(또는 그 이하)로 재현탁시킵니다. 용해물을 50mL 원뿔형 원심분리 튜브로 옮기고 내독소가 제거될 때까지 4°C에서 보관합니다.
참고: 이 단계에서 파지 용해물이 농축되었는지 확인하고(> 108 pfu/mL) 내독소 제거 과정에서 파지 손실을 측정하기 위해 파지를 역가화하는 것은 선택 사항입니다. - 용해물의 총 부피에 0.4 부피의 1-옥탄올( 재료 표 참조)을 추가하여 T4 파지 용해물에서 오염된 내독소를 제거합니다.
참고: 내독소는 면역 자극성이 높기 때문에 제거되며, 따라서 내독소의 존재는 파지 독립적 선천성 면역 반응의 유도로 이어질 수 있다25.
주의 : 1-옥탄올은 냄새가 강한 방향족, 유기물, 가연성 화합물이며 눈에 자극을 줍니다. 1-옥탄올로 작업할 때는 적절한 PPE를 착용하십시오. 증기 흡입을 피하기 위해 흄 후드에서 모든 작업을 수행하십시오. 흄 후드 외부에서 작업할 때 튜브가 누출되는 것을 방지하기 위해 밀봉 필름을 사용하십시오. - 누출을 방지하기 위해 원추형 원심분리기 튜브의 뚜껑을 밀봉 필름으로 밀봉하십시오. 플랫폼 또는 흔들리는 셰이커에서 120rpm으로 실온에서 1시간 동안 흔든 다음 4°C에서 흔들지 않고 1.5시간 동안 배양합니다.
- 4000 x g 에서 10분 동안 원심분리하여 1-옥탄올에서 내독소가 제거된 용해물을 분리합니다. 1-옥탄올 층은 용해물 위에 떠 있습니다. P1000 피펫을 사용하여 가능한 한 많은 1-옥탄올을 조심스럽게 제거하고 적절한 위험/가연성 액체 폐기물 용기에 버립니다.
- 18G 바늘과 10mL 주사기를 사용하여 나머지 1-옥탄올 층 아래의 파지 용해물을 수집하고 1-옥탄올 층이 수집되지 않도록 주의합니다. 용해물을 4 °C에서 진공이 될 때까지 보관하십시오.
- T4 파지 용해물의 1mL 부분 표본을 멸균된 1.5mL 마이크로 원심분리 튜브로 옮깁니다. 실온에서 4000 x g 에서 뚜껑을 열고 속도 진공으로 용해물에서 잔류 1-옥탄올을 증발시킵니다. 3시간 동안 또는 파지 용해물 부피가 30% 감소할 때까지 진공 속도를 높입니다.25. 적정할 때까지 4 °C에서 보관하십시오.
- pfu/mL 단위의 농도를 측정하기 위해 파지 용해물을 역가화합니다. 생성된 T4 파지 용해물을 SM 완충액에 원하는 농도로 희석하고 역정을 재하여 확인합니다.
- 제조업체 지침에 따라 발색 내독소 정량 분석 키트를 사용하여 T4 파지 용해물에 존재하는 내독소를 정량화합니다( 재료 표 참조). 최종 파지 용해물의 내독소 수준을 내독소 제거 전 샘플, 차량 대조군, 완충액 및 마우스 식수와 비교합니다.
참고: 발색 내독소 정량 키트는 1-옥탄올25에 의해 비활성화됩니다. 내독소를 정량화하기 전에 1-옥탄올을 제거하기 위한 속도 진공 단계(단계 1.2.16)를 수행합니다. 증류수의 내독소 함량은 20 EU/mL25로 추정됩니다. 그러나 마우스 식수의 내독소 함량은 시설마다 다를 수 있습니다. 파지 용해물의 내독소 수치가 음용수에 존재하는 양을 초과하는 경우 내독소 제거 단계(1.2.12-1.2.16)를 반복하는 것이 좋습니다. - 농축된 내독소가 제거된 T4 파지 용해물을 4°C의 SM 완충액에 보관합니다.
- 차량 제어를 위한 파지가 없는 박테리아 용해물의 준비
참고: 파지가 없는 박테리아 용해물은 1.2단계에서 파지 용해물 생산 시 생성된 박테리아 오염 물질(예: 내독소)로 인한 영향을 제어하기 위한 매개체로 준비할 수 있으며, 이는 마우스에 접종할 때 실험 결과에 영향을 미칠 수 있습니다.- E. coli의 하룻밤 배양에서 E. coli를 1:50으로 100mL의 LB 배지로 하위 배양합니다. 파지를 첨가하지 않고 37°C에서 3시간 동안 흔들거나 1.2단계에서 생성된 파지 용해물의 배양 시간과 일치시키면서 박테리아를 계속 배양합니다.
- 대장균 배양을 50mL 원뿔형 튜브로 옮기고 30 초 펄스 (3x) 동안 30kHz의 얼음 위에서 초음파 발생기 프로브 (재료 표 참조)를 사용하여 세포를 용해하여 박테리아 세포를 수동으로 용해합니다.
- 모든 청소, 세척 및 내독소 제거 단계를 포함하여 1.2단계부터 시작하여 1.2단계에 따라 프로토콜의 나머지 부분을 따릅니다.
알림: 원심 필터 장치를 사용하여 농축하는 동안 차량 용해물은 파지가 없기 때문에 파지 용해물보다 필터를 더 빨리 통과합니다. 따라서 원심분리 시간을 5분에서 2-5분으로 단축하여 장기간 원심분리 중에 한외필터 멤브레인이 건조되지 않도록 합니다. - 비히클 용해물을 역가화하여 파지가 포함되어 있지 않은지 확인합니다.
- 제조업체 지침에 따라 발색 내독소 정량 분석 키트를 사용하여 차량 용해물의 내독소 수준을 측정하십시오. 파지 용해물의 내독소 수준과 일치하도록 SM 완충액에 차량 용해물을 희석합니다.
- 대체 실험 대조군: 열 불활성화 파지 용해물의 준비
참고: 파지가 없는 박테리아 용해물의 대안은 열 비활성화 파지 용해물입니다. 열 불활성화는 파지 비리온을 해리하는 반면, 지질다당류(LPS)와 같은 잔류 내독소는 열에 안정적입니다 8,33. 이 방법은 Gogokhia et al.8에 의해 면역 활성화에 온전하고 생존 가능한 파지 비리온이 필요한지 여부를 결정하는 데 사용되었습니다. 연구자들은 두 가지 방법(파지 프리 vs. 열 비활성화)을 모두 테스트하고 어떤 대조군이 실험 요구에 가장 적합한지 결정하는 것이 좋습니다. 어느 쪽을 선택하든, 파지 스톡을 농축하고 세척하는 데 필요한 상당한 조작으로 인해 완충액 제어가 적절하지 않을 수 있음을 인정하는 것이 중요합니다.- 1.2단계(마우스당 100μL)에서 세척, 정제 및 희석된 T4 파지 용해물을 필요한 양의 뚜껑 잠금 장치가 장착된 멸균 마이크로 원심분리기 튜브로 옮깁니다.
- 95°C에서 15분 동안 열 블록에 용해시킵니다16.
- 선택 사항: 파지/박테리아 핵산 제거가 필요한 경우 Jakočiūnė 및 Moodley34에 따라 DNase I 및 RNase A 처리를 수행합니다. 간단히:
- 50μL DNase I 10x 완충액, 1μL DNase I(1U/μL) 및 1μL RNase A(10mg/mL)( 재료 표 참조)를 450μL의 열 비활성화 파지 용해물에 추가합니다.
- 37°C에서 히트 블록에서 1.5시간 동안 흔들지 않고 용해물을 배양합니다.
- 20 μL 0.5 M 에틸렌디아민테트라아세트산(EDTA)34을 첨가하여 DNase I 및 RNase A를 비활성화합니다.
- 여러 튜브를 사용하는 경우 용해물을 식히고 결합하기 위해 실온에서 10분 동안 유지합니다. 적정할 때까지 4 °C에서 보관하십시오.
- 파지 역가를 수행하여 용해물에 생존 가능한 T4 파지가 존재하지 않는지 확인합니다. 열이 비활성화된 용해물을 4°C에서 보관합니다.
- 제조업체 지침에 따라 발색 내독소 정량 분석 키트를 사용하여 열 비활성화 용해물의 내독소 수준을 측정하십시오. 일치하는 파지 용해물에 존재하는 내독소 수준에 따라 SM 완충액에 열 비활성화 용해물을 희석합니다.
2. 대장균 단일집락 마우스의 T4 파지 관리 및 모니터링
- 대장균을 가진 마우스의 단일 식민지화
- 하룻밤 동안 LB 배지에서 단일 콜로니에서 채취한 E. coli를 배양하여 GF 마우스8에 투여할 E. coli를 준비합니다.
- 엄격한 무균 조건(35) 하에서, 200μL의 대장균 배양을 멸균 비닐 분리체 또는 구강 위축에 의한 생물학적 배제 밀폐 케이지에 수용된 GF 마우스에 투여한다. 공기내화성 박테리아를 사용하는 경우, 각 마우스의 등에 200μL의 박테리아 배양액을 도포하여 마우스를 집락화할 수도 있습니다.
참고: 접종 용량은 균주에 따라 다르며, 박테리아마다 다른 pH 생존 능력36,37을 보여줍니다. Zucoloto et al.35는 동물당 1 x 108 cfu로 접종할 것을 권장합니다. 여기에 나타낸 대표적인 결과는 하룻밤 배양액을 접종한 마우스로부터 생성되었다(cfu는 측정되지 않음). 파일럿 실험을 수행하여 관심 마우스 균주의 신뢰할 수 있는 집락화를 초래하는 용량을 결정할 수 있습니다. 구강에 의해 투여되는 박테리아의 양은 마우스의 연령 및 체중에 의해 영향을 받을 수 있다. 최대 허용 용량에 대해서는 개별 실험실 또는 기관 동물 윤리 프로토콜에 문의하십시오. 여기서 제안하는 부피는 마우스 체중의 10%(예: 20g 마우스의 경우 최대 200μL)의 개비지 허용치를 기준으로 합니다. 일부 박테리아 종은 위의 산성을 견디지 못하고 장에 서식하지 못합니다. 위산을 중화하기 위해 먼저 100μL의 1M NaHCO3로 개비팅하는 것을 고려한다2. 엄격한 혐기성 생물을 사용하여 식민지화하는 경우, 미생물은 혐기성 조건에서 성장해야 하며 개별적으로 준비된 밀폐 용기(각 마우스당 1개)에 담아 gnotobiotic 동물 시설로 옮겨야 합니다. 산소 노출로 인한 미생물 생존율 손실을 제한하기 위해 용기를 개봉한 후 각 gavage를 신속하게 수행합니다. - 건강에 악영향을 미치는지 쥐를 모니터링합니다.
알림: 건강에 악영향을 미치는 경우 관련 동물 보호 시설에서 정한 기준을 참조하십시오. 가능한 건강상의 악영향은 다음을 포함하되 이에 국한되지 않습니다: (1) 위액의 흡인: 증상에는 코를 통한 기포 배출, "입 벌리기" 호흡/헐떡임이 포함됩니다. (2) 식도 천공 : 증상으로는 급격한 건강 악화, 구부정함, 무기력, 24 시간 이내에 동물의 죽음으로 이어지는 것이 포함됩니다. (3) 반복되는 망원으로 인한 식도의 염증 : 증상으로는 망구 바늘을 삽입하는 데 어려움이 있습니다. (4) 마이크로바이옴의 변화로 인한 설사. - 적어도 일주일에 한 번 배양 및/또는 16S rRNA 염기서열분석35를 통해 대변 펠릿의 박테리아 집락을 확인합니다.
참고: 실험용 마우스 생산을 위해 gnotobiotic 분리체 내에서 육종가를 식민지화하는 경우 6주 된 1세대 자손(F1) 실험용 마우스의 생성을 위해 최소 9주 전에 미리 계획하십시오. 대안적으로, GF 성체 마우스는 단일집락화될 수 있다. 이러한 접근법에서, 파지 접종 전에 집락화 후 7주를 기다리는 것이 권장되는데, 이는 GF 마우스에 복잡한 미생물군을 도입한 후 장 점막이 안정화되는 데 필요한 시간이기 때문이다(38).
- E. coli monocolonized 마우스에 T4 파지의 경구 접종
- T4 파지 용해물 및 비히클 컨트롤을 SM 완충액에서 미리 결정된 농도로 희석합니다. Hsu et al.2에 따르면, 마우스당 2 x 106 pfu를 투여할 수 있도록 묽은 파지 용해물2.
참고: 생체 내 파지의 안정성에 따라 더 높거나 낮은 농도의 파지를 사용할 수 있습니다. 마우스당 2 x 102, 2 x 104 및 2 x 106 pfu의 T4 파지를 투여한 결과, 용량에 의존하지 않는 것으로 보이는 장에서 안정적이고 장기적인 집락화가 이루어졌습니다(대표 결과 섹션에 표시). 따라서 파지-박테리아 역학은 대규모 실험 전에 생체 내에서 시범 운영되어야 합니다. - 멸균된 gnotobiotic 조건에서 각 마우스에 100μL의 오토클레이브 1M NaHCO3 를 투여하여 위산을 중화합니다. 10분 동안 기다린 다음 100μL의 T4 파지 용해물 또는 차량 제어로 gavage합니다.
- 건강에 악영향을 미치는지 쥐를 모니터링합니다.
- T4 파지 용해물 및 비히클 컨트롤을 SM 완충액에서 미리 결정된 농도로 희석합니다. Hsu et al.2에 따르면, 마우스당 2 x 106 pfu를 투여할 수 있도록 묽은 파지 용해물2.
3. 생체 내 T4 파지 수준 모니터링
참고: 마우스에 파지를 접종하면 분변 또는 조직 샘플에서 파지와 표적 박테리아의 농도를 측정할 수 있습니다. 이것은 두 유기체의 파지 감염 및 집락화 역학의 역학에 대한 정보를 제공합니다.
- 분변 펠릿의 농도를 결정하기 위한 스폿 도금 T4 파지
- 각 마우스의 분변 펠릿을 멸균되고 사전 계량된 마이크로 원심분리기 튜브에 수집하여 T4 파지 및 대장균 수준을 측정합니다. 도금될 때까지 튜브를 얼음 위에 보관하십시오.
알림: 포집과 도금 사이의 중간에 샘플을 얼음 위에 놓아 내공성 박테리아의 성장을 늦춥니다. 몇 시간 동안 여전히 호기성 박테리아가 성장하거나 산소 노출로 인해 혐기성 박테리아가 일부 사멸하여 박테리아 수가 왜곡될 수 있습니다. 따라서 박테리아 및 파지 도금은 샘플 채취 후 가능한 한 빨리 수행해야 합니다. 혐기성 박테리아는 산소 노출을 용납하지 않습니다. 샘플을 보존하려면 샘플을 밀봉된 튜브에 모으고 수집 후 가능한 한 빨리 튜브를 혐기성 챔버로 옮깁니다. 분변 샘플에서 성장이 감지되지 않으면 박테리아 정량을 위해 16S rRNA qPCR과 같은 대안을 고려하십시오. - 각 튜브의 최종 무게를 기록하고 초기 튜브 무게를 빼서 샘플 무게를 계산합니다. 이것은 T4 파지 및 대장균 농도를 샘플 중량(각각 pfu/g 또는 cfu/g)으로 정규화하는 데 사용됩니다.
- 멸균 SM 완충액 1mL를 각 튜브에 추가하고 최대 속도(>1분)로 완전히 와류시켜 분변 펠릿을 균질화합니다. 샘플이 15mg 미만인 경우 더 작은 부피의 SM 버퍼를 추가할 수 있습니다. 샘플의 cfu/g 또는 pfu/g를 계산하기 위해 각 샘플에 추가된 SM 버퍼의 부피를 기록합니다.
- 180 μL SM 완충액에 각 샘플의 20 μL를 10의 계수로 8 (또는 예상 파지 농도에 따라 그 이상) 연속 희석액을 준비합니다. 첫 번째 튜브/웰에 추가하기 전에 균질화된 각 샘플을 잠시 와류하여 혼합합니다. 피펫은 각 첨가 사이에 혼합하고 각 희석 사이에 팁을 교체하여 샘플 캐리오버를 통해 파지 또는 박테리아 수가 부풀어 오르는 것을 방지합니다.
참고: 샘플에 존재하는 섬유와 파편이 피펫팅을 방해하는 경우 분변 슬러리에 추가 버퍼를 추가하여 스톡 샘플을 더 희석하십시오. - E. coli(파지 플라크 분석용) 또는 LB 한천 플레이트(박테리아 콜로니 분석용)가 포함된 LB 연질 한천 플레이트에 각 희석액 5μL를 주입하여 각 샘플의 T4 파지 및 대장균 농도를 측정합니다. 정확도를 위해 각 샘플을 세 번 찾습니다.
참고: 96웰 플레이트에서 연속 희석액을 준비하는 경우 8채널 P20 멀티채널 피펫을 사용하여 연속 희석된 샘플의 각 컬럼을 플레이트에 피펫팅할 수 있습니다. 가장 희석된 것에서 가장 농축된 것으로 이동하더라도, 파지가 피펫 팁의 벽에 부착되어 각각의 새로운 웰에 첨가되는 파지의 양을 변경할 수 있기 때문에, 각 희석 사이에 팁을 변경한다31. - 플레이트를 뒤집어 인큐베이터에 넣기 전에 각 부분을 건조시키십시오. 37 °C에서 밤새 배양합니다.
- 각 샘플에 대해 스폿당 3-30개의 가산 플라크가 있는 희석액을 선택합니다. 그 자리에 있는 플라크의 수와 사용된 희석액을 계산하고 기록합니다.
- 플라크의 수를 각 지점에 도금된 부피로 나누어 샘플의 pfu/g을 계산하여 pfu/μL를 제공합니다. 여기에 희석 계수와 각 샘플에 추가된 SM 버퍼의 부피를 곱하여 pfu/샘플을 제공합니다. 마지막으로 샘플 중량으로 나누어 pfu/g30을 제공합니다.

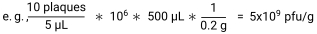
- 각 마우스의 분변 펠릿을 멸균되고 사전 계량된 마이크로 원심분리기 튜브에 수집하여 T4 파지 및 대장균 수준을 측정합니다. 도금될 때까지 튜브를 얼음 위에 보관하십시오.
- 실험 종점에서 조직 샘플링
- 선택한 각 시점에 승인된 기관 동물 윤리 프로토콜에 따라 마우스를 안락사시키고 분장 내용물, 소장 및 대장 내용물, 관심 조직을 멸균되고 미리 계량된 2mL 둥근 바닥 마이크로 원심분리기 튜브에 수집합니다.
- 샘플 무게를 계산하기 위해 각 튜브의 최종 무게를 기록합니다. 티슈와 세칼 내용물은 당일 플레이팅될 때까지 얼음에 보관합니다.
- 멸균 SM 완충액을 각 튜브에 추가하고 추가된 부피를 기록합니다.
- 세칼 및 장 내용물의 경우 와류는 3.1.3단계에 따라 >1분 동안 철저히 샘플링합니다.
- 조직 샘플의 경우 각 튜브에 하나의 멸균 금속 비드를 추가합니다. 조직 용해기( 재료 표 참조)를 사용하여 20Hz에서 5분 동안 또는 조직이 해리되고 현탁액이 균질해질 때까지 조직을 균질화합니다.
참고: 샘플이 잘 균질화되지 않으면 첨가되는 SM 버퍼의 부피를 늘리거나, 균질화 시간을 늘리거나, 균질화 주파수를 30Hz로 늘리는 것이 좋습니다. 조직 균질화기는 또한 박테리아 및 파지 회수를 허용하면서 조직을 해리시키는 데 사용될 수 있습니다39,40. 균질화기는 조직 용해기보다 더 높은 주파수에서 작동하면서 박테리아 무결성을 유지합니다. - 단계 3.1.4-3.1.841에 설명된 대로 각 샘플의 E. coli 및 T4 파지 농도를 결정하기 위해 각 샘플의 연속 희석액을 10의 계수로 준비하고 스폿 도금을 수행합니다.
Access restricted. Please log in or start a trial to view this content.
결과
쥐 장에서 T4 파지/대장균 다이아드 사이의 상호작용을 조사하기 위해 T4 파지와 차량 용해물을 준비, 세척 및 정제했습니다(그림 1A). T4 파지 용해물을 플라크 분석으로 적정하고 SM 완충액에서 2 x 107 pfu/mL(2 x 106 pfu/mouse)로 희석했습니다. 또한 비히클 용해물을 역정하여 생존 가능한 파지 존재가 없음을 확인하고 T4 파지 용해물과 동일한 부피의 SM 완충?...
Access restricted. Please log in or start a trial to view this content.
토론
마이크로바이옴의 파지 연구는 박테리아 파지에 비해 상당한 도전 과제를 제시합니다. 특히, 파지는 원핵생물 및 진핵생물 종의 시퀀싱 및 식별을 용이하게 하는 16S 및 18S 리보솜 소단위체와 유사한 모든 파지에 공통적인 보존된 계통발생학적 마커를 각각 포함하지 않는다(42). 그러나 판독 길이, 처리량 증가 및 비용 절감을 포함한 차세대 염기서열 분석 접근법의 발전으로 박테...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 것이 없습니다.
감사의 말
저자들은 이 연구를 수행한 땅이 xwməθkwəy̓əm(Musqueam) 국가의 전통적이고 조상적이며 미개척된 영토임을 인정합니다. 그것이 위치한 땅은 수천 년 동안 이 사이트에서 한 세대에서 다음 세대로 문화, 역사 및 전통을 전해 온 Musqueam 사람들에게 항상 배움의 장소였습니다. 우리는 다른 사람들이 https://native-land.ca 에서 살고 일하는 고향에 대해 더 많이 배우도록 권장합니다. 저자는 캐나다 자연 과학 및 공학 위원회(NSERC) 캐나다 대학원 장학금 - 석사(NP), Michael Smith Health Research BC 연수생 상(RT-2023-3174, MH), 캐나다 자연 과학 및 공학 연구 위원회(NSERC) 디스커버리 보조금 프로그램(RGPIN-2019-04591 to C.T., RGPIN-2016-04282 to LCO), Canadian Institute for Advanced Research/Humans and the Microbiome(FL-001253 Appt 3362, C.T.), Michael Smith Foundation for Health Research Scholar Award(18239, C.T.), Canadian Institutes for Health Research(PJT-159458 to LCO) 및 Canadian Foundation for Innovation(34673 to LCO 및 38277 to CT)을 수상했습니다. UBC GREx Biological Resilience Initiative의 지원을 받는 UBC Center for Disease Modelling 및 ubcFLOW의 기술 지원과 원고에 대한 비판적 토론과 평가를 위해 Osborne 및 Tropini 연구소 구성원에게 감사드립니다. 그림 1A 와 그림 2A 는 Biorender.com 를 사용하여 생성되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1-octanol (99%) | Thermofisher | CAAAA15977-AP | |
| 50 ml PES Steriflip Sterile Disposable Vacuum Filter Units | Millipore Sigma | SCGP00525 | |
| Agarose (Low-EEO/Multi-Purpose/Molecular Biology Grade) | Fisher BioReagents | BP160-500 | |
| Amicon® 100kDa Ultra-15 centrifugal filter device, Ultracel-100 | Millipore Sigma | UFC910008 | |
| BD Microtainer® Tubes, SST | BD Medical | 365967 | |
| Bioexclusion airtight cages (ISO cages) | Techiplast | 1245ISOCAGE | |
| C1000 Touch™ Thermal Cycler with 96-Well Fast Reaction Module | BioRad | 1851196 | |
| Calcium Chloride Dihydrate (White Crystals to Powder) | Fisher BioReagents | BP510-500 | |
| Cap Locks For 1.5ML Tube 100/pk | Andwin Scientific | 16812612 | |
| Chloroform (Ethanol as Preservative/Certified ACS) | Fisher | C298-500 | |
| Copper coated steel beads (4.5 mm) | Crosman Corporation | 0767 | |
| DNeasy Blood & Tissue Kit (50) | Thermo Scientific | 69504 | |
| DreamTaq Green PCR Master Mix (2X) | Thermo Scientific | K1081 | |
| Ethylenediaminetetraacetic acid (EDTA) disodium salt solution, for molecular biology, 0.5 M in H2O | Sigma Aldrich | E7889 | |
| Fisher BioReagents™ Agar, Powder / Flakes, Fisher BioReagents™ | Fisher Bioreagents | BP1423-500 | |
| Fisher BioReagents™ Microbiology Media: LB Broth (Powder) - Lennox | Fisher Bioreagents | BP1427-500 | |
| GeneRuler 100 bp DNA Ladder | Thermo Scientific | SM0241 | |
| Green FastMix® qPCR mix, 1250 rxns | QuantaBio | 95072-012 | |
| HEPA filters for isocage lids, AUTOCLAVABLE H14 FILTERS FOR ISO LINE- IRRADIATED | Techiplast | UISOHEPAXTBOX-300 | |
| Magnesium sulfate heptahydrate | Fisher BioReagents | BP213-1 | |
| MaxQ 6000 Incubated Shaker | Thermo Scientific | 8354-30-0009 | |
| Microbiology Media: LB Broth (Powder) - Lennox | Fisher BioReagents | BP1427-500 | |
| Microcentrifuge Tubes with Locking Snap Cap, 2ml | Fisher | 14-666-315 | |
| Parafilm sealing film | Bemis | PM-996 | |
| Phage stocks | Carolina Biological Supply | n/a | |
| PicoLab® Mouse Diet 20 EXT | LabDiet | 5R58 | |
| Pierce™ Chromogenic Endotoxin Quant Kit | Thermo Scientific | A39552S | |
| RNase A (17,500 U) | Qiagen | 19101 | |
| RNase-free DNase Set | Qiagen | 79254 | |
| Sodium Bicarbonate (Fine White Powder) | Fisher Chemical | BP328-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Chemical | S271 | |
| Sonicator (probe model CL-18; power source model FB50) | Fisher scentific | n/a | |
| Sterile flexible film isolator | Class Biologically Clean | n/a | |
| SYBR™ Safe DNA Gel Stain | Invitrogen | S33102 | |
| T100 Thermal Cycler | BioRad | 1861096 | |
| T4 phage primer, forward (CCACACATAGCGCGAGTATAA) | IDT | n/a | |
| T4 phage primer, forward (GAAACTCGGTCAGGCTATCAA) | IDT | n/a | |
| TissueLyser II | Qiagen | 85300 | |
| Tris-HCl, 1M Solution, pH 8.0, Molecular Biology Grade, Ultrapure | Thermo Scientific | AAJ22638AE | |
| Water, (DNASE, RNASE free) | Fisher BioReagents | BP2484100 |
참고문헌
- Rohwer, F., Segall, A. M. A century of phage lessons. Nature. 528 (7580), 46-47 (2015).
- Hsu, B. B., et al. Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model. Cell Host & Microbe. 25 (6), 803-814.e5 (2019).
- Gordillo Altamirano, F. L., Barr, J. J. Phage Therapy in the postantibiotic era. Clinical Microbiology Reviews. 32 (2), (2019).
- Schooley, R. T., et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Ott, S. J., et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152 (4), 799-811.e7 (2017).
- Zuo, T., et al. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 67 (4), 634-643 (2018).
- Norman, J. M., et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 160 (3), 447-460 (2015).
- Gogokhia, L., et al. Expansion of bacteriophages is linked to aggravated intestinal inflammation and colitis. Cell Host & Microbe. 25 (2), 285-299.e8 (2019).
- Brunse, A., et al. Fecal filtrate transplantation protects against necrotizing enterocolitis. The ISME Journal. 16 (3), 686-694 (2022).
- Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. M., Hooper, L. V. A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17621-17626 (2012).
- Barr, J. J., et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proceedings of the National Academy of Sciences of the United States of America. 110 (26), 10771-10776 (2013).
- Nguyen, S., et al. Bacteriophage Transcytosis provides a mechanism to cross epithelial cell layers. mBio. 8 (6), (2017).
- Bichet, M. C., et al. Bacteriophage uptake by mammalian cell layers represents a potential sink that may impact phage therapy. iScience. 24 (4), 102287(2021).
- Buttimer, C., et al. Impact of a phage cocktail targeting Escherichia coli and Enterococcus faecalis as members of a gut bacterial consortium in vitro and in vivo. Frontiers in Microbiology. 13, 936083(2022).
- Li, Y., et al. Bacteriophages allow selective depletion of gut bacteria to produce a targeted-bacterium-depleted mouse model. Cell Reports Methods. 2 (11), 100324(2022).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20236-20241 (2013).
- Federici, S., et al. Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 185 (16), 2879-2898.e4 (2022).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science (New York, N.Y.). 363 (6434), (2019).
- Fluckiger, A., et al. Cross-reactivity between tumor MHC class I-restricted antigens and an enterococcal bacteriophage. Science (New York, N.Y.). 369 (6506), 936-942 (2020).
- Majewska, J., et al. Induction of Phage-Specific Antibodies by Two Therapeutic Staphylococcal Bacteriophages Administered per os. Frontiers in Immunology. 10, 2607(2019).
- Weiss, M., et al. In vivo replication of T4 and T7 bacteriophages in germ-free mice colonized with Escherichia coli. Virology. 393 (1), 16-23 (2009).
- Thomson, C. A., Morgan, S. C., Ohland, C., McCoy, K. D. From germ-free to wild: modulating microbiome complexity to understand mucosal immunology. Mucosal Immunology. 15 (6), 1085-1094 (2022).
- Al-Asmakh, M., Zadjali, F. Use of germ-free animal models in microbiota-related research. Journal of Microbiology and Biotechnology. 25 (10), 1583-1588 (2015).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Bonilla, N., et al. Phage on tap-a quick and efficient protocol for the preparation of bacteriophage laboratory stocks. PeerJ. 4, e2261(2016).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. 1, Cold Spring Harbor Laboratory Press. New York, NY. (2001).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology (Clifton, N.J). 501, 69-76 (2009).
- Manikantha, B., Karthika, R., Murugadas, V., Vishnuvinayagam, S., Rao, B. M. Comparison of the single agar and double agar layer methods for enumeration of bacteriophages. Fishery Technology. 59, 60-63 (2022).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, e3064(2012).
- Louten, J. Chapter 7 - Detection and diagnosis of viral infections. Essential Human Virology. , 111-132 (2016).
- Richter, Ł, et al. Adsorption of bacteriophages on polypropylene labware affects the reproducibility of phage research. Scientific Reports. 11 (1), 7387(2021).
- Merck KGaA. Amicon Ultra-15 Centrifugal Filter Devices. , Darmstadt, Germany. https://www.emdmillipore.com/CA/en/product/Amicon-Ultra-15-Centrifugal-Filter-Unit,MM_NF-UFC901024#documentation (2018).
- Hecker, W., Witthauer, D., Staerk, A. Validation of dry heat inactivation of bacterial endotoxins. PDA Journal of Pharmaceutical Science and Technology. 48 (4), 197-204 (1994).
- Jakočiūnė, D., Moodley, A. A Rapid bacteriophage DNA extraction method. Methods and Protocols. 1 (3), 27(2018).
- Zucoloto, A. Z., Yu, I. L., McCoy, K. D., McDonald, B. Generation, maintenance, and monitoring of gnotobiotic mice. STAR Protocols. 2 (2), 100536(2021).
- Ng, K. M., et al. Single-strain behavior predicts responses to environmental pH and osmolality in the gut microbiota. mBio. 14 (4), e0075323(2023).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nature Reviews. Microbiology. , (2023).
- Bergstrom, K., Xia, L. The barrier and beyond: Roles of intestinal mucus and mucin-type O-glycosylation in resistance and tolerance defense strategies guiding host-microbe symbiosis. Gut Microbes. 14 (1), 2052699(2022).
- Askar, M., Ashraf, W., Scammell, B., Bayston, R. Comparison of different human tissue processing methods for maximization of bacterial recovery. European Journal of Clinical Microbiology & Infectious Diseases. 38 (1), 149-155 (2019).
- Redanz, S., Podbielski, A., Warnke, P. Improved microbiological diagnostic due to utilization of a high-throughput homogenizer for routine tissue processing. Diagnostic Microbiology and Infectious Disease. 82 (3), 189-193 (2015).
- Bhinder, G., et al. The Citrobacter rodentium mouse model: studying pathogen and host contributions to infectious colitis. Journal of Visualized Experiments. 72, e50222(2013).
- Reyes, A., Semenkovich, N. P., Whiteson, K., Rohwer, F., Gordon, J. I. Going viral: next-generation sequencing applied to phage populations in the human gut. Nature Reviews Microbiology. 10 (9), 607-617 (2012).
- Camarillo-Guerrero, L. F., Almeida, A., Rangel-Pineros, G., Finn, R. D., Lawley, T. D. Massive expansion of human gut bacteriophage diversity. Cell. 184 (4), 1098-1109.e9 (2021).
- Reyes, A., et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466 (7304), 334-338 (2010).
- Bach, M. S., et al. Filamentous bacteriophage delays healing of Pseudomonas-infected wounds. Cell Reports. Medicine. 3 (6), 100656(2022).
- Filyk, H. A., Osborne, L. C. The multibiome: The intestinal ecosystem's influence on immune homeostasis, health, and disease. EBioMedicine. 13, 46-54 (2016).
- Rohwer, F., Merry, Y., Maughan, H., Hisakawa, N. Heather Life in Our Phage World: A Centennial Field Guide to the Earth's Most Diverse Inhabitants. Wholon. , San Diego. (2014).
- Glonti, T., Pirnay, J. P. In Vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 14 (7), 1490(2022).
- Fraser, J. S., Yu, Z., Maxwell, K. L., Davidson, A. R. Ig-like domains on bacteriophages: a tale of promiscuity and deceit. Journal of Molecular Biology. 359 (2), 496-507 (2006).
- Li, H., et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications. 6, 8292(2015).
- Bergström, A., et al. Nature of bacterial colonization influences transcription of mucin genes in mice during the first week of life. BMC Research Notes. 5, 402(2012).
- Adams, M. H. Bacteriophages. , Interscience Publishers. https://books.google.co.uk/books?id=3wVrAAAAMAAJ (1959).
- Kutter, E., Sulakvelidze, A. Bacteriophages: Biology and Applications. , CRC Press. https://books.google.co.uk/books?id=flHOvAEACAAJ (2004).
- Bao, H., et al. Dysbiosis and intestinal inflammation caused by Salmonella Typhimurium in mice can be alleviated by preadministration of a lytic phage. Microbiological Research. 260, 127020(2022).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유