Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
T4-Bakteriophagen- und E. coli-Interaktion im murinen Darm: Ein prototypisches Modell zur Untersuchung der Wirt-Bakteriophagen-Dynamik in vivo
In diesem Artikel
Zusammenfassung
Bakteriophagen (Phagen), Viren, die Bakterien infizieren, sind ein integraler Bestandteil des Darmmikrobioms. Obwohl diese symbiotischen Bewohner die bakterielle Fitness und Populationsdynamik vorantreiben, ist wenig darüber bekannt, wie sie sich auf die Darmhomöostase und -krankheit auswirken. Dieses Protokoll untersucht isolierte T4-Phagen in einem Mausmodell, die an andere Phagen-Bakterien-Paare angepasst werden können.
Zusammenfassung
Bakteriophagen (Phagen) sind Viren, die Bakterien mit Spezies- und Stammspezifität infizieren und die am häufigsten vorkommenden biologischen Einheiten in allen bekannten Ökosystemen sind. Innerhalb von Bakteriengemeinschaften, wie sie in der Darmmikrobiota vorkommen, sind Phagen an der Regulierung der Populationsdynamik der Mikrobiota und der Förderung der bakteriellen Evolution beteiligt. In den letzten zehn Jahren ist das Interesse an der Phagenforschung wieder gestiegen, zum Teil aufgrund der wirtsspezifischen Abtötungsfähigkeiten lytischer Phagen, die ein vielversprechendes Instrument bieten, um der zunehmenden Bedrohung durch antibiotikaresistente Bakterien entgegenzuwirken. Darüber hinaus deuten neuere Studien, die zeigen, dass Phagen am Darmschleim haften, darauf hin, dass sie eine schützende Rolle bei der Verhinderung des bakteriellen Eindringens in das darunter liegende Epithel spielen könnten. Wichtig ist, dass gestörte Phageome wie bakterielle Mikrobiome mit verschlechterten Ergebnissen bei Krankheiten wie entzündlichen Darmerkrankungen in Verbindung gebracht wurden. Frühere Studien haben gezeigt, dass Phagen das Mikrobiom von Tieren und Menschen durch Stuhlfiltrattransplantationen modulieren können, was der Gesundheit des Wirts zugute kommt. Mit dieser jüngsten Forschungswelle geht die Notwendigkeit einher, Protokolle für die Untersuchung von Phagen im Kontext des Darmmikrobioms zu erstellen und zu standardisieren. Dieses Protokoll bietet eine Reihe von Verfahren zur Untersuchung isolierter T4-Phagen und ihres bakteriellen Wirts, Escherichia coli, im Kontext des murinen Magen-Darm-Trakts. Die hier beschriebenen Methoden beschreiben, wie man von einem Phagenlysat ausgeht, es Mäusen verabreicht und die Auswirkungen auf bakterielle Wirts- und Phagenspiegel bewertet. Dieses Protokoll kann modifiziert und auf andere Phagen-Bakterien-Paare angewendet werden und bietet einen Ausgangspunkt für die Untersuchung der Wirt-Phagen-Dynamik in vivo.
Einleitung
Bakteriophagen oder Phagen sind Viren, die Bakterien mit Spezies- und Stammspezifität infizieren und abtöten1. Phagen spielen eine wichtige Rolle in komplexen Bakteriengemeinschaften wie der Darmmikrobiota, wo sie an der Regulierung der Populationsdynamik und der Förderung der bakteriellen Fitness beteiligt sind2. In den letzten zehn Jahren ist das Interesse an der Phagenforschung aufgrund des Aufkommens antimikrobiell resistenter Krankheitserreger3 und des Potenzials der Phagentherapie als alternative Behandlungsstrategie wieder gestiegen. In den letzten Jahren wurden lytische Phagencocktails mit einigem Erfolg bei schweren, antibiotikaresistenten bakteriellen septischen Infektionen beim Menschen intravenös eingesetzt 3,4. Die orale Phagentherapie wurde auch als potenzielle Alternative zu Antibiotika zur Behandlung von Darminfektionen und Entzündungen vorgeschlagen. Darüber hinaus wurden Phagen mit dem Erfolg von fäkalen Filtrattransplantationen (FFT) in Verbindung gebracht, bei denen es sich um fäkale Mikrobiota-Präparate handelt, die gefiltert wurden, um Bakterien zu entfernen, bei der Behandlung von rezidivierenden Clostridioides difficile-Infektionen (rCDI)5,6, entzündlichen Darmerkrankungen (IBD)7,8 und nekrotisierender Enterokolitis bei Frühgeborenen9. Angesichts dieser Ergebnisse ist es wichtig, Wechselwirkungen sowohl zwischen Phagen und der Darmmikrobiota als auch zwischen Phagen und dem Säugetierwirt zu berücksichtigen, da die Hinzufügung neuer Phagen in eine bereits bestehende Gemeinschaft indirekte Auswirkungen auf die Gemeinschaft als Ganzes und nicht nur auf ihre Zielbakterien haben kann 2,10.
Die Untersuchung von Phageninteraktionen mit ihren Zielbakterien in vitro hat sich als nützlich erwiesen, um die Mechanismen und Auswirkungen von Phagen- und Bakterieninteraktionen im Darm zu verstehen. In diesem Setting wurde gezeigt, dass Escherichia coli-spezifische T4-Phagen der Ordnung Caudovirales Immunglobulin (Ig)-ähnliche Domänen benötigen, die sich in hochantigenen äußeren Kapsidproteinen (Hoc) auf der Virionoberfläche befinden, um am Darmschleimzu haften 11. Darüber hinaus haben Transwell-Assays gezeigt, dass T4-Phagen in der Lage sind, mit Epithelzellkulturen zu interagieren und durch Makropinozytose durch Zellschichten zu translozieren12,13. Diese Ergebnisse stützen die Hypothese, dass Phagen mit ihrem metazoischen Wirt interagieren können, obwohl sie nicht in der Lage sind, eukaryotische Zellen zu infizieren. Diese Modelle sind zwar nützlich, aber es fehlt ihnen die gesamte Bandbreite komplexer Interaktionen, die in einem Darmökosystem auftreten und für eine umfassende Untersuchung der dreigliedrigen Interaktion zwischen Phagen, Bakterien und dem Metazoenwirt erforderlich sind.
Mausmodelle sind ein wichtiges Werkzeug, um Phagen in komplexen Umgebungen zu untersuchen. Eine wünschenswerte Anwendung der Phagenverabreichung ist eine alternative Strategie zur Behandlung von antibiotikaresistenten Infektionen oder Pathobionten, die mit chronischen entzündlichen Erkrankungen, einschließlich CED, assoziiert sind. Neue Literatur deutet jedoch darauf hin, dass das Verhalten von Phagen in vitro die Funktionen in vivo nicht vollständig abbildet. Buttimer et al.14 zeigten, dass ein Phagencocktail in der Lage war, die Zielbakterien in einem vereinfachten menschlichen Mikrobiota-Konsortium in vitro zu depletieren, aber nicht in vivo in gnotobiotischen Mäusen repliziert werden konnte, die mit demselben Bakterien-Phagen-Konsortium besiedelt waren. Darüber hinaus führte der T7-Phage in einem konventionellen Mausmikrobiom zu einer selektiven Erschöpfung seiner Zieldarmbakterien, obwohl im Laufe der Zeit eine allmähliche Erholung beobachtet wurde, was auf eine entwickelte Resistenz hinweist15. Andere Studien haben die Koexistenz von oral verabreichten Phagen und ihren Zielbakterienstämmen in vivo nachgewiesen 2,16. Tatsächlich führte die Phagenverabreichung über die Koexistenz von Phagen und Bakterien hinaus zu weitreichenden Veränderungen in der Gesamtzusammensetzung und -funktion der Mikrobiota-Gemeinschaft 2,16. Dies ist für Krankheitssituationen relevant, da mehrere Studien Assoziationen zwischen einer erhöhten relativen Abundanz von Caudovirales und IBD gefunden haben 7,8,17, die unabhängig von Veränderungen der bakteriellen Abundanz waren7. Es ist nicht bekannt, ob dies ein Treiber oder eine Folge der Krankheitspathogenese ist.
Der historische Schwerpunkt der Phagenforschung lag auf der Beziehung zwischen einem Phagen und seinem Zielbakterium. Es ist jedoch auch wichtig, mögliche Wechselwirkungen zwischen Phagen und der Schleimhaut, dem Epithel und dem Immunsystem des Metazoenwirts zu berücksichtigen. Diese Wechselwirkungen spielen alle eine wichtige Rolle bei der Gesamtreaktion auf Darmphageninfektionen. Um dies zu demonstrieren, wurden Phagen mit keimfreien (GF) Mäusen untersucht, um ihre Auswirkungen auf das Immunsystem ohne Eingriffe der Mikrobiota aufzuklären8. In diesem System wurden Phagen-Nukleinsäuren durch Toll-like-Rezeptoren (TLRs) nachgewiesen, die sich in Endosomen phagozytärer Immunzellen (Makrophagen und dendritische Zellen) befinden. Dies aktivierte die nachgeschaltete Signalübertragung und stimulierte die T-Zell-abhängige Produktion von Interferon (IFN)-γ8 oder Typ I IFNs18. Darüber hinaus implizierten Flückiger et al.19 Gedächtnis-CD8+ T-Zellen bei der Erkennung von Phagen-kodierten (Prophagen-) Antigenen, was zu einer T-Zell-Kreuzreaktivität mit Tumorantigenen führte, was zu einer verringerten Tumorlast führte. Schließlich wurde die Phagen-spezifische Antikörperproduktion in Mausstudien dokumentiert, in denen Phagen kontinuierlich über Trinkwasser 8,20 oder durch wiederholte orale Sonde über mehrere Monate hinweg an Tiermodelle abgegeben wurden20, was die Fähigkeit von Phagenproteinen zur Förderung humoraler Immunantworten zeigt. Obwohl diese Arten der Phageninokulation eine optimale und kontinuierliche Vorbereitung des Immunsystems ermöglichen, repräsentieren sie möglicherweise nicht die natürlich vorkommenden Wechselwirkungen zwischen Phagen und der Darmumgebung oder die Kinetik der oral angewendeten Phagentherapie. Bisher hat eine begrenzte Anzahl von Studien die Interaktionen von Phagen mit einer einzigen Bakterienart in monokolonisierten Mausmodellen untersucht21. Monokolonisierte Mäuse erwiesen sich jedoch als entscheidend für die Entschlüsselung mikrobenspezifischer Effekte einzelner Spezies auf den Magen-Darm-Trakt und die Immunentwicklung 22,23,24, und sie könnten sich noch als nützlich erweisen, um dreigliedrige Interaktionen zwischen Phagen, ihren Zielbakterien und dem Metazoenwirt zu verstehen.
Spannenderweise gibt es noch viel über die Wechselwirkungen zwischen Darmphagen und Darmkommensalbakterien sowie über die Wechselwirkungen zwischen dem Metazoen-Wirt und den darin befindlichen Phagen zu lernen. Dieses Protokoll bietet eine Reihe von Verfahren zur Untersuchung von isolierten T4-Phagen und seinem bakteriellen Gegenstück, E. coli (K-12, BW25113), unter Verwendung eines gnotobiotischen Mausmodells. Diese standardisierten Verfahren bieten auch eine Grundlage für die Optimierung anderer Phagen/Bakterien-Dyaden, indem die Wachstumsparameter an die interessierenden Paare angepasst werden. Die hier beschriebenen Methoden skizzieren: (1) Herstellung von T4-Phagen- und Vehikellysaten für orale Sonden von Mäusen; (2) Orale Verabreichung von T4-Phagen an monokolonisierte gnotobiotische Mäuse von E. coli ; (3) Überwachung der T4-Phagenspiegel in Mäusekot und -gewebe im Laufe der Zeit.
Für die hier vorgestellten repräsentativen Ergebnisse wurden gereinigte T4-Phagenlysate aus Phagenbankbeständen des Rohwer Lab vermehrt. Die Phagen-on-Tap-Methode zur Vermehrung von T4-Phagen wurde angepasst25, wie in diesem Protokoll referenziert. Die Methode liefert innerhalb von drei Tagen Phagenbestände mit hohem Titer und niedrigem Endotoxingehalt. Mit diesem Ansatz wurden routinemäßig 10 ml ≥ 1010 plaquebildende Einheiten (pfu)/ml T4-Phagen mit < 0,5 Endotoxineinheiten (EU)/ml gesammelt. Die empfohlenen Endotoxingehalte für die orale oder intravenöse Verabreichung an Mäuse liegen bei ≤ 20 EU/ml bzw. ≤ 5 EU/kg/h (bzw. 0,1 EU über 1 h für eine 20-g-Maus), was dies zu einer geeigneten Methode der Phagenpräparation für die In-vivo-Inokulation macht. Alle Phagenbestände wurden bei 4 °C in salzhaltigem Magnesium (SM)-Phagenpuffer gelagert (Rezeptur in Schritt 1.1.5.1). E. coli wurde in LB-Medien kultiviert. Für verschiedene Phagen-Bakterien-Paare können verschiedene Nährmedien und Wachstumsbedingungen aus diesem Protokoll angepasst werden. Phagen können auch aus der Umwelt wie Abwasser, Meerwasser, Boden und Darminhalt stammen und können gemäß Sambrook und Russell26 vor der Herstellung unter den geeigneten Wachstums- und Vermehrungsbedingungen für jedes Phagen-Wirt-Paarvon Interesse 25 isoliert und gereinigt werden. Alternativ können Phagen aus kommerziellen Quellen (siehe Materialtabelle) oder aus Phagenbanken bezogen werden.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Experimente wurden in Übereinstimmung mit den Richtlinien des UBC Animal Care Committee und den vom Biosafety Committee genehmigten Protokollen (A23-0113, B19-0038) durchgeführt. Mäuse wurden an der University of British Columbia unter pathogenfreien Bedingungen im Center for Disease Modelling untergebracht. C57BL/6-Mäuse wurden innerhalb der Anlage in einem sterilen, flexiblen Filmisolator gezüchtet, der mit steriler Mausnahrung, Wasser, Einstreu und Nistmaterial versorgt wurde. Die Mäuse wurden in einem 12-stündigen Tag-Nacht-Zyklus gehalten. Experimentelle Mäuse, sowohl männliche als auch weibliche, waren in jedem Experiment altersgleich, zwischen 6 und 12 Wochen alt und wogen für alle Experimente 15-30 g.
1. Herstellung von Phagen- und Vehikellysaten für die orale Sonde bei Mäusen
- Phagenreinigung und Stammerzeugung
HINWEIS: In dieser Studie werden T4-Phagen gezüchtet und getitert, indem sie mit der unten beschriebenen Einzelagarschichtmethode auf einen Bakterienrasen aufgebracht werden. Die Doppel-Agar-Schicht-Methode wurde bereits beschrieben25,27und kann auch mit ähnlicher Wirksamkeit verwendet werden. Für dieses Protokoll wurde die Einzel-Agar-Schicht-Methode ausgewählt, da sie eine verbesserte Sichtbarkeit der Plaques bietet28.- Züchten Sie E. coli in 5 ml sterilem LB-Medium in sterilen Polystyrol- oder Glaskulturröhrchen (mit Kappen). Die Röhrchen werden bei 37 °C unter Schütteln bei 200 U/min über Nacht inkubiert, bis die stationäre Phase erreicht ist.
- Bereiten Sie weichen Agar in einer Glasmedienflasche vor, indem Sie LB mit 0,5% Agar autoklavieren und vor der Supplementierung auf 50 °C oder darunter abkühlen (während es flüssig bleibt). Bereiten Sie genügend weichen Agar für 15 ml pro Platte vor.
- Ergänzen Sie Weichagar mit MgSO4 und CaCl2 bis zu einer Endkonzentration von jeweils 1 mM. Fügen Sie 100 μl E. coli-Kultur über Nacht pro 3 ml Weichagar hinzu. Rühren Sie vorsichtig mit einem magnetischen Rührstab um, um die Nahrungsergänzungsmittel und die Kultur im weichen Agar zu homogenisieren.
HINWEIS: Die Konsistenz des Volumens und der Dichte von E. coli , die der Weichagarzubereitung zugesetzt werden , ist entscheidend (siehe Abschnitt "Repräsentative Ergebnisse"). - Fügen Sie 15 ml Weichagar + E. coli pro Petrischale (15 cm Durchmesser) mit einer serologischen Pipette hinzu. Lassen Sie die Platten bei Raumtemperatur für den Gebrauch am selben Tag aushärten.
HINWEIS: Die Teller werden bei geöffneten Deckeln in ca. 20 Minuten aushärten. Der Agar bleibt weich, verschiebt sich aber nicht, wenn die Platten umgedreht werden. - Bereiten Sie 8-10 serielle Verdünnungen des Quell-T4-Phagen im Faktor 10 vor, indem Sie ihn in SM-Puffer verdünnen. 5 μl jeder Verdünnung auf Platten auftragen. Lassen Sie die Platten über Nacht bei 37 °C trocknen, umdrehen und inkubieren.
- Zur Herstellung von salzhaltigem Magnesium (SM)-Phagenpuffer werden in 1 l deionisiertem H2O 100 mM NaCl, 8 mM MgSO4·7H2O und 50 mM Tris-HCl (pH 7,4) gelöst. Autoklavieren und bei Raumtemperatur lagern.
HINWEIS: Am nächsten Tag sollte E. coli im gesamten weichen LB-Agar zu einem Rasen herangewachsen sein. Plaques oder entfernte Wachstumsbereiche, die im E. coli-Rasen sichtbar sind, treten dort auf, wo die Phagenabtötung infizierter E. coli-Wirte stattfand. Jede Plaque stellt eine plaquebildende Einheit (PFU) dar.
- Zur Herstellung von salzhaltigem Magnesium (SM)-Phagenpuffer werden in 1 l deionisiertem H2O 100 mM NaCl, 8 mM MgSO4·7H2O und 50 mM Tris-HCl (pH 7,4) gelöst. Autoklavieren und bei Raumtemperatur lagern.
- Entnehmen Sie eine einzelne Plaque von der weichen Agarplatte, indem Sie eine sterile Pipettenspitze in die Mitte der Plaque schieben und am Ende der Spitze einen Agarstopfen erzeugen. Den Plaque-Stopfen in 1 ml SM-Puffer in einem 1,7-ml-Mikrozentrifugenröhrchen resuspendieren. Wirbeln Sie das Röhrchen 1 Minute lang mit maximaler Geschwindigkeit zum Mischen vor.
- Zentrifugieren Sie das Röhrchen bei 4000 x g für 5 min bei Raumtemperatur, um Schmutz aus dem Lysat zu entfernen. Übertragen Sie den Überstand in ein neues Mikrozentrifugenröhrchen.
- Um den isolierten Phagen zu vermehren, wiederholen Sie die Schritte 1.1.1 bis 1.1.3. 100 μl des isolierten Phagen werden in einem konischen Röhrchen zu einem 15-ml-Aliquot von Weichagar mit E. coli gegeben. Drehen Sie das Röhrchen dreimal um, um es zu mischen, und gießen Sie das Agar in eine Petrischale.
- Lassen Sie die Platten trocknen, bevor Sie sie umdrehen und über Nacht bei 37 °C inkubieren. Bereiten Sie eine Rasenkontrollplatte ohne Phagen vor, um die Lebensfähigkeit von E. coli zu bestätigen.
HINWEIS: Nach der Inkubation über Nacht sollte die Kontrollplatte einen Rasen mit E. coli haben, während die phagenhaltige Platte vollständig lysiert werden sollte. - Um den Phagen aus der Platte zu extrahieren, geben Sie 5 ml SM-Puffer auf die Oberfläche der Phagen-Clearing-Platte und schütteln Sie sie bei 70 U/min auf einer Wippe für 15 Minuten bei Raumtemperatur.
- Sammeln Sie den Puffer von der Platte in ein konisches 50-ml-Zentrifugenröhrchen und zentrifugieren Sie ihn bei 4000 x g für 5 Minuten bei Raumtemperatur, um alle Rückstände von der Agarplatte zu pelletieren.
- Das T4-Phagenstammlysat wird in ein neues Röhrchen gegeben und bis zur Titration und Vermehrung bei 4 °C gelagert.
HINWEIS: T4-Phagen sind über 10 Jahre stabil25; Die Stabilität hängt jedoch von der Art des Phagen und den Lagerbedingungen ab. Der Phagentiter variiert auch mit der Lagerzeit. Phagen sind frostempfindlich. Daher wird die Kryokonservierung in flüssigem Stickstoff und die Vermeidung von Gefrier-Tau-Zyklen empfohlen, da dies die Phagen schädigen und den Phagentiterum 25 reduzieren kann. - Titern Sie das T4-Phagenstammlysat, um die Konzentration in pfu/ml zu bestimmen, wie zuvor beschrieben 25,29,30. Ein T4-Phagenstamm mit hohem Titer enthält 108 pfu/ml oder mehr.
- Herstellung von experimentellen Phagenlysaten
- Kultivieren Sie E. coli in 5 ml LB-Medien in sterilen Polystyrol- oder Glaskulturröhrchen (mit Kappen). Die Röhrchen werden über Nacht bei 37 °C und Schütteln bei 200 U/min inkubiert, bis die stationäre Phase erreicht ist.
- Subkultur der E. coli-Kultur über Nacht 1:50 in 100 ml LB-Medien in einem konischen Glaskolben. Bei 37 °C mit Schütteln bei 200 U/min inkubieren, bis die Bakterien die frühe bis mittlere exponentielle Phase erreicht haben (ca. 1,5 h).
HINWEIS: Eine anfängliche Wachstumskurve kann durchgeführt werden, um die optische Dichte im Bereich von 600 nm (OD600) zu bestimmen, bei dem sich die Bakterienkultur in einer exponentiellen Phase befindet. Die Kultur in einem konischen Glasröhrchen wird empfohlen, da neuere Erkenntnisse gezeigt haben, dass Phagen an Kunststoffen wie Polypropylen31 haften können. - 100 μl des T4-Phagenbestands mit hohem Titer aus Schritt 1.1 in die E. coli-Subkultur geben und bei 37 °C unter Schütteln 3 h inkubieren oder bis das neue Lysat nicht mehr trüb ist. Sammeln Sie das T4-Phagenlysat in konischen 50-ml-Röhrchen und fahren Sie entweder direkt mit den Reinigungsschritten fort oder lagern Sie es bei Bedarf bis zum nächsten Tag bei 4 °C.
HINWEIS: Eine größere Phagen-Burst-Größe (was auf eine höhere durchschnittliche Anzahl von Virionen hinweist, die pro Replikationszyklus freigesetzt werden) erfordert eine längere Inkubationszeit für die bakterielle Subkultur in Schritt 1.2.2. Dies sorgt für eine erhöhte Bakteriendichte vor dem Aufspießen mit Phagenbeständen. - Zentrifugieren Sie Lysate bei 4000 x g für 20 Minuten bei Raumtemperatur, um verbleibende Bakterien und Zelltrümmer zu pelletieren. Den resultierenden Überstand mit einem 0,22-μm-Nylonfilter filtrieren und das Filtrat in neue konische 50-ml-Zentrifugenröhrchen überführen.
- Fügen Sie 0,1 Volumen Chloroform zu jedem Volumen gefilterten T4-Phagenlysats hinzu, um verbleibende Bakterien abzutöten und das Bakterienwachstum zu verhindern. Kurz zum Mischen einreiben und 10 Minuten bei Raumtemperatur inkubieren.
HINWEIS: Lipidumhüllte Phagen reagieren empfindlich auf Chloroform, das den Phagentiter25 senken kann. Überspringen Sie diesen Schritt bei Bedarf.
VORSICHT: Chloroform ist ein giftiges organisches Lösungsmittel, das beim Einatmen, Verschlucken oder Aufnehmen über die Haut gefährlich ist. Verwenden Sie einen Abzug und geeignete persönliche Schutzausrüstung (PSA), wenn Sie mit Chloroform arbeiten. Verwenden Sie bei der Arbeit mit Chloroform Glas anstelle von serologischen Styroporpipetten, da es mit den meisten Kunststoffen nicht kompatibel ist. Chloroform kann für die Schritte 1.2.5-1.2.6 in konische Zentrifugenröhrchen aus Polypropylen gegeben werden, sollte jedoch nicht langfristig in Kunststoffröhrchen gelagert werden. - Zentrifugieren Sie das Lysat bei 4000 x g für 5 min bei Raumtemperatur, um das Chloroform vom Lysat zu trennen. Verwenden Sie eine serologische Pipette, um die oberste Lysatschicht vorsichtig in ein neues konisches 50-ml-Röhrchen zu übertragen, ohne die darunter liegende Chloroformschicht zu stören. Entsorgen Sie den Chloroformabfall in den entsprechenden Behälter für gefährliche flüssige Abfälle. Lysate bei 4 °C lagern, bis die Konzentration und der Pufferaustausch am nächsten Tag erreicht sind.
- Konzentrieren Sie Phagenlysate in einem 100-kDa-Zentrifugalfiltergerät (siehe Materialtabelle), indem Sie 13 ml Phagenlysat in das obere Reservoir des Geräts geben und 5 Minuten lang bei 4000 x g zentrifugieren oder bis der größte Teil des Lysats durch den Filter in das untere Reservoir gelangt ist.
HINWEIS: Streben Sie an, am Ende der Schleuderzeit etwa 2 ml Lysat zu haben. Wenn die Phagenkonzentration im Filter unter Zugabe von Lysat zunimmt, werden sich die Schleuderzeiten wahrscheinlich verlängern. Zentrifugalfiltervorrichtungen haben einen physikalischen Totstopp, um zu verhindern, dass sie trocken schleudern32. Lassen Sie die Filtermembran nicht austrocknen, wenn eine weitere Verwendung beabsichtigt ist (z. B. durch Entfernen der gesamten Flüssigkeit aus dem oberen Behälter). Die Schleuderzeiten können je nach Phagentyp und Titer variieren. - Pipettieren Sie mit einer P200- oder P1000-Pipette die verbleibenden ~2 ml Lysat vorsichtig im oberen Reservoir auf und ab, um die Filtermembran nach jedem Schleudern zu befreien. Entsorgen Sie das Filtrat aus dem unteren Reservoir in einen Abfallbehälter und lassen Sie den konzentrierten Phagen im oberen Reservoir.
- Wiederholen Sie die Schritte 1.2.7-1.2.8, bis das gesamte Volumen des Phagenlysats durch die Filtervorrichtung geleitet wurde, wobei nach jedem Schleudern ~2 ml konzentrierter Phagen im oberen Reservoir zurückgehalten werden.
- Befreien Sie die Filtermembran nach dem letzten Schleudern, indem Sie das verbleibende Lysat (~2 ml) im oberen Reservoir auf und ab pipettieren. Waschen Sie den Phagen (Pufferaustausch), indem Sie 12 ml SM-Puffer in das obere Reservoir geben und 10 Minuten lang bei 4000 x g zentrifugieren oder bis der größte Teil des Puffers den Filter passiert hat.
- Das Filtrat wird verworfen und der Waschschritt (Schritt 1.2.10) wiederholt. Die verbleibenden 2 ml Lysat im SM-Puffer werden zur Langzeitlagerung auf ein Endvolumen von 10 ml (oder weniger) resuspendiert. Das Lysat wird in ein konisches 50-ml-Zentrifugenröhrchen überführt und bis zur Entfernung des Endotoxins bei 4 °C gelagert.
HINWEIS: Es ist optional, den Phagen in diesem Stadium zu titern, um sicherzustellen, dass das Phagenlysat konzentriert wurde (> 108 pfu/ml) und um den Phagenverlust während des Endotoxinentfernungsprozesses zu bestimmen. - Entfernen Sie kontaminierende Endotoxine aus dem T4-Phagenlysat, indem Sie 0,4 Volumen 1-Octanol (siehe Materialtabelle) zum Gesamtvolumen des Lysats hinzufügen.
HINWEIS: Endotoxine werden entfernt, da sie stark immunstimulierend sind und daher ihre Anwesenheit zur Induktion einer phagenunabhängigen angeborenen Immunantwort führen kann25.
ACHTUNG: 1-Octanol ist eine aromatische, organische, brennbare Verbindung mit starkem Geruch und Augenreizung. Tragen Sie geeignete PSA, wenn Sie mit 1-Octanol arbeiten. Führen Sie alle Arbeiten in einem Abzug durch, um das Einatmen von Dampf zu vermeiden. Verwenden Sie Dichtungsfolie, um das Auslaufen von Rohren zu verhindern, wenn Sie außerhalb des Abzugs arbeiten. - Verschließen Sie den Deckel des konischen Zentrifugenröhrchens mit Siegelfolie, um ein Auslaufen zu verhindern. 1 h lang bei 120 U/min auf einer Plattform oder einem Schaukelschüttler bei Raumtemperatur schütteln, gefolgt von einer Inkubation bei 4 °C für 1,5 h ohne Schütteln.
- Zentrifugieren Sie 10 Minuten lang bei 4000 x g , um das Endotoxin-Cleared-Lysat vom 1-Octanol zu trennen. Die 1-Octanol-Schicht schwimmt auf dem Lysat. Verwenden Sie eine P1000-Pipette, um vorsichtig so viel 1-Oktanol wie möglich zu entfernen und in den entsprechenden Behälter für gefährliche/brennbare flüssige Abfälle zu werfen.
- Verwenden Sie eine 18-g-Nadel und eine 10-ml-Spritze, um das Phagenlysat unter der verbleibenden 1-Octanol-Schicht zu sammeln, und achten Sie darauf, dass sich die 1-Octanol-Schicht nicht ansammelt. Lysat bei 4 °C bis zum Schnellvakuum lagern.
- Übertragen Sie 1 ml Aliquots von T4-Phagenlysat in sterile 1,5-ml-Mikrozentrifugenröhrchen. Schnellvakuum mit geöffneten Deckeln bei 4000 x g bei Raumtemperatur, um restliches 1-Oktanol aus dem Lysat zu verdampfen. Beschleunigen Sie das Vakuum für 3 Stunden oder bis das Phagenlysatvolumen um 30 % reduziert wurde25. Bis zur Titration bei 4 °C lagern.
- Titern Sie das Phagenlysat, um die Konzentration in pfu/ml zu bestimmen. Verdünnen Sie das resultierende T4-Phagenlysat in SM-Puffer auf die gewünschte Konzentration und einen erneuten Titer zur Bestätigung.
- Quantifizieren Sie die im T4-Phagenlysat vorhandenen Endotoxine mit einem chromogenen Endotoxin-Quantifizierungskit gemäß den Anweisungen des Herstellers (siehe Materialtabelle). Vergleichen Sie die Endotoxinwerte im endgültigen Phagenlysat mit einer Probe vor der Endotoxinentfernung, Vehikelkontrollen, Puffer und Maustrinkwasser.
HINWEIS: Das chromogene Endotoxin-Quantifizierungskit wird durch 1-Octanol25 inaktiviert. Führen Sie Schnellvakuumschritte durch, um 1-Octanol zu entfernen (Schritt 1.2.16), bevor Sie Endotoxine quantifizieren. Der Endotoxingehalt für destilliertes Wasser wird auf 20 EU/ml25 geschätzt; Der Endotoxingehalt des Trinkwassers von Mäusen kann jedoch zwischen den Einrichtungen variieren. Wenn der Endotoxingehalt im Phagenlysat die im Trinkwasser vorhandene Menge übersteigt, sollten Sie die Schritte zur Endotoxinentfernung wiederholen (1.2.12-1.2.16). - Konzentrierte, mit Endotoxin beseitigte T4-Phagenlysate in SM-Puffer bei 4 °C lagern.
- Herstellung von phagenfreiem Bakterienlysat für Fahrzeugkontrollen
HINWEIS: Ein phagenfreies Bakterienlysat kann als Vehikel zur Kontrolle von Auswirkungen auf bakterielle Verunreinigungen (z. B. Endotoxin) hergestellt werden, die bei der Herstellung von Phagenlysat in Schritt 1.2 erzeugt werden und die experimentellen Ergebnisse bei der Impfung in Mäuse beeinträchtigen könnten.- Aus einer Übernachtkultur von E. coli subkultivieren Sie die E. coli 1:50 in 100 ml LB-Medien. Ohne Zugabe von Phagen werden die Bakterien unter Schütteln bei 37 °C für 3 Stunden oder entsprechend der Inkubationszeit für das in Schritt 1.2 hergestellte Phagenlysat weiter kultiviert.
- Die E. coli-Kultur in konische 50-ml-Röhrchen überführen und Zellen mit einer Ultraschallsonde (siehe Materialtabelle) auf Eis bei 30 kHz für 30 s-Impulse (3x) lysieren, um Bakterienzellen manuell zu lysieren.
- Befolgen Sie den Rest des Protokolls gemäß Schritt 1.2, beginnend mit Schritt 1.2.4, einschließlich aller Reinigungs-, Wasch- und Endotoxinentfernungsschritte.
Anmerkungen: Während der Konzentration mit der Zentrifugalfiltervorrichtung fließt das Vehikellysat aufgrund des Fehlens von Phagen schneller durch den Filter als das Phagenlysat. Verkürzen Sie daher die Zentrifugationszeiten von 5 Minuten auf 2-5 Minuten, um sicherzustellen, dass die Ultrafiltermembran bei längerer Zentrifugation nicht austrocknet. - Titern Sie das Vehikellysat, um zu bestätigen, dass es keinen Phagen enthält.
- Verwenden Sie ein chromogenes Endotoxin-Quantifizierungskit gemäß den Anweisungen des Herstellers, um den Endotoxingehalt im Fahrzeuglysat zu messen. Verdünnen Sie das Vehikelysat in SM-Puffer, um es an die Endotoxingehalte im Phagenlysat anzupassen.
- Alternative experimentelle Kontrollen: Herstellung von hitzeinaktiviertem Phagenlysat
HINWEIS: Eine Alternative zum Phagenfreien Bakterienlysat ist ein hitzeinaktiviertes Phagenlysat. Die Hitzeinaktivierung dissoziiert Phagenvirionen, während verbleibende Endotoxine wie Lipopolysaccharide (LPS) hitzestabil sind 8,33. Diese Methode wurde von Gogokhia et al.8 verwendet, um festzustellen, ob intakte, lebensfähige Phagenvirionen für die Immunaktivierung erforderlich sind. Die Forscher werden ermutigt, beide Methoden (phagenfrei vs. hitzeinaktiviert) zu testen und festzustellen, welche Kontrolle für ihre experimentellen Anforderungen am besten geeignet ist. Unabhängig davon, wofür man sich entscheidet, ist es wichtig zu beachten, dass eine Pufferkontrolle aufgrund der erheblichen Manipulation, die erforderlich ist, um einen Phagenbestand zu konzentrieren und zu reinigen, wahrscheinlich nicht angemessen ist.- Übertragen Sie das erforderliche Volumen des gereinigten, gereinigten und verdünnten T4-Phagenlysats aus Schritt 1.2 (100 μl pro Maus) in sterile Mikrozentrifugenröhrchen mit Deckelverschlüssen.
- Lysate auf einem Wärmeblock bei 95 °C 15 minerhitzen 16.
- OPTIONAL: Wenn die Entfernung von Phagen-/Bakteriennukleinsäuren erforderlich ist, führen Sie eine DNase I- und RNase A-Behandlung gemäß Jakočiūnė und Moodley34 durch. Kurz:
- 50 μl DNase I 10x Puffer, 1 μl DNase I (1 U/μl) und 1 μl RNase A (10 mg/ml) (siehe Materialtabelle) zu 450 μl hitzeinaktiviertem Phagenlysat geben.
- Inkubieren Sie die Lysate bei 37 °C für 1,5 h in einem Wärmeblock, ohne zu schütteln.
- Inaktivieren Sie die DNase I und RNase A durch Zugabe von 20 μl 0,5 M Ethylendiamintetraessigsäure (EDTA)34.
- Halten Sie die Lysate 10 Minuten lang bei Raumtemperatur, um sie abzukühlen und zu kombinieren, wenn mehrere Röhrchen verwendet werden. Bis zur Titration bei 4 °C lagern.
- Führen Sie einen Phagentiter durch, um zu bestätigen, dass kein lebensfähiger T4-Phagen im Lysat vorhanden ist. Wärmeinaktivierte Lysate bei 4 °C lagern.
- Verwenden Sie ein chromogenes Endotoxin-Quantifizierungskit gemäß den Anweisungen des Herstellers, um den Endotoxingehalt im hitzeinaktivierten Lysat zu messen. Verdünnen Sie das hitzeinaktivierte Lysat in SM-Puffer entsprechend dem Endotoxingehalt im passenden Phagenlysat.
2. Verabreichung und Überwachung von T4-Phagen in monokolonisierten E. coli-Mäusen
- Monokolonisation von Mäusen mit E. coli
- Bereiten Sie E. coli für die Verabreichung an GF-Mäuse8 vor, indem Sie E. coli, die über Nacht aus einer einzigen Kolonie in LB-Medien entnommen wurden, kultivieren.
- Unter strengen, sterilen Bedingungen35 werden 200 μl E. coli-Kultur an GF-Mäuse verabreicht, die entweder in sterilen Vinylisolatoren oder luftdichten Bioexclusion-Käfigen durch orale Sonde untergebracht sind. Bei Verwendung von aerotoleranten Bakterien können Mäuse auch durch Auftragen von 200 μl Bakterienkultur auf den Rücken jeder Maus besiedelt werden.
HINWEIS: Die Impfdosis hängt vom Stamm ab, da verschiedene Bakterien unterschiedliche pH-Überlebensfähigkeiten aufweisen36,37. Zucoloto et al.35 empfehlen die Inokulation mit 1 x 108 KBE pro Tier. Die hier gezeigten repräsentativen Ergebnisse wurden von Mäusen generiert, die mit einer Übernachtkultur geimpft wurden (KBE wurde nicht bestimmt). Pilotversuche können durchgeführt werden, um eine Dosis zu bestimmen, die zu einer zuverlässigen Besiedlung des interessierenden Mausstamms führt. Die Menge der Bakterien, die durch orale Sonde verabreicht werden sollen, kann durch das Alter und Gewicht der Mäuse beeinflusst werden. Konsultieren Sie das individuelle Tierethikprotokoll für Labore oder institutionelle Tiere, um die maximal zulässigen Dosen zu erfahren. Das hier vorgeschlagene Volumen basiert auf einer Sondenzugabe von 10 % des Körpergewichts der Maus (z. B. maximal 200 μl für eine 20-g-Maus). Einige Bakterienarten vertragen den Säuregehalt des Magens nicht und können den Darm nicht besiedeln. Erwägen Sie eine erste Messung mit 100 μl 1 M NaHCO3, um die Magensäure zu neutralisieren2. Wenn eine strikte Anaerobie zur Besiedlung verwendet wird, muss die Mikrobe unter anaeroben Bedingungen gezüchtet und in individuell vorbereiteten luftdichten Behältern (1 für jede Maus) in die gnotobiotische Tieranlage überführt werden. Führen Sie jede Sonde schnell durch, sobald der Behälter geöffnet ist, um den Verlust der mikrobiellen Lebensfähigkeit aufgrund von Sauerstoffeinwirkung zu begrenzen. - Überwachen Sie Mäuse auf gesundheitliche Beeinträchtigungen.
HINWEIS: Bei gesundheitlichen Beeinträchtigungen sind die von der jeweiligen Tierpflegeeinrichtung festgelegten Standards zu beachten. Mögliche gesundheitsschädliche Auswirkungen sind unter anderem: (1) Aspiration von Sondenflüssigkeit: Zu den Symptomen gehören das Ausstoßen von Blasen über die Nase, das Atmen / Keuchen mit "offenem Mund". (2) Perforation der Speiseröhre: Zu den Symptomen gehören eine schnell angeschlagene Gesundheit, Buckeln, Lethargie, die innerhalb von 24 Stunden zum Tod des Tieres führt. (3) Entzündung der Speiseröhre durch wiederholte Sonden: Zu den Symptomen gehören Schwierigkeiten beim Einführen der Sondennadel. (4) Durchfall aufgrund von Veränderungen des Mikrobioms. - Bestätigen Sie die bakterielle Besiedlung in Kotpellets durch Kultivierung mindestens einmal pro Woche und/oder durch 16S rRNA-Sequenzierung35.
HINWEIS: Wenn Sie Züchter in einem gnotobiotischen Isolator für die Produktion von Versuchsmäusen besiedeln, planen Sie mindestens 9 Wochen im Voraus die Erzeugung von 6 Wochen alten Versuchsmäusen der ersten Generation von Nachkommen (F1) ein. Alternativ können erwachsene GF-Mäuse monokolonisiert werden. Bei diesem Ansatz wird empfohlen, 7 Wochen nach der Besiedlung vor der Phagenimpfung zu warten, da dies die Zeit ist, die die Darmschleimhaut benötigt, um sich nach der Einführung einer komplexen Mikrobiota in GF-Mäuse zu stabilisieren38.
- Orale Inokulation von T4-Phagen in monokolonisierte E. coli-Mäuse
- Verdünnen Sie T4-Phagenlysate und Vehikelkontrollen auf eine vorbestimmte Konzentration in SM-Puffer. Gemäß Hsu et al.2 verdünnen Phagenlysate, um die Verabreichung von 2 x 106 pfu pro Maus zu ermöglichen2.
HINWEIS: Je nach Stabilität des Phagen in vivo kann eine höhere oder niedrigere Phagenkonzentration verwendet werden. Dosen von 2 x 102, 2 x 104 und 2 x 106 pfu T4-Phagen pro Maus führten zu einer stabilen und langfristigen Besiedlung im Darm, die nicht dosisabhängig zu sein schien (siehe Abschnitt "Repräsentative Ergebnisse"). Die Kinetik von Phagenbakterien sollte daher vor groß angelegten Experimenten in vivo pilotiert werden. - Unter sterilen, gnotobiotischen Bedingungen wird jede Maus mit 100 μl autoklaviertem 1 M NaHCO3 versorgt, um die Magensäure zu neutralisieren. Warten Sie 10 Minuten, dann Sonde mit 100 μl T4-Phagenlysat oder Vehikelkontrolle.
- Überwachen Sie Mäuse auf gesundheitliche Beeinträchtigungen.
- Verdünnen Sie T4-Phagenlysate und Vehikelkontrollen auf eine vorbestimmte Konzentration in SM-Puffer. Gemäß Hsu et al.2 verdünnen Phagenlysate, um die Verabreichung von 2 x 106 pfu pro Maus zu ermöglichen2.
3. Überwachung der T4-Phagenspiegel in vivo
HINWEIS: Sobald Mäuse mit Phagen geimpft wurden, kann die Konzentration sowohl von Phagen als auch von Zielbakterien in Stuhl- oder Gewebeproben gemessen werden. Dies gibt Aufschluss über die Kinetik der Phageninfektion und die Besiedlungsdynamik beider Organismen.
- Spot-Plattierung von T4-Phagen zur Bestimmung der Konzentration in Kotpellets
- Sammeln Sie Kotpellets von jeder Maus in sterilen, vorgewogenen Mikrozentrifugenröhrchen, um den T4-Phagen- und E. coli-Gehalt zu messen. Lagern Sie die Röhrchen bis zum Anrichten auf Eis.
HINWEIS: Legen Sie die Proben in der Zwischenzeit zwischen der Entnahme und dem Plattieren auf Eis, um das Wachstum aerotoleranter Bakterien zu verlangsamen. Über mehrere Stunden hinweg kann es immer noch zu einem Wachstum aerober Bakterien oder zum Absterben anaerober Bakterien aufgrund von Sauerstoffeinwirkung kommen, was zu einer verzerrten Bakterienzahl führen kann. Daher sollte die Bakterien- und Phagenbeschichtung so schnell wie möglich nach der Probenentnahme durchgeführt werden. Obligate anaerobe Bakterien vertragen keine Sauerstoffexposition. Um die Probe zu konservieren, sammeln Sie die Proben in versiegelten Röhrchen und überführen Sie die Röhrchen so schnell wie möglich nach der Entnahme in eine anaerobe Kammer. Wenn in Kotproben kein Wachstum festgestellt wird, sollten Sie Alternativen wie die 16S rRNA qPCR für die bakterielle Quantifizierung in Betracht ziehen. - Notieren Sie die endgültigen Gewichte jedes Röhrchens und berechnen Sie das Probengewicht, indem Sie das ursprüngliche Röhrchengewicht subtrahieren. Dies wird zur Normalisierung der T4-Phagen- und E. coli-Konzentration auf das Probengewicht (pfu/g bzw. KBE/g) verwendet.
- Geben Sie 1 ml sterilen SM-Puffer in jedes Röhrchen und wirbeln Sie gründlich bei maximaler Geschwindigkeit (>1 min) vor, um Kotpellets zu homogenisieren. Wenn die Probe weniger als 15 mg enthält, kann ein kleineres Volumen SM-Puffer hinzugefügt werden. Notieren Sie das Volumen des SM-Puffers, das jeder Probe zugesetzt wird, um KBE/g oder PFU/g der Probe zu berechnen.
- Bereiten Sie eine Reihe von 8 (oder mehr, abhängig von der erwarteten Phagenkonzentration) seriellen Verdünnungen von 20 μl jeder Probe in 180 μl SM-Puffer in Faktor 10 vor. Wirbeln Sie jede homogenisierte Probe kurz vor, um sie zu mischen, bevor sie in das erste Röhrchen/die erste Vertiefung gegeben wird. Pipette zum Mischen zwischen jeder Zugabe und Wechseln der Spitzen zwischen jeder Verdünnung, um ein Aufblähen der Phagen- oder Bakterienzahl durch Probenverschleppung zu verhindern.
HINWEIS: Wenn in der Probe vorhandene Fasern und Ablagerungen das Pipettieren behindern, fügen Sie der Stuhlaufschlämmung zusätzlichen Puffer hinzu, um die Stammprobe weiter zu verdünnen. - 5 μl jeder Verdünnung auf LB-Weichagarplatten mit E. coli (für Phagen-Plaque-Assays) oder LB-Agarplatten (1,5 % Agar, für Bakterienkolonie-Assays) auftragen, um die T4-Phagen- und E. coli-Konzentration in jeder Probe zu bestimmen. Um genau zu sein, erkennen Sie jede Probe in dreifacher Ausfertigung.
HINWEIS: Bei der Herstellung von seriellen Verdünnungen in einer 96-Well-Platte kann eine 8-Kanal-P20-Mehrkanalpipette verwendet werden, um jede Säule der seriell verdünnten Probe auf Platten zu pipettieren. Wechseln Sie die Spitzen zwischen jeder Verdünnung, auch wenn Sie von der am stärksten verdünnten zur konzentriertesten wechseln, da der Phagen an den Wänden der Pipettenspitze haften und die Menge des Phagens ändern kann, der in jede neue Vertiefung gegeben wird31. - Lassen Sie jede Stelle trocknen, bevor Sie die Platte umdrehen und in den Inkubator legen. Über Nacht bei 37 °C inkubieren.
- Wählen Sie für jede Probe die Verdünnung aus, bei der 3-30 zählbare Plaques pro Spot vorhanden sind. Zählen und notieren Sie die Anzahl der Plaques an der Stelle und die verwendete Verdünnung.
- Berechnen Sie pfu/g der Probe, indem Sie die Anzahl der Plaques durch das an jeder Stelle plattierte Volumen dividieren, um pfu/μl zu erhalten. Multiplizieren Sie dies mit dem Verdünnungsfaktor und mit dem Volumen des SM-Puffers, der jeder Probe zugesetzt wird, um pfu/Probe zu erhalten. Zum Schluss durch das Probengewicht dividieren, um pfu/g30 zu erhalten.

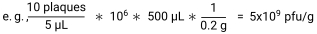
- Sammeln Sie Kotpellets von jeder Maus in sterilen, vorgewogenen Mikrozentrifugenröhrchen, um den T4-Phagen- und E. coli-Gehalt zu messen. Lagern Sie die Röhrchen bis zum Anrichten auf Eis.
- Gewebeentnahme an experimentellen Endpunkten
- Zu jedem ausgewählten Zeitpunkt werden Mäuse gemäß dem genehmigten institutionellen Tierethikprotokoll eingeschläfert und Blinddarminhalt, Dünn- und Dickdarminhalt und alle Gewebe von Interesse in sterilen, vorgewogenen 2-ml-Mikrozentrifugenröhrchen mit rundem Boden gesammelt.
- Notieren Sie die endgültigen Gewichte jedes Röhrchens, um das Probengewicht zu berechnen. Lagern Sie Taschentücher und Stuhlinhalt bis zum Anrichten am selben Tag auf Eis.
- Geben Sie sterilen SM-Puffer in jedes Röhrchen und notieren Sie die hinzugefügten Volumina.
- Für Kalk- und Darminhalt Wirbelproben gründlich (>1 min) gemäß Schritt 3.1.3 durchführen.
- Für Gewebeproben fügen Sie jedem Röhrchen eine sterile Metallperle hinzu. Homogenisieren Sie Gewebe mit einem Gewebelyser (siehe Materialtabelle) bei 20 Hz für 5 min oder bis das Gewebe dissoziiert ist und die Suspension homogen ist.
HINWEIS: Wenn sich die Proben nicht gut homogenisieren lassen, sollten Sie das Volumen des zugegebenen SM-Puffers erhöhen, die Homogenisierungszeit verlängern oder die Homogenisierungsfrequenz auf 30 Hz erhöhen. Ein Gewebehomogenisator kann auch verwendet werden, um Gewebe zu dissoziieren und gleichzeitig die Rückgewinnung von Bakterien und Phagen zu ermöglichen39,40. Homogenisatoren werden mit höheren Frequenzen als Gewebelyser betrieben, während die Integrität der Bakterien erhalten bleibt. - Bereiten Sie serielle Verdünnungen jeder Probe in Faktoren von 10 vor und führen Sie eine Spot-Plattierung durch, um die Phagenkonzentrationen von E. coli und T4 in jeder Probe zu bestimmen, wie in Schritt 3.1.4-3.1.841 beschrieben.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Um die Wechselwirkungen zwischen der T4-Phagen/E. coli-Dyade im murinen Darm zu untersuchen, wurden T4-Phagen- und Vehikellysate hergestellt, gereinigt und gereinigt (Abbildung 1A). T4-Phagenlysate wurden mittels Plaque-Assay titeriert und in SM-Puffer auf 2 x 107 pfu/ml (2 x 106 pfu/m) verdünnt. Vehikellysate wurden ebenfalls titerisiert, um zu bestätigen, dass keine lebensfähigen Phagen vorhanden sind, und in der gleichen Menge SM-Puffer wie das T4-Phagenl...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Untersuchung von Phagen im Mikrobiom stellt im Vergleich zu ihren bakteriellen Gegenstücken eine große Herausforderung dar. Insbesondere enthalten Phagen keinen konservierten phylogenetischen Marker, der allen Phagen gemeinsam ist, ähnlich den ribosomalen 16S- und 18S-Untereinheiten, die die Sequenzierung und Identifizierung von prokaryotischen bzw. eukaryotischen Spezies erleichtern42. Mit den Fortschritten bei den Sequenzierungsansätzen der nächsten Generation, einschließlich der Erhö...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren erkennen an, dass das Land, an dem sie diese Forschung durchgeführt haben, das traditionelle, angestammte und nicht abgetretene Territorium der xwməθkwəy̓əm (Musqueam) Nation ist. Das Land, auf dem es sich befindet, war schon immer ein Ort des Lernens für das Volk der Musqueam, das seit Jahrtausenden seine Kultur, Geschichte und Traditionen an diesem Ort von einer Generation zur nächsten weitergegeben hat. Wir ermutigen andere, mehr über die Heimatländer zu erfahren, in denen sie bei https://native-land.ca leben und arbeiten. Die Autoren danken der Unterstützung durch die Canadian Graduate Scholarships - Master (N.P.), den Michael Smith Health Research BC Trainee Award (RT-2023-3174, an MH), das Discovery Grants Program des Natural Sciences and Engineering Research Council of Canada (NSERC) (RGPIN-2019-04591 bis C.T., RGPIN-2016-04282 bis LCO), das Canadian Institute for Advanced Research / Humans and the Microbiome (FL-001253 Appt 3362, an C.T.), Michael Smith Foundation for Health Research Scholar Award (18239, an C.T.), Canadian Institutes for Health Research (PJT-159458 an LCO) und die Canadian Foundation for Innovation (34673 an LCO und 38277 an CT). Wir sind dankbar für die technische Unterstützung durch das UBC Centre for Disease Modelling und ubcFLOW, das von der UBC GREx Biological Resilience Initiative unterstützt wird, sowie für die Mitglieder der Labore Osborne und Tropini für kritische Diskussionen und die Bewertung des Manuskripts. Abbildung 1A und Abbildung 2A wurden mit Biorender.com erstellt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-octanol (99%) | Thermofisher | CAAAA15977-AP | |
| 50 ml PES Steriflip Sterile Disposable Vacuum Filter Units | Millipore Sigma | SCGP00525 | |
| Agarose (Low-EEO/Multi-Purpose/Molecular Biology Grade) | Fisher BioReagents | BP160-500 | |
| Amicon® 100kDa Ultra-15 centrifugal filter device, Ultracel-100 | Millipore Sigma | UFC910008 | |
| BD Microtainer® Tubes, SST | BD Medical | 365967 | |
| Bioexclusion airtight cages (ISO cages) | Techiplast | 1245ISOCAGE | |
| C1000 Touch™ Thermal Cycler with 96-Well Fast Reaction Module | BioRad | 1851196 | |
| Calcium Chloride Dihydrate (White Crystals to Powder) | Fisher BioReagents | BP510-500 | |
| Cap Locks For 1.5ML Tube 100/pk | Andwin Scientific | 16812612 | |
| Chloroform (Ethanol as Preservative/Certified ACS) | Fisher | C298-500 | |
| Copper coated steel beads (4.5 mm) | Crosman Corporation | 0767 | |
| DNeasy Blood & Tissue Kit (50) | Thermo Scientific | 69504 | |
| DreamTaq Green PCR Master Mix (2X) | Thermo Scientific | K1081 | |
| Ethylenediaminetetraacetic acid (EDTA) disodium salt solution, for molecular biology, 0.5 M in H2O | Sigma Aldrich | E7889 | |
| Fisher BioReagents™ Agar, Powder / Flakes, Fisher BioReagents™ | Fisher Bioreagents | BP1423-500 | |
| Fisher BioReagents™ Microbiology Media: LB Broth (Powder) - Lennox | Fisher Bioreagents | BP1427-500 | |
| GeneRuler 100 bp DNA Ladder | Thermo Scientific | SM0241 | |
| Green FastMix® qPCR mix, 1250 rxns | QuantaBio | 95072-012 | |
| HEPA filters for isocage lids, AUTOCLAVABLE H14 FILTERS FOR ISO LINE- IRRADIATED | Techiplast | UISOHEPAXTBOX-300 | |
| Magnesium sulfate heptahydrate | Fisher BioReagents | BP213-1 | |
| MaxQ 6000 Incubated Shaker | Thermo Scientific | 8354-30-0009 | |
| Microbiology Media: LB Broth (Powder) - Lennox | Fisher BioReagents | BP1427-500 | |
| Microcentrifuge Tubes with Locking Snap Cap, 2ml | Fisher | 14-666-315 | |
| Parafilm sealing film | Bemis | PM-996 | |
| Phage stocks | Carolina Biological Supply | n/a | |
| PicoLab® Mouse Diet 20 EXT | LabDiet | 5R58 | |
| Pierce™ Chromogenic Endotoxin Quant Kit | Thermo Scientific | A39552S | |
| RNase A (17,500 U) | Qiagen | 19101 | |
| RNase-free DNase Set | Qiagen | 79254 | |
| Sodium Bicarbonate (Fine White Powder) | Fisher Chemical | BP328-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Chemical | S271 | |
| Sonicator (probe model CL-18; power source model FB50) | Fisher scentific | n/a | |
| Sterile flexible film isolator | Class Biologically Clean | n/a | |
| SYBR™ Safe DNA Gel Stain | Invitrogen | S33102 | |
| T100 Thermal Cycler | BioRad | 1861096 | |
| T4 phage primer, forward (CCACACATAGCGCGAGTATAA) | IDT | n/a | |
| T4 phage primer, forward (GAAACTCGGTCAGGCTATCAA) | IDT | n/a | |
| TissueLyser II | Qiagen | 85300 | |
| Tris-HCl, 1M Solution, pH 8.0, Molecular Biology Grade, Ultrapure | Thermo Scientific | AAJ22638AE | |
| Water, (DNASE, RNASE free) | Fisher BioReagents | BP2484100 |
Referenzen
- Rohwer, F., Segall, A. M. A century of phage lessons. Nature. 528 (7580), 46-47 (2015).
- Hsu, B. B., et al. Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model. Cell Host & Microbe. 25 (6), 803-814.e5 (2019).
- Gordillo Altamirano, F. L., Barr, J. J. Phage Therapy in the postantibiotic era. Clinical Microbiology Reviews. 32 (2), (2019).
- Schooley, R. T., et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Ott, S. J., et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152 (4), 799-811.e7 (2017).
- Zuo, T., et al. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 67 (4), 634-643 (2018).
- Norman, J. M., et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 160 (3), 447-460 (2015).
- Gogokhia, L., et al. Expansion of bacteriophages is linked to aggravated intestinal inflammation and colitis. Cell Host & Microbe. 25 (2), 285-299.e8 (2019).
- Brunse, A., et al. Fecal filtrate transplantation protects against necrotizing enterocolitis. The ISME Journal. 16 (3), 686-694 (2022).
- Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. M., Hooper, L. V. A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17621-17626 (2012).
- Barr, J. J., et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proceedings of the National Academy of Sciences of the United States of America. 110 (26), 10771-10776 (2013).
- Nguyen, S., et al. Bacteriophage Transcytosis provides a mechanism to cross epithelial cell layers. mBio. 8 (6), (2017).
- Bichet, M. C., et al. Bacteriophage uptake by mammalian cell layers represents a potential sink that may impact phage therapy. iScience. 24 (4), 102287(2021).
- Buttimer, C., et al. Impact of a phage cocktail targeting Escherichia coli and Enterococcus faecalis as members of a gut bacterial consortium in vitro and in vivo. Frontiers in Microbiology. 13, 936083(2022).
- Li, Y., et al. Bacteriophages allow selective depletion of gut bacteria to produce a targeted-bacterium-depleted mouse model. Cell Reports Methods. 2 (11), 100324(2022).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20236-20241 (2013).
- Federici, S., et al. Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 185 (16), 2879-2898.e4 (2022).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science (New York, N.Y.). 363 (6434), (2019).
- Fluckiger, A., et al. Cross-reactivity between tumor MHC class I-restricted antigens and an enterococcal bacteriophage. Science (New York, N.Y.). 369 (6506), 936-942 (2020).
- Majewska, J., et al. Induction of Phage-Specific Antibodies by Two Therapeutic Staphylococcal Bacteriophages Administered per os. Frontiers in Immunology. 10, 2607(2019).
- Weiss, M., et al. In vivo replication of T4 and T7 bacteriophages in germ-free mice colonized with Escherichia coli. Virology. 393 (1), 16-23 (2009).
- Thomson, C. A., Morgan, S. C., Ohland, C., McCoy, K. D. From germ-free to wild: modulating microbiome complexity to understand mucosal immunology. Mucosal Immunology. 15 (6), 1085-1094 (2022).
- Al-Asmakh, M., Zadjali, F. Use of germ-free animal models in microbiota-related research. Journal of Microbiology and Biotechnology. 25 (10), 1583-1588 (2015).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Bonilla, N., et al. Phage on tap-a quick and efficient protocol for the preparation of bacteriophage laboratory stocks. PeerJ. 4, e2261(2016).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. 1, Cold Spring Harbor Laboratory Press. New York, NY. (2001).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology (Clifton, N.J). 501, 69-76 (2009).
- Manikantha, B., Karthika, R., Murugadas, V., Vishnuvinayagam, S., Rao, B. M. Comparison of the single agar and double agar layer methods for enumeration of bacteriophages. Fishery Technology. 59, 60-63 (2022).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, e3064(2012).
- Louten, J. Chapter 7 - Detection and diagnosis of viral infections. Essential Human Virology. , 111-132 (2016).
- Richter, Ł, et al. Adsorption of bacteriophages on polypropylene labware affects the reproducibility of phage research. Scientific Reports. 11 (1), 7387(2021).
- Merck KGaA. Amicon Ultra-15 Centrifugal Filter Devices. , Darmstadt, Germany. https://www.emdmillipore.com/CA/en/product/Amicon-Ultra-15-Centrifugal-Filter-Unit,MM_NF-UFC901024#documentation (2018).
- Hecker, W., Witthauer, D., Staerk, A. Validation of dry heat inactivation of bacterial endotoxins. PDA Journal of Pharmaceutical Science and Technology. 48 (4), 197-204 (1994).
- Jakočiūnė, D., Moodley, A. A Rapid bacteriophage DNA extraction method. Methods and Protocols. 1 (3), 27(2018).
- Zucoloto, A. Z., Yu, I. L., McCoy, K. D., McDonald, B. Generation, maintenance, and monitoring of gnotobiotic mice. STAR Protocols. 2 (2), 100536(2021).
- Ng, K. M., et al. Single-strain behavior predicts responses to environmental pH and osmolality in the gut microbiota. mBio. 14 (4), e0075323(2023).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nature Reviews. Microbiology. , (2023).
- Bergstrom, K., Xia, L. The barrier and beyond: Roles of intestinal mucus and mucin-type O-glycosylation in resistance and tolerance defense strategies guiding host-microbe symbiosis. Gut Microbes. 14 (1), 2052699(2022).
- Askar, M., Ashraf, W., Scammell, B., Bayston, R. Comparison of different human tissue processing methods for maximization of bacterial recovery. European Journal of Clinical Microbiology & Infectious Diseases. 38 (1), 149-155 (2019).
- Redanz, S., Podbielski, A., Warnke, P. Improved microbiological diagnostic due to utilization of a high-throughput homogenizer for routine tissue processing. Diagnostic Microbiology and Infectious Disease. 82 (3), 189-193 (2015).
- Bhinder, G., et al. The Citrobacter rodentium mouse model: studying pathogen and host contributions to infectious colitis. Journal of Visualized Experiments. 72, e50222(2013).
- Reyes, A., Semenkovich, N. P., Whiteson, K., Rohwer, F., Gordon, J. I. Going viral: next-generation sequencing applied to phage populations in the human gut. Nature Reviews Microbiology. 10 (9), 607-617 (2012).
- Camarillo-Guerrero, L. F., Almeida, A., Rangel-Pineros, G., Finn, R. D., Lawley, T. D. Massive expansion of human gut bacteriophage diversity. Cell. 184 (4), 1098-1109.e9 (2021).
- Reyes, A., et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466 (7304), 334-338 (2010).
- Bach, M. S., et al. Filamentous bacteriophage delays healing of Pseudomonas-infected wounds. Cell Reports. Medicine. 3 (6), 100656(2022).
- Filyk, H. A., Osborne, L. C. The multibiome: The intestinal ecosystem's influence on immune homeostasis, health, and disease. EBioMedicine. 13, 46-54 (2016).
- Rohwer, F., Merry, Y., Maughan, H., Hisakawa, N. Heather Life in Our Phage World: A Centennial Field Guide to the Earth's Most Diverse Inhabitants. Wholon. , San Diego. (2014).
- Glonti, T., Pirnay, J. P. In Vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 14 (7), 1490(2022).
- Fraser, J. S., Yu, Z., Maxwell, K. L., Davidson, A. R. Ig-like domains on bacteriophages: a tale of promiscuity and deceit. Journal of Molecular Biology. 359 (2), 496-507 (2006).
- Li, H., et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications. 6, 8292(2015).
- Bergström, A., et al. Nature of bacterial colonization influences transcription of mucin genes in mice during the first week of life. BMC Research Notes. 5, 402(2012).
- Adams, M. H. Bacteriophages. , Interscience Publishers. https://books.google.co.uk/books?id=3wVrAAAAMAAJ (1959).
- Kutter, E., Sulakvelidze, A. Bacteriophages: Biology and Applications. , CRC Press. https://books.google.co.uk/books?id=flHOvAEACAAJ (2004).
- Bao, H., et al. Dysbiosis and intestinal inflammation caused by Salmonella Typhimurium in mice can be alleviated by preadministration of a lytic phage. Microbiological Research. 260, 127020(2022).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten