Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Murin Bağırsağında T4 Bakteriyofaj ve E. coli Etkileşimi: İn Vivo Konak-Bakteriyofaj Dinamiğini İncelemek İçin Prototipik Bir Model
Bu Makalede
Özet
Bakterileri enfekte eden virüsler olan bakteriyofajlar (fajlar), bağırsak mikrobiyomunun ayrılmaz bir bileşenidir. Bu simbiyotik sakinler bakteriyel zindeliği ve popülasyon dinamiklerini yönlendirse de, bağırsak homeostazını ve hastalığını nasıl etkiledikleri hakkında çok az şey anlaşılmıştır. Bu protokol, diğer faj-bakteri çiftlerine uyarlanabilen bir fare modeli içinde izole edilmiş T4 fajlarını inceler.
Özet
Bakteriyofajlar (fajlar), bakterileri tür ve suş düzeyinde özgüllükle enfekte eden virüslerdir ve bilinen tüm ekosistemlerde en bol bulunan biyolojik varlıklardır. Bağırsak mikrobiyotasında bulunanlar gibi bakteri topluluklarında fajlar, mikrobiyota popülasyon dinamiklerini düzenlemede ve bakteri evrimini yönlendirmede rol oynar. Son on yılda, kısmen, antimikrobiyal dirençli bakterilerin artan tehdidine karşı koymak için umut verici bir araç sunan litik fajların konakçıya özgü öldürme yetenekleri nedeniyle, faj araştırmalarına olan ilgi yeniden artmıştır. Ayrıca, fajların bağırsak mukusuna yapıştığını gösteren son çalışmalar, altta yatan epitele bakteri istilasını önlemede koruyucu bir role sahip olabileceklerini düşündürmektedir. Daha da önemlisi, bakteriyel mikrobiyomlar gibi, bozulmuş fageomlar, inflamatuar bağırsak hastalığı gibi hastalıklarda kötüleşen sonuçlarla ilişkilendirilmiştir. Önceki çalışmalar, fajların dışkı süzüntüsü nakli yoluyla hayvanların ve insanların mikrobiyomunu modüle edebildiğini ve konakçının sağlığına fayda sağladığını göstermiştir. Bu son araştırma dalgasıyla birlikte, bağırsak mikrobiyomu bağlamında fajları incelemek için protokoller oluşturma ve standartlaştırma gerekliliği ortaya çıkıyor. Bu protokol, izole edilmiş T4 fajlarını ve bakteriyel konakçıları Escherichia coli'yi murin gastrointestinal sistemi bağlamında incelemek için bir dizi prosedür sağlar. Burada açıklanan yöntemler, bir faj lizatından nasıl başlanacağını, farelere nasıl uygulanacağını ve bakteri konakçısı ve faj seviyeleri üzerindeki etkilerin nasıl değerlendirileceğini özetlemektedir. Bu protokol değiştirilebilir ve diğer faj-bakteri çiftlerine uygulanabilir ve konak-faj dinamiklerini in vivo olarak incelemek için bir başlangıç noktası sağlar.
Giriş
Bakteriyofajlar veya fajlar, tür ve suş düzeyinde özgüllük1 ile bakterileri enfekte eden ve öldüren virüslerdir. Fajlar, popülasyon dinamiklerini düzenlemede ve bakteriyel uygunluğu yönlendirmede rol oynadıkları bağırsak mikrobiyotası gibi karmaşık bakteri topluluklarında önemli roller oynarlar2. Son on yıl boyunca, antimikrobiyal dirençli patojenlerin3 yükselişi ve alternatif bir tedavi stratejisi olarak faj tedavisinin potansiyeli nedeniyle faj araştırmalarına olan ilgi yeniden artmıştır. Son yıllarda, litik faj kokteylleri, insanlarda ciddi, antibiyotiğe dirençli bakteriyel septik enfeksiyonlarda bir miktar başarı ile intravenöz olarak kullanılmıştır 3,4. Oral faj tedavisi, bağırsak enfeksiyonlarını ve iltihabı tedavi etmek için antibiyotiklere potansiyel bir alternatif olarak da önerilmiştir. Ayrıca, fajlar, tekrarlayan Clostridioides difficile enfeksiyonu (rCDI)5,6, inflamatuar bağırsak bozuklukları (IBD)7,8 ve erken doğmuş domuzlarda nekrotizan enterokolit tedavisinde bakterileri uzaklaştırmak için filtrelenmiş dışkı mikrobiyota preparatları olan dışkı süzüntü nakillerinin(FFT) başarısında rol oynamıştır. Bu sonuçlar göz önüne alındığında, hem fajlar ve bağırsak mikrobiyotası hem de fajlar ve memeli konakçı arasındaki etkileşimleri dikkate almak önemlidir, çünkü önceden var olan bir topluluğa yeni fajların eklenmesi, yalnızca hedef bakteriler üzerinde değil, bir bütün olarak topluluk üzerinde dolaylı etkilere sahip olabilir 2,10.
Fajların hedef bakterilerle etkileşimlerinin in vitro olarak incelenmesinin, bağırsaktaki faj ve bakteri etkileşimlerinin mekanizmalarını ve etkilerini anlamak için yararlı olduğu kanıtlanmıştır. Bu ortamda, Caudovirales takımının Escherichia coli'ye özgü T4 fajlarının, bağırsak mukusunayapışmak için virion yüzeyindeki yüksek antijenik dış kapsid (Hoc) proteinleri içinde yer alan immünoglobulin (Ig) benzeri alanlara ihtiyaç duyduğu gösterilmiştir 11. Ek olarak, transwell deneyleri, T4 fajlarının epitel hücre kültürleri ile etkileşime girebildiğini ve makropinositoz12,13 ile hücre katmanları boyunca yer değiştirebildiğini göstermiştir. Bu sonuçlar, fajların ökaryotik hücreleri enfekte edemeseler bile metazoan konakçılarıyla etkileşime girebilecekleri hipotezini desteklemektedir. Bu modeller, yararlı olmakla birlikte, fajlar, bakteriler ve metazoan konakçı arasındaki üçlü etkileşimin kapsamlı bir şekilde araştırılması için gerekli olan bir bağırsak ekosisteminde meydana gelen tüm karmaşık etkileşimlerden yoksundur.
Fare modelleri, karmaşık ortamlarda fajları araştırmak için önemli bir araçtır. Faj uygulamasının arzu edilen bir uygulaması, IBD dahil olmak üzere kronik enflamatuar hastalıklarla ilişkili antimikrobiyal dirençli enfeksiyonları veya patobiyonları tedavi etmek için alternatif bir stratejidir. Bununla birlikte, ortaya çıkan literatür, in vitro faj davranışının in vivo fonksiyonları tam olarak temsil etmediğini göstermektedir. Buttimer ve ark.14, bir faj kokteylinin, basitleştirilmiş bir insan mikrobiyota konsorsiyumunda hedeflenen bakterileri in vitro olarak tüketebildiğini, ancak aynı bakteri-faj konsorsiyumu ile kolonize edilen gnotobiyotik farelerde in vivo olarak çoğaltılamadığını gösterdi. Ayrıca, geleneksel bir fare mikrobiyomunda, T7 fajı, hedef bağırsak bakterilerinin seçici olarak tükenmesine yol açtı, ancak zaman içinde kademeli iyileşme gözlendi, bu da gelişmiş direncingöstergesi 15. Diğer çalışmalar, oral yoldan uygulanan fajların ve hedef bakteri suşlarının in vivo 2,16 bir arada bulunduğunu göstermiştir. Gerçekten de, faj/bakteri birlikteliğinin ötesinde, faj uygulaması genel mikrobiyota topluluğu bileşiminde ve işlevinde yaygın değişikliklere yol açmıştır 2,16. Bu, hastalık ortamlarında önemlidir, çünkü birkaç çalışma, Caudovirales'in nispi bolluğunun artması ile IBD 7,8,17 arasında bakteri bolluğundaki değişikliklerden bağımsız olarak ilişkiler bulmuştur7. Bunun hastalık patogenezinin bir itici gücü mü yoksa bir sonucu mu olduğu bilinmemektedir.
Faj araştırmasının tarihsel odak noktası, bir faj ile hedef bakteri arasındaki ilişki etrafında olmuştur. Bununla birlikte, faj ile metazoan konağın mukozası, epiteli ve bağışıklık sistemi arasındaki potansiyel etkileşimleri dikkate almak da önemlidir. Bu etkileşimlerin tümü, bağırsak faj enfeksiyonuna verilen genel yanıtta önemli bir rol oynar. Bunu göstermek için, mikrobiyota8'in müdahalesi olmadan bağışıklık sistemi üzerindeki etkilerini aydınlatmak için mikropsuz (GF) fareler kullanılarak fajlar incelenmiştir. Bu sistemde, faj nükleik asitleri, fagositik immün hücrelerin (makrofajlar ve dendritik hücreler) endozomları içinde bulunan Toll benzeri reseptörler (TLR'ler) tarafından tespit edildi. Bu, aşağı akış sinyalini aktive etti ve T hücresine bağlı interferon (IFN)-γ8 veya tip I IFN'ler18 üretimini uyardı. Ayrıca, Fluckiger ve ark.19, faj kodlu (kehanet) antijenlerin tanınmasında bellek CD8+ T hücrelerini kullandılar, bu da tümör antijenleri ile T hücresi çapraz reaktivitesi ile sonuçlandı ve bu da tümör yükünün azalmasına neden oldu. Son olarak, fajlara özgü antikor üretimi, fajların hayvan modellerine içme suyu 8,20 yoluyla sürekli olarak verildiğiveya birkaç ay boyunca tekrarlanan oral gavaj yoluyla20 faj proteinlerinin humoral bağışıklık tepkilerini destekleme kapasitesini gösterdiği fare çalışmalarında belgelenmiştir. Bu faj aşılama modları, bağışıklık sisteminin optimal ve sürekli olarak hazırlanmasına izin verse de, fajlar ve bağırsak ortamı arasında doğal olarak meydana gelen etkileşimleri veya oral yoldan uygulanan faj tedavisinin kinetiğini temsil etmeyebilirler. Şimdiye kadar, sınırlı sayıda çalışma, monokolonize fare modellerinde fajın tek bir bakteri türüyle etkileşimlerini incelemiştir21. Bununla birlikte, monokolonize fareler, bireysel türlerin gastrointestinal (GI) sistem ve bağışıklık gelişimi 22,23,24 üzerindeki mikroplara özgü etkilerinin deşifre edilmesinde kritik olduğunu kanıtlamıştır ve fajlar, hedef bakterileri ve metazoan konakçı arasındaki üçlü etkileşimleri anlamada yararlı olabilirler.
Heyecan verici bir şekilde, bağırsak fajı ve bağırsak kommensal bakterileri arasındaki etkileşimlerin yanı sıra metazoan konakçı ile içinde bulunan fajlar arasında meydana gelen etkileşimler hakkında öğrenilecek çok şey var. Bu protokol, bir gnotobiyotik fare modeli kullanarak izole edilmiş T4 fajını ve bakteriyel muadili E. coli'yi (K-12, BW25113) incelemek için bir dizi prosedür sağlar. Bu standartlaştırılmış prosedürler ayrıca, büyüme parametrelerini ilgilenilen çiftlere uyarlayarak diğer faj/bakteri çiftlerini optimize etmek için bir temel sağlar. Burada açıklanan yöntemler şunları özetlemektedir: (1) Farelerin oral gavajı için T4 faj ve araç lizatlarının hazırlanması; (2) T4 fajının E. coli monokolonize gnotobiyotik farelere oral yoldan verilmesi; (3) Fare dışkısında ve dokularında T4 faj seviyelerinin zaman içinde izlenmesi.
Burada sunulan temsili sonuçlar için, saflaştırılmış T4 faj lizatları, Rohwer Laboratuvarı tarafından tutulan faj bankası stoklarından çoğaltıldı. T4 fajını yaymak için Phage-on-Tap yöntemi, bu protokolde atıfta bulunulduğu gibi25'e uyarlanmıştır. Yöntem, üç gün içinde yüksek titre, endotoksin düşük faj stokları verir. Bu yaklaşım kullanılarak, rutin olarak 10 mL ≥10 10 plak oluşturan birim (pfu)/mL < 0.5 endotoksin birimi (EU)/mL T4 faj toplandı. Farelere oral veya intravenöz uygulama için önerilen endotoksin seviyeleri sırasıyla ≤ 20 EU/mL ve ≤ 5 EU/kg/s'dir (veya 20 g'lık bir fare için 1 saat boyunca uygulanan 0.1 EU), bu da bunu in vivo aşılama için uygun bir faj hazırlama yöntemi haline getirir. Tüm faj stokları 4 °C'de salin magnezyum (SM) faj tamponunda saklandı (tarif adım 1.1.5.1'de verilmiştir). E. coli , LB ortamında yetiştirildi. Çeşitli faj-bakteri çiftleri için, çeşitli kültür ortamları ve büyüme koşulları bu protokolden uyarlanabilir. Fajlar ayrıca atık su, deniz suyu, toprak ve bağırsak içeriği gibi çevreden de elde edilebilir ve ilgilenilen her bir faj-konakçı çifti için uygun büyüme ve yayılma koşulları kullanılarak hazırlanmadan önce Sambrook ve Russell26'ya göre izole edilebilir ve saflaştırılabilir25. Alternatif olarak, fajlar ticari kaynaklardan (bkz . Malzeme Tablosu) veya faj bankalarından elde edilebilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneyler, UBC Hayvan Bakım Komitesi ve Biyogüvenlik Komitesi onaylı protokoller (A23-0113, B19-0038) tarafından belirlenen yönergelere uygun olarak gerçekleştirilmiştir. Fareler, British Columbia Üniversitesi'nde, Hastalık Modelleme Merkezi'nde patojen içermeyen koşullar altında barındırıldı. C57BL/6 fareleri, steril fare diyeti, su, yatak takımı ve yuvalama malzemesi ile sağlanan steril bir esnek film izolatöründe tesis içinde yetiştirildi. Fareler 12 saatlik bir gündüz / gece döngüsünde tutuldu. Hem erkek hem de dişi deney fareleri, her deneyde 6 ila 12 haftalık arasında değişen ve tüm deneyler için 15-30 g ağırlığında yaşları eşleştirildi.
1. Farelerde oral gavaj için faj ve araç lizatlarının hazırlanması
- Faj saflaştırma ve stok üretimi
NOT: Bu çalışmada, T4 fajları, aşağıda açıklanan tek agar tabakası yöntemi kullanılarak bir bakteri çimi üzerine kaplanarak büyütülür ve titrelenir. Çift agar tabakası yöntemi daha önce açıklanmıştır25,27ve benzer etkinlikle de kullanılabilir. Daha iyi plak görünürlüğü sağladığı için bu protokol için tek agar tabakası yöntemi seçilmiştir28.- Steril polistiren veya cam kültür tüplerinde (kapaklı) 5 mL steril LB ortamında E. coli büyütün. Tüpleri 37 °C'de, sabit faza ulaşılana kadar gece boyunca 200 rpm'de çalkalayarak inkübe edin.
- Takviyeden önce LB'yi %0,5 agar ile otoklavlayarak ve 50 °C veya altına soğutarak (sıvı kalırken) bir cam ortam şişesinde yumuşak agar hazırlayın. Tabak başına 15 mL'ye yetecek kadar yumuşak agar hazırlayın.
- Yumuşak agarı MgS04 ve CaCl 2 ile her biri için 1 mM'lik bir nihai konsantrasyona kadar destekleyin. Her 3 mL yumuşak agar için 100 μL gece boyunca E. coli kültürü ekleyin. Yumuşak agardaki takviyeleri ve kültürü homojenize etmek için manyetik bir karıştırma çubuğu kullanarak hafifçe karıştırın.
NOT: Yumuşak agar preparatına eklenen E. coli'nin hacmi ve yoğunluğundaki tutarlılık kritiktir (temsili sonuçlar bölümünde özetlenmiştir). - Serolojik bir pipet kullanarak Petri kabı başına (15 cm çapında) 15 mL yumuşak agar + E. coli ekleyin. Plakaların aynı gün kullanım için oda sıcaklığına ayarlanmasına izin verin.
NOT: Plakalar, kapaklar açıkken yaklaşık 20 dakika içinde sertleşecektir. Agar yumuşak kalacak ancak plakalar ters çevrildiğinde kaymayacaktır. - SM tamponunda seyrelterek kaynak T4 fajının 8-10 seri dilüsyonunu 10 faktör olarak hazırlayın. Her seyreltmenin 5 μL'sini plakalara yerleştirin. Lekelerin kurumasına, ters çevirmesine ve plakaları gece boyunca 37 °C'de inkübe etmesine izin verin.
- Tuzlu Magnezyum (SM) faj tamponu hazırlamak için, 1 L deiyonizeH2O'da100 mM NaCl, 8 mM MgSO4·7H2Ove 50 mM Tris-HCl'yi (pH 7.4) çözün. Otoklavlayın ve oda sıcaklığında saklayın.
NOT: Ertesi gün, E. coli yumuşak LB agar boyunca bir çime dönüşmüş olmalıydı. E. coli çimlerinde görülebilen plaklar veya temizlenmiş büyüme alanları, enfekte E. coli konakçılarının faj öldürmesinin meydana geldiği yerlerde ortaya çıkacaktır. Her plak, bir plak oluşturma birimini (pfu) temsil eder.
- Tuzlu Magnezyum (SM) faj tamponu hazırlamak için, 1 L deiyonizeH2O'da100 mM NaCl, 8 mM MgSO4·7H2Ove 50 mM Tris-HCl'yi (pH 7.4) çözün. Otoklavlayın ve oda sıcaklığında saklayın.
- Steril bir pipet ucunu plağın ortasına iterek yumuşak agar plakasından tek bir plak seçin ve ucun ucunda bir agar tıkacı oluşturun. Plak tapasını 1.7 mL'lik bir mikrosantrifüj tüpünde 1 mL SM tamponuna yeniden süspanse edin. Karıştırmak için tüpü maksimum hızda 1 dakika vorteksleyin.
- Lizattaki kalıntıları temizlemek için tüpü oda sıcaklığında 5 dakika boyunca 4000 x g'da santrifüjleyin. Süpernatanı yeni bir mikrosantrifüj tüpüne aktarın.
- İzole edilmiş fajı çoğaltmak için 1.1.1-1.1.3 adımlarını tekrarlayın. Konik bir tüpte E. coli içeren 15 mL'lik bir yumuşak agar alikotuna 100 μL izole faj ekleyin. Karıştırmak için tüpü üç kez ters çevirin ve agarı bir petri kabına dökün.
- Ters çevirmeden ve gece boyunca 37 °C'de inkübe etmeden önce plakaların kurumasını bekleyin. E. coli'nin canlılığını doğrulamak için fajsız bir çim kontrol plakası hazırlayın.
NOT: Gece boyunca inkübasyondan sonra, kontrol plakasında bir E.coli çimi bulunmalı ve faj içeren plaka tamamen parçalanmalıdır. - Fajı plakadan çıkarmak için, fajla temizlenmiş plakanın yüzeyine 5 mL SM tamponu ekleyin ve oda sıcaklığında 15 dakika boyunca bir külbütör üzerinde 70 rpm'de çalkalayın.
- Tamponu plakadan 50 mL'lik bir konik santrifüj tüpüne toplayın ve agar plakasındaki kalıntıları toplamak için oda sıcaklığında 5 dakika boyunca 4000 x g'da santrifüjleyin.
- T4 faj stoğu lizatını yeni bir tüpe toplayın ve titrasyon ve yayılmaya kadar 4 °C'de saklayın.
NOT: T4 fajları 10 yıldan fazlastabildir 25; Bununla birlikte, stabilite fajın türüne ve saklama koşullarına bağlı olacaktır. Faj titresi de saklama süresine göre değişecektir. Fajlar donmaya karşı hassastır. Bu nedenle, sıvı nitrojende kriyoprezervasyon yapılması ve fajlara zarar verebileceği ve faj titresini25 azaltabileceği için donma-çözülme döngülerinden kaçınılması önerilir. - Daha önce tarif edildiği gibi pfu / mL'deki konsantrasyonu belirlemek için T4 faj stok lizatını titreedin 25,29,30. Yüksek titreli bir T4 faj stoğu 108 pfu / mL veya daha fazlasını içerecektir.
- Deneysel faj lizatlarının hazırlanması
- Steril polistiren veya cam kültür tüplerinde (kapaklı) 5 mL LB ortamında kültür E. coli . Tüpleri gece boyunca 37 °C'de 200 rpm'de çalkalanarak, sabit faza ulaşılana kadar inkübe edin.
- Gece boyunca alt kültür E. coli kültürü 100 mL LB ortamında 1:50 cam konik bir şişede. Bakteriler erken ila orta üstel faza (yaklaşık 1,5 saat) ulaşana kadar 200 rpm'de çalkalayarak 37 ° C'de inkübe edin.
NOT: Bakteri kültürünün üstel fazda olduğu 600 nm (OD600) aralığında optik yoğunluğu belirlemek için bir başlangıç büyüme eğrisi gerçekleştirilebilir. Son kanıtlar fajların polipropilen31 gibi plastiklere yapışabildiğini bulduğundan, cam konik bir tüpte kültür önerilmektedir. - Adım 1.1'den itibaren 100 μL yüksek titreli T4 faj stoğu E. coli alt kültürüne ekleyin ve 37 ° C'de 3 saat çalkalayarak veya yeni lizat artık bulanık olmayana kadar inkübe edin. T4 faj lizatını 50 mL'lik konik tüplere toplayın ve doğrudan temizleme adımlarına geçin veya gerekirse ertesi güne kadar 4 °C'de saklayın.
NOT: Daha büyük bir faj patlaması boyutu (replikasyon döngüsü başına salınan daha yüksek bir ortalama virion sayısını gösterir), adım 1.2.2'de bakteri alt kültürü için daha uzun bir inkübasyon süresi gerektirir. Bu, faj stokları ile sivrilmeden önce bakteri yoğunluğunun artmasını sağlar. - Kalan bakteri ve hücresel kalıntıları peletlemek için oda sıcaklığında 20 dakika boyunca 4000 x g'da lizatları santrifüjleyin. Elde edilen süpernatanı 0.22 μm'lik bir naylon filtre kullanarak filtreyle sterilize edin ve süzüntüyü yeni 50 mL'lik konik santrifüj tüplerine aktarın.
- Kalan bakterileri öldürmek ve bakteri üremesini önlemek için filtrelenmiş T4 faj lizatının her hacmine 0.1 hacim kloroform ekleyin. Karıştırmak için kısaca vorteks yapın ve oda sıcaklığında 10 dakika inkübe edin.
NOT: Lipid zarflı fajlar kloroforma duyarlıdır, bu da faj titresini25 azaltabilir. Gerekirse bu adımı atlayın.
DİKKAT: Kloroform, solunduğunda, yutulduğunda veya cilt yoluyla emildiğinde tehlikeli olan toksik bir organik çözücüdür. Kloroform ile çalışırken çeker ocak ve uygun kişisel koruyucu ekipman (KKD) kullanın. Çoğu plastikle uyumlu olmadığı için kloroform ile çalışırken polistiren serolojik pipetler yerine cam kullanın. Kloroform, 1.2.5-1.2.6 adımları için polipropilen konik santrifüj tüplerine yerleştirilebilir, ancak plastik tüplerde uzun süre saklanmamalıdır. - Kloroformu lizattan ayırmak için lizatı 4000 x g'da oda sıcaklığında 5 dakika santrifüjleyin. Alttaki kloroform tabakasını bozmadan üst lizat tabakasını 50 mL'lik yeni bir konik tüpe dikkatlice aktarmak için serolojik bir pipet kullanın. Kloroform atıklarını uygun tehlikeli sıvı atık kabına atın. Lizatları ertesi gün konsantrasyon ve tampon değişimine kadar 4 °C'de saklayın.
- Cihazın üst rezervuarına 13 mL faj lizat ekleyerek ve 5 dakika boyunca 4000 x g'da santrifüjleyerek veya lizatın çoğu filtreden alt rezervuara geçene kadar 100 kDa'lık bir santrifüj filtre cihazında (Malzeme Tablosuna bakınız) faj lizatlarını konsantre edin.
NOT: Sıkma süresinin sonunda yaklaşık 2 mL lizat elde etmeyi hedefleyin. Lizat ilavesiyle filtredeki faj konsantrasyonu arttıkça, sıkma süreleri muhtemelen artacaktır. Santrifüj filtre cihazları, kuru dönmelerini önlemek için fiziksel bir ölü durdurmaya sahiptir32. Sürekli kullanım amaçlanıyorsa filtre membranının kurumasına izin vermeyin (yani, üst rezervuardaki tüm sıvıyı çıkararak). Sıkma süreleri faj tipine ve titreye göre değişebilir. - Bir P200 veya P1000 pipeti kullanarak, her dönüşten sonra filtre membranının tıkanıklığını açmak için kalan ~2 mL lizatı üst rezervuar içinde yukarı ve aşağı hafifçe pipetleyin. Süzüntüyü alt rezervuardan bir atık kabına atın ve konsantre fajı üst rezervuarda bırakın.
- Her dönüşten sonra üst rezervuarda ~2 mL konsantre faj tutulacak şekilde, tüm faj lizat hacmi filtre cihazından geçene kadar 1.2.7-1.2.8 adımlarını tekrarlayın.
- Son sıkmadan sonra üst rezervuarda kalan lizatı (~2 mL) yukarı ve aşağı pipetleyerek filtre membranının tıkanıklığını açın. Üst rezervuara 12 mL SM tamponu ekleyerek fajı (tampon değişimi) yıkayın ve 4000 x g'da 10 dakika boyunca veya tamponun çoğu filtreden geçene kadar santrifüjleyin.
- Süzüntüyü atın ve yıkama adımını tekrarlayın (adım 1.2.10). Uzun süreli depolama için SM tamponunda kalan 2 mL lizatı 10 mL (veya daha az) nihai hacme yeniden süspanse edin. Lizatı 50 mL'lik bir konik santrifüj tüpüne aktarın ve endotoksin giderilene kadar 4 ° C'de saklayın.
NOT: Faj lizatının konsantre edildiğinden emin olmak (> 108 pfu / mL) ve endotoksin çıkarma işlemi sırasında faj kaybını belirlemek için bu aşamada fajı titre etmek isteğe bağlıdır. - Toplam lizat hacmine 0.4 hacim 1-oktanol (Malzeme Tablosuna bakınız) ekleyerek T4 faj lizatından kirletici endotoksinleri çıkarın.
NOT: Endotoksinler, yüksek oranda immünostimülatör oldukları için çıkarılır ve bu nedenle varlıkları, fajdan bağımsız doğuştan gelen bir bağışıklık tepkisinin indüksiyonuna yol açabilir25.
DİKKAT: 1-Oktanol, güçlü bir kokuya sahip aromatik, organik, yanıcı bir bileşiktir ve gözü tahriş eder. 1-oktanol ile çalışırken uygun KKD giyin. Buhar solunmasını önlemek için tüm işleri çeker ocakta gerçekleştirin. Çeker ocak dışında çalışırken tüplerin sızmasını önlemek için sızdırmazlık filmi kullanın. - Sızıntıyı önlemek için konik santrifüj tüpünün kapağını sızdırmazlık filmi ile kapatın. Bir platform veya sallanan çalkalayıcı üzerinde 120 rpm'de oda sıcaklığında 1 saat çalkalayın, ardından 4 °C'de 1,5 saat çalkalamadan inkübe edin.
- Endotoksin ile temizlenmiş lizatı 1-oktanolden ayırmak için 10 dakika boyunca 4000 x g'da santrifüjleyin. 1-oktanol tabakası lizatın üzerinde yüzecektir. Mümkün olduğunca 1000 oktanol'ü dikkatlice çıkarmak için bir P1 pipeti kullanın ve uygun tehlikeli/yanıcı sıvı atık kabına atın.
- 18 oktanol katmanını toplamamaya dikkat ederek, kalan 1 oktanol tabakasının altındaki faj lizatını toplamak için 1 G iğne ve 1 mL şırınga kullanın. Lizatı hızlı vakuma kadar 4 °C'de saklayın.
- T4 faj lizatının 1 mL alikotlarını steril 1.5 mL mikrosantrifüj tüplerine aktarın. Lizattan kalan 1-oktanol'ü buharlaştırmak için oda sıcaklığında 4000 x g'da kapaklar açıkken hızlı vakum. 3 saat boyunca veya faj lizat hacmi %30 oranında azaltılana kadar hızlı vakum25. Titrasyona kadar 4 °C'de saklayın.
- Pfu / mL'deki konsantrasyonu belirlemek için faj lizatını titre edin. Elde edilen T4 faj lizatını SM tamponunda istenen konsantrasyona seyreltin ve onaylamak için yeniden titre edin.
- Üretici talimatlarına göre bir kromojenik endotoksin kantitasyon kiti kullanarak T4 faj lizatında bulunan endotoksinleri ölçün (bkz. Malzeme Tablosu). Son faj lizatındaki endotoksin seviyelerini, endotoksin giderme öncesi numune, araç kontrolleri, tampon ve fare içme suyu ile karşılaştırın.
NOT: Kromojenik endotoksin kantifikasyon kiti 1-oktanol25 ile inaktive edilir. Endotoksinleri ölçmeden önce 1-oktanol'ü (adım 1.2.16) çıkarmak için hızlı vakum adımlarını gerçekleştirin. Damıtılmış su için endotoksin içeriğinin 20 EU/mL25 olduğu tahmin edilmektedir; Bununla birlikte, fare içme suyunun endotoksin içeriği tesisler arasında değişebilir. Faj lizatındaki endotoksin seviyeleri içme suyunda bulunan miktarı aşarsa, endotoksin giderme adımlarını tekrarlamayı düşünün (1.2.12-1.2.16). - Konsantre, endotoksin ile temizlenmiş T4 faj lizatlarını 4 ° C'de SM tamponunda saklayın.
- Araç kontrolleri için fajsız bakteri lizatının hazırlanması
NOT: Faj içermeyen bir bakteri lizatı, farelere aşılandığında deneysel sonuçları etkileyebilecek adım 1.2'de faj lizat üretiminde üretilen bakteriyel kirleticilere (örneğin, endotoksin) bağlı herhangi bir etkiyi kontrol etmek için bir araç olarak hazırlanabilir.- Bir gecede E. coli kültüründen, E. coli 1:50'yi 100 mL LB ortamına alt kültürleyin. Faj eklemeden, 37 ° C'de 3 saat çalkalarken veya adım 1.2'de üretilen faj lizatı için inkübasyon süresini eşleştirirken bakterileri kültürlemeye devam edin.
- Bakteri hücrelerini manuel olarak parçalamak için 30 s darbeler (3x) için 30 kHz'de buz üzerinde bir sonikatör probu (Malzeme Tablosuna bakınız) kullanarak E. coli kültürünü 50 mL konik tüplere ve lizaz hücrelerine aktarın.
- Tüm temizleme, yıkama ve endotoksin giderme adımları dahil olmak üzere adım 1.2.4'ten başlayarak adım 1.2'ye göre protokolün geri kalanını izleyin.
NOT: Santrifüj filtre cihazını kullanarak konsantrasyon sırasında, araç lizatı, faj yokluğundan dolayı filtreden faj lizatından daha hızlı akacaktır. Bu nedenle, uzun süreli santrifüjleme sırasında ultrafiltre membranının kurumamasını sağlamak için santrifüj sürelerini 5 dakikadan 2-5 dakikaya kısaltın. - Faj içermediğini doğrulamak için araç lizatını titre edin.
- Araç lizatındaki endotoksin seviyelerini ölçmek için üretici talimatlarına göre bir kromojenik endotoksin kantitasyon kiti kullanın. Faj lizatındaki endotoksin seviyelerine uyması için araç lizatını SM tamponunda seyreltin.
- Alternatif deneysel kontroller: ısıyla inaktive edilmiş faj lizatının hazırlanması
NOT: Faj içermeyen bakteri lizatına bir alternatif, ısıyla etkisiz hale getirilmiş bir faj lizatıdır. Isı inaktivasyonu faj viryonlarını ayrıştırırken, lipopolisakkaritler (LPS) gibi rezidüel endotoksinler ısıya dayanıklıdır 8,33. Bu yöntem Gogokhia ve ark.8 tarafından immün aktivasyon için sağlam, canlı faj virionların gerekli olup olmadığını belirlemek için kullanılmıştır. Araştırmacılar, her iki yöntemi de (fajsız ve ısıyla etkisizleştirilmiş) test etmeye ve deneysel ihtiyaçları için hangi kontrolün en uygun olduğunu belirlemeye teşvik edilir. Hangisi seçilirse seçilsin, bir faj stoğunu konsantre etmek ve temizlemek için gereken önemli manipülasyon nedeniyle bir tampon kontrolünün uygun olma ihtimalinin düşük olduğunu kabul etmek önemlidir.- Gerekli hacimde temizlenmiş, saflaştırılmış ve seyreltilmiş T4 faj lizatını adım 1.2'den (fare başına 100 μL) kapak kilitleri ile donatılmış steril mikrosantrifüj tüplerine aktarın.
- Lizatları 95 °C'de 15 dakikaısıtın 16.
- İSTEĞE BAĞLI: Faj/bakteriyel nükleik asitlerin çıkarılması gerekiyorsa, Jakočiūnė ve Moodley34'e göre DNaz I ve RNase A tedavisi uygulayın. Kısaca:
- 450 μL ısıyla inaktive edilmiş faj lizatına 50 μL DNaz I 10x tampon, 1μL DNaz I (1 U/μL) ve 1 μL RNase A (10 mg/mL) (Malzeme Tablosuna bakınız) ekleyin.
- Lizatları 37 °C'de bir ısı bloğunda 1,5 saat çalkalamadan inkübe edin.
- 20 μL 0.5 M etilendiamintetraasetik asit (EDTA)34 ekleyerek DNaz I ve RNase A'yı etkisiz hale getirin.
- Lizatları soğutmak için 10 dakika oda sıcaklığında tutun ve birden fazla tüp kullanılıyorsa lizatları birleştirin. Titrasyona kadar 4 °C'de saklayın.
- Lizatta canlı bir T4 fajı bulunmadığını doğrulamak için bir faj titresi uygulayın. Isı ile etkisiz hale getirilmiş lizatları 4 °C'de saklayın.
- Isıyla inaktive edilmiş lizattaki endotoksin seviyelerini ölçmek için üretici talimatlarına göre bir kromojenik endotoksin kantitasyon kiti kullanın. SM tamponundaki ısıyla etkisiz hale getirilmiş lizatı, eşleşen faj lizatında bulunan endotoksin seviyelerine göre seyreltin.
2. E. coli monokolonize farelerde T4 fajının uygulanması ve izlenmesi
- E. coli ile farelerin monokolonizasyonu
- E. coli'yi gece boyunca LB ortamında tek bir koloniden toplanan E. coli'yi kültürleyerek GF farelerine8 uygulama için hazırlayın.
- Sıkı, steril koşullaraltında 35, oral gavaj yoluyla steril vinil izolatörlere veya biyo-dışlama hava geçirmez kafeslere yerleştirilmiş GF farelerine 200 μL E. coli kültürü uygulayın. Aerotolerant bakteriler kullanılıyorsa, fareler ayrıca her farenin sırtına 200 μL bakteri kültürü uygulanarak kolonize edilebilir.
NOT: Farklı bakteriler farklı pH hayatta kalma kabiliyetigösterdiğinden, aşılama dozu suşa bağlı olacaktır 36,37. Zucoloto ve ark.35, hayvan başına 1 x 108 cfu ile aşılamayı önermektedir. Burada gösterilen temsili sonuçlar, bir gece kültürü ile aşılanmış farelerden üretilmiştir (cfu belirlenmemiştir). İlgilenilen fare suşunun güvenilir kolonizasyonu ile sonuçlanan bir dozu belirlemek için pilot deneyler yapılabilir. Oral gavaj ile uygulanacak bakteri hacmi, farelerin yaşı ve ağırlığından etkilenebilir. İzin verilen maksimum dozlar için bireysel laboratuvar veya kurumsal hayvan etik protokolüne danışın. Burada önerilen hacim, fare vücut ağırlığının %10'u kadar bir gavaj payına dayanmaktadır (örneğin, 20 g'lık bir fare için maksimum 200 μL). Bazı bakteri türleri midenin asitliğini tolere etmez ve bağırsakları kolonize edemez. Mide asitlerininötralize etmek için önce 100 μL 1 M NaHCO3 ile gavaging yapmayı düşünün 2. Kolonize etmek için katı bir anaerob kullanılıyorsa, mikrobun anaerobik koşullar altında büyütülmesi ve ayrı ayrı hazırlanmış hava geçirmez kaplarda (her fare için 1 adet) gnotobiyotik hayvan tesisine aktarılması gerekecektir. Oksijene maruz kalma nedeniyle mikrobiyal canlılık kaybını sınırlamak için kap açıldıktan sonra her gavajı hızlı bir şekilde gerçekleştirin. - Fareleri olumsuz sağlık etkileri açısından izleyin.
NOT: Olumsuz sağlık etkileri olması durumunda, ilgili hayvan bakım tesisi tarafından belirlenen standartlara bakın. Olası olumsuz sağlık etkileri aşağıdakileri içerir, ancak bunlarla sınırlı değildir: (1) Gavaj sıvısının aspirasyonu: semptomlar arasında burun yoluyla kabarcıkların dışarı atılması, "açık ağız" solunum/nefes alma yer alır. (2) Yemek borusunun delinmesi: semptomlar arasında hızla sağlıksızlık, kamburluk, uyuşukluk yer alır ve 24 saat içinde hayvanın ölümüne yol açar. (3) Tekrarlanan gavajlar nedeniyle yemek borusu iltihabı: semptomlar arasında gavaj iğnesinin yerleştirilmesinde zorluk yer alır. (4) Mikrobiyomdaki değişikliklere bağlı ishal. - Haftada en az bir kez kültürleyerek ve/veya 16S rRNA dizilimi35 ile dışkı peletlerinde bakteri kolonizasyonunu doğrulayın.
NOT: Deney farelerinin üretimi için yetiştiricileri bir gnotobiyotik izolatör içinde kolonize ediyorsanız, 6 haftalık birinci nesil yavru (F1) deney farelerinin üretimi için en az 9 hafta önceden plan yapın. Alternatif olarak, GF yetişkin fareler monokolonize edilebilir. Bu yaklaşımda, faj aşılamasından önce kolonizasyondan sonra 7 hafta beklenmesi önerilir, çünkü bu, GF farelerine karmaşık bir mikrobiyota eklendikten sonra bağırsak mukozasının stabilize olması için gereken süredir38.
- T4 fajının E. coli monokolonize farelere oral aşılanması
- T4 faj lizatlarını ve araç kontrollerini SM tamponunda önceden belirlenmiş bir konsantrasyona seyreltin. Hsu ve ark.2'ye göre, fare 2 başına 2 x 106 pfu'nun uygulanmasına izin vermek için faj lizatlarını seyreltin2.
NOT: İn vivo fajın stabilitesine bağlı olarak daha yüksek veya daha düşük bir faj konsantrasyonu kullanılabilir. Fare başına 2 x 102, 2 x 104 ve 2 x 106 pfu T4 faj dozları, bağırsakta doza bağımlı görünmeyen stabil ve uzun süreli kolonizasyona neden oldu (temsili sonuçlar bölümünde gösterilmiştir). Bu nedenle faj-bakteri kinetiği, büyük ölçekli deneylerden önce in vivo olarak denenmelidir. - Steril, gnotobiyotik koşullar altında, mide asitlerini nötralize etmek için her fareyi 100 μL otoklavlanmış 1 MNaHCO3 ile gavajlayın. 10 dakika bekleyin, ardından 100 μL T4 faj lizatı veya araç kontrolü ile gavajlayın.
- Fareleri olumsuz sağlık etkileri açısından izleyin.
- T4 faj lizatlarını ve araç kontrollerini SM tamponunda önceden belirlenmiş bir konsantrasyona seyreltin. Hsu ve ark.2'ye göre, fare 2 başına 2 x 106 pfu'nun uygulanmasına izin vermek için faj lizatlarını seyreltin2.
3. T4 faj seviyelerinin in vivo izlenmesi
NOT: Fareler faj ile aşılandıktan sonra, hem fajların hem de hedef bakterilerin konsantrasyonu dışkı veya doku örneklerinde ölçülebilir. Bu, her iki organizmanın faj enfeksiyonunun kinetiği ve kolonizasyon dinamikleri hakkında bilgi sağlar.
- Dışkı peletlerindeki konsantrasyonu belirlemek için nokta kaplama T4 fajı
- T4 faj ve E. coli seviyelerini ölçmek için her fareden dışkı peletlerini steril, önceden tartılmış, mikrosantrifüj tüplerinde toplayın. Tüpleri kaplamaya kadar buz üzerinde saklayın.
NOT: Aerotolerant bakterilerin büyümesini yavaşlatmak için toplama ve kaplama arasındaki ara dönemde numuneleri buz üzerine yerleştirin. Birkaç saat boyunca, hala aerobik bakteri üremesi veya oksijene maruz kalma nedeniyle çarpık bakteri sayımlarına yol açabilecek bazı anaerobik bakteri ölümleri olabilir. Bu nedenle, numune alındıktan sonra mümkün olan en kısa sürede bakteri ve faj kaplaması yapılmalıdır. Zorunlu anaerobik bakteriler oksijene maruz kalmayı tolere etmeyecektir. Numuneyi korumak için, numuneleri kapalı tüplere toplayın ve tüpleri aldıktan sonra mümkün olan en kısa sürede anaerobik bir odaya aktarın. Dışkı örneklerinde büyüme tespit edilmezse, bakteri kantitasyonu için 16S rRNA qPCR gibi alternatifleri düşünün. - Her tüpün son ağırlıklarını kaydedin ve ilk tüp ağırlığını çıkararak numune ağırlığını hesaplayın. Bu, T4 faj ve E. coli konsantrasyonunu numune ağırlığına (sırasıyla pfu/g veya cfu/g) normalleştirmek için kullanılacaktır.
- Her tüpe 1 mL steril SM tamponu ekleyin ve dışkı peletlerini homojenize etmek için maksimum hızda (>1 dakika) iyice girdaplayın. Numune 15 mg'dan azsa, daha küçük bir hacimde SM tamponu eklenebilir. Numunenin cfob/g veya pfu/g hesaplamaları için her numuneye eklenen SM tamponunun hacmini kaydedin.
- 10 faktöründe 180 μL SM tamponunda her numuneden 20 μL'lik 8 (veya beklenen faj konsantrasyonuna bağlı olarak daha fazla) seri dilüsyon serisi hazırlayın. İlk tüpe/kuyucuğa eklemeden önce karıştırmak için homojenleştirilmiş her numuneyi kısaca vorteksleyin. Numune taşıma yoluyla faj veya bakteri sayımlarının şişmesini önlemek için her ekleme arasında karıştırmak ve her seyreltme arasında uçları değiştirmek için pipet kullanın.
NOT: Numunede bulunan lifler ve kalıntılar pipetlemeyi engelliyorsa, stok numuneyi daha da seyreltmek için dışkı bulamacına ek tampon ekleyin. - Her numunede T4 faj ve E. coli konsantrasyonunu belirlemek için E. coli (faj plak deneyleri için) veya LB agar plakaları (bakteri kolonisi deneyleri için% 1.5 agar) içeren LB yumuşak agar plakalarına her seyreltmenin 5 μL'sini yerleştirin. Doğruluk için, her numuneyi üç kopya halinde tespit edin.
NOT: 96 oyuklu bir plakada seri seyreltmeler hazırlıyorsanız, seri olarak seyreltilmiş numunenin her bir sütununu plakalara pipetlemek için 8 kanallı bir P20 çok kanallı pipet kullanılabilir. Faj pipet ucunun duvarlarına yapışabileceğinden ve her yeni kuyucuğa eklenen faj miktarını değiştirebileceğinden, en seyreltikten en konsantreye doğru hareket etse bile, her seyreltme arasında uçları değiştirin31. - Plakayı ters çevirmeden ve inkübatöre yerleştirmeden önce her noktanın kurumasını bekleyin. Gece boyunca 37 °C'de inkübe edin.
- Her numune için, nokta başına 3-30 sayılabilir plak bulunan seyreltmeyi seçin. Noktadaki plakların sayısını ve kullanılan seyreltmeyi sayın ve kaydedin.
- Plak sayısını, pfu/μL vermek için her bir noktada kaplanan hacme bölerek numunenin pfu/g'sini hesaplayın. Son olarak, pfu/g30 verecek şekilde numune ağırlığına bölün.

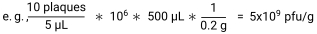
- T4 faj ve E. coli seviyelerini ölçmek için her fareden dışkı peletlerini steril, önceden tartılmış, mikrosantrifüj tüplerinde toplayın. Tüpleri kaplamaya kadar buz üzerinde saklayın.
- Deneysel uç noktalarda doku örneklemesi
- Seçilen her zaman noktasında, onaylanmış kurumsal hayvan etiği protokolüne göre farelere ötenazi yapın ve çekal içeriğini, ince ve kalın bağırsak içeriğini ve ilgilenilen dokuları steril, önceden tartılmış 2 mL yuvarlak tabanlı mikrosantrifüj tüplerinde toplayın.
- Numune ağırlığını hesaplamak için her tüpün son ağırlıklarını kaydedin. Mendilleri ve çekal içeriğini aynı gün kaplamaya kadar buz üzerinde saklayın.
- Her tüpe steril SM tamponu ekleyin ve eklenen hacimleri kaydedin.
- Çekal ve bağırsak içeriği için, adım 3.1.3'e göre iyice (>1 dakika) vorteks numuneleri alın.
- Doku örnekleri için, her tüpe bir steril metal boncuk ekleyin. 20 Hz'de 5 dakika boyunca veya dokular ayrışana ve süspansiyon homojen olana kadar bir doku parçalayıcı (Malzeme Tablosuna bakınız) kullanarak dokuları homojenize edin.
NOT: Numuneler iyi homojen olmazsa, eklenen SM tamponunun hacmini artırmayı, homojenizasyon süresini artırmayı veya homojenizasyon frekansını 30 Hz'e çıkarmayı düşünün. Bakteri ve faj geri kazanımına izin verirken dokuları ayırmak için bir doku homojenizatörü de kullanılabilir39,40. Homojenizatörler, bakteri bütünlüğünü korurken doku parçalayıcılardan daha yüksek frekanslarda çalıştırılır. - Her numunenin 10 faktöründe seri dilüsyonlarını hazırlayın ve adım 3.1.4-3.1.841'de açıklandığı gibi her numunedeki E. coli ve T4 faj konsantrasyonlarını belirlemek için nokta kaplama yapın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Fare bağırsağında T4 faj/E. coli dyad arasındaki etkileşimleri araştırmak için T4 fajı ve araç lizatları hazırlandı, temizlendi ve saflaştırıldı (Şekil 1A). T4 faj lizatları plak testi ile titre edildi ve SM tamponunda 2 x 107 pfu/mL'ye (2 x 106 pfu/fare) seyreltildi. Araç lizatları ayrıca canlı faj varlığını doğrulamak için titre edildi ve T4 faj lizatı ile aynı hacimde SM tamponu içinde seyreltildi. Endotoksin seviyeleri, bir ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Mikrobiyomdaki fajların incelenmesi, bakteriyel muadillerine kıyasla önemli bir zorluk teşkil etmektedir. Spesifik olarak, fajlar, sırasıyla prokaryotik ve ökaryotik türlerin dizilenmesinde ve tanımlanmasında kolaylık sağlayan 16S ve 18S ribozomal alt birimlerine benzer tüm fajlarda ortak olan korunmuş bir filogenetik belirteç içermez42. Bununla birlikte, artan okuma uzunlukları, verim ve azalan maliyetler dahil olmak üzere yeni nesil dizileme yaklaşımlarındaki ilerlemelerle b...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Yazarlar, bu araştırmayı yaptıkları arazinin xwməθkwəy̓əm (Musqueam) Ulusunun geleneksel, atalarından kalma ve işlenmemiş toprakları olduğunu kabul ediyorlar. Üzerinde bulunduğu arazi, binlerce yıldır kültürlerini, tarihlerini ve geleneklerini bu sitede bir nesilden diğerine aktaran Musqueam halkı için her zaman bir öğrenme yeri olmuştur. Diğerlerini, https://native-land.ca'da yaşadıkları ve çalıştıkları yerel topraklar hakkında daha fazla bilgi edinmeye teşvik ediyoruz. Yazarlar, Kanada Doğa Bilimleri ve Mühendislik Konseyi (NSERC) Kanada Yüksek Lisans Bursları - Yüksek Lisans (NP), Michael Smith Sağlık Araştırmaları BC Stajyer Ödülü (RT-2023-3174, MH'ye), Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi (NSERC) Keşif Hibeleri Programı (RGPIN-2019-04591'den CT'ye, RGPIN-2016-04282'den LCO'ya), Kanada İleri Araştırma Enstitüsü / İnsanlar ve Mikrobiyom (FL-001253 Appt 3362, CT'ye), Michael Smith Sağlık Araştırmaları Vakfı Burs Ödülü (18239, CT'ye), Kanada Sağlık Araştırmaları Enstitüleri (PJT-159458'den LCO'ya) ve Kanada İnovasyon Vakfı (34673'ten LCO'ya ve 38277'den CT'ye). UBC GREx Biyolojik Dayanıklılık Girişimi tarafından desteklenen UBC Hastalık Modelleme Merkezi ve ubcFLOW'un teknik desteği için ve makalenin eleştirel tartışmaları ve değerlendirilmesi için Osborne ve Tropini laboratuvarlarının üyelerine minnettarız. Şekil 1A ve Şekil 2A , Biorender.com kullanılarak oluşturulmuştur.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-octanol (99%) | Thermofisher | CAAAA15977-AP | |
| 50 ml PES Steriflip Sterile Disposable Vacuum Filter Units | Millipore Sigma | SCGP00525 | |
| Agarose (Low-EEO/Multi-Purpose/Molecular Biology Grade) | Fisher BioReagents | BP160-500 | |
| Amicon® 100kDa Ultra-15 centrifugal filter device, Ultracel-100 | Millipore Sigma | UFC910008 | |
| BD Microtainer® Tubes, SST | BD Medical | 365967 | |
| Bioexclusion airtight cages (ISO cages) | Techiplast | 1245ISOCAGE | |
| C1000 Touch™ Thermal Cycler with 96-Well Fast Reaction Module | BioRad | 1851196 | |
| Calcium Chloride Dihydrate (White Crystals to Powder) | Fisher BioReagents | BP510-500 | |
| Cap Locks For 1.5ML Tube 100/pk | Andwin Scientific | 16812612 | |
| Chloroform (Ethanol as Preservative/Certified ACS) | Fisher | C298-500 | |
| Copper coated steel beads (4.5 mm) | Crosman Corporation | 0767 | |
| DNeasy Blood & Tissue Kit (50) | Thermo Scientific | 69504 | |
| DreamTaq Green PCR Master Mix (2X) | Thermo Scientific | K1081 | |
| Ethylenediaminetetraacetic acid (EDTA) disodium salt solution, for molecular biology, 0.5 M in H2O | Sigma Aldrich | E7889 | |
| Fisher BioReagents™ Agar, Powder / Flakes, Fisher BioReagents™ | Fisher Bioreagents | BP1423-500 | |
| Fisher BioReagents™ Microbiology Media: LB Broth (Powder) - Lennox | Fisher Bioreagents | BP1427-500 | |
| GeneRuler 100 bp DNA Ladder | Thermo Scientific | SM0241 | |
| Green FastMix® qPCR mix, 1250 rxns | QuantaBio | 95072-012 | |
| HEPA filters for isocage lids, AUTOCLAVABLE H14 FILTERS FOR ISO LINE- IRRADIATED | Techiplast | UISOHEPAXTBOX-300 | |
| Magnesium sulfate heptahydrate | Fisher BioReagents | BP213-1 | |
| MaxQ 6000 Incubated Shaker | Thermo Scientific | 8354-30-0009 | |
| Microbiology Media: LB Broth (Powder) - Lennox | Fisher BioReagents | BP1427-500 | |
| Microcentrifuge Tubes with Locking Snap Cap, 2ml | Fisher | 14-666-315 | |
| Parafilm sealing film | Bemis | PM-996 | |
| Phage stocks | Carolina Biological Supply | n/a | |
| PicoLab® Mouse Diet 20 EXT | LabDiet | 5R58 | |
| Pierce™ Chromogenic Endotoxin Quant Kit | Thermo Scientific | A39552S | |
| RNase A (17,500 U) | Qiagen | 19101 | |
| RNase-free DNase Set | Qiagen | 79254 | |
| Sodium Bicarbonate (Fine White Powder) | Fisher Chemical | BP328-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Chemical | S271 | |
| Sonicator (probe model CL-18; power source model FB50) | Fisher scentific | n/a | |
| Sterile flexible film isolator | Class Biologically Clean | n/a | |
| SYBR™ Safe DNA Gel Stain | Invitrogen | S33102 | |
| T100 Thermal Cycler | BioRad | 1861096 | |
| T4 phage primer, forward (CCACACATAGCGCGAGTATAA) | IDT | n/a | |
| T4 phage primer, forward (GAAACTCGGTCAGGCTATCAA) | IDT | n/a | |
| TissueLyser II | Qiagen | 85300 | |
| Tris-HCl, 1M Solution, pH 8.0, Molecular Biology Grade, Ultrapure | Thermo Scientific | AAJ22638AE | |
| Water, (DNASE, RNASE free) | Fisher BioReagents | BP2484100 |
Referanslar
- Rohwer, F., Segall, A. M. A century of phage lessons. Nature. 528 (7580), 46-47 (2015).
- Hsu, B. B., et al. Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model. Cell Host & Microbe. 25 (6), 803-814.e5 (2019).
- Gordillo Altamirano, F. L., Barr, J. J. Phage Therapy in the postantibiotic era. Clinical Microbiology Reviews. 32 (2), (2019).
- Schooley, R. T., et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Ott, S. J., et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152 (4), 799-811.e7 (2017).
- Zuo, T., et al. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 67 (4), 634-643 (2018).
- Norman, J. M., et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 160 (3), 447-460 (2015).
- Gogokhia, L., et al. Expansion of bacteriophages is linked to aggravated intestinal inflammation and colitis. Cell Host & Microbe. 25 (2), 285-299.e8 (2019).
- Brunse, A., et al. Fecal filtrate transplantation protects against necrotizing enterocolitis. The ISME Journal. 16 (3), 686-694 (2022).
- Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. M., Hooper, L. V. A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17621-17626 (2012).
- Barr, J. J., et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proceedings of the National Academy of Sciences of the United States of America. 110 (26), 10771-10776 (2013).
- Nguyen, S., et al. Bacteriophage Transcytosis provides a mechanism to cross epithelial cell layers. mBio. 8 (6), (2017).
- Bichet, M. C., et al. Bacteriophage uptake by mammalian cell layers represents a potential sink that may impact phage therapy. iScience. 24 (4), 102287(2021).
- Buttimer, C., et al. Impact of a phage cocktail targeting Escherichia coli and Enterococcus faecalis as members of a gut bacterial consortium in vitro and in vivo. Frontiers in Microbiology. 13, 936083(2022).
- Li, Y., et al. Bacteriophages allow selective depletion of gut bacteria to produce a targeted-bacterium-depleted mouse model. Cell Reports Methods. 2 (11), 100324(2022).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20236-20241 (2013).
- Federici, S., et al. Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 185 (16), 2879-2898.e4 (2022).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science (New York, N.Y.). 363 (6434), (2019).
- Fluckiger, A., et al. Cross-reactivity between tumor MHC class I-restricted antigens and an enterococcal bacteriophage. Science (New York, N.Y.). 369 (6506), 936-942 (2020).
- Majewska, J., et al. Induction of Phage-Specific Antibodies by Two Therapeutic Staphylococcal Bacteriophages Administered per os. Frontiers in Immunology. 10, 2607(2019).
- Weiss, M., et al. In vivo replication of T4 and T7 bacteriophages in germ-free mice colonized with Escherichia coli. Virology. 393 (1), 16-23 (2009).
- Thomson, C. A., Morgan, S. C., Ohland, C., McCoy, K. D. From germ-free to wild: modulating microbiome complexity to understand mucosal immunology. Mucosal Immunology. 15 (6), 1085-1094 (2022).
- Al-Asmakh, M., Zadjali, F. Use of germ-free animal models in microbiota-related research. Journal of Microbiology and Biotechnology. 25 (10), 1583-1588 (2015).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Bonilla, N., et al. Phage on tap-a quick and efficient protocol for the preparation of bacteriophage laboratory stocks. PeerJ. 4, e2261(2016).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. 1, Cold Spring Harbor Laboratory Press. New York, NY. (2001).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology (Clifton, N.J). 501, 69-76 (2009).
- Manikantha, B., Karthika, R., Murugadas, V., Vishnuvinayagam, S., Rao, B. M. Comparison of the single agar and double agar layer methods for enumeration of bacteriophages. Fishery Technology. 59, 60-63 (2022).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, e3064(2012).
- Louten, J. Chapter 7 - Detection and diagnosis of viral infections. Essential Human Virology. , 111-132 (2016).
- Richter, Ł, et al. Adsorption of bacteriophages on polypropylene labware affects the reproducibility of phage research. Scientific Reports. 11 (1), 7387(2021).
- Merck KGaA. Amicon Ultra-15 Centrifugal Filter Devices. , Darmstadt, Germany. https://www.emdmillipore.com/CA/en/product/Amicon-Ultra-15-Centrifugal-Filter-Unit,MM_NF-UFC901024#documentation (2018).
- Hecker, W., Witthauer, D., Staerk, A. Validation of dry heat inactivation of bacterial endotoxins. PDA Journal of Pharmaceutical Science and Technology. 48 (4), 197-204 (1994).
- Jakočiūnė, D., Moodley, A. A Rapid bacteriophage DNA extraction method. Methods and Protocols. 1 (3), 27(2018).
- Zucoloto, A. Z., Yu, I. L., McCoy, K. D., McDonald, B. Generation, maintenance, and monitoring of gnotobiotic mice. STAR Protocols. 2 (2), 100536(2021).
- Ng, K. M., et al. Single-strain behavior predicts responses to environmental pH and osmolality in the gut microbiota. mBio. 14 (4), e0075323(2023).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nature Reviews. Microbiology. , (2023).
- Bergstrom, K., Xia, L. The barrier and beyond: Roles of intestinal mucus and mucin-type O-glycosylation in resistance and tolerance defense strategies guiding host-microbe symbiosis. Gut Microbes. 14 (1), 2052699(2022).
- Askar, M., Ashraf, W., Scammell, B., Bayston, R. Comparison of different human tissue processing methods for maximization of bacterial recovery. European Journal of Clinical Microbiology & Infectious Diseases. 38 (1), 149-155 (2019).
- Redanz, S., Podbielski, A., Warnke, P. Improved microbiological diagnostic due to utilization of a high-throughput homogenizer for routine tissue processing. Diagnostic Microbiology and Infectious Disease. 82 (3), 189-193 (2015).
- Bhinder, G., et al. The Citrobacter rodentium mouse model: studying pathogen and host contributions to infectious colitis. Journal of Visualized Experiments. 72, e50222(2013).
- Reyes, A., Semenkovich, N. P., Whiteson, K., Rohwer, F., Gordon, J. I. Going viral: next-generation sequencing applied to phage populations in the human gut. Nature Reviews Microbiology. 10 (9), 607-617 (2012).
- Camarillo-Guerrero, L. F., Almeida, A., Rangel-Pineros, G., Finn, R. D., Lawley, T. D. Massive expansion of human gut bacteriophage diversity. Cell. 184 (4), 1098-1109.e9 (2021).
- Reyes, A., et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466 (7304), 334-338 (2010).
- Bach, M. S., et al. Filamentous bacteriophage delays healing of Pseudomonas-infected wounds. Cell Reports. Medicine. 3 (6), 100656(2022).
- Filyk, H. A., Osborne, L. C. The multibiome: The intestinal ecosystem's influence on immune homeostasis, health, and disease. EBioMedicine. 13, 46-54 (2016).
- Rohwer, F., Merry, Y., Maughan, H., Hisakawa, N. Heather Life in Our Phage World: A Centennial Field Guide to the Earth's Most Diverse Inhabitants. Wholon. , San Diego. (2014).
- Glonti, T., Pirnay, J. P. In Vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 14 (7), 1490(2022).
- Fraser, J. S., Yu, Z., Maxwell, K. L., Davidson, A. R. Ig-like domains on bacteriophages: a tale of promiscuity and deceit. Journal of Molecular Biology. 359 (2), 496-507 (2006).
- Li, H., et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications. 6, 8292(2015).
- Bergström, A., et al. Nature of bacterial colonization influences transcription of mucin genes in mice during the first week of life. BMC Research Notes. 5, 402(2012).
- Adams, M. H. Bacteriophages. , Interscience Publishers. https://books.google.co.uk/books?id=3wVrAAAAMAAJ (1959).
- Kutter, E., Sulakvelidze, A. Bacteriophages: Biology and Applications. , CRC Press. https://books.google.co.uk/books?id=flHOvAEACAAJ (2004).
- Bao, H., et al. Dysbiosis and intestinal inflammation caused by Salmonella Typhimurium in mice can be alleviated by preadministration of a lytic phage. Microbiological Research. 260, 127020(2022).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır