Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Взаимодействие бактериофага Т4 и кишечной палочки в кишечнике мышей: прототипная модель для изучения динамики бактериофагов хозяина in vivo
В этой статье
Резюме
Бактериофаги (фаги), вирусы, заражающие бактерии, являются неотъемлемым компонентом микробиома кишечника. Хотя эти симбиотические обитатели управляют бактериальной приспособленностью и динамикой популяции, мало что известно о том, как они влияют на гомеостаз кишечника и болезни. Этот протокол изучает изолированные фаги Т4 в мышиной модели, адаптируемые к другим фаго-бактериальным парам.
Аннотация
Бактериофаги (фаги) — это вирусы, которые инфицируют бактерии со специфичностью на уровне видов и штаммов и являются наиболее распространенными биологическими объектами во всех известных экосистемах. В бактериальных сообществах, таких как микробиоты кишечника, фаги участвуют в регулировании динамики популяций микробиоты и стимулируют эволюцию бактерий. В последнее десятилетие возобновился интерес к исследованиям фагов, отчасти из-за специфичной для хозяина способности литических фагов убивать, что является многообещающим инструментом для противодействия растущей угрозе устойчивых к противомикробным препаратам бактерий. Кроме того, недавние исследования, демонстрирующие, что фаги прилипают к кишечной слизи, позволяют предположить, что они могут играть защитную роль в предотвращении бактериальной инвазии в нижележащий эпителий. Важно отметить, что, как и бактериальные микробиомы, нарушенные фагеомы связаны с ухудшением исходов таких заболеваний, как воспалительные заболевания кишечника. Предыдущие исследования показали, что фаги могут модулировать микробиом животных и людей с помощью трансплантации фекальных фильтратов, принося пользу здоровью хозяина. В связи с недавней волной исследований возникла необходимость в разработке и стандартизации протоколов изучения фагов в контексте микробиома кишечника. Данный протокол предусматривает комплекс процедур для изучения изолированных фагов Т4 и их бактериального хозяина, кишечной палочки, в контексте желудочно-кишечного тракта мышей. Методы, описанные здесь, описывают, как начать с лизата фага, ввести его мышам и оценить влияние на бактериальный хозяин и уровни фагов. Этот протокол может быть модифицирован и применен к другим фаго-бактериальным парам и является отправной точкой для изучения динамики хозяин-фаг in vivo.
Введение
Бактериофаги, или фаги, — это вирусы, которые инфицируют и убивают бактерии со специфичностью на уровне видов и штаммов1. Фаги играют важную роль в сложных бактериальных сообществах, таких как микробиота кишечника, где они участвуют в регулировании динамики популяций и обеспечении приспособленности бактерий2. В течение последнего десятилетия возродился интерес к исследованиям фагов в связи с ростом числа устойчивых к противомикробнымпрепаратам патогенов3 и потенциалом фаговой терапии в качестве альтернативной стратегии лечения. В последние годы коктейли с литическими фагами используются внутривенно с некоторым успехом при серьезных, устойчивых к антибиотикам бактериальных септических инфекциях у людей 3,4. Пероральная фаговая терапия также была предложена в качестве потенциальной альтернативы антибиотикам для лечения кишечных инфекций и воспалений. Кроме того, фаги участвуют в успешном проведении трансплантации фекального фильтрата (БПФ), представляющего собой препараты фекальной микробиоты, фильтруемые для удаления бактерий, при лечении рецидивирующей инфекции Clostridioides difficile (rCDI)5,6, воспалительных заболеваний кишечника (ВЗК)7,8 и некротизирующего энтероколита у недоношенных свиней9. Учитывая эти результаты, важно учитывать взаимодействие как между фагами и микробиотой кишечника, так и между фагами и хозяином млекопитающих, поскольку добавление новых фагов в уже существующее сообщество может иметь косвенное влияние на сообщество в целом, а не только на его целевыебактерии 2,10.
Изучение взаимодействия фагов с бактериями-мишенями in vitro оказалось полезным для понимания механизмов и последствий взаимодействия фагов и бактерий в кишечнике. В этих условиях было показано, что специфическим Т4-фагам Escherichia coli порядка Caudovirales требуются иммуноглобулиновые (Ig)-подобные домены, расположенные в высокоантигенных белках внешнего капсида (Hoc) на поверхности вириона, для прилипания к кишечной слизи11. Кроме того, трансвелл-анализы показали, что фаги Т4 способны взаимодействовать с эпителиальными клеточными культурами и транслоцироваться через клеточные слои путем макропиноцитоза12,13. Эти результаты подтверждают гипотезу о том, что фаги могут взаимодействовать со своим многоклеточным хозяином, даже если они не способны инфицировать эукариотические клетки. Эти модели, хотя и полезны, не учитывают весь спектр сложных взаимодействий, происходящих в экосистеме кишечника, которые необходимы для всестороннего исследования трехстороннего взаимодействия между фагами, бактериями и многоклеточным хозяином.
Мышиные модели являются важным инструментом для исследования фагов в сложных средах. Желательным применением фагового введения является альтернативная стратегия лечения инфекций, устойчивых к противомикробным препаратам, или патологий, связанных с хроническими воспалительными заболеваниями, включая ВЗК. Тем не менее, в новой литературе высказывается предположение, что поведение фагов in vitro не в полной мере отражает функции in vivo. Buttimer et al.14 продемонстрировали, что фаговый коктейль способен истощать целевые бактерии в упрощенном консорциуме микробиоты человека in vitro, но не может быть воспроизведен in vivo на гнотобиотических мышах, колонизированных тем же бактериально-фаговым консорциумом. Кроме того, в обычном микробиоме мышей фаг Т7 приводил к селективному истощению кишечных бактерий-мишеней, хотя со временем наблюдалось постепенное восстановление, что свидетельствует об эволюционировавшей резистентности15. Другие исследования продемонстрировали сосуществование перорально вводимых фагов и их штаммов-мишеней бактерий in vivo 2,16. Действительно, помимо сосуществования фагов и бактерий, введение фагов привело к широкомасштабным изменениям в общем составе и функционировании сообщества микробиоты 2,16. Это актуально в условиях заболевания, поскольку в нескольких исследованиях была обнаружена связь между повышенным относительным количеством Caudovirales и ВЗК 7,8,17, которые не зависели от изменений в бактериальной численности7. Остается неизвестным, является ли это драйвером или следствием патогенеза заболевания.
Исторически в центре внимания фаговых исследований были отношения между фагом и его бактерией-мишенью. Однако также важно учитывать потенциальные взаимодействия между фагом и слизистой оболочкой, эпителием и иммунной системой многоклеточного хозяина. Все эти взаимодействия играют важную роль в общей реакции на кишечную фаговую инфекцию. Чтобы продемонстрировать это, фаги были изучены на безмикробных мышах (GF), чтобы выяснить их влияние на иммунную систему без вмешательства микробиоты8. В этой системе фаговые нуклеиновые кислоты детектировались толл-подобными рецепторами (TLR), расположенными в эндосомах фагоцитарных иммунных клеток (макрофагов и дендритных клеток). Это активировало нисходящую передачу сигналов и стимулировало Т-клеточную зависимую продукцию интерферона (ИФН)-γ8 или ИФН I типа18. Кроме того, Fluckiger et al.19 вовлекали CD8+ Т-клетки памяти в распознавание фаг-кодируемых (профаговых) антигенов, что приводило к перекрестной реактивности Т-клеток с опухолевыми антигенами, что приводило к снижению опухолевой нагрузки. Наконец, выработка фагоспецифических антител была задокументирована в исследованиях на мышах, где фаги доставлялись животным моделям непрерывно через питьевую воду 8,20 или путем многократного перорального зондирования в течение несколькихмесяцев20, демонстрируя способность фаговых белков стимулировать гуморальный иммунный ответ. Несмотря на то, что эти способы фаговой инокуляции позволяют обеспечить оптимальную и непрерывную подготовку иммунной системы, они могут не отражать естественное взаимодействие между фагами и кишечной средой, а также кинетику пероральной фаговой терапии. До сих пор в ограниченном числе исследований изучалось взаимодействие фага с одним видом бактерий в моноколонизированных мышиных моделях21. Тем не менее, моноколонизированные мыши оказались критически важными в расшифровке микробно-специфических эффектов отдельных видов на желудочно-кишечный тракт (ЖКТ) и иммунное развитие 22,23,24, и они еще могут оказаться полезными для понимания трехсторонних взаимодействий между фагами, их бактериями-мишенями и многоклеточным хозяином.
Интересно, что еще многое предстоит узнать о взаимодействии между кишечным фагом и кишечными комменсальными бактериями, а также о взаимодействиях, которые происходят между многоклеточным хозяином и фагами, которые в нем находятся. Этот протокол предусматривает набор процедур для изучения изолированного фага Т4 и его бактериального аналога E. coli (K-12, BW25113) с использованием гнотобиотической мышиной модели. Эти стандартизированные процедуры также обеспечивают основу для оптимизации других диад фаг/бактерия путем адаптации параметров роста к интересующим парам. Методы, описанные здесь, включают: (1) Приготовление фагов Т4 и носителей лизатов для перорального зондирования мышей; (2) Пероральное введение фага Т4 моноколонизированным гнотобиотическим мышам E. coli ; (3) Мониторинг уровня фагов Т4 в фекалиях и тканях мышей с течением времени.
Для получения репрезентативных результатов, представленных здесь, очищенные лизаты фагов Т4 размножали из запасов фаговых банков, поддерживаемых лабораторией Рохвера. Метод Phage-on-Tap для размножения фага Т4 был адаптирован25, как указано в этом протоколе. Метод позволяет получить высокие титры и низкий уровень эндотоксинов в течение трех дней. Используя этот подход, обычно собирали 10 мл ≥10 10 бляшеобразующих единиц (БОЕ)/мл фага Т4 с < 0,5 единиц эндотоксина (ЕС)/мл. Рекомендуемые уровни эндотоксина для перорального или внутривенного введения мышам составляют ≤ 20 ЕС/мл и ≤ 5 ЕЗЕ/кг/ч (или 0,1 ЕИ, вводимых в течение 1 ч для мышей весом 20 г), соответственно, что делает этот метод подходящим методом подготовки фагов для инокуляции in vivo . Все запасы фагов хранили при температуре 4 °C в фаговом буфере на основе солевого магния (SM) (рецепт приведен на этапе 1.1.5.1). Кишечную палочку культивировали в средах LB. Для различных пар фаг-бактерии этот протокол может адаптировать различные питательные среды и условия роста. Фаги также могут быть получены из окружающей среды, такой как сточные воды, морская вода, почва и содержимое кишечника, и могут быть изолированы и очищены в соответствии с Сэмбруком и Расселом26 перед приготовлением, используя соответствующие условия роста и размножения для каждой интересующей пары фаг-хозяин25. В качестве альтернативы фаги могут быть получены из коммерческих источников (см. Таблицу материалов) или из фаговых банков.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты проводились в соответствии с рекомендациями, установленными Комитетом по уходу за животными UBC и протоколами, утвержденными Комитетом по биобезопасности (A23-0113, B19-0038). Мыши были помещены в Университет Британской Колумбии в условиях, свободных от патогенов, в Центре моделирования заболеваний. Мыши C57BL/6 были выращены на объекте в стерильном изоляторе из гибкой пленки, обеспеченном стерильным мышиным кормом, водой, подстилкой и гнездовым материалом. Мышей поддерживали в 12-часовом цикле день/ночь. Экспериментальные мыши, как самцы, так и самки, были сопоставимы по возрасту в каждом эксперименте, в возрасте от 6 до 12 недель и весом 15-30 г для всех экспериментов.
1. Приготовление фагов и носителей лизатов для перорального зондирования мышей
- Фаговая очистка и формирование запасов
ПРИМЕЧАНИЕ: В этом исследовании фаги Т4 выращивают и титруют путем нанесения на газон из бактерий с использованием метода одного слоя агара, описанного ниже. Метод двойного агарового слоя был описан ранее25,27а также может использоваться с аналогичной эффективностью. Для этого протокола был выбран метод одного слоя агара, поскольку он обеспечивает улучшенную видимость зубного налета28.- Выращивают кишечную палочку в 5 мл стерильной среды LB в стерильных пробирках из полистирола или стеклянных культуральных пробирок (с крышками). Инкубируйте пробирки при температуре 37 °C при встряхивании при 200 об/мин в течение ночи, пока не будет достигнута неподвижная фаза.
- Готовят мягкий агар в стеклянной бутылке с наполнителем путем автоклавирования LB с 0,5% агаром и охлаждения до 50 °C или ниже (оставаясь при этом жидкостью) перед добавлением. Приготовьте достаточное количество мягкого агара по 15 мл на тарелку.
- Добавьте мягкий агар с MgSO4 и CaCl2 до конечной концентрации 1 мМ для каждого. Добавьте 100 мкл ночной культуры кишечной палочки на каждые 3 мл мягкого агара. Осторожно перемешайте с помощью магнитной мешалки, чтобы гомогенизировать добавки и культуру в мягком агаре.
ПРИМЕЧАНИЕ: Постоянство объема и плотности кишечной палочки , добавляемой в препарат мягкого агара, имеет решающее значение (указано в разделе репрезентативных результатов). - Добавьте 15 мл мягкого агара + кишечной палочки в чашку Петри (диаметр 15 см) с помощью серологической пипетки. Дайте тарелкам застыть при комнатной температуре для использования в тот же день.
ПРИМЕЧАНИЕ: Тарелки застынут примерно через 20 минут с открытыми крышками. Агар останется мягким, но не будет смещаться при переворачивании пластин. - Готовят 8-10 серийных разведений исходного фага Т4 в коэффициентах 10 путем разведения в буфере СМ. Нанесите по 5 мкл каждого раствора на планшеты. Дайте пятнам высохнуть, переверните и инкубируйте пластины при 37 °C в течение ночи.
- Для приготовления фагового буфера на основе солевого магния (СМ) в 1 л деионизированного H2O растворяют 100 мМ NaCl, 8 мМ MgSO4·7H2O и 50 мМ Tris-HCl (рН 7,4). Автоклавируйте и храните при комнатной температуре.
ПРИМЕЧАНИЕ: На следующий день кишечная палочка должна была вырасти в газон по всему мягкому агару LB. Бляшки или расчищенные участки роста, видимые на газоне E. coli , появятся там, где произошло фаговое уничтожение инфицированных хозяев E. coli . Каждая табличка представляет собой единицу формирования бляшки (БОУ).
- Для приготовления фагового буфера на основе солевого магния (СМ) в 1 л деионизированного H2O растворяют 100 мМ NaCl, 8 мМ MgSO4·7H2O и 50 мМ Tris-HCl (рН 7,4). Автоклавируйте и храните при комнатной температуре.
- Возьмите одну бляшку из мягкой агаровой пластины, вдавливая стерильный наконечник пипетки в центр бляшки, создавая агаровую пробку на конце наконечника. Повторно суспендируйте пробку бляшки в 1 мл буфера SM в пробирке для микроцентрифуги объемом 1,7 мл. Встряхните трубку на максимальной скорости в течение 1 минуты для смешивания.
- Центрифугируйте пробирку при 4000 x g в течение 5 минут при комнатной температуре, чтобы удалить мусор из лизата. Перелейте надосадочную жидкость в новую микроцентрифужную пробирку.
- Для размножения изолированного фага повторите шаги 1.1.1-1.1.3. Добавьте 100 мкл изолированного фага к 15 мл аликвоты мягкого агара, содержащего кишечную палочку, в конической пробирке. Переверните пробирку три раза, чтобы перемешать, и вылейте агар в чашку Петри.
- Дайте планшетам высохнуть, прежде чем переворачивать и инкубировать в течение ночи при 37 °C. Подготовьте контрольную пластину для газона без фага для подтверждения жизнеспособности кишечной палочки .
ПРИМЕЧАНИЕ: После ночной инкубации контрольная пластина должна иметь газон E.coli, в то время как пластина, содержащая фаги, должна быть полностью лизирована. - Чтобы извлечь фаг из планшета, добавьте 5 мл буфера SM на поверхность планшета, очищенного фагом, и встряхните при 70 об/мин на коромысле в течение 15 мин при комнатной температуре.
- Соберите буфер с планшета в коническую центрифужную пробирку объемом 50 мл и центрифугируйте при 4000 x g в течение 5 минут при комнатной температуре, чтобы гранулировать любой мусор из агаровой пластины.
- Соберите лизат фага Т4 в новую пробирку и храните при температуре 4 °C до титрования и распространения.
ПРИМЕЧАНИЕ: Фаги Т4 стабильны более 10 лет25; Однако стабильность будет зависеть от типа фага и условий хранения. Титр фага также будет меняться в зависимости от времени хранения. Фаги чувствительны к замораживанию. Поэтому рекомендуется проводить криоконсервацию в жидком азоте и избегать циклов замораживания-оттаивания, так как это может привести к повреждению фагов, снижая титр фагов25. - Титр лизата фага Т4 для определения концентрации в БОЕ/мл, как описано ранее 25,29,30. Фаговый запас Т4 с высоким титром будет содержать 108 КОЕ/мл или более.
- Получение экспериментальных фаговых лизатов
- Бактериологическое исследование E. coli в 5 мл жидких сред в стерильных пробирках из полистирола или стекла (с крышками). Инкубируйте пробирки в течение ночи при температуре 37 °C при встряхивании при 200 об/мин, пока не будет достигнута неподвижная фаза.
- Субкультура: ночная культура кишечной палочки 1:50 в 100 мл LB среды в стеклянной конической колбе. Инкубируйте при температуре 37 °C при встряхивании при 200 об/мин до тех пор, пока бактерии не достигнут ранней или средней экспоненциальной фазы (около 1,5 ч).
ПРИМЕЧАНИЕ: Начальная кривая роста может быть выполнена для определения оптической плотности в диапазоне 600 нм (OD600), в котором бактериальная культура находится в экспоненциальной фазе. Предполагается культивирование в стеклянной конической пробирке, поскольку недавние данные показали, что фаги способны прилипать к пластмассам, таким как полипропилен31. - Добавьте 100 мкл высокотитрового фагового запаса Т4 из стадии 1.1 в субкультуру E. coli и инкубируйте при 37 °C при встряхивании в течение 3 ч или до тех пор, пока новый лизат не перестанет мутнеть. Соберите лизат фага Т4 в конические пробирки по 50 мл и либо приступайте непосредственно к этапам очистки, либо, при необходимости, храните при температуре 4 °C до следующего дня.
ПРИМЕЧАНИЕ: Больший размер фагового всплеска (указывающий на более высокое среднее количество вирионов, высвобождаемых за цикл репликации) требует более длительного инкубационного периода для бактериальной субкультуры на этапе 1.2.2. Это обеспечивает повышенную плотность бактерий перед спайком с запасами фагов. - Центрифуга лисаты при 4000 x g в течение 20 минут при комнатной температуре, чтобы гранулировать оставшиеся бактерии и клеточный мусор. Полученную надосадочную жидкость процедить-стерилизовать с помощью нейлонового фильтра 0,22 мкм и перенести фильтрат в новые конические центрифужные пробирки объемом 50 мл.
- Добавьте 0,1 объема хлороформа к каждому объему отфильтрованного лизата фага Т4, чтобы убить все оставшиеся бактерии и предотвратить рост бактерий. Быстро перемешать и инкубировать при комнатной температуре в течение 10 мин.
ПРИМЕЧАНИЕ: Фаги с липидной оболочкой чувствительны к хлороформу, что может снижать титр фага25. При необходимости пропустите этот шаг.
ВНИМАНИЕ: Хлороформ является токсичным органическим растворителем, который опасен при вдыхании, проглатывании или всасывании через кожу. При работе с хлороформом используйте вытяжной шкаф и соответствующие средства индивидуальной защиты (СИЗ). При работе с хлороформом используйте стекло вместо полистирольных серологических пипеток, так как он не совместим с большинством пластмасс. Хлороформ можно помещать в полипропиленовые конические центрифужные пробирки для этапов 1.2.5-1.2.6, но не следует хранить длительное время в пластиковых пробирках. - Центрифугируйте лизат при 4000 x g в течение 5 минут при комнатной температуре, чтобы отделить хлороформ от лизата. С помощью серологической пипетки осторожно переложите верхний слой лизата в новую коническую пробирку объемом 50 мл, не нарушая нижележащий слой хлороформа. Выбросьте отходы хлороформа в соответствующий контейнер для опасных жидких отходов. Хранят лизаты при температуре 4 °C до концентрации и замены буфера на следующий день.
- Сконцентрируйте лизаты фагов в центробежном фильтрующем устройстве с давлением 100 кДа (см. таблицу материалов), добавив 13 мл лизата фага в верхний резервуар устройства и центрифугируя при 4000 x g в течение 5 мин или до тех пор, пока большая часть лизата не пройдет через фильтр в нижний резервуар.
ПРИМЕЧАНИЕ: Стремитесь получить примерно 2 мл лизата в конце времени отжима. По мере увеличения концентрации фагов в фильтре с добавлением лизата, время отжима, вероятно, будет увеличиваться. Центробежные фильтрующие устройства имеют физическую мертвую остановку, предотвращающую их сухое вращение32. Не допускайте высыхания фильтрующей мембраны, если предполагается ее дальнейшее использование (например, путем удаления всей жидкости из верхнего резервуара). Время вращения может варьироваться в зависимости от типа фага и титра. - Используя пипетку P200 или P1000, осторожно пипетируйте оставшиеся ~2 мл лизата вверх и вниз в верхнем резервуаре, чтобы прочистить фильтрующую мембрану после каждого отжима. Выбросьте фильтрат из нижнего резервуара в контейнер для отходов, оставив концентрированный фаг в верхнем резервуаре.
- Повторяйте шаги 1.2.7-1.2.8 до тех пор, пока весь объем лизата фага не будет пропущен через фильтрующее устройство, при этом ~2 мл концентрированного фага остаются в верхнем резервуаре после каждого отжима.
- Очистите фильтрующую мембрану после последнего отжима, пипетируя оставшийся лизат (~2 мл) в верхнем резервуаре вверх и вниз. Промыть фаг (буферный обмен), добавив 12 мл буфера SM в верхний резервуар и центрифугу при 4000 x g в течение 10 мин или до тех пор, пока большая часть буфера не пройдет через фильтр.
- Выбросьте фильтрат и повторите этап промывки (шаг 1.2.10). Ресуспендируйте оставшиеся 2 мл лизата в буфере SM до конечного объема 10 мл (или меньше) для длительного хранения. Перелейте лизат в коническую центрифужную пробирку объемом 50 мл и храните при температуре 4 °C до удаления эндотоксина.
ПРИМЕЧАНИЕ: Титрование фага на этом этапе не является обязательным, чтобы убедиться в концентрации лизата фага (> 108 КОЕ/мл), а также для определения потери фага в процессе удаления эндотоксина. - Удаляют контаминирующие эндотоксины из лизата фага Т4, добавляя 0,4 объема 1-октанола (см. таблицу материалов) к общему объему лизата.
ПРИМЕЧАНИЕ: Эндотоксины удаляются, так как они обладают высокой иммуностимулирующей способностью, и поэтому их присутствие может привести к индукции фагонезависимого врожденного иммунного ответа25.
ВНИМАНИЕ: 1-Октанол является ароматическим, органическим, легковоспламеняющимся соединением с сильным запахом и раздражает глаза. При работе с 1-октанолом носите соответствующие СИЗ. Все работы выполняйте в вытяжном шкафу, чтобы избежать вдыхания пара. Используйте уплотнительную пленку, чтобы предотвратить протекание трубок при работе вне вытяжного шкафа. - Закройте крышку конической центрифужной пробирки уплотнительной пленкой, чтобы предотвратить утечку. Встряхивают при 120 об/мин на платформе или качающемся шейкере при комнатной температуре в течение 1 ч с последующей инкубацией при 4 °С в течение 1,5 ч, не встряхивая.
- Центрифуга при 4000 x g в течение 10 мин для отделения очищенного эндотоксином лизата от 1-октанола. Слой 1-октанола будет плавать поверх лизата. Используйте пипетку P1000, чтобы осторожно удалить как можно больше 1-октанола и вылить в соответствующий контейнер для опасных/легковоспламеняющихся жидких отходов.
- Используйте иглу 18 G и шприц объемом 10 мл для сбора лизата фага под оставшимся слоем 1-октанола, стараясь не собирать слой 1-октанола. Храните лизат при температуре 4 °C до быстрого вакуумирования.
- Переносят 1 мл аликвоты лизата фага Т4 в стерильные пробирки микроцентрифуг объемом 1,5 мл. Скоростной вакуум с открытыми крышками при 4000 x g при комнатной температуре для испарения остаточного 1-октанола из лизата. Скорость вакуумирования в течение 3 ч или до тех пор, пока объем лизата фага не уменьшится на 30%25. Хранить при температуре 4 °C до титрования.
- Титр лизата фага для определения концентрации в БОЕ/мл. Разбавьте полученный лизат фага Т4 в буфере SM до желаемой концентрации и повторите титр для подтверждения.
- Количественное определение эндотоксинов, присутствующих в лизате фага Т4, с помощью набора для количественного определения хромогенного эндотоксина в соответствии с инструкциями производителя (см. таблицу материалов). Сравните уровни эндотоксина в конечном лизате фага с образцом до удаления эндотоксина, контрольными элементами транспортного средства, буфером и питьевой водой для мышей.
ПРИМЕЧАНИЕ: Набор для количественного определения хромогенного эндотоксина инактивирован 1-октанолом25. Выполните ускоренные вакуумные шаги для удаления 1-октанола (шаг 1.2.16) перед количественным определением эндотоксинов. Содержание эндотоксинов в дистиллированной воде оценивается в 20 ЕС/мл25; Однако содержание эндотоксинов в питьевой воде для мышей может варьироваться в зависимости от учреждения. Если уровни эндотоксина в лизате фага превышают количество, присутствующее в питьевой воде, рассмотрите возможность повторения этапов удаления эндотоксина (1.2.12-1.2.16). - Концентрированные, очищенные от эндотоксинов лизаты фагов Т4 хранят в буфере SM при температуре 4 °C.
- Приготовление бесфагового бактериального лизата для управления транспортными средствами
ПРИМЕЧАНИЕ: Бесфаговый бактериальный лизат может быть приготовлен в качестве средства для контроля любых эффектов, вызванных бактериальными загрязнителями (например, эндотоксином), образующимися при производстве лизата фагов на этапе 1.2, которые могут повлиять на экспериментальные результаты при инокуляции мышам.- Из ночной культуры кишечной палочки, субкультуры кишечной палочки 1:50 в 100 мл среды LB. Без добавления фага продолжают культивировать бактерии, встряхивая при 37 °C в течение 3 ч или сопоставляя время инкубации для лизата фага, полученного на этапе 1.2.
- Перенесите культуру E. coli в конические пробирки объемом 50 мл и лизируйте клетки с помощью зонда-ультразвукатора (см. Таблицу материалов) на льду с частотой 30 кГц в течение 30 с импульсов (3x) для ручного лизиса бактериальных клеток.
- Следуйте остальной части протокола в соответствии с шагом 1.2, начиная с шага 1.2.4, включая все этапы очистки, промывки и удаления эндотоксинов.
ПРИМЕЧАНИЕ: Во время концентрирования с использованием центробежного фильтрующего устройства автомобильный лизат будет проходить через фильтр быстрее, чем лизат фага, из-за отсутствия фага. Поэтому сократите время центрифугирования с 5 минут до 2-5 минут, чтобы мембрана ультрафильтра не высыхала при длительном центрифугировании. - Измерьте титр лизата, чтобы убедиться, что он не содержит фагов.
- Используйте набор для количественного определения хромогенного эндотоксина в соответствии с инструкциями производителя для измерения уровня эндотоксинов в лизате автомобиля. Разбавьте транспортный лизат в буфере SM в соответствии с уровнями эндотоксинов в лизате фага.
- Альтернативный экспериментальный контроль: получение термоинактивированного фагового лизата
ПРИМЕЧАНИЕ: Альтернативой бесфаговому бактериальному лизату является термоинактивированный лизат фагов. Тепловая инактивация диссоциирует вирионы фагов, в то время как остаточные эндотоксины, такие как липополисахариды (ЛПС), термостабильны 8,33. Этот метод был использован Gogokhia et al.8 для определения того, требуются ли интактные, жизнеспособные вирионы фагов для иммунной активации. Исследователям предлагается протестировать оба метода (без фагов и с инактивацией при нагревании) и определить, какой контроль наиболее подходит для их экспериментальных нужд. Какой бы вариант ни был выбран, важно признать, что буферный контроль вряд ли будет подходящим из-за значительных манипуляций, которые требуются для концентрации и очистки запаса фагов.- Переложите необходимый объем очищенного, очищенного и разбавленного лизата фага Т4 со стадии 1,2 (100 мкл на мышь) в стерильные пробирки для микроцентрифуг с замками крышки.
- Нагревают лизаты на тепловом блоке при температуре 95 °C в течение 15 мин16.
- НЕОБЯЗАТЕЛЬНО: Если требуется удаление фаговых/бактериальных нуклеиновых кислот, выполните обработку ДНКазой I и РНКазой А в соответствии с Jakočiūnė и Moodley34. Кратко:
- Добавьте 50 мкл 10-кратного буфера ДНКазы I, 1 мкл ДНКазы I (1 мЕд/мкл) и 1 мкл РНКазы А (10 мг/мл) (см. таблицу материалов) к 450 мкл термоинактивированного фагового лизата.
- Лизаты инкубируют при 37 °C в течение 1,5 ч в тепловом блоке, не встряхивая.
- Инактивируйте ДНКазу I и РНКазу А, добавив 20 мкл 0,5 М этилендиаминтетрауксусной кислоты (ЭДТА)34.
- Подержите лизаты при комнатной температуре в течение 10 минут, чтобы охладить и соединить лизаты, если используется несколько пробирок. Хранить при температуре 4 °C до титрования.
- Выполните титр фага, чтобы убедиться, что в лизате нет жизнеспособного фага Т4. Хранить термоинактивированные лизаты при температуре 4 °C.
- Используйте набор для количественного определения хромогенного эндотоксина в соответствии с инструкциями производителя для измерения уровня эндотоксинов в термоинактивированном лизате. Разбавляют инактивированный теплом лизат в буфере SM в соответствии с уровнями эндотоксинов, присутствующими в подобранном фаговом лизате.
2. Введение и мониторинг фага Т4 у моноколонизированных мышей E. coli
- Моноколонизация мышей E. coli
- Подготовьте E. coli к введению мышам GF8 путем культивирования E. coli , взятой из одной колонии в среде LB, в течение ночи.
- В строгих стерильных условиях35 вводят 200 мкл культивирования E. coli мышам GF, помещенным либо в стерильные виниловые изоляторы, либо в герметичные клетки с биоэксклюзией, через ротовой зонд. При использовании аэротолерантных бактерий мышей также можно колонизировать путем нанесения 200 мкл бактериальной культуры на спину каждой мыши.
ПРИМЕЧАНИЕ: Доза инокуляции будет зависеть от штамма, так как разные бактерии демонстрируют разную способность к выживанию рН36,37. Zucoloto et al.35 рекомендуют инокуляцию 1 х 108 КОЕ на животное. Репрезентативные результаты, показанные здесь, были получены от мышей, привитых ночной культурой (КОЕ не определяли). Пилотные эксперименты могут быть проведены для определения дозы, которая приводит к надежной колонизации интересующего штамма мышей. На количество бактерий, вводимых через пероральный зонд, может влиять возраст и вес мышей. Проконсультируйтесь с протоколом этики отдельных лабораторий или учреждений для определения максимально допустимых доз. Предлагаемый здесь объем основан на припуске на зонд в 10% от массы тела мыши (например, максимум 200 мкл для мыши весом 20 г). Некоторые виды бактерий не переносят кислотность желудка и не могут колонизировать кишечник. Рассмотрите возможность первого измерения со 100 мкл 1 М NaHCO3 для нейтрализации желудочных кислот2. Если для колонизации используется строгий анаэроб, микроб необходимо будет выращивать в анаэробных условиях и переносить в гнотобиотический животноводческий комплекс в индивидуально подготовленных герметичных контейнерах (по 1 для каждой мыши). Выполняйте каждый зонд быстро после вскрытия контейнера, чтобы ограничить потерю жизнеспособности микробов из-за воздействия кислорода. - Следите за мышами на предмет неблагоприятных последствий для здоровья.
ПРИМЕЧАНИЕ: В случае неблагоприятных последствий для здоровья руководствуйтесь стандартами, установленными соответствующим учреждением по уходу за животными. Возможные неблагоприятные последствия для здоровья включают, но не ограничиваются: (1) Аспирация жидкости из зонда: симптомы включают выталкивание пузырьков через нос, дыхание/дыхание «открытым ртом». (2) Перфорация пищевода: симптомы включают быстрое ухудшение здоровья, сгорбление, вялость, приводящие к смерти животного в течение 24 ч. (3) Воспаление пищевода из-за повторных пересадок через зонд: симптомы включают трудности с введением иглы для зондирования. (4) Диарея из-за изменений в микробиоме. - Подтвердите бактериальную колонизацию в фекальных гранулах путем культивирования не реже одного раза в неделю и/или секвенирования 16S рРНК35.
ПРИМЕЧАНИЕ: Если вы колонизируете заводчиков в пределах гнотобиотического изолятора для производства экспериментальных мышей, планируйте по крайней мере за 9 недель до рождения 6-недельного потомства первого поколения (F1) экспериментальных мышей. В качестве альтернативы взрослые мыши GF могут быть моноколонизированы. При таком подходе рекомендуется подождать 7 недель после колонизации перед инокуляцией фагов, так как это время, необходимое для стабилизации слизистой оболочки кишечника после введения сложной микробиоты мышам GF38.
- Пероральная инокуляция фага Т4 моноколонизированным мышам E. coli
- Разбавляют лизаты фагов Т4 и контроль транспортных средств до заданной концентрации в буфере SM. Согласно Hsu et al.2, разбавляют лизаты фагов для введения 2 x 106 БОЕ на мышь2.
ПРИМЕЧАНИЕ: Более высокая или более низкая концентрация фага может быть использована в зависимости от стабильности фага in vivo. Дозы 2 x 102, 2 x 104 и 2 x 106 pfu фага Т4 на мышь приводили к стабильной и длительной колонизации в кишечнике, которая, по-видимому, не была дозозависимой (показано в разделе репрезентативных результатов). Поэтому кинетика фаговых бактерий должна быть опробована in vivo перед крупномасштабными экспериментами. - В стерильных гнотобиотических условиях обмочите каждую мышь 100 мкл автоклавного 1 M NaHCO3 для нейтрализации желудочных кислот. Подождите 10 мин, затем проведите зонд со 100 мкл лизата фага Т4 или контролем транспортного средства.
- Следите за мышами на предмет неблагоприятных последствий для здоровья.
- Разбавляют лизаты фагов Т4 и контроль транспортных средств до заданной концентрации в буфере SM. Согласно Hsu et al.2, разбавляют лизаты фагов для введения 2 x 106 БОЕ на мышь2.
3. Мониторинг уровня фагов Т4 in vivo
ПРИМЕЧАНИЕ: После того, как мыши были инокулированы фагом, концентрация как фагов, так и целевых бактерий может быть измерена в образцах фекалий или тканей. Это дает информацию о кинетике фаговой инфекции и динамике колонизации обоих организмов.
- Точечное нанесение фага Т4 для определения концентрации в фекальных гранулах
- Соберите фекальные гранулы с каждой мыши в стерильные, предварительно взвешенные микроцентрифужные пробирки для измерения уровня фага Т4 и кишечной палочки . Храните тюбики на льду до покрытия.
ПРИМЕЧАНИЕ: Поместите образцы на лед в промежутке между сбором и нанесением покрытия, чтобы замедлить рост аэротолерантных бактерий. В течение нескольких часов все еще может наблюдаться рост аэробных бактерий или некоторая гибель анаэробных бактерий из-за воздействия кислорода, что может привести к искажению количества бактерий. Поэтому бактериальное и фаговое покрытие следует проводить как можно скорее после взятия пробы. Облигатные анаэробные бактерии плохо переносят воздействие кислорода. Чтобы сохранить пробу, соберите пробы в герметичные пробирки и перенесите пробирки в анаэробную камеру как можно скорее после сбора. Если в образцах фекалий не обнаружено роста, рассмотрите альтернативные варианты, такие как кПЦР 16S рРНК для количественного определения бактерий. - Запишите окончательный вес каждой пробирки и рассчитайте вес образца путем вычитания начального веса пробирки. Это будет использоваться для нормализации концентрации фага Т4 и кишечной палочки до массы образца (КОЕ/г или КОЕ/г соответственно).
- Добавьте 1 мл стерильного буфера SM в каждую пробирку и тщательно перемешайте на максимальной скорости (>1 мин) для гомогенизации фекальных гранул. Если проба содержит менее 15 мг, можно добавить меньший объем SM-буфера. Запишите объем буфера SM, добавленного к каждой выборке, для расчета КОЕ/г или КОЕ/г образца.
- Приготовьте серию из 8 (или более в зависимости от ожидаемой концентрации фагов) серийных разведений по 20 мкл каждого образца в буфере SM объемом 180 мкл с коэффициентом 10. Кратковременно перемешайте каждый гомогенизированный образец, чтобы перемешать перед добавлением в первую пробирку/лунку. Пипетка для смешивания между каждым добавлением и сменой наконечников между каждым разведением, чтобы предотвратить завышение количества фагов или бактерий при переносе образца.
ПРИМЕЧАНИЕ: Если волокна и мусор, присутствующие в образце, препятствуют пипетированию, добавьте дополнительный буфер к фекальной суспензии для дальнейшего разбавления исходного образца. - Наносите по 5 мкл каждого разведения на мягкие агаровые планшеты LB , содержащие E. coli (для анализа фаговых бляшек) или пластины из агара LB (1,5% агара для анализа бактериальных колоний) для определения концентрации фага T4 и E. coli в каждом образце. Для точности расположите каждый образец в трех экземплярах.
ПРИМЕЧАНИЕ: При приготовлении последовательных разведений в 96-луночном планшете можно использовать 8-канальную многоканальную пипетку P20 для пипетирования каждой колонки последовательно разбавленного образца на планшеты. Меняйте наконечники между каждым разведением, даже при переходе от наиболее разбавленного к наиболее концентрированному, так как фаг может прилипать к стенкам наконечника пипетки и изменять количество фага, добавляемого в каждую новую лунку31. - Дайте каждому пятну высохнуть, прежде чем переворачивать тарелку и помещать ее в инкубатор. Инкубировать в течение ночи при температуре 37 °C.
- Для каждого образца выберите разведение, при котором на пятно приходится от 3 до 30 счетных бляшек. Подсчитайте и запишите количество бляшек в пятне и используемое разведение.
- Рассчитайте pfu/г образца, разделив количество бляшек на объем, нанесенный в каждой точке, чтобы получить pfu/мкл. Умножьте это значение на коэффициент разбавления и на объем SM-буфера, добавленного к каждому образцу, чтобы получить pfu/образец. Наконец, разделите на вес образца, чтобы получить pfu/g30.

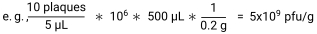
- Соберите фекальные гранулы с каждой мыши в стерильные, предварительно взвешенные микроцентрифужные пробирки для измерения уровня фага Т4 и кишечной палочки . Храните тюбики на льду до покрытия.
- Забор образцов тканей в экспериментальных конечных точках
- В каждый выбранный момент времени усыпляйте мышей в соответствии с утвержденным институциональным протоколом этики животных и собирайте содержимое слепой кишки, содержимое тонкой и толстой кишки, а также любые ткани, представляющие интерес, в стерильные, предварительно взвешенные 2 мл пробирки для микроцентрифуг с круглым дном.
- Запишите окончательный вес каждой пробирки, чтобы рассчитать вес образца. Храните салфетки и содержимое слепой кишки на льду до нанесения покрытия в тот же день.
- Добавьте стерильный буфер SM в каждую пробирку и запишите добавленные объемы.
- Для содержимого слепой кишки и кишечника тщательно (>1 мин) проводят вихревые пробы в соответствии с этапом 3.1.3.
- Для образцов тканей добавьте по одной стерильной металлической бусине в каждую пробирку. Гомогенизируйте ткани с помощью тканевого лизера (см. Таблицу материалов) при частоте 20 Гц в течение 5 мин или до тех пор, пока ткани не диссоциируют и суспензия не станет однородной.
ПРИМЕЧАНИЕ: Если образцы плохо гомогенизируются, рассмотрите возможность увеличения объема добавляемого буфера SM, увеличения времени гомогенизации или увеличения частоты гомогенизации до 30 Гц. Тканевый гомогенизатор также может быть использован для диссоциации тканей, обеспечивая при этом бактериальное и фаговое восстановление39,40. Гомогенизаторы работают на более высоких частотах, чем тканевые лизеры, сохраняя при этом целостность бактерий. - Приготовьте последовательные разведения каждого образца в коэффициентах 10 и выполните точечное покрытие для определения концентраций E. coli и Т4-фагов в каждом образце, как описано в шаге 3.1.4-3.1.841.
Access restricted. Please log in or start a trial to view this content.
Результаты
Для изучения взаимодействий между диадой Т4-фаг/E. coli в кишечнике мышей были приготовлены, очищены и очищены Т4-фаг и транспортные лизаты (рис. 1А). Титрование лизатов фагов Т4 проводили методом бляшечного анализа и разбавляли до 2 х 107 КОЕ/мл (2 х 106 КОЕ/мышь) в ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Изучение фагов в микробиоме представляет собой серьезную проблему по сравнению с их бактериальными аналогами. В частности, фаги не содержат консервативного филогенетического маркера, общего для всех фагов, сходного с 16S и 18S рибосомными субъединицами, которые позволяют легко секвенир?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы признают, что земля, на которой они проводили это исследование, является традиционной, исконной и незаселенной территорией народа xwməθkwəy̓əm (Musqueam). Земля, на которой он расположен, всегда была местом обучения для народа Маскеам, который на протяжении тысячелетий передавал свою культуру, историю и традиции из поколения в поколение на этом месте. Мы призываем других узнать больше о родных землях, в которых они живут и работают в https://native-land.ca. Авторы выражают признательность за поддержку со стороны Совета по естественным наукам и инженерным наукам Канады (NSERC) Canadian Graduate Scholarships - Master's (N.P.), Michael Smith Health Research BC Trainee Award (RT-2023-3174, to MH), Программы грантов на открытие Совета по естественным наукам и инженерным исследованиям Канады (NSERC) (RGPIN-2019-04591 для C.T., RGPIN-2016-04282 для LCO), Канадского института перспективных исследований / Люди и микробиом (FL-001253 Appt 3362, Премия Фонда Майкла Смита (Michael Smith Foundation for Health Research Scholar Award) (18239, C.T.), Канадских институтов исследований в области здравоохранения (PJT-159458 LCO) и Канадского фонда инноваций (34673 для LCO и 38277 для CT). Мы благодарны за техническую поддержку со стороны Центра моделирования заболеваний UBC и ubcFLOW, который поддерживается Инициативой биологической устойчивости UBC GREx, а также членам лабораторий Осборна и Тропини за критическое обсуждение и оценку рукописи. Рисунки 1А и 2А были созданы с помощью Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-octanol (99%) | Thermofisher | CAAAA15977-AP | |
| 50 ml PES Steriflip Sterile Disposable Vacuum Filter Units | Millipore Sigma | SCGP00525 | |
| Agarose (Low-EEO/Multi-Purpose/Molecular Biology Grade) | Fisher BioReagents | BP160-500 | |
| Amicon® 100kDa Ultra-15 centrifugal filter device, Ultracel-100 | Millipore Sigma | UFC910008 | |
| BD Microtainer® Tubes, SST | BD Medical | 365967 | |
| Bioexclusion airtight cages (ISO cages) | Techiplast | 1245ISOCAGE | |
| C1000 Touch™ Thermal Cycler with 96-Well Fast Reaction Module | BioRad | 1851196 | |
| Calcium Chloride Dihydrate (White Crystals to Powder) | Fisher BioReagents | BP510-500 | |
| Cap Locks For 1.5ML Tube 100/pk | Andwin Scientific | 16812612 | |
| Chloroform (Ethanol as Preservative/Certified ACS) | Fisher | C298-500 | |
| Copper coated steel beads (4.5 mm) | Crosman Corporation | 0767 | |
| DNeasy Blood & Tissue Kit (50) | Thermo Scientific | 69504 | |
| DreamTaq Green PCR Master Mix (2X) | Thermo Scientific | K1081 | |
| Ethylenediaminetetraacetic acid (EDTA) disodium salt solution, for molecular biology, 0.5 M in H2O | Sigma Aldrich | E7889 | |
| Fisher BioReagents™ Agar, Powder / Flakes, Fisher BioReagents™ | Fisher Bioreagents | BP1423-500 | |
| Fisher BioReagents™ Microbiology Media: LB Broth (Powder) - Lennox | Fisher Bioreagents | BP1427-500 | |
| GeneRuler 100 bp DNA Ladder | Thermo Scientific | SM0241 | |
| Green FastMix® qPCR mix, 1250 rxns | QuantaBio | 95072-012 | |
| HEPA filters for isocage lids, AUTOCLAVABLE H14 FILTERS FOR ISO LINE- IRRADIATED | Techiplast | UISOHEPAXTBOX-300 | |
| Magnesium sulfate heptahydrate | Fisher BioReagents | BP213-1 | |
| MaxQ 6000 Incubated Shaker | Thermo Scientific | 8354-30-0009 | |
| Microbiology Media: LB Broth (Powder) - Lennox | Fisher BioReagents | BP1427-500 | |
| Microcentrifuge Tubes with Locking Snap Cap, 2ml | Fisher | 14-666-315 | |
| Parafilm sealing film | Bemis | PM-996 | |
| Phage stocks | Carolina Biological Supply | n/a | |
| PicoLab® Mouse Diet 20 EXT | LabDiet | 5R58 | |
| Pierce™ Chromogenic Endotoxin Quant Kit | Thermo Scientific | A39552S | |
| RNase A (17,500 U) | Qiagen | 19101 | |
| RNase-free DNase Set | Qiagen | 79254 | |
| Sodium Bicarbonate (Fine White Powder) | Fisher Chemical | BP328-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Chemical | S271 | |
| Sonicator (probe model CL-18; power source model FB50) | Fisher scentific | n/a | |
| Sterile flexible film isolator | Class Biologically Clean | n/a | |
| SYBR™ Safe DNA Gel Stain | Invitrogen | S33102 | |
| T100 Thermal Cycler | BioRad | 1861096 | |
| T4 phage primer, forward (CCACACATAGCGCGAGTATAA) | IDT | n/a | |
| T4 phage primer, forward (GAAACTCGGTCAGGCTATCAA) | IDT | n/a | |
| TissueLyser II | Qiagen | 85300 | |
| Tris-HCl, 1M Solution, pH 8.0, Molecular Biology Grade, Ultrapure | Thermo Scientific | AAJ22638AE | |
| Water, (DNASE, RNASE free) | Fisher BioReagents | BP2484100 |
Ссылки
- Rohwer, F., Segall, A. M. A century of phage lessons. Nature. 528 (7580), 46-47 (2015).
- Hsu, B. B., et al. Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model. Cell Host & Microbe. 25 (6), 803-814.e5 (2019).
- Gordillo Altamirano, F. L., Barr, J. J. Phage Therapy in the postantibiotic era. Clinical Microbiology Reviews. 32 (2), (2019).
- Schooley, R. T., et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Ott, S. J., et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152 (4), 799-811.e7 (2017).
- Zuo, T., et al. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 67 (4), 634-643 (2018).
- Norman, J. M., et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 160 (3), 447-460 (2015).
- Gogokhia, L., et al. Expansion of bacteriophages is linked to aggravated intestinal inflammation and colitis. Cell Host & Microbe. 25 (2), 285-299.e8 (2019).
- Brunse, A., et al. Fecal filtrate transplantation protects against necrotizing enterocolitis. The ISME Journal. 16 (3), 686-694 (2022).
- Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. M., Hooper, L. V. A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17621-17626 (2012).
- Barr, J. J., et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proceedings of the National Academy of Sciences of the United States of America. 110 (26), 10771-10776 (2013).
- Nguyen, S., et al. Bacteriophage Transcytosis provides a mechanism to cross epithelial cell layers. mBio. 8 (6), (2017).
- Bichet, M. C., et al. Bacteriophage uptake by mammalian cell layers represents a potential sink that may impact phage therapy. iScience. 24 (4), 102287(2021).
- Buttimer, C., et al. Impact of a phage cocktail targeting Escherichia coli and Enterococcus faecalis as members of a gut bacterial consortium in vitro and in vivo. Frontiers in Microbiology. 13, 936083(2022).
- Li, Y., et al. Bacteriophages allow selective depletion of gut bacteria to produce a targeted-bacterium-depleted mouse model. Cell Reports Methods. 2 (11), 100324(2022).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20236-20241 (2013).
- Federici, S., et al. Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 185 (16), 2879-2898.e4 (2022).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science (New York, N.Y.). 363 (6434), (2019).
- Fluckiger, A., et al. Cross-reactivity between tumor MHC class I-restricted antigens and an enterococcal bacteriophage. Science (New York, N.Y.). 369 (6506), 936-942 (2020).
- Majewska, J., et al. Induction of Phage-Specific Antibodies by Two Therapeutic Staphylococcal Bacteriophages Administered per os. Frontiers in Immunology. 10, 2607(2019).
- Weiss, M., et al. In vivo replication of T4 and T7 bacteriophages in germ-free mice colonized with Escherichia coli. Virology. 393 (1), 16-23 (2009).
- Thomson, C. A., Morgan, S. C., Ohland, C., McCoy, K. D. From germ-free to wild: modulating microbiome complexity to understand mucosal immunology. Mucosal Immunology. 15 (6), 1085-1094 (2022).
- Al-Asmakh, M., Zadjali, F. Use of germ-free animal models in microbiota-related research. Journal of Microbiology and Biotechnology. 25 (10), 1583-1588 (2015).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Bonilla, N., et al. Phage on tap-a quick and efficient protocol for the preparation of bacteriophage laboratory stocks. PeerJ. 4, e2261(2016).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. 1, Cold Spring Harbor Laboratory Press. New York, NY. (2001).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology (Clifton, N.J). 501, 69-76 (2009).
- Manikantha, B., Karthika, R., Murugadas, V., Vishnuvinayagam, S., Rao, B. M. Comparison of the single agar and double agar layer methods for enumeration of bacteriophages. Fishery Technology. 59, 60-63 (2022).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, e3064(2012).
- Louten, J. Chapter 7 - Detection and diagnosis of viral infections. Essential Human Virology. , 111-132 (2016).
- Richter, Ł, et al. Adsorption of bacteriophages on polypropylene labware affects the reproducibility of phage research. Scientific Reports. 11 (1), 7387(2021).
- Merck KGaA. Amicon Ultra-15 Centrifugal Filter Devices. , Darmstadt, Germany. https://www.emdmillipore.com/CA/en/product/Amicon-Ultra-15-Centrifugal-Filter-Unit,MM_NF-UFC901024#documentation (2018).
- Hecker, W., Witthauer, D., Staerk, A. Validation of dry heat inactivation of bacterial endotoxins. PDA Journal of Pharmaceutical Science and Technology. 48 (4), 197-204 (1994).
- Jakočiūnė, D., Moodley, A. A Rapid bacteriophage DNA extraction method. Methods and Protocols. 1 (3), 27(2018).
- Zucoloto, A. Z., Yu, I. L., McCoy, K. D., McDonald, B. Generation, maintenance, and monitoring of gnotobiotic mice. STAR Protocols. 2 (2), 100536(2021).
- Ng, K. M., et al. Single-strain behavior predicts responses to environmental pH and osmolality in the gut microbiota. mBio. 14 (4), e0075323(2023).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nature Reviews. Microbiology. , (2023).
- Bergstrom, K., Xia, L. The barrier and beyond: Roles of intestinal mucus and mucin-type O-glycosylation in resistance and tolerance defense strategies guiding host-microbe symbiosis. Gut Microbes. 14 (1), 2052699(2022).
- Askar, M., Ashraf, W., Scammell, B., Bayston, R. Comparison of different human tissue processing methods for maximization of bacterial recovery. European Journal of Clinical Microbiology & Infectious Diseases. 38 (1), 149-155 (2019).
- Redanz, S., Podbielski, A., Warnke, P. Improved microbiological diagnostic due to utilization of a high-throughput homogenizer for routine tissue processing. Diagnostic Microbiology and Infectious Disease. 82 (3), 189-193 (2015).
- Bhinder, G., et al. The Citrobacter rodentium mouse model: studying pathogen and host contributions to infectious colitis. Journal of Visualized Experiments. 72, e50222(2013).
- Reyes, A., Semenkovich, N. P., Whiteson, K., Rohwer, F., Gordon, J. I. Going viral: next-generation sequencing applied to phage populations in the human gut. Nature Reviews Microbiology. 10 (9), 607-617 (2012).
- Camarillo-Guerrero, L. F., Almeida, A., Rangel-Pineros, G., Finn, R. D., Lawley, T. D. Massive expansion of human gut bacteriophage diversity. Cell. 184 (4), 1098-1109.e9 (2021).
- Reyes, A., et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466 (7304), 334-338 (2010).
- Bach, M. S., et al. Filamentous bacteriophage delays healing of Pseudomonas-infected wounds. Cell Reports. Medicine. 3 (6), 100656(2022).
- Filyk, H. A., Osborne, L. C. The multibiome: The intestinal ecosystem's influence on immune homeostasis, health, and disease. EBioMedicine. 13, 46-54 (2016).
- Rohwer, F., Merry, Y., Maughan, H., Hisakawa, N. Heather Life in Our Phage World: A Centennial Field Guide to the Earth's Most Diverse Inhabitants. Wholon. , San Diego. (2014).
- Glonti, T., Pirnay, J. P. In Vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 14 (7), 1490(2022).
- Fraser, J. S., Yu, Z., Maxwell, K. L., Davidson, A. R. Ig-like domains on bacteriophages: a tale of promiscuity and deceit. Journal of Molecular Biology. 359 (2), 496-507 (2006).
- Li, H., et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications. 6, 8292(2015).
- Bergström, A., et al. Nature of bacterial colonization influences transcription of mucin genes in mice during the first week of life. BMC Research Notes. 5, 402(2012).
- Adams, M. H. Bacteriophages. , Interscience Publishers. https://books.google.co.uk/books?id=3wVrAAAAMAAJ (1959).
- Kutter, E., Sulakvelidze, A. Bacteriophages: Biology and Applications. , CRC Press. https://books.google.co.uk/books?id=flHOvAEACAAJ (2004).
- Bao, H., et al. Dysbiosis and intestinal inflammation caused by Salmonella Typhimurium in mice can be alleviated by preadministration of a lytic phage. Microbiological Research. 260, 127020(2022).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены