É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Interação Bacteriófago T4 e E. coli no Intestino Murino: Um Modelo Prototípico para Estudo da Dinâmica Hospedeiro-Bacteriófago In Vivo
Neste Artigo
Resumo
Os bacteriófagos (fagos), vírus que infectam bactérias, são um componente integral do microbioma intestinal. Embora esses habitantes simbióticos impulsionem a aptidão bacteriana e a dinâmica populacional, pouco se entende sobre como eles afetam a homeostase intestinal e a doença. Este protocolo estuda fagos isolados de T4 dentro de um modelo murino, adaptável a outros pares fago-bactérias.
Resumo
Bacteriófagos (fagos) são vírus que infectam bactérias com especificidade em nível de espécie e cepa e são as entidades biológicas mais abundantes em todos os ecossistemas conhecidos. Dentro de comunidades bacterianas, como as encontradas na microbiota intestinal, os fagos estão implicados na regulação da dinâmica populacional da microbiota e na condução da evolução bacteriana. Tem havido um interesse renovado na pesquisa de fagos na última década, em parte devido às capacidades de matar os fagos líticos específicos do hospedeiro, que oferecem uma ferramenta promissora para combater a crescente ameaça de bactérias resistentes a antimicrobianos. Além disso, estudos recentes demonstrando que os fagos aderem ao muco intestinal sugerem que eles podem ter um papel protetor na prevenção da invasão bacteriana no epitélio subjacente. É importante ressaltar que, assim como os microbiomas bacterianos, os fageomas interrompidos têm sido associados a desfechos piorados em doenças como a doença inflamatória intestinal. Estudos anteriores demonstraram que os fagos podem modular o microbioma de animais e humanos por meio de transplantes de filtrados fecais, beneficiando a saúde do hospedeiro. Com essa recente onda de pesquisas, surge a necessidade de estabelecer e padronizar protocolos para o estudo de fagos no contexto do microbioma intestinal. Este protocolo fornece um conjunto de procedimentos para estudar fagos isolados de T4 e seu hospedeiro bacteriano, Escherichia coli, no contexto do trato gastrointestinal murino. Os métodos descritos aqui descrevem como começar a partir de um lisado de fago, administrá-lo a camundongos e avaliar os efeitos sobre os níveis de hospedeiro bacteriano e fago. Este protocolo pode ser modificado e aplicado a outros pares fago-bactéria e fornece um ponto de partida para o estudo da dinâmica hospedeiro-fago in vivo.
Introdução
Bacteriófagos, ou fagos, são vírus que infectam e matam bactérias com especificidade em nível de espécie e cepa1. Os fagos desempenham papéis importantes dentro de comunidades bacterianas complexas, como a microbiota intestinal, onde têm sido implicados na regulação da dinâmica populacional e na condução da aptidão bacteriana2. Ao longo da última década, tem havido um interesse renovado na pesquisa de fagos devido ao aumento de patógenos resistentes a antimicrobianos3 e ao potencial da fagoterapia como estratégia alternativa de tratamento. Nos últimos anos, coquetéis de fagos líticos têm sido utilizados por via intravenosa com algum sucesso em infecções sépticas bacterianas graves e resistentes a antibióticos em humanos 3,4. A fagoterapia oral também tem sido proposta como uma alternativa potencial aos antibióticos para tratar infecções intestinais e inflamação. Além disso, fagos têm sido implicados no sucesso dos transplantes de filtrado fecal (FFT), que são preparações da microbiota fecal que foram filtradas para remover bactérias, no tratamento da infecção recorrente por Clostridioides difficile (rCDI)5,6, distúrbios inflamatórios intestinais (DII)7,8 e enterocolite necrosante em suínos prematuros9. Diante desses resultados, é importante considerar interações tanto entre fagos e a microbiota intestinal, quanto entre fagos e mamíferos hospedeiros, pois a adição de novos fagos a uma comunidade preexistente pode ter efeitos indiretos sobre a comunidade como um todo, e não apenas sobre suas bactérias-alvo 2,10.
O estudo das interações dos fagos com suas bactérias-alvo in vitro tem se mostrado útil para a compreensão dos mecanismos e impactos das interações entre fagos e bactérias no intestino. Nesse contexto, demonstrou-se que fagos T4 específicos de Escherichia coli da ordem Caudovirales necessitam de domínios semelhantes a imunoglobulinas (Ig) localizados dentro de proteínas altamente antigênicas do capsídeo externo (Hoc) na superfície do vírion para aderir ao muco intestinal11. Além disso, ensaios transwell mostraram que fagos T4 são capazes de interagir com culturas de células epiteliais e translocar através das camadas celulares por macropinocitose12,13. Estes resultados suportam a hipótese de que os fagos podem interagir com seus hospedeiros metazoários, mesmo sendo incapazes de infectar células eucarióticas. Esses modelos, embora úteis, carecem de toda a gama de interações complexas que ocorrem em um ecossistema intestinal que são necessárias para uma exploração abrangente da interação tripartite entre fagos, bactérias e o hospedeiro metazoário.
Modelos de camundongos são uma ferramenta importante para a investigação de fagos em ambientes complexos. Uma aplicação desejável da administração de fagos é como uma estratégia alternativa para tratar infecções resistentes a antimicrobianos ou patobiontes associados a doenças inflamatórias crônicas, incluindo DII. No entanto, a literatura emergente sugere que o comportamento dos fagos in vitro não representa completamente as funções in vivo. Buttimer et al.14 demonstraram que um coquetel de fagos foi capaz de esgotar as bactérias-alvo em um consórcio simplificado de microbiota humana in vitro, mas não pôde ser replicado in vivo em camundongos gnotobióticos colonizados com o mesmo consórcio bactéria-fago. Além disso, em um microbioma convencional de camundongos, o fago T7 levou à depleção seletiva de suas bactérias intestinais alvo, embora a recuperação gradual tenha sido observada ao longo do tempo, indicando resistência evoluída15. Outros estudos demonstraram a coexistência de fagos administrados por via oral e suas cepas bacterianas alvo in vivo 2,16. De fato, além da coexistência de fago/bactéria, a administração de fagos levou a mudanças generalizadas na composição e função geral da comunidade da microbiota 2,16. Isso é relevante em situações de doença, pois vários estudos encontraram associações entre o aumento da abundância relativa de caudovirais e DII 7,8,17 que foram independentes de mudanças na abundância bacteriana7. Ainda não se sabe se isso é um fator determinante ou consequência da patogênese da doença.
O foco histórico da investigação de fagos tem sido em torno da relação entre um fago e sua bactéria-alvo. No entanto, também é importante considerar potenciais interações entre o fago e a mucosa, o epitélio e o sistema imune do hospedeiro metazoário. Todas essas interações desempenham um papel importante na resposta global à infecção intestinal por fago. Para demonstrar isso, fagos têm sido estudados utilizando camundongos germ-free (GF) para elucidar seu impacto no sistema imune sem interferência da microbiota8. Nesse sistema, os ácidos nucléicos dos fagos foram detectados por receptores do tipo Toll (TLRs) localizados dentro de endossomos de células imunes fagocíticas (macrófagos e células dendríticas). Isso ativou a sinalização a jusante e estimulou a produção dependente de células T de interferon (IFN)-γ 8 ou IFNs tipo I18. Além disso, Fluckiger et al.19 implicaram células T CD8+ de memória no reconhecimento de antígenos codificados por fagos (prófagos), o que resultou em reatividade cruzada de células T com antígenos tumorais, resultando em redução da carga tumoral. Finalmente, a produção de anticorpos fago-específicos foi documentada em estudos em camundongos onde fagos foram entregues a modelos animais de forma contínua através da água potável 8,20, ou por gavagem oral repetida ao longo de vários meses20, demonstrando a capacidade das proteínas dos fagos em promover respostas imunes humais. Embora esses modos de inoculação de fagos permitam o priming ótimo e contínuo do sistema imunológico, eles podem não representar as interações naturais entre fagos e o ambiente intestinal, nem a cinética da terapia fagológica aplicada por via oral. Até o momento, um número limitado de estudos examinou as interações do fago com uma única espécie bacteriana em modelos de camundongos monocolonizados21. No entanto, camundongos monocolonizados mostraram-se críticos para decifrar os efeitos micróbio-específicos de espécies individuais sobre o trato gastrointestinal (GI) e o desenvolvimento imunológico 22,23,24, e ainda podem ser úteis na compreensão das interações tripartites entre fagos, suas bactérias-alvo e o hospedeiro metazoário.
De forma empolgante, ainda há muito a aprender sobre as interações entre fagos intestinais e bactérias comensais intestinais, bem como as interações que ocorrem entre o hospedeiro metazoário e os fagos que residem nele. Este protocolo fornece um conjunto de procedimentos para estudar o fago isolado de T4 e sua contraparte bacteriana, E. coli (K-12, BW25113), usando um modelo gnotobiótico em camundongos. Esses procedimentos padronizados também fornecem uma base para otimizar outras díades de fago/bactéria, adaptando os parâmetros de crescimento aos pares de interesse. Os métodos aqui descritos descrevem: (1) Preparação de fagos T4 e lisados veiculares para gavagem oral de camundongos; (2) Administração oral de fago T4 a camundongos monocolonizados de E. coli gnotobióticos; (3) Monitoramento dos níveis de fagos T4 em fezes e tecidos de camundongos ao longo do tempo.
Para os resultados representativos aqui apresentados, lisados purificados de fagos T4 foram propagados a partir de estoques de bancos de fagos mantidos pelo Rohwer Lab. O método Phage-on-Tap para propagação de fago T4 foi adaptado25, conforme referenciado neste protocolo. O método produz altos títulos e baixos estoques de fago com endotoxina em três dias. Utilizando essa abordagem, 10 mL de ≥ 1010 unidades formadoras de placa (pfu)/mL de fago T4 com < 0,5 unidades de endotoxina (EU)/mL foram rotineiramente coletados. Os níveis recomendados de endotoxinas para administração oral ou intravenosa em ratinhos são ≤ 20 EU/ml e ≤ 5 EU/kg/h (ou 0,1 EU administrados durante 1 h para um ratinho de 20 g), respetivamente, tornando este um método adequado de preparação de fagos para inoculação in vivo . Todos os estoques de fago foram armazenados a 4 °C em tampão fagogênico salino magnésio (SM) (receita fornecida na etapa 1.1.5.1). E. coli foi cultivada em meio LB. Para vários pares de fagos-bactérias, diversos meios de cultura e condições de crescimento podem ser adaptados a partir deste protocolo. Os fagos também podem ser obtidos do ambiente, tais como águas residuais, água marinha, solo e conteúdo intestinal, e podem ser isolados e purificados conforme Sambrook e Russell26 antes da preparação, usando as condições apropriadas de crescimento e propagação para cada par fago-hospedeiro de interesse25. Alternativamente, os fagos podem ser obtidos de fontes comerciais (ver Tabela de Materiais) ou de bancos de fagos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os experimentos foram conduzidos de acordo com as diretrizes estabelecidas pelo Comitê de Cuidados com Animais da UBC e protocolos aprovados pelo Comitê de Biossegurança (A23-0113, B19-0038). Camundongos foram alojados na Universidade da Colúmbia Britânica sob condições livres de patógenos no Center for Disease Modelling. Camundongos C57BL/6 foram criados dentro da instalação em um isolador de filme flexível estéril, fornecido com dieta estéril para camundongos, água, cama e material de nidificação. Os camundongos foram mantidos em um ciclo dia/noite de 12 h. Camundongos experimentais, machos e fêmeas, foram pareados por idade dentro de cada experimento, variando entre 6 e 12 semanas de idade e pesando 15-30 g para todos os experimentos.
1. Preparação de lisados de fago e veículo para gavagem oral em camundongos
- Purificação de fagos e geração de estoque
NOTA: Neste estudo, os fagos T4 são cultivados e titulados por plaqueamento em um gramado de bactérias usando o método de camada única de ágar, descrito abaixo. O método da dupla camada de ágar já foi descrito anteriormente25,27e também pode ser usado com eficácia semelhante. O método de camada única de ágar foi selecionado para este protocolo por proporcionar melhor visibilidade da placa28.- Cultivar E. coli em 5 mL de LB estéril em tubos estéreis de poliestireno ou de cultura de vidro (com tampas). Incubar os tubos a 37 °C com agitação a 200 rpm durante a noite, até atingir a fase estacionária.
- Preparar ágar macio em um frasco de meio de vidro autoclavando LB com 0,5% de ágar e resfriando a 50 °C ou menos (permanecendo um líquido) antes da suplementação. Preparar ágar macio suficiente para 15 mL por placa.
- Suplemente ágar mole com MgSO4 e CaCl2 até uma concentração final de 1 mM para cada um. Adicionar 100 μL de cultura de E. coli durante a noite para cada 3 mL de ágar mole. Mexa suavemente usando uma barra de agitação magnética para homogeneizar os suplementos e cultura no ágar macio.
NOTA: A consistência no volume e densidade de E. coli que é adicionada à preparação de ágar mole é crítica (descrita na seção de resultados representativos). - Adicionar 15 mL de ágar mole + E. coli por placa de Petri (15 cm de diâmetro) usando uma pipeta sorológica. Deixe as placas ajustadas à temperatura ambiente para uso no mesmo dia.
OBS: As placas serão ajustadas em aproximadamente 20 min com as tampas abertas. O ágar permanecerá macio, mas não mudará quando as placas forem invertidas. - Preparar 8-10 diluições seriadas do fago T4 da fonte em factores de 10 diluindo em tampão SM. Colocar 5 μL de cada diluição em placas. Deixe as manchas secarem, invertam e incubem as placas a 37 °C durante a noite.
- Para preparar o tampão de fago de magnésio salino (SM), em 1 L de H2O deionizado, dissolver 100 mM NaCl, 8 mM MgSO4·7H2O e 50 mM Tris-HCl (pH 7,4). Autoclave e armazenamento em temperatura ambiente.
NOTA: No dia seguinte, E. coli deveria ter crescido em um gramado em todo o ágar LB macio. Placas, ou áreas limpas de crescimento visíveis no gramado de E. coli , aparecerão onde ocorreu a morte de hospedeiros infectados por E. coli . Cada placa representa uma unidade formadora de placa (pfu).
- Para preparar o tampão de fago de magnésio salino (SM), em 1 L de H2O deionizado, dissolver 100 mM NaCl, 8 mM MgSO4·7H2O e 50 mM Tris-HCl (pH 7,4). Autoclave e armazenamento em temperatura ambiente.
- Escolha uma única placa da placa de ágar macia empurrando uma ponta de pipeta estéril para o centro da placa, criando um plugue de ágar no final da ponta. Ressuspenda o plugue da placa em 1 mL de tampão SM em um tubo de microcentrífuga de 1,7 mL. Vórtice o tubo à velocidade máxima durante 1 min para misturar.
- Centrifugar o tubo a 4000 x g durante 5 minutos à temperatura ambiente para remover quaisquer detritos do lisado. Transfira o sobrenadante para um novo tubo de microcentrífuga.
- Para propagar o fago isolado, repita os passos 1.1.1-1.1.3. Adicionar 100 μL do fago isolado a uma alíquota de 15 mL de ágar mole contendo E. coli em um tubo cônico. Inverta o tubo três vezes para misturar e despeje o ágar em uma placa de Petri.
- Deixe as placas secarem antes de inverter e incubar durante a noite a 37 °C. Preparar uma placa de controle de gramado sem fago para confirmar a viabilidade de E. coli .
NOTA: Após a incubação durante a noite, a placa de controle deve ter um gramado de E.coli , enquanto a placa contendo fago deve ser completamente lisada. - Para extrair o fago da placa, adicione 5 mL de tampão SM à superfície da placa desobstruída por fagos e agite a 70 rpm em um balancim por 15 minutos à temperatura ambiente.
- Recolher o tampão da placa num tubo de centrífuga cónica de 50 ml e centrifugar a 4000 x g durante 5 minutos à temperatura ambiente para pelar quaisquer detritos da placa de ágar.
- Recolher o lisado de fago T4 num tubo novo e armazenar a 4 °C até à titulação e propagação.
NOTA: Os fagos T4 são estáveis por mais de 10 anos25; no entanto, a estabilidade dependerá do tipo de fago e das condições de armazenamento. O título de fago também varia com o tempo de armazenamento. Os fagos são sensíveis ao congelamento. Portanto, recomenda-se a criopreservação em nitrogênio líquido e evitar ciclos de congelamento-descongelamento, pois isso pode danificar os fagos, reduzindo o título de fago25. - Titular o lisado de estoque de fago T4 para determinar a concentração em pfu/mL, conforme descrito anteriormente 25,29,30. Um estoque de fago T4 de alto título conterá 10a 8 pfu/mL ou mais.
- Preparação de lisados fagológicos experimentais
- Cultura de E. coli em 5 mL de LB em tubos estéreis de poliestireno ou vidro (com tampas). Incubar os tubos durante a noite a 37 °C com agitação a 200 rpm, até atingir a fase estacionária.
- Subcultivar a cultura noturna de E. coli 1:50 em meio LB de 100 mL em frasco cônico de vidro. Incubar a 37 °C com agitação a 200 rpm até que as bactérias tenham atingido a fase exponencial precoce a média (aprox. 1,5 h).
NOTA: Uma curva de crescimento inicial pode ser realizada para determinar a densidade óptica na faixa de 600 nm (OD600) na qual a cultura bacteriana está em fase exponencial. A cultura em tubo cônico de vidro é sugerida, pois evidências recentes descobriram que os fagos são capazes de aderir a plásticos como o polipropileno31. - Adicionar 100 μL do estoque de fago T4 de alto título da etapa 1.1 na subcultura de E. coli e incubar a 37 °C com agitação por 3 h, ou até que o novo lisado não esteja mais turvo. Recolher o lisado de fago T4 em tubos cónicos de 50 ml e proceder directamente às etapas de limpeza ou, se necessário, conservar a 4 °C até ao dia seguinte.
NOTA: Um tamanho de explosão de fago maior (indicando um maior número médio de viriões libertados por ciclo de replicação) requer um período de incubação mais longo para a subcultura bacteriana no passo 1.2.2. Isso proporciona um aumento da densidade de bactérias antes de aumentar os estoques de fagos. - Centrifugar lisados a 4000 x g durante 20 minutos à temperatura ambiente para peletizar quaisquer bactérias e detritos celulares remanescentes. Filtrar-esterilizar o sobrenadante resultante usando um filtro de nylon de 0,22 μm e transferir o filtrado para novos tubos de centrífuga cônica de 50 mL.
- Adicionar 0,1 volumes de clorofórmio a cada volume de lisado de fago T4 filtrado para matar as bactérias restantes e impedir o crescimento bacteriano. Vórtice brevemente para misturar e incubar à temperatura ambiente durante 10 min.
NOTA: Os fagos envelopados com lipídios são sensíveis ao clorofórmio, o que pode reduzir o título de fago25. Ignore esta etapa, se necessário.
CUIDADO: O clorofórmio é um solvente orgânico tóxico que é perigoso quando inalado, ingerido ou absorvido através da pele. Use um exaustor e equipamento de proteção individual (EPI) apropriado ao trabalhar com clorofórmio. Use vidro em vez de pipetas sorológicas de poliestireno ao trabalhar com clorofórmio, pois não é compatível com a maioria dos plásticos. O clorofórmio pode ser colocado em tubos de centrífuga cónica de polipropileno para os passos 1.2.5-1.2.6, mas não deve ser armazenado a longo prazo em tubos de plástico. - Centrifugar o lisado a 4000 x g durante 5 minutos à temperatura ambiente para separar o clorofórmio do lisado. Use uma pipeta sorológica para transferir cuidadosamente a camada de lisado superior para um novo tubo cônico de 50 mL sem perturbar a camada de clorofórmio subjacente. Eliminar os resíduos de clorofórmio no recipiente adequado para resíduos líquidos perigosos. Conservar lisados a 4 °C até à concentração e troca de tampão no dia seguinte.
- Concentrar os lisados de fagos num dispositivo de filtro centrífugo de 100 kDa (ver Tabela de Materiais) adicionando 13 ml de lisado de fago ao reservatório superior do dispositivo e centrifugando a 4000 x g durante 5 minutos, ou até que a maior parte do lisado tenha passado através do filtro para o reservatório inferior.
NOTA: Objetivo de ter aproximadamente 2 mL de lisado no final do tempo de spin. À medida que a concentração de fagos aumenta no filtro com a adição de lisado, os tempos de rotação provavelmente aumentarão. Os dispositivos de filtragem centrífuga têm um ponto morto físico para evitar que fiquem secos32. Não deixe a membrana do filtro secar se o uso continuado for planejado (ou seja, removendo todo o líquido do reservatório superior). Os tempos de rotação podem variar de acordo com o tipo de fago e o título. - Usando uma pipeta P200 ou P1000, pipetar suavemente os ~2 mL restantes de lisado para cima e para baixo dentro do reservatório superior para desobstruir a membrana do filtro após cada giro. Descarte o filtrado do reservatório inferior em um recipiente de resíduos, deixando o fago concentrado no reservatório superior.
- Repetir os passos 1.2.7-1.2.8 até que todo o volume de lisado de fago tenha sido passado através do dispositivo filtrante, com ~2 mL de fago concentrado retido no reservatório superior após cada spin.
- Desobstruir a membrana do filtro após o último giro pipetando o lisado restante (~2 mL) no reservatório superior para cima e para baixo. Lavar o fago (troca de tampão) adicionando 12 mL de tampão SM ao reservatório superior e centrifugar a 4000 x g por 10 min, ou até que a maior parte do tampão tenha passado pelo filtro.
- Eliminar o filtrado e repetir o passo de lavagem (passo 1.2.10). Ressuspender os 2 mL restantes de lisado em tampão SM para um volume final de 10 mL (ou menos), para armazenamento a longo prazo. Transferir o lisado para um tubo de centrífuga cônica de 50 mL e armazenar a 4 °C até a remoção da endotoxina.
NOTA: É opcional titular o fago nesta fase para garantir que o lisado do fago tenha sido concentrado (> 108 pfu/mL) e para determinar a perda de fago durante o processo de remoção da endotoxina. - Remover endotoxinas contaminantes do lisado de fago T4 adicionando 0,4 volumes de 1-octanol (ver Tabela de Materiais) ao volume total de lisado.
NOTA: As endotoxinas são removidas por serem altamente imunoestimulantes e, portanto, sua presença pode levar à indução de uma resposta imune inata independente de fago25.
CUIDADO: 1-Octanol é um composto aromático, orgânico, inflamável com um odor forte e é um irritante para os olhos. Use EPI apropriado ao trabalhar com 1-octanol. Execute todo o trabalho em uma capela de fumaça para evitar a inalação de vapor. Use película de vedação para evitar o vazamento de tubos ao trabalhar fora do exaustor. - Sele a tampa do tubo centrífugo cônico com película de vedação para evitar vazamentos. Agitar a 120 rpm em plataforma ou agitador à temperatura ambiente durante 1 h, seguido de incubação a 4 °C durante 1,5 h, sem agitar.
- Centrifugar a 4000 x g durante 10 minutos para separar o lisado eliminado de endotoxinas do 1-octanol. A camada de 1-octanol flutuará sobre o lisado. Use uma pipeta P1000 para remover cuidadosamente o máximo possível de 1-octanol e descartar no recipiente apropriado de resíduos líquidos perigosos/inflamáveis.
- Use uma agulha de 18 G e uma seringa de 10 mL para coletar o lisado do fago abaixo da camada restante de 1-octanol, tomando cuidado para não coletar a camada de 1-octanol. Conservar lisado a 4 °C até à velocidade de vácuo.
- Transferir alíquotas de 1 mL de lisado de fago T4 para tubos de microcentrífuga estéreis de 1,5 mL. Acelerar o vácuo com as tampas abertas a 4000 x g à temperatura ambiente para evaporar o 1-octanol residual do lisado. Acelerar o vácuo por 3 h ou até que o volume de lisado do fago tenha sido reduzido em 30%25. Conservar a 4 °C até à titulação.
- Titular o lisado do fago para determinar a concentração em pfu/mL. Diluir o lisado de fago T4 resultante em tampão SM até a concentração desejada e re-titular para confirmar.
- Quantificar as endotoxinas presentes no lisado de fago T4 utilizando um kit de quantificação de endotoxinas cromogénicas, de acordo com as instruções do fabricante (ver Tabela de Materiais). Comparar os níveis de endotoxina no lisado final do fago com uma amostra de pré-remoção de endotoxina, controles do veículo, tampão e água potável de camundongos.
NOTA: O kit de quantificação de endotoxinas cromogênicas é inativado por 1-octanol25. Executar etapas de vácuo de velocidade para remover 1-octanol (passo 1.2.16) antes de quantificar as endotoxinas. O teor de endotoxinas para a água destilada é estimado em 20 EU/mL25; no entanto, o conteúdo de endotoxinas da água potável de camundongos pode variar entre as instalações. Se os níveis de endotoxina no lisado de fago excederem a quantidade presente na água potável, considere repetir as etapas de remoção de endotoxinas (1.2.12-1.2.16). - Armazenar lisados de fago T4 concentrados e eliminados por endotoxinas em tampão SM a 4 °C.
- Preparação de lisado bacteriano livre de fagos para controles de veículos
NOTA: Um lisado bacteriano livre de fagos pode ser preparado como um veículo para controlar quaisquer efeitos devido a contaminantes bacterianos (por exemplo, endotoxina) gerados na produção de lisado de fago na etapa 1.2, o que poderia afetar os resultados experimentais quando inoculado em camundongos.- A partir de uma cultura noturna de E. coli, subcultivar a E. coli 1:50 em 100 mL de LB. Sem adição de fago, continuar a cultivar as bactérias agitando a 37 °C durante 3 h ou igualando o tempo de incubação do lisado de fago produzido no passo 1.2.
- Transferir a cultura de E. coli para tubos cônicos de 50 mL e células de lise usando uma sonda sonicadora (ver Tabela de Materiais) em gelo a 30 kHz por pulsos de 30 s (3x) para lisar manualmente as células bacterianas.
- Siga o restante do protocolo conforme a etapa 1.2, começando na etapa 1.2.4, incluindo todas as etapas de limpeza, lavagem e remoção de endotoxinas.
NOTA: Durante a concentração usando o dispositivo de filtro centrífugo, o lisado do veículo fluirá através do filtro mais rapidamente do que o lisado de fago, devido à ausência de fago. Portanto, diminua os tempos de centrifugação de 5 minutos para 2-5 minutos para garantir que a membrana do ultrafiltro não seque durante a centrifugação prolongada. - Titer o lisado do veículo para confirmar que não contém fago.
- Use um kit de quantificação de endotoxinas cromogênicas de acordo com as instruções do fabricante para medir os níveis de endotoxinas no lisado do veículo. Diluir o lisado do veículo em tampão SM para corresponder aos níveis de endotoxina no lisado de fago.
- Controles experimentais alternativos: preparação de lisado de fago inativado termicamente
NOTA: Uma alternativa ao lisado bacteriano livre de fagos é um lisado de fago inativado pelo calor. A inativação térmica dissocia os viriões dos fagos, enquanto endotoxinas residuais como os lipopolissacarídeos (LPS) são estáveis ao calor 8,33. Esse método foi utilizado por Gogokhia et al.8 para determinar se virions fagos intactos e viáveis eram necessários para a ativação imune. Os pesquisadores são encorajados a testar ambos os métodos (livre de fagos vs. inativado pelo calor) e determinar qual controle é mais apropriado para suas necessidades experimentais. Seja qual for a escolha, é importante reconhecer que é improvável que um controle tampão seja apropriado devido à manipulação significativa necessária para concentrar e limpar um estoque de fago.- Transfira o volume necessário de lisado de fago T4 limpo, purificado e diluído da etapa 1,2 (100 μL por rato) para tubos de microcentrífuga estéreis equipados com fechaduras de tampa.
- Aquecer lisados num bloco térmico a 95 °C durante 15 min16.
- OPCIONAL: Se a remoção de ácidos nucleicos fagos/bacterianos for necessária, execute o tratamento com DNase I e RNase A conforme Jakočiūnė e Moodley34. Brevemente:
- Adicionar 50 μL de tampão DNase I 10x, 1 μL de DNase I (1 U/μL) e 1 μL de RNase A (10 mg/mL) (ver Tabela de Materiais) a 450 μL de lisado de fago inativado pelo calor.
- Incubar lisados a 37 °C durante 1,5 h num bloco de calor, sem agitar.
- Inativar a DNase I e RNase A adicionando 20 μL de ácido etilenodiaminotetracético (EDTA) 0,5 M34.
- Segure os lisados à temperatura ambiente durante 10 minutos para arrefecer e combine os lisados se forem utilizados vários tubos. Conservar a 4 °C até à titulação.
- Realizar um título de fago para confirmar que nenhum fago T4 viável está presente no lisado. Conservar lisados inactivados termicamente a 4 °C.
- Use um kit de quantificação de endotoxina cromogênica de acordo com as instruções do fabricante para medir os níveis de endotoxina no lisado inativado pelo calor. Diluir o lisado inativado pelo calor em tampão SM de acordo com os níveis de endotoxina presentes no lisado de fago correspondente.
2. Administração e monitoramento de fago T4 em camundongos monocolonizados com E. coli
- Monocolonização de camundongos com E. coli
- Preparar E. coli para administração em camundongos GF8 cultivando E. coli colhida de uma única colônia em meio LB durante a noite.
- Sob condições rigorosas e estéreis35, administrar 200 μL de cultura de E. coli a camundongos GF alojados em isoladores de vinil estéreis ou gaiolas herméticas de bioexclusão por gavagem oral. Se usar bactérias aerotolerantes, camundongos também podem ser colonizados pela aplicação de 200 μL de cultura bacteriana no dorso de cada camundongo.
OBS: A dose de inoculação será dependente da cepa, pois diferentes bactérias demonstram diferentes capacidades de sobrevivência ao pH36,37. Zucoloto et al.35 recomendam a inoculação com 1 x 108 ufc por animal. Resultados representativos mostrados aqui foram gerados a partir de camundongos inoculados com uma cultura noturna (ufc não foi determinado). Experimentos piloto podem ser realizados para determinar uma dose que resulte em colonização confiável da linhagem de camundongos de interesse. O volume de bactérias a ser administrado por gavagem oral pode ser afetado pela idade e peso dos camundongos. Consulte o protocolo de ética animal individual de laboratório ou institucional para obter doses máximas permitidas. O volume sugerido aqui é baseado em uma permissão de gavagem de 10% do peso corporal do camundongo (por exemplo, 200 μL no máximo para um camundongo de 20 g). Algumas espécies bacterianas não toleram a acidez do estômago e não conseguem colonizar o intestino. Considere a primeira gavagem com 100 μL de NaHCO3 1 M para neutralizar os ácidos estomacais2. Se usar um anaeróbio estrito para colonizar, o micróbio precisará ser cultivado em condições anaeróbias e transferido para a instalação animal gnotobiótica em recipientes herméticos preparados individualmente (1 para cada camundongo). Execute cada gavagem rapidamente assim que o recipiente for aberto para limitar a perda de viabilidade microbiana devido à exposição ao oxigênio. - Monitorar camundongos para efeitos adversos à saúde.
NOTA: Em caso de efeitos adversos para a saúde, consulte as normas estabelecidas pela instalação de cuidados aos animais relevante. Os possíveis efeitos adversos à saúde incluem, mas não estão limitados a: (1) Aspiração de líquido de gavagem: os sintomas incluem expulsão de bolhas pelo nariz, respiração de "boca aberta" / ofegação. (2) Perfuração do esôfago: os sintomas incluem saúde rapidamente doente, curvamento, letargia, levando à morte do animal dentro de 24 h. (3) Inflamação do esôfago devido a gavagem repetida: os sintomas incluem dificuldade para inserir a agulha de gavagem. (4) Diarreia por alterações no microbioma. - Confirmar a colonização bacteriana em pellets fecais por meio de cultura pelo menos uma vez por semana e/ou por sequenciamento de 16S rRNA35.
NOTA: Se colonizar criadores dentro de um isolador gnotobiótico para produção de camundongos experimentais, planeje com pelo menos 9 semanas de antecedência a geração de camundongos experimentais de primeira geração de descendentes (F1) com 6 semanas de idade. Alternativamente, camundongos GF adultos podem ser monocolonizados. Nessa abordagem, recomenda-se aguardar 7 semanas pós-colonização antes da inoculação do fago, pois este é o tempo necessário para que a mucosa intestinal se estabilize após a introdução de uma microbiota complexa em camundongos GF38.
- Inoculação oral de fago T4 em camundongos monocolonizados com E. coli
- Diluir os lisados de fago T4 e os controlos do veículo até uma concentração pré-determinada em tampão SM. De acordo com Hsu et al.2, os lisados de fagos diluídos para permitir a administração de 2 x 106 pfu por camundongo2.
NOTA: Uma maior ou menor concentração de fago pode ser usada dependendo da estabilidade do fago in vivo. Doses de 2 x 10, 2,2 x 10,4 e 2 x 10,6 pfu de fago T4 por camundongo resultaram em colonização estável e de longo prazo no intestino que não pareceu ser dose-dependente (mostrado na seção de resultados representativos). A cinética fago-bactéria deve, portanto, ser testada in vivo antes de experimentos em larga escala. - Sob condições estéreis e gnotobióticas, gavagem cada camundongo com 100 μL de NaHCO3 1 M autoclavado para neutralizar os ácidos estomacais. Esperar 10 minutos e, em seguida, gavagem com 100 μL de lisado de fago T4 ou controle do veículo.
- Monitorar camundongos para efeitos adversos à saúde.
- Diluir os lisados de fago T4 e os controlos do veículo até uma concentração pré-determinada em tampão SM. De acordo com Hsu et al.2, os lisados de fagos diluídos para permitir a administração de 2 x 106 pfu por camundongo2.
3. Monitoramento dos níveis de fagos T4 in vivo
NOTA: Uma vez que os ratos tenham sido inoculados com fago, a concentração de ambos os fagos e bactérias-alvo pode ser medida em amostras fecais ou de tecido. Isso fornece informações sobre a cinética da infecção do fago e a dinâmica de colonização de ambos os organismos.
- Spot plating de fago T4 para determinação da concentração em pellets fecais
- Coletar pastilhas fecais de cada camundongo em tubos de microcentrífuga estéreis e pré-pesados para medir os níveis de T4 fago e E. coli . Guarde os tubos no gelo até o revestimento.
NOTA: Coloque as amostras no gelo no intervalo entre a coleta e o plaqueamento para retardar o crescimento de bactérias aerotolerantes. Ao longo de várias horas, ainda pode haver crescimento de bactérias aeróbicas, ou alguma morte de bactérias anaeróbicas devido à exposição ao oxigênio, o que pode levar a contagens distorcidas de bactérias. Portanto, a plaqueação de bactérias e fagos deve ser realizada o mais rápido possível após a coleta das amostras. As bactérias anaeróbicas obrigatórias não toleram a exposição ao oxigênio. Para preservar a amostra, colete as amostras em tubos selados e transfira os tubos para uma câmara anaeróbia o mais rápido possível após a coleta. Se nenhum crescimento for detectado em amostras fecais, considere alternativas como 16S rRNA qPCR para quantificação bacteriana. - Registre os pesos finais de cada tubo e calcule o peso da amostra subtraindo o peso inicial do tubo. Isso será usado para normalizar a concentração de fago T4 e E. coli para o peso da amostra (pfu/g ou ufc/g, respectivamente).
- Adicionar 1 mL de tampão SM estéril a cada tubo e vórtice completamente à velocidade máxima (>1 min) para homogeneizar os pellets fecais. Se a amostra for inferior a 15 mg, pode ser adicionado um volume menor de tampão SM. Registar o volume de tampão SM adicionado a cada amostra para cálculos de ufc/g ou pfu/g de amostra.
- Preparar uma série de 8 (ou mais, dependendo da concentração esperada de fago) diluições seriadas de 20 μL de cada amostra em tampão SM de 180 μL, em fatores de 10. Vórtice cada amostra homogeneizada brevemente para misturar antes de adicionar ao primeiro tubo/poço. Pipeta para misturar entre cada adição e mudar as pontas entre cada diluição para evitar a insuflação da contagem de fagos ou bactérias através do transporte da amostra.
NOTA: Se as fibras e os detritos presentes na amostra dificultarem a pipetagem, adicione tampão adicional ao chorume fecal para diluir ainda mais a amostra-mãe. - Colocar 5 μL de cada diluição em placas de ágar mole LB contendo E. coli (para ensaios de placa de fago) ou placas de ágar LB (ágar 1,5%, para ensaios de colónias bacterianas) para determinar a concentração de T4 phage e E. coli em cada amostra. Para precisão, identifique cada amostra em triplicata.
NOTA: Se preparar diluições em série numa placa de 96 poços, pode ser utilizada uma pipeta multicanal P20 de 8 canais para pipetar cada coluna de amostra diluída em série para chapas. Trocar as pontas entre cada diluição, mesmo passando da mais diluída para a mais concentrada, pois o fago pode aderir às paredes da ponta da pipeta e alterar a quantidade de fago adicionada a cada novo poço31. - Deixe cada ponto secar antes de inverter a placa e colocá-la na incubadora. Incubar durante a noite a 37 °C.
- Para cada amostra, selecione a diluição na qual há 3-30 placas contáveis por ponto. Conte e registre o número de placas no local e a diluição utilizada.
- Calcular pfu/g de amostra dividindo o número de placas pelo volume plaqueado em cada ponto para dar pfu/μL. Multiplique este pelo factor de diluição e pelo volume de tampão SM adicionado a cada amostra para obter pfu/amostra. Por último, divida pelo peso da amostra para obter pfu/g30.

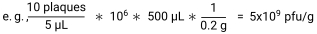
- Coletar pastilhas fecais de cada camundongo em tubos de microcentrífuga estéreis e pré-pesados para medir os níveis de T4 fago e E. coli . Guarde os tubos no gelo até o revestimento.
- Amostragem de tecido em desfechos experimentais
- Em cada momento selecionado, eutanasiar camundongos de acordo com o protocolo institucional de ética animal aprovado e coletar conteúdo cecal, conteúdo do intestino delgado e grosso e quaisquer tecidos de interesse em tubos de microcentrífuga de fundo redondo estéreis e pré-pesados de 2 mL.
- Registre os pesos finais de cada tubo para calcular o peso da amostra. Armazenar tecidos e conteúdo cecal no gelo até o plaqueamento no mesmo dia.
- Adicione buffer SM estéril a cada tubo e registre os volumes adicionados.
- Para o conteúdo cecal e intestinal, amostras de vórtice cuidadosamente (>1 min) de acordo com a etapa 3.1.3.
- Para amostras de tecido, adicione uma conta de metal estéril a cada tubo. Homogeneizar os tecidos usando um lisador de tecido (ver Tabela de Materiais) a 20 Hz por 5 min ou até que os tecidos estejam dissociados e a suspensão seja homogênea.
NOTA: Se as amostras não homogeneizarem bem, considere aumentar o volume de tampão SM adicionado, aumentar o tempo de homogeneização ou aumentar a frequência de homogeneização para 30 Hz. Um homogeneizador tecidual também pode ser usado para dissociar tecidos, permitindo a recuperação bacteriana efagológica 39,40. Os homogeneizadores são operados em frequências mais altas do que os lisadores teciduais, mantendo a integridade das bactérias. - Preparar diluições seriadas de cada amostra em factores de 10 e proceder a plaqueamento pontual para determinar as concentrações de E. coli e T4 phage em cada amostra, tal como descrito nos passos 3.1.4-3.1.841.
Access restricted. Please log in or start a trial to view this content.
Resultados
Para investigar as interações entre a díade T4 fago/E. coli no intestino murino, o fago T4 e os lisados veiculares foram preparados, limpos e purificados (Figura 1A). Os lisados de fagos T4 foram titulados por ensaio de placa e diluídos a 2 x 107 pfu/mL (2 x 106 pfu/camundongo) em tampão SM. Os lisados de veículos também foram titulados para confirmar a ausência de fagos viáveis e diluídos no mesmo volume de tampão SM que o lisado de fago T4. Os nív...
Access restricted. Please log in or start a trial to view this content.
Discussão
O estudo de fagos no microbioma apresenta um desafio significativo em comparação com seus homólogos bacterianos. Especificamente, os fagos não contêm um marcador filogenético conservado comum a todos os fagos, semelhante às subunidades ribossomais 16S e 18S, que permita a facilidade no sequenciamento e identificação de espécies procarióticas e eucarióticas, respectivamente42. No entanto, com os avanços nas abordagens de sequenciamento de próxima geração, incluindo o aumento do comp...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores reconhecem que a terra em que realizaram esta pesquisa é o território tradicional, ancestral e não cedido da Nação xwməθkwəy̓əm (Musqueam). A terra em que está situado sempre foi um lugar de aprendizado para o povo Musqueam, que por milênios transmitiu em sua cultura, história e tradições de uma geração para a outra neste local. Encorajamos outras pessoas a aprender mais sobre as terras nativas em que vivem e trabalham em https://native-land.ca. Os autores agradecem o apoio do Conselho de Ciências Naturais e Engenharia do Canadá (NSERC) Canadian Graduate Scholarships - Master's (N.P.), Michael Smith Health Research BC Trainee Award (RT-2023-3174, para MH), Natural Sciences and Engineering Research Council of Canada (NSERC) Discovery Grants Program (RGPIN-2019-04591 to C.T., RGPIN-2016-04282 to LCO), Canadian Institute for Advanced Research / Humans and the Microbiome (FL-001253 Appt 3362, para C.T.), Michael Smith Foundation for Health Research Scholar Award (18239, para C.T.), Canadian Institutes for Health Research (PJT-159458 para LCO) e Canadian Foundation for Innovation (34673 para LCO e 38277 para CT). Agradecemos o apoio técnico do UBC Centre for Disease Modelling e do ubcFLOW, que é apoiado pela UBC GREx Biological Resilience Initiative, e aos membros dos laboratórios Osborne e Tropini pelas discussões críticas e avaliação do manuscrito. A Figura 1A e a Figura 2A foram criadas usando Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-octanol (99%) | Thermofisher | CAAAA15977-AP | |
| 50 ml PES Steriflip Sterile Disposable Vacuum Filter Units | Millipore Sigma | SCGP00525 | |
| Agarose (Low-EEO/Multi-Purpose/Molecular Biology Grade) | Fisher BioReagents | BP160-500 | |
| Amicon® 100kDa Ultra-15 centrifugal filter device, Ultracel-100 | Millipore Sigma | UFC910008 | |
| BD Microtainer® Tubes, SST | BD Medical | 365967 | |
| Bioexclusion airtight cages (ISO cages) | Techiplast | 1245ISOCAGE | |
| C1000 Touch™ Thermal Cycler with 96-Well Fast Reaction Module | BioRad | 1851196 | |
| Calcium Chloride Dihydrate (White Crystals to Powder) | Fisher BioReagents | BP510-500 | |
| Cap Locks For 1.5ML Tube 100/pk | Andwin Scientific | 16812612 | |
| Chloroform (Ethanol as Preservative/Certified ACS) | Fisher | C298-500 | |
| Copper coated steel beads (4.5 mm) | Crosman Corporation | 0767 | |
| DNeasy Blood & Tissue Kit (50) | Thermo Scientific | 69504 | |
| DreamTaq Green PCR Master Mix (2X) | Thermo Scientific | K1081 | |
| Ethylenediaminetetraacetic acid (EDTA) disodium salt solution, for molecular biology, 0.5 M in H2O | Sigma Aldrich | E7889 | |
| Fisher BioReagents™ Agar, Powder / Flakes, Fisher BioReagents™ | Fisher Bioreagents | BP1423-500 | |
| Fisher BioReagents™ Microbiology Media: LB Broth (Powder) - Lennox | Fisher Bioreagents | BP1427-500 | |
| GeneRuler 100 bp DNA Ladder | Thermo Scientific | SM0241 | |
| Green FastMix® qPCR mix, 1250 rxns | QuantaBio | 95072-012 | |
| HEPA filters for isocage lids, AUTOCLAVABLE H14 FILTERS FOR ISO LINE- IRRADIATED | Techiplast | UISOHEPAXTBOX-300 | |
| Magnesium sulfate heptahydrate | Fisher BioReagents | BP213-1 | |
| MaxQ 6000 Incubated Shaker | Thermo Scientific | 8354-30-0009 | |
| Microbiology Media: LB Broth (Powder) - Lennox | Fisher BioReagents | BP1427-500 | |
| Microcentrifuge Tubes with Locking Snap Cap, 2ml | Fisher | 14-666-315 | |
| Parafilm sealing film | Bemis | PM-996 | |
| Phage stocks | Carolina Biological Supply | n/a | |
| PicoLab® Mouse Diet 20 EXT | LabDiet | 5R58 | |
| Pierce™ Chromogenic Endotoxin Quant Kit | Thermo Scientific | A39552S | |
| RNase A (17,500 U) | Qiagen | 19101 | |
| RNase-free DNase Set | Qiagen | 79254 | |
| Sodium Bicarbonate (Fine White Powder) | Fisher Chemical | BP328-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Chemical | S271 | |
| Sonicator (probe model CL-18; power source model FB50) | Fisher scentific | n/a | |
| Sterile flexible film isolator | Class Biologically Clean | n/a | |
| SYBR™ Safe DNA Gel Stain | Invitrogen | S33102 | |
| T100 Thermal Cycler | BioRad | 1861096 | |
| T4 phage primer, forward (CCACACATAGCGCGAGTATAA) | IDT | n/a | |
| T4 phage primer, forward (GAAACTCGGTCAGGCTATCAA) | IDT | n/a | |
| TissueLyser II | Qiagen | 85300 | |
| Tris-HCl, 1M Solution, pH 8.0, Molecular Biology Grade, Ultrapure | Thermo Scientific | AAJ22638AE | |
| Water, (DNASE, RNASE free) | Fisher BioReagents | BP2484100 |
Referências
- Rohwer, F., Segall, A. M. A century of phage lessons. Nature. 528 (7580), 46-47 (2015).
- Hsu, B. B., et al. Dynamic modulation of the gut microbiota and metabolome by bacteriophages in a mouse model. Cell Host & Microbe. 25 (6), 803-814.e5 (2019).
- Gordillo Altamirano, F. L., Barr, J. J. Phage Therapy in the postantibiotic era. Clinical Microbiology Reviews. 32 (2), (2019).
- Schooley, R. T., et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Ott, S. J., et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology. 152 (4), 799-811.e7 (2017).
- Zuo, T., et al. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 67 (4), 634-643 (2018).
- Norman, J. M., et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell. 160 (3), 447-460 (2015).
- Gogokhia, L., et al. Expansion of bacteriophages is linked to aggravated intestinal inflammation and colitis. Cell Host & Microbe. 25 (2), 285-299.e8 (2019).
- Brunse, A., et al. Fecal filtrate transplantation protects against necrotizing enterocolitis. The ISME Journal. 16 (3), 686-694 (2022).
- Duerkop, B. A., Clements, C. V., Rollins, D., Rodrigues, J. L. M., Hooper, L. V. A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17621-17626 (2012).
- Barr, J. J., et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proceedings of the National Academy of Sciences of the United States of America. 110 (26), 10771-10776 (2013).
- Nguyen, S., et al. Bacteriophage Transcytosis provides a mechanism to cross epithelial cell layers. mBio. 8 (6), (2017).
- Bichet, M. C., et al. Bacteriophage uptake by mammalian cell layers represents a potential sink that may impact phage therapy. iScience. 24 (4), 102287(2021).
- Buttimer, C., et al. Impact of a phage cocktail targeting Escherichia coli and Enterococcus faecalis as members of a gut bacterial consortium in vitro and in vivo. Frontiers in Microbiology. 13, 936083(2022).
- Li, Y., et al. Bacteriophages allow selective depletion of gut bacteria to produce a targeted-bacterium-depleted mouse model. Cell Reports Methods. 2 (11), 100324(2022).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20236-20241 (2013).
- Federici, S., et al. Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 185 (16), 2879-2898.e4 (2022).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science (New York, N.Y.). 363 (6434), (2019).
- Fluckiger, A., et al. Cross-reactivity between tumor MHC class I-restricted antigens and an enterococcal bacteriophage. Science (New York, N.Y.). 369 (6506), 936-942 (2020).
- Majewska, J., et al. Induction of Phage-Specific Antibodies by Two Therapeutic Staphylococcal Bacteriophages Administered per os. Frontiers in Immunology. 10, 2607(2019).
- Weiss, M., et al. In vivo replication of T4 and T7 bacteriophages in germ-free mice colonized with Escherichia coli. Virology. 393 (1), 16-23 (2009).
- Thomson, C. A., Morgan, S. C., Ohland, C., McCoy, K. D. From germ-free to wild: modulating microbiome complexity to understand mucosal immunology. Mucosal Immunology. 15 (6), 1085-1094 (2022).
- Al-Asmakh, M., Zadjali, F. Use of germ-free animal models in microbiota-related research. Journal of Microbiology and Biotechnology. 25 (10), 1583-1588 (2015).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Bonilla, N., et al. Phage on tap-a quick and efficient protocol for the preparation of bacteriophage laboratory stocks. PeerJ. 4, e2261(2016).
- Sambrook, J., Russell, D. W. Molecular Cloning: A Laboratory Manual. 1, Cold Spring Harbor Laboratory Press. New York, NY. (2001).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology (Clifton, N.J). 501, 69-76 (2009).
- Manikantha, B., Karthika, R., Murugadas, V., Vishnuvinayagam, S., Rao, B. M. Comparison of the single agar and double agar layer methods for enumeration of bacteriophages. Fishery Technology. 59, 60-63 (2022).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. 63, e3064(2012).
- Louten, J. Chapter 7 - Detection and diagnosis of viral infections. Essential Human Virology. , 111-132 (2016).
- Richter, Ł, et al. Adsorption of bacteriophages on polypropylene labware affects the reproducibility of phage research. Scientific Reports. 11 (1), 7387(2021).
- Merck KGaA. Amicon Ultra-15 Centrifugal Filter Devices. , Darmstadt, Germany. https://www.emdmillipore.com/CA/en/product/Amicon-Ultra-15-Centrifugal-Filter-Unit,MM_NF-UFC901024#documentation (2018).
- Hecker, W., Witthauer, D., Staerk, A. Validation of dry heat inactivation of bacterial endotoxins. PDA Journal of Pharmaceutical Science and Technology. 48 (4), 197-204 (1994).
- Jakočiūnė, D., Moodley, A. A Rapid bacteriophage DNA extraction method. Methods and Protocols. 1 (3), 27(2018).
- Zucoloto, A. Z., Yu, I. L., McCoy, K. D., McDonald, B. Generation, maintenance, and monitoring of gnotobiotic mice. STAR Protocols. 2 (2), 100536(2021).
- Ng, K. M., et al. Single-strain behavior predicts responses to environmental pH and osmolality in the gut microbiota. mBio. 14 (4), e0075323(2023).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nature Reviews. Microbiology. , (2023).
- Bergstrom, K., Xia, L. The barrier and beyond: Roles of intestinal mucus and mucin-type O-glycosylation in resistance and tolerance defense strategies guiding host-microbe symbiosis. Gut Microbes. 14 (1), 2052699(2022).
- Askar, M., Ashraf, W., Scammell, B., Bayston, R. Comparison of different human tissue processing methods for maximization of bacterial recovery. European Journal of Clinical Microbiology & Infectious Diseases. 38 (1), 149-155 (2019).
- Redanz, S., Podbielski, A., Warnke, P. Improved microbiological diagnostic due to utilization of a high-throughput homogenizer for routine tissue processing. Diagnostic Microbiology and Infectious Disease. 82 (3), 189-193 (2015).
- Bhinder, G., et al. The Citrobacter rodentium mouse model: studying pathogen and host contributions to infectious colitis. Journal of Visualized Experiments. 72, e50222(2013).
- Reyes, A., Semenkovich, N. P., Whiteson, K., Rohwer, F., Gordon, J. I. Going viral: next-generation sequencing applied to phage populations in the human gut. Nature Reviews Microbiology. 10 (9), 607-617 (2012).
- Camarillo-Guerrero, L. F., Almeida, A., Rangel-Pineros, G., Finn, R. D., Lawley, T. D. Massive expansion of human gut bacteriophage diversity. Cell. 184 (4), 1098-1109.e9 (2021).
- Reyes, A., et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 466 (7304), 334-338 (2010).
- Bach, M. S., et al. Filamentous bacteriophage delays healing of Pseudomonas-infected wounds. Cell Reports. Medicine. 3 (6), 100656(2022).
- Filyk, H. A., Osborne, L. C. The multibiome: The intestinal ecosystem's influence on immune homeostasis, health, and disease. EBioMedicine. 13, 46-54 (2016).
- Rohwer, F., Merry, Y., Maughan, H., Hisakawa, N. Heather Life in Our Phage World: A Centennial Field Guide to the Earth's Most Diverse Inhabitants. Wholon. , San Diego. (2014).
- Glonti, T., Pirnay, J. P. In Vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 14 (7), 1490(2022).
- Fraser, J. S., Yu, Z., Maxwell, K. L., Davidson, A. R. Ig-like domains on bacteriophages: a tale of promiscuity and deceit. Journal of Molecular Biology. 359 (2), 496-507 (2006).
- Li, H., et al. The outer mucus layer hosts a distinct intestinal microbial niche. Nature Communications. 6, 8292(2015).
- Bergström, A., et al. Nature of bacterial colonization influences transcription of mucin genes in mice during the first week of life. BMC Research Notes. 5, 402(2012).
- Adams, M. H. Bacteriophages. , Interscience Publishers. https://books.google.co.uk/books?id=3wVrAAAAMAAJ (1959).
- Kutter, E., Sulakvelidze, A. Bacteriophages: Biology and Applications. , CRC Press. https://books.google.co.uk/books?id=flHOvAEACAAJ (2004).
- Bao, H., et al. Dysbiosis and intestinal inflammation caused by Salmonella Typhimurium in mice can be alleviated by preadministration of a lytic phage. Microbiological Research. 260, 127020(2022).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados