A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المقايسة القائمة على نقل طاقة الرنين للتلألؤ الحيوي (BRET) لقياس تفاعلات CRAF مع 14-3-3 بروتينات في الخلايا الحية
In This Article
Summary
يصف هذا البروتوكول مقايسة قائمة على BRET لقياس تفاعلات كيناز CRAF مع 14-3-3 بروتينات في الخلايا الحية. يحدد البروتوكول خطوات لإعداد الخلايا ، وقراءة انبعاثات BRET ، وتحليل البيانات. يتم أيضا تقديم مثال على النتيجة مع تحديد عناصر التحكم المناسبة واستكشاف الأخطاء وإصلاحها لتحسين الفحص.
Abstract
CRAF هو المستجيب الأساسي ل RAS GTPases ويلعب دورا مهما في تكوين الأورام للعديد من السرطانات التي تحركها KRAS. بالإضافة إلى ذلك ، يعد CRAF نقطة ساخنة لطفرات الخط الجرثومي ، والتي ثبت أنها تسبب اعتلال RASopathy التنموي ، متلازمة نونان. تحتوي جميع كينازات RAF على مواقع ربط متعددة تعتمد على الفسفرة ل 14-3-3 بروتينات تنظيمية. يلعب الارتباط التفاضلي ل 14-3-3 لهذه المواقع أدوارا أساسية في تكوين ثنائيات RAF النشطة في غشاء البلازما في ظل ظروف الإشارات وفي الحفاظ على التثبيط الذاتي لسلاح الجو الملكي البريطاني في ظل ظروف هادئة. يعد فهم كيفية تنظيم هذه التفاعلات وكيف يمكن تعديلها أمرا بالغ الأهمية لتحديد الأساليب العلاجية الجديدة التي تستهدف وظيفة سلاح الجو الملكي البريطاني. هنا ، أصف مقايسة نقل طاقة الرنين الحيوي (BRET) لقياس تفاعلات CRAF مع 14-3-3 بروتينات في الخلايا الحية. على وجه التحديد ، يقيس هذا الفحص تفاعلات CRAF المنصهرة مع مانح نانو لوسيفيراز و 14-3-3 المنصهرة مع متقبل علامة Halo ، حيث يؤدي تفاعل RAF و 14-3-3 إلى نقل الطاقة من مانح إلى متقبل وتوليد إشارة BRET. يوضح البروتوكول كذلك أن هذه الإشارة يمكن أن تتعطل بسبب الطفرات التي تظهر لمنع ارتباط 14-3-3 بكل موقع من مواقع الإرساء عالية التقارب لسلاح الجو الملكي البريطاني. يصف هذا البروتوكول إجراءات بذر الخلايا ونقلها وإعادة طلائها ، إلى جانب تعليمات مفصلة لقراءة انبعاثات BRET ، وإجراء تحليل البيانات ، وتأكيد مستويات التعبير عن البروتين. بالإضافة إلى ذلك ، يتم توفير أمثلة على نتائج الفحص ، جنبا إلى جنب مع خطوات التحسين واستكشاف الأخطاء وإصلاحها.
Introduction
كينازات سلاح الجو الملكي البريطاني (ARAF و BRAF و CRAF) هي المستجيبات المباشرة ل RAS GTPases والأعضاء البادئين في سلسلة كيناز RAF-MEK-ERK المؤيدة للتكاثر / المؤيدة للبقاء. أظهرت الدراسات الحديثة أن تعبير CRAF يلعب دورا رئيسيا في تكوين الأورام للعديد من السرطانات التي تحركها KRAS ، بما في ذلك سرطان الرئة ذو الخلايا غير الصغيرة وسرطان الغدة القنوية البنكرياسية1،2،3،4،5. علاوة على ذلك ، تسبب طفرات CRAF الجرثومية شكلا حادا بشكل خاص من اعتلال RASopathy ، متلازمة نونان 6,7. يعد فهم تنظيم CRAF أمرا بالغ الأهمية لتطوير مناهج علاجية ناجحة تستهدف وظيفتها في الخلايا.
يمكن تقسيم جميع كينازات RAF إلى مجالين وظيفيين ، مجال تحفيزي C-terminal (CAT) ومجال تنظيمي N-terminal (REG) ، يتحكم في نشاطه (الشكل 1A)8. يشمل مجال REG مجال ربط RAS (RBD) ، والمجال الغني بالسيستين (CRD) ، ومنطقة غنية بالسيرين / ثريونين (S / T-rich). والجدير بالذكر أن المنطقة الغنية ب S / T تحتوي على موقع N ، الذي يرتبط ب 14-3-3 بطريقة تعتمد على الفسفرة (S259 في CRAF ؛ الشكل 1 أ) 8. يشمل مجال CAT مجال كيناز ، إلى جانب موقع إرساء ثان عالي التقارب 14-3-3 ، يشار إليه باسم موقع C (S621 في CRAF ؛ الشكل 1 أ) 8. يلعب الارتباط التفاضلي للبروتينات 14-3-3 dimeric بمواقع N 'و C ، جنبا إلى جنب مع CRD ، أدوارا حاسمة في كل من تنشيط وتثبيط RAF9،10،11،12،13. في ظل ظروف الإشارات العادية ، يبدأ تنشيط RAF من خلال تجنيده في غشاء البلازما بواسطة RAS ، مما يسمح له بتكوين دايمرات نشطة ، والتي يكون مغاير BRAF-CRAF هو الشكل النشط السائد14,15. تشير المقايسات الكيميائية الحيوية باستخدام BRAF و CRAF ، جنبا إلى جنب مع هياكل المجهر الإلكتروني المبرد (Cryo-EM) ل dimeric BRAF ، إلى أن dimer 14-3-3 يعمل على استقرار ثنائيات RAF النشطة عن طريق الارتباط في وقت واحد بموقع C 'لكل من بروتومرات RAF (الشكل 1B) 9،13،16،17. على العكس من ذلك ، أظهرت الدراسات أنه في ظل ظروف هادئة ، يتبنى RAF تأكيدا خلويا ومثبطا ذاتيا ، حيث يرتبط مجال REG بمجال CAT ويمنع نشاطه12،18،19،20. يتم تثبيت هذه الحالة المغلقة بواسطة dimer 14-3-3 المرتبط بموقع CRD و N 'في مجال REG وموقع C في مجال CAT (الشكل 1B) 10،13،21. في BRAF ، يتم دعم هذا النموذج من خلال هياكل Cryo-EM الحديثة لمونومرات BRAF ذاتية التثبيط ودراساتنا الكيميائية الحيويةالسابقة 10،12،13،21،22. ومع ذلك، ففي حين تبين أن المادة 14-3-3 تؤدي دورا مثبطا في المادة23 من النظام الأساسي لاتفاقية الإبلاغ الموحد، فإن حالة التثبيط الذاتي الشبيهة ب BRAF قد تؤدي دورا أقل في المادة12 من النظام الأساسي للنموذج الموحد؛ لذلك هناك حاجة إلى مزيد من الدراسات لتوضيح الآليات التي تنظم بها البروتينات 14-3-3 نشاط CRAF. يتطلب التنظيم بوساطة 14-3-3 لكينازات RAF عددا كبيرا من أحداث فسفرة RAF وإزالة الفسفرة ، والارتباط بالبروتينات التنظيمية المختلفة ، والتفاعلات مع غشاء البلازما8. لذلك ، من الأهمية بمكان أن يتم قياس تفاعلات 14-3-3-RAF في ظل ظروف ذات صلة من الناحية الفسيولوجية وفي وجود طبقة ثنائية دهنية سليمة.
لمعالجة هذه المشكلة ، تم استخدام تقنية NanoBRET (من هنا فصاعدا المشار إليها باسم N-BRET ؛ انظر جدول المواد للحصول على تفاصيل المجموعة) لتطوير مقايسة قائمة على القرب لقياس تفاعلات CRAF مع 14-3-3 بروتينات في الخلايا الحية (الشكل 1C). يقيس هذا النظام القائم على BRET تفاعلات اثنين من البروتينات ذات الأهمية (POI) ، حيث يتم تمييز أحد البروتينات بمتبرع نانولوسيفيراز (نانو) والآخر بعلامة Halo ، لوضع العلامات باستخدام متقبل الطاقة Halo618 ligand22,24. يؤدي تفاعل البروتينات ذات الأهمية إلى نقل الطاقة من مانح إلى متلقي ، والذي بدوره يولد إشارة BRET (الشكل 1C). يوفر البروتين المانح النانوي شديد السطوع (الانبعاث (em) 460 نانومتر) و Halo618 ligand (em 618 nm) فصلا طيفيا وحساسية أكبر على BRET التقليدي ، مما يجعله منصة مثالية لدراسة التفاعلات الأضعف واكتشاف التغييرات الطفيفة في الربط24. في الواقع ، قمنا سابقا بتطوير اختبار قائم على N-BRET لقياس تفاعلات التثبيط الذاتي لمجالات RAF REG و CAT ، والتي كانت ضرورية لتوصيف لوحة من طفرات RASopathy في BRAF CRD وأظهرنا الأهمية الحاسمة لهذا المجال للحفاظ على التثبيط الذاتي ومنع تنشيط BRAF التأسيسي12.
يقيس الفحص الموصوف هنا تفاعلات CRAF ، المنصهرة في علامة نانو N-terminal (Nano-CRAF) ، وشكل زيتا المتماثل ل 14-3-3 المنصهر في علامة الهالة الطرفية C (14-3-3ζ-Halo; الشكل 1 ج). لقد أظهرنا أن تفاعلات Nano-CRAF مع 14-3-3ζ-Halo تولد إشارة BRET قوية ، والتي بدورها يمكن أن تتعطل بسبب الطفرات التي تمنع ارتباط 14-3-3 بموقع N (S259A) و / أو موقع C (S621A). يوفر البروتوكول التالي خطوات مفصلة لإجراء هذا الفحص وتحسينه واستكشاف الأخطاء وإصلاحه.
Protocol
ملاحظة: يتم إجراء هذا الفحص في خلايا 293FT. خط ظهاري مميز جيدا وقابل للنقل بسهولة مشتق من خلايا الكلى الجنينية البشرية. عادة ما يوفر طبق استزراع واحد متلاقى بطول 10 سم لهذه الخلايا خلايا كافية لبذر 20 بئرا من ألواح زراعة الأنسجة المكونة من 6 آبار. يجب تنفيذ الخطوات 1-3 باستخدام تقنية معقمة في خزانة السلامة البيولوجية.
1. بذر الخلايا (اليوم الأول)
ملاحظة: في هذه الخطوة ، يتم فصل الخلايا عن طبق (أطباق) زراعة الأنسجة ، وعدها ، وزرعها في ألواح زراعة الأنسجة المكونة من 6 آبار لنقلها في الخطوة 2 (الشكل 2).
- نضح الوسائط من الخلايا في طبق 10 سم. اغسل الخلايا ب 5 مل من محلول ملحي مخزن بالفوسفات (PBS) وانضحه.
- أضف 1 مل من حمض التربسين والإيثيلين ديامينيترايتيك (EDTA) واحتضانها لمدة 3-5 دقائق عند 37 درجة مئوية لفصل الخلايا عن الطبق.
- أضف 9 مل من وسط النسر المعدل الكامل من Dulbecco (DMEM) إلى الخلايا لتحييد التربسين والماصة لأعلى ولأسفل بشكل متكرر لتوليد تعليق متجانس لخلية واحدة.
- انقل على الفور 20 ميكرولتر من الخلايا إلى أنبوب سعة 1.7 مل واخلطها مع 20 ميكرولتر من صبغة تريبان الزرقاء. عد الخلايا باستخدام عداد الخلايا الآلي (جدول المواد) أو مقياس الدم.
- خفف الخلايا إلى 2 × 105 خلايا / مل في وسائط DMEM كاملة وأضف 2 مل إلى كل بئر من صفيحة زراعة الأنسجة المكونة من 6 آبار (4 × 105 خلايا / بئر). احتضان الخلايا عند 37 درجة مئوية و 10٪ CO2 بين عشية وضحاها.
ملاحظة: يوصى باستخدام خلايا 293FT التي تم تمريرها أقل من 20x. لقد وجدنا سابقا أن استخدام الخلايا ذات أرقام مرور أكبر يمكن أن يؤدي إلى انخفاض نسب BRET وزيادة تباين الإشارة من بئر إلى بئر.
2. نقل الخلايا (اليوم الثاني)
ملاحظة: هنا ، يتم نقل الخلايا باستخدام تركيبات تعبير pCMV5-NanoLuc-CRAF و pCMV5-14-3-3ζ-Halo ، جنبا إلى جنب مع المتجه الفارغ pCDNA3.1 (الشكل 2).
- قبل النقل ، قم بتخفيف بلازميدات N-BRET إلى 5 نانوغرام / ميكرولتر و pCDNA3.1 إلى 100 نانوغرام / ميكرولتر ، وقم بترقيم مجموعة من الأنابيب المعقمة سعة 1.7 مل.
- أضف 100 ميكرولتر من وسائط النقل (انظر جدول المواد للحصول على التفاصيل) إلى كل أنبوب ، جنبا إلى جنب مع 5 نانوغرام من pCMV5-NanoLuc-CRAF ، و 10 نانوغرام من pCMV5-14-3-3ζ و 200 نانوغرام من PCDNA3.1.
- أضف 2 ميكرولتر من كاشف النقل (انظر جدول المواد للحصول على التفاصيل) ودوامة برفق للخلط. قم بتدوير الأنابيب لفترة وجيزة في جهاز طرد مركزي دقيق لضمان جمع كل السوائل في قاع الأنابيب ثم احتضانها عند حوالي 25 درجة مئوية لمدة 15 دقيقة.
- أضف معقدات النقل بالتنقيط إلى الخلايا واحتضانها عند 37 درجة مئوية / 10٪ CO2 لمدة 16-20 ساعة للسماح بالتعبير عن البروتينات الموسومة بالهالة والنانو.
ملاحظة: تعد إضافة الحمض النووي الحامل الفارغ (pCDNA3.1) أمرا ضروريا لتحقيق كفاءة نقل عالية لتركيبات تعبير N-BRET. يؤدي الفشل في إضافة ناقلات فارغة إلى انخفاض مستويات التعبير لبروتينات 14-3-3ζ-Halo و Nano-CRAF ، وبالتالي يؤدي إلى نسب BRET ضعيفة وغير متسقة ، كما تمت مناقشته سابقا22.
3. إعادة طلاء الخلية (اليوم الثالث)
ملاحظة: في هذه الخطوة ، يتم نقل الخلايا إلى لوحة 384 بئرا وإما Halo 618 ligand (+ ligand ؛ جدول المواد) أو تمت إضافة DMSO (+ مركبة) لقراءة انبعاثات BRET في الخطوة 4. يتم نقل الخلايا المتبقية إلى ألواح استزراع جديدة من 6 آبار لتحليل اللطخة الغربية في الخطوة 5 (الشكل 2).
- اجمع المواد التالية وقم بإعداد منطقة العمل كما هو موضح أدناه.
- باستخدام حمام مائي بدرجة حرارة 37 درجة مئوية ، قم بتسخين التربسين-EDTA مسبقا ، جنبا إلى جنب مع كل من وسائط الفحص الخالية من المصل ووسائط الفحص المكملة ب 10٪ من FBS (انظر جدول المواد للحصول على التفاصيل).
- بناء على عدد العينات المراد قياسها ، قم قبل تسمية ثلاث مجموعات من الأنابيب المعقمة سعة 1.7 مل (المجموعة 1-3) ، ومجموعة واحدة من الأنابيب السفلية المخروطية المعقمة سعة 15 مل. جهز جهاز طرد مركزي دلو متأرجح بإدخالات أنبوب سعة 15 مل وقم بالتبريد المسبق إلى 4 درجات مئوية.
- ضع العناصر التالية في غطاء زراعة الأنسجة: خزانات الكواشف ، وألواح زراعة الأنسجة المكونة من 384 بئرا ، وألواح زراعة الأنسجة المكونة من 6 آبار ، وماصة ونصائح متعددة القنوات ، وشرائح / غرف عد الخلايا ، وصبغة تريبان الزرقاء (جدول المواد) ، جنبا إلى جنب مع مجموعات أنابيب 1.7 مل 1-3.
- حصاد الخلايا وعدها كما هو موضح أدناه.
- نضح الوسائط من ألواح 6 آبار وأضف 250 ميكرولتر من التربسين-EDTA إلى الخلايا. احتضان الألواح المكونة من 6 آبار عند 37 درجة مئوية حتى تبدأ الخلايا في الانفصال (3-5 دقائق).
- أضف 1 مل من وسائط الفحص المكملة ب FBS بنسبة 10٪ إلى كل بئر لتحييد التربسين والماصة لأعلى ولأسفل بقوة لتوليد تعليق أحادي الخلية.
- انقل 1 مل من معلق الخلية إلى أنابيب 15 مل المحددة مسبقا. أضف 1 مل أخرى من وسائط الفحص المكملة ب FBS بنسبة 10٪ إلى كل أنبوب من أنابيب 15 مل.
- اقلب الأنابيب 5x لخلطها وانقل على الفور 20 ميكرولتر من تعليق الخلية إلى الأنبوب 1.
- أجهزة الطرد المركزي في جهاز الطرد المركزي دلو التأرجح المبرد مسبقا لمدة 5 دقائق عند ~ 250 × جم. أثناء خطوة الطرد المركزي ، امزج 20 ميكرولتر من صبغة الخلايا الزرقاء المثقبية مع الخلايا الموجودة في مجموعة الأنبوب 1 ثم عد الخلايا باستخدام إما عداد الخلايا الآلي أو مقياس الدم. العائد من 6-8 × 105 خلايا / مل نموذجي.
- قم بإزالة أنابيب 15 مل من جهاز الطرد المركزي وشفط الوسائط من كريات الخلية. أعد تعليق كريات الخلية إلى 2 × 105 خلايا / مل في وسائط فحص خالية من المصل وماصة بقوة لتوليد تعليق خلية واحدة.
ملاحظة: يتم استخدام وسائط الفحص الخالية من المصل لتهدئة مسارات إشارات الخلايا الطبيعية.
- إعادة طلاء الخلايا في لوحات 384 بئر و 6 آبار كما هو موضح أدناه.
- اقلب أنابيب 15 مل عدة مرات لضمان تعليق خلية متجانسة ونقل أنابيب 500 ميكرولتر إلى 1.7 مل مجموعة 2 ومجموعة 3.
- أضف 0.5 ميكرولتر من DMSO (+ مركبة) للضبط 2 و 0.5 ميكرولتر من Halo 618 ligand (+ ligand) إلى مجموعة الأنبوب 3 والماصة للخلط.
- نقل معلقات خلايا + مركبة و + ليجند إلى آبار منفصلة لخزانات الكاشف. باستخدام الماصة متعددة القنوات (جدول المواد) ، انقل 40 ميكرولتر من تعليق خلية + مركبة من خزانات الكاشف إلى الآبار المكررة أربع مرات للوحة الاستزراع المكونة من 384 بئرا. كرر هذه الخطوة لمعلقات خلايا الرباط +.
- نقل الخلايا المتبقية إلى لوحات ثقافة جديدة من 6 آبار. احتضان الألواح المكونة من 384 بئرا و 6 آبار طوال الليل عند 37 درجة مئوية و 5٪ CO2.
4. قراءة انبعاثات BRET (اليوم 4)
ملاحظة: في هذه الخطوة ، تتم إضافة ركيزة nanoluciferase (انظر جدول المواد للحصول على التفاصيل) إلى الخلايا الموجودة في لوحة الاستزراع المكونة من 384 بئرا ويتم قراءة انبعاثات متقبل N-BRET (618 نانومتر) والمانحة (460 نانومتر) (الشكل 2). ثم يتم حساب نسب BRET المصححة.
- قم بتسخين وسائط الفحص الخالية من المصل مسبقا في حمام مائي بدرجة حرارة 37 درجة مئوية وقم بإذابة ركيزة nanoluciferase عند 25 درجة مئوية. تمييع الركيزة نانولوسيفيراز 1: 100 في وسائط فحص خالية من المصل ونقلها إلى خزان الكاشف. قم بإعداد ما يكفي من هذا الخليط لإضافة 10 ميكرولتر إلى كل بئر من لوحة 384 بئرا ، بالإضافة إلى 10٪ -15٪ حجم إضافي.
- باستخدام ماصة متعددة القنوات (جدول المواد) ، انقل 10 ميكرولتر من خليط الركيزة إلى كل بئر من الآبار التي تحتوي على خلايا في لوحة الاستزراع المكونة من 384 بئرا. قم بتدوير اللوحة برفق لمدة 1 دقيقة ، إما يدويا أو باستخدام شاكر مداري.
- أدخل لوحة 384 بئرا في قارئ الألواح متعدد الأوضاع وسجل انبعاثات 460 نانومتر و 618 نانومتر لجميع الآبار التي تحتوي على خلايا.
ملاحظة: بالنسبة لقارئ الألواح متعدد الأوضاع المستخدم في هذه الخطوة (انظر جدول المواد للحصول على التفاصيل)، تم استخدام ارتفاع قراءة يبلغ 6.5 مم، مع قياس وقت قراءة 0.1 ثانية، ومع ذلك قد تكون هناك حاجة إلى مزيد من التحسين في حالة استخدام قارئات لوحات أخرى. - احسب نسب BRET الأولية ل + مركبة و + ligand بوحدات milliBRET (mBU) بشكل فردي ، باستخدام المعادلة التالية:
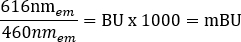
- احسب نسبة BRET المصححة بطرح نسبة + BRET للمركبة من نسبة + Ligand (الجدول التكميلي 1).
ملاحظة: عند مقارنة نتائج تجارب متعددة ، يمكن تجميع نسب BRET المصححة وتسويتها إلى متوسط زوج Wildtype (WT) N-BRET ، الذي يتكون منNano-CRAF WT و 14-3-3ζWT-Halo (الجدول التكميلي 1).
5. تأكيد مستويات التعبير عن البروتين (الأيام 4 و 5)
ملاحظة: في هذه الخطوة ، يتم تحليل الخلايا الموجودة في الصفائح المكونة من 6 آبار ويتم تحديد مستويات التعبير البروتيني لبروتينات Nano-CRAF و 14-3-3ζ-Halo عن طريق تحليل اللطخة الغربية باستخدام الأجسام المضادة الخاصة بعلامات Halo و Nano. (الشكل 2).
- أضف مثبطات الأنزيم البروتيني والفوسفاتيز إلى محلول تحلل NP40 (جدول المواد) ، مما يسمح ب 200 ميكرولتر من محلول التحلل لكل عينة.
- نضح الوسائط من 6 لوحات جيدة تحتوي على خلايا. اغسل الخلايا مرة واحدة مع 1 مل من برنامج تلفزيوني بارد ونضح.
- أضف 125 ميكرولتر من محلول تحلل NP40 إلى كل بئر واحتضان 6 ألواح بئر عند 4 درجات مئوية على منصة هزازة لمدة 15 دقيقة لتحلل الخلايا.
- نقل المحللات إلى أنابيب سعة 1.7 مل على الثلج وأجهزة الطرد المركزي عند 20000 × جم لمدة 10 دقائق عند 4 درجات مئوية. ضع المحللة التي تم تطهيرها مرة أخرى على الثلج وحدد تركيز البروتين باستخدام المقايسات المتاحة تجاريا ، مثل مقايسات حمض برادفورد أو حمض بيكينشونيك (BCA).
- تطبيع تركيز البروتين عبر جميع العينات عن طريق نقل حجم مناسب من محلول المحللة ومحلول تحلل NP40 إلى أنابيب جديدة سعة 1.7 مل إلى حجم إجمالي قدره 100 ميكرولتر.
- قم بغلي 5x من محلول عينة البروتين (جدول المواد) لمدة 1 دقيقة وأضف 25 ميكرولتر لكل عينة. قم بغلي العينات لمدة 5-6 دقائق ثم قم بنبض أجهزة الطرد المركزي للأنابيب لفترة وجيزة لضمان تجمع كل العينة في قاعدة الأنبوب.
- قم بتحميل 25 ميكرولتر من العينة في كل بئر من المواد الهلامية البروتينية المكررة (الجل 1 والجل 2) ثم انقل البروتينات إلى أغشية النيتروسليلوز أو PVDF باستخدام إجراءات النشاف الغربية القياسية ، كما هو موضح سابقا22.
- قم بسد الأغشية في 3٪ BSA-PBS عند 25 درجة مئوية لمدة 30 دقيقة ثم احتضان الأغشية طوال الليل باستخدام الأجسام المضادة Halo (1: 1000 تخفيف ؛ جل 1) وإما نانولوسيفيراز أو جسم مضاد CRAF (تخفيف 1: 500 ؛ جل 2) في محلول ملحي مخزن تريس ، مكمل ب 0.2٪ توين -20 (TBST ؛ جدول المواد).
- اغسل الأغشية 1x لمدة 5 دقائق في 10 مل من TBST ثم احتضانها في درجة حرارة الغرفة لمدة ساعة واحدة باستخدام الجسم المضاد الثانوي HRP المضاد للفأر ، المخفف 1: 10000 في TBST.
- اغسل الأغشية 3 مرات على منصة هزازة في 10 مل من TBST عند 25 درجة مئوية لمدة 5 دقائق لكل منها. قم بإزالة TBST وتصور نطاقات البروتين باستخدام كواشف ECL وإما معالج فيلم الأشعة السينية أو أي نظام تصوير مناسب آخر.
النتائج
عند إجراء كما هو موضح في هذا البروتوكول (الشكل 2) ، يجب أن ينتج تفاعل Nano-CRAFWT و 14-3-3ζ-Halo نسب BRET مصححة من 50-60 mBU (الشكل 3A ؛ الجدول التكميلي 1). يحتوي CRAF على موقعين للرسو يعتمدان على الفسفرة 14-3-3 ، موقع N وموقع C (الشكل 1)8. لذلك...
Discussion
أظهرت الدراسات السابقة أن بروتينات 14-3-3 تلعب أدوارا حاسمة في كل من تنشيط وتثبيط كينازات RAF. إن فهم كيفية تنظيم هذه الأحداث الملزمة وتأثيرات تعديل هذه التفاعلات على إشارات سلاح الجو الملكي البريطاني وتكوين الأورام المدفوع بسلاح الجو الملكي البريطاني قد يكشف عن نقاط ضعف علاجية جديدة تستهدف ...
Disclosures
لا شيء للكشف عنه.
Acknowledgements
تم تمويل هذا المشروع جزئيا بأموال فيدرالية من المعهد الوطني للسرطان ، المعاهد الوطنية للصحة ، تحت رقم المشروع ZIA BC 010329.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| HaloTag® mouse monoclonal antibody | Promega | G9211 | Antibody for detecting HaloTag tagged proteins by immunoblot |
| NanoLuc® mouse monoclonal antibody | R&D Systems | MAB10026 | Antibody for detecting Nano-tagged proteins by immunoblot |
| CRAF mouse monoclonal antibody (E10) | Santa Crus Biotechnology | sc-7267 | Antibody directly detecting CRAF proteins by immunoblot |
| ECL anti-mouse HRP secondary antibody | Amersham | NA931-1ML | Secondary HRP conjugated mouse antibody (from sheep) |
| Reagents | |||
| X-tremeGENE™ 9 | Roche/Sigma | 6365809001 | |
| NanoBRET™ kit | Promega | N1661 | NanoBRET kit containing Halo 618 ligand and NanoGlo (nanoluciferase) substrate |
| DPBS, without Ca++ and Mg++ | Quality Biologicals | 114-057-101 | |
| Trypsin-EDTA (0.05%), phenol red | Life Technologies | 25300120 | |
| DMEM cell culture media | Life Technologies | 11995073 | High glucose, L-glutamine, phenol red, sodium pyruvate; without HEPES, suppliment media with 10% FBS, 2 mM L-glutamine and 100U penicillin-streptomycin |
| L-Glutamine (200 mM) | Life Technologies | 25030164 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140163 | |
| Opti-MEM™ I reduced serum media | Gibco | 31985062 | For cell transfection |
| Opti-MEM reduced serum media, no phenol red | Gibco | 11058021 | For replating cells on Day 3. Supplement with 2 mM L-glutamine and 100U penicillin-streptomycin, along with 10% FBS (where indicated). |
| Invitrogen Trypan Blue Stain | Thermo Scientific | T10282 | |
| NP40 lysis buffer | N/A | N/A | 20 mM Tris (pH 8.0), 137mM NaCl, 10% glycerol, NP40 alternative (Milipore, Cat# 492016). Store at 4 degrees C.. Add the following protease and phosphatase immediately prior to use: 20 µM leupeptin, 0.5 mM sodium orthovanidate, 0.15 U/mL, 1mM PMSF. |
| 5x gel sample buffer | N/A | N/A | 240 mM Tris (pH 8.0), 9.5% SDS, 30% glycerol, 500mM DTT, 3mM bromophenol blue. Store at -20 degrees C. |
| Cell lines | |||
| 293FT cells (human) | Thermo Scientific | R70007 | |
| DNA vectors | |||
| pCMV5-Nano-CRAF WT and mutant | N/A | N/A | |
| pCMV5-14-3-3ζ-Halo | N/A | N/A | |
| Equipment | |||
| EnVision 2104 Multimode Plate Reader | PerkinElmer 2104 | 2104-0010 | 600LP NanoBRET & M460/50 nm NanoBRET emmisions filters, Luminescence 404 mirror, 6.5 mm measurement height and 0.1 s measurement time |
| Invitrogen Countess™ II Automated Cell Counter | Thermo Scientific | AMQAX1000 | |
| ThermoFisher E1-ClipTip™ Multichannel Pipettor | Thermo Scientific | 4672070 | |
| Software | |||
| GraphPad Prism (version 10.0.3) | GraphPad | www.graphpad.com | |
| Other | |||
| ThermoFisher ClipTip Multichannel pipette tips | Thermo Scientific | 94410153 | |
| Reagent Reservoir, 25 mL Divided, Sterile | Thomas Scientific | 1228K16 | |
| Perkin Elmer 384-well CulturPlate™ | PerkinElmer | 6007680 | White, polystyrene, tissue culture treated |
| Countess Cell Counting Chamber Slides | Thermo Scientific | C10228 |
References
- Blasco, R. B., et al. c-Raf, but not B-Raf, is essential for development of K-Ras oncogene-driven non-small cell lung carcinoma. Cancer Cell. 19, 652-663 (2011).
- Blasco, M. T., et al. Complete regression of advanced pancreatic ductal adenocarcinomas upon combined inhibition of EGFR and C-RAF. Cancer Cell. 35, 573-587 (2019).
- Karreth, F. A., Frese, K. K., DeNicola, G. M., Baccarini, M., Tuveson, D. A. C-Raf is required for the initiation of lung cancer by K-Ras(G12D). Cancer Discov. 1, 128-136 (2011).
- Lito, P., et al. Disruption of CRAF-mediated MEK activation is required for effective MEK inhibition in KRAS mutant tumors. Cancer Cell. 25, 697-710 (2014).
- Sanclemente, M., et al. c-RAF ablation induces regression of advanced Kras/Trp53 mutant lung adenocarcinomas by a mechanism independent of MAPK signaling. Cancer Cell. 33, 217-228 (2018).
- Razzaque, M. A., et al. Germline gain-of-function mutations in RAF1 cause Noonan syndrome. Nat Genet. 39, 1013-1017 (2007).
- Pandit, B., et al. Gain-of-function RAF1 mutations cause Noonan and LEOPARD syndromes with hypertrophic cardiomyopathy. Nat Genet. 39, 1007-1012 (2007).
- Terrell, E. M., Morrison, D. K. Ras-mediated activation of the Raf family kinases. Cold Spring Harb Perspect Med. 9 (1), 033746 (2019).
- Kondo, Y., et al. Cryo-EM structure of a dimeric B-Raf:14-3-3 complex reveals asymmetry in the active sites of B-Raf kinases. Science. 366, 109-115 (2019).
- Park, E., et al. Architecture of autoinhibited and active BRAF-MEK1-14-3-3 complexes. Nature. 575 (7783), 545-550 (2019).
- Tzivion, G., Luo, Z., Avruch, J. A dimeric 14-3-3 protein is an essential cofactor for Raf kinase activity. Nature. 394, 88-92 (1998).
- Spencer-Smith, R., et al. RASopathy mutations provide functional insight into the BRAF cysteine-rich domain and reveal the importance of autoinhibition in BRAF regulation. Mol Cell. 82, 4262-4276 (2022).
- Martinez Fiesco, J. A., Durrant, D. E., Morrison, D. K., Zhang, P. Structural insights into the BRAF monomer-to-dimer transition mediated by RAS binding. Nat Commun. 13, 486 (2022).
- Freeman, A. K., Ritt, D. A., Morrison, D. K. The importance of Raf dimerization in cell signaling. Small GTPases. 4, 180-185 (2013).
- Freeman, A. K., Ritt, D. A., Morrison, D. K. Effects of Raf dimerization and its inhibition on normal and disease-associated Raf signaling. Mol Cell. 49, 751-758 (2013).
- Rushworth, L. K., Hindley, A. D., O'Neill, E., Kolch, W. Regulation and role of Raf-1/B-Raf heterodimerization. Mol Cell Biol. 26, 2262-2272 (2006).
- Garnett, M. J., Rana, S., Paterson, H., Barford, D., Marais, R. Wild-type and mutant B-RAF activate C-RAF through distinct mechanisms involving heterodimerization. Mol Cell. 20, 963-969 (2005).
- Tran, N. H., Wu, X., Frost, J. A. B-Raf and Raf-1 are regulated by distinct autoregulatory mechanisms. J Biol Chem. 280, 16244-16253 (2005).
- Chong, H., Guan, K. L. Regulation of Raf through phosphorylation and N terminus-C terminus interaction. J Biol Chem. 278, 36269-36276 (2003).
- Cutler, R. E., Stephens, R. M., Saracino, M. R., Morrison, D. K. Autoregulation of the Raf-1 serine/threonine kinase. Proc Natl Acad Sci U S A. 95, 9214-9219 (1998).
- Park, E., et al. Cryo-EM structure of a RAS/RAF recruitment complex. Nat Commun. 14, 4580 (2023).
- Spencer-Smith, R., Morrison, D. K. Protocol for measuring BRAF autoinhibition in live cells using a proximity-based NanoBRET assay. STAR Protoc. 4, 102461 (2023).
- Clark, G. J., et al. 14-3-3 zeta negatively regulates raf-1 activity by interactions with the Raf-1 cysteine-rich domain. J Biol Chem. 272, 20990-20993 (1997).
- Machleidt, T., et al. NanoBRET--A novel BRET platform for the analysis of protein-protein interactions. ACS Chem Biol. 10, 1797-1804 (2015).
- Hekman, M., et al. Dynamic changes in C-Raf phosphorylation and 14-3-3 protein binding in response to growth factor stimulation: differential roles of 14-3-3 protein binding sites. J Biol Chem. 279, 14074-14086 (2004).
- Hatzivassiliou, G., et al. RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth. Nature. 464, 431-435 (2010).
- Bondzi, C., Grant, S., Krystal, G. W. A novel assay for the measurement of Raf-1 kinase activity. Oncogene. 19, 5030-5033 (2000).
- Spencer-Smith, R., et al. Inhibition of RAS function through targeting an allosteric regulatory site. Nat Chem Biol. 13 (1), 62-68 (2016).
- Roy, S., et al. 14-3-3 facilitates Ras-dependent Raf-1 activation in vitro and in vivo. Mol Cell Biol. 18, 3947-3955 (1998).
- Durrant, D. E., et al. Development of a high-throughput NanoBRET screening platform to identify modulators of the RAS/RAF interaction. Mol Cancer Ther. 20, 1743-1754 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved