Method Article
التصوير الحي وتوصيف ديناميكيات الخلايا الدبقية الصغيرة في جنين الزرد
In This Article
Summary
نوضح طريقة تستفيد من الفحص المجهري متحد البؤر للمسح السريع لإجراء تصوير مباشر لخلايا الخلايا الدبقية الصغيرة في القفص البصري لسمك الزرد النامي ، مما يسمح بتحليل ديناميكيات هذه الخلايا في الجسم الحي.
Abstract
الخلايا الدبقية الصغيرة هي خلايا ديناميكية للغاية وهجرتها واستعمار حمة الدماغ هي خطوة حاسمة لنمو الدماغ ووظيفته بشكل صحيح. تمتلك أجنة الزرد النامية خارجيا شفافية بصرية ، والتي إلى جانب خطوط مراسل معدلة وراثيا جيدة المواصفات التي تصف الخلايا الدبقية الصغيرة بالفلورسنت ، تجعل الزرد نموذجا مثاليا للفقاريات لمثل هذه الدراسات. في هذه الورقة ، نستفيد من الميزات الفريدة لنموذج الزرد لتصور ديناميكيات الخلايا الدبقية الصغيرة في الجسم الحي وتحت الظروف الفسيولوجية. نستخدم الفحص المجهري متحد البؤر لتسجيل الفاصل الزمني لخلايا الخلايا الدبقية الصغيرة في القفص البصري لجنين الزرد ، ثم استخراج بيانات التتبع باستخدام برنامج IMARIS 10.0 للحصول على مسار هجرة الخلايا ومتوسط السرعة والتوزيع في القفص البصري في مراحل النمو المختلفة. يمكن أن يكون هذا البروتوكول أداة مفيدة لتوضيح الأهمية الفسيولوجية لسلوك الخلايا الدبقية الصغيرة في سياقات مختلفة ، مما يساهم في توصيف أعمق لهذه الخلايا شديدة الحركة.
Introduction
باعتبارها بلاعم مقيمة في الجهاز العصبي المركزي (CNS) ، تمثل الخلايا الدبقية الصغيرة مجموعة متميزة غير عصبية تمثل ما يصل إلى 15٪ من جميع الخلايا الدبقية في الدماغ البالغ. اكتسبت دراسة بيولوجيا الخلايا الدبقية الصغيرة اهتماما متزايدا في السنوات الأخيرة بسبب أهميتها الراسخة في التنمية وعلم وظائف الأعضاء والمرض1. في ظل الظروف الفسيولوجية ، تكون الخلايا الدبقية الصغيرة ديناميكية للغاية ، وتقوم باستمرار بمسح حمة الدماغ 2,3. يسمح هذا السلوك للخلايا الدبقية الصغيرة باستعمار الدماغ ولعب أدوار محورية في تطوره مثل تشكيل الدوائر العصبية4 ، والتقليم المشبكي5 ، وتكوين الأوعية الدموية6. علاوة على ذلك ، تسمح هذه الطبيعة الديناميكية المتأصلة للخلايا الدبقية الصغيرة بمراقبة الجهاز العصبي المركزي باستمرار بحثا عن علامات العدوى أو الإصابة أو أي انحرافات عن التوازن7. لتشريح ديناميكيات الخلايا المعقدة هذه ، لا غنى عن التصوير الحي للخلايا الدبقية الصغيرة عبر المكان والزمان. لحسن الحظ ، فإن الشفافية البصرية لأجنة الزرد النامية خارجيا ، إلى جانب توفر خطوط مراسلة معدلة وراثيا جيدة المواصفات والتي تصف الخلايا الدبقية الصغيرة بالفلورسنت ، تضع الزرد كنموذج مثالي للفقاريات لمثل هذه التحقيقات. يوفر التصوير الحي في أجنة الزرد نهجا غير جراحي لا يتطلب جراحة أو معالجة واسعة النطاق للأنسجة، مما يقلل من الاضطرابات المحتملة لحالة الجهاز العصبي المركزي. هذا اعتبار حاسم عند دراسة الخلايا الدبقية الصغيرة ، لأنها حساسة للغاية حتى للتغيرات الطفيفة في البيئة خارج الخلية8.
هنا ، نقدم إرشادات لتتبع حركات الخلايا الدبقية الصغيرة 3D بنجاح في جنين الزرد ، مما يسمح برؤية غير مسبوقة لسلوك الخلايا الدبقية الصغيرة داخل البنية السليمة لحمة الدماغ النامية (انظر الشكل 1 للحصول على نظرة عامة رسومية للبروتوكول). يوضح هذا البروتوكول خطوة بخطوة كيفية إعداد وتصوير الخلايا الدبقية الصغيرة لأسماك الزرد في مراحل النمو المختلفة وكيفية استخراج بيانات عالية الدقة حول حركة الخلايا الدبقية الصغيرة لتوفير رؤى قيمة حول أنماط هجرتها واستجاباتها للإشارات البيئية. نوضح أيضا أنه يمكن تكييف هذا البروتوكول لإجراء تصوير حي متعدد الألوان ، وبالتالي توسيع نطاق تطبيقه لدراسة الخلايا الدبقية الصغيرة مع الخطوط المعدلة وراثيا التي تميز الخلايا المجاورة ، بما في ذلك الخلايا العصبية3 ، والخلايا قليلة التغصن9 ، والخلايا البطانية10 (كما هو موضح في الشكل 2). من خلال الإضافة إلى صندوق الأدوات الذي يسمح للمرء بمراقبة وتوصيف ديناميكيات سلوك الخلايا الدبقية الصغيرة بشكل مباشر في الوقت الفعلي وفي بيئتها الطبيعية ، من المحتمل أن يساهم هذا البروتوكول في توضيح وظائف الخلايا الدبقية الصغيرة بشكل أفضل أثناء التطور المبكر ، سواء في علم وظائف الأعضاء أو المرض.
Protocol
وقد تم الحفاظ على سمك الزرد في ظل ظروف قياسية، وفقا لما ذكره FELASA42 والمؤسسات (جامعة بروكسل الحرة، بروكسل، بلجيكا؛ وجامعة بروكسل الحرة، بروكسل، بلجيكا). ULB) المبادئ التوجيهية واللوائح. تمت الموافقة على جميع الإجراءات التجريبية من قبل اللجنة الأخلاقية لرعاية ULB (CEBEA) من ULB.
1. تربية الزرد وإعداد الأجنة
ملاحظة: تم استخدام الخط المعدل وراثيا لسمك الزرد Tg (mpeg1: eGFP) gl22 الذي يعبر عن بروتين eGFP الفلوري في الضامة ، بما في ذلك الخلايا الدبقية الصغيرة ، لتوليد بيانات التتبع الموضحة في هذا البروتوكول. تتوفر خطوط مراسل البلاعم الأخرى من ZIRC ويمكن استخدامها أيضا. عند اختيار الخط المعدل وراثيا ، من المهم مراعاة أن شدة الإشارة العالية ستسهل الحصول على الصور وتجزئة الخلايا.
- الحفاظ على الزرد (Danio rerio) عند درجة حرارة 28 درجة مئوية وإدارتها وفقا للبروتوكولات المعمول بها11.
- تحفيز التزاوج عن طريق وضع الأسماك الإناث والذكور معا في حوض تربية ، مع قاع شبكي وفاصل ، في وقت متأخر بعد الظهر قبل تاريخ ولادة الأجنة المطلوب. قم بإزالة الفاصل في صباح اليوم التالي لوقت تزاوج الأسماك.
- اجمع البويضات المخصبة باستخدام شبكة وانقلها إلى طبق بتري 100 مم يحتوي على وسط E3 (5 مللي مول كلوريد الصوديوم ، 0.17 مللي مول KCl ، 0.33 مللي مول CaCl2 ، 0.33 مللي مول MgSO4) مع 0.01٪ أزرق الميثيلين. اعتمادا على الخلفية الوراثية للخط المعدل وراثيا لسمك الزرد المستخدم ، إذا تم تثبيط تكوين الصباغ لتسهيل التصوير ، أضف 0.003٪ من N-phenylthiourea (PTU) إلى المخزن المؤقت E3 الذي تتطور فيه الأجنة ، بدءا من 6 ساعات بعد الإخصاب (hpf) وتحديث المحلول كل يومين حتى يتم الوصول إلى مرحلة النمو المطلوبة.
ملاحظة: لتجنب التعرض الطويل ل PTU الذي يمكن أن يؤثر على التطور الجنيني12 ، يقترح استخدام ، إذا كان متاحا ، خط معدل وراثيا على خلفية ناقصة الصباغ ، مثل Casperw2 ، والذي يسمح بالتصوير الواضح دون الحاجة إلى تعريض الأجنة ل PTU لفترة طويلة من الزمن13. - إذا كانت الأجنة المراد تصويرها أصغر من 3 أيام بعد الإخصاب (dpf) ، فقم بإزالتها عند 24 hpf. استخدم مجهرا مجسما للتأكد من أن جميع الأجنة قد تم تفكيكها وعدم تلفها بسبب العلاج الأنزيمي (انظر الخطوة 1.4.2).
- في حالة وجود عدد محدود من البويضات ، قم بذلك يدويا باستخدام ملقط تشريح دقيق لقرص المشيم وسحبه للخارج ، وتحرير كل جنين بعناية من المشيم.
- في حالة وجود عدد أكبر من البيض ، قم بإجراء عملية إزالة التأين إنزيميا عن طريق احتضان البيض بكميات كبيرة في درجة حرارة الغرفة (RT) في محلول Pronase 1 مجم / مل في وسط E3 لفترة وجيزة (عادة 5-10 دقائق ، حتى تنفتح الحبال تحت الحفيف بلطف). بعد ذلك ، يتم التخلص من محلول Pronase ، ويتم شطف الأجنة جيدا 3x باستخدام E3 الطازج ، لإزالة أي مشيم متبقي وإنزيم متبقي.
2. تصاعد الزرد
- تحضير محلول أغاروز منخفض الذوبان بنسبة 1٪ في المخزن المؤقت E3. قم بتبريد الأغاروز إلى 37 درجة مئوية في كتلة تسخين فوق الطاولة وأضف محلول الميثان سلفونات Tricaine الطازج (160 مجم / لتر) ، مما يساعد في الحفاظ على تخدير الأجنة أثناء التصوير. دوامة الحل لتجانسها تماما.
- تخدير الأجنة بإضافة 160 مجم / لتر من تريكايين ميثان سلفونات إلى طبق بتري الذي يحتوي على الأجنة في محلول E3. تحقق للتحقق من توقف الحركة وحدد أجنة الزرد ذات التألق المطلوب. تحقق من صحة الجنين عن طريق تصور نبضات قلبه باستخدام مجهر ستيريو برايتفيلد. باستخدام ماصة نقل عريضة الرأس ، قم بسحب واحد ، أو ما يصل إلى ثلاثة ، من الأجنة المختارة ونقلها إلى لوحة تصوير زجاجية سفلية.
- تحت المجهر ستيريو ، استخدم ماصة لإزالة أكبر قدر ممكن من الوسائط ، مع الحرص على عدم لمس أو إتلاف الأجنة ؛ بعد ذلك ، استبدل الوسط بمحلول الأغاروز منخفض الذوبان بنسبة 1٪ المعد مسبقا. بعد ذلك ، استخدم طرفا بلاستيكيا رفيعا مدببا مثبتا في نهاية إبرة إغاظة لدفع كل جنين برفق إلى أسفل لوحة التصوير ، وتوجيهه بحيث يكون جانبه الظهري مواجها للزجاج لضمان رؤية جيدة للصمت البصري والحد الأدنى من الأغاروز منخفض الذوبان بين الجنين والزجاج.
- تخيل الجنين المركب على الفور باستخدام مجهر متحد البؤر مقلوب يتميز بخطة Apo Objective عالية الجودة (10x / 0.45 Plan Apo أو 20x / 0.75 Plan Apo المستخدمة هنا). إذا كان الفاصل الزمني سيعمل لفترة طويلة (أكثر من ساعة) ، أضف قطرة أو قطرتين من المخزن المؤقت E3 مع Tricaine methanesulfonate (160 مجم / لتر) إلى لوحة التصوير الزجاجية السفلية لمنع الأغاروز منخفض الذوبان من الجفاف بشكل مفرط.
ملاحظة: من الأهمية بمكان الانتظار حتى يتجمد الأغاروز تماما قبل إضافة المخزن المؤقت E3 ووسائط الميثان سلفونات التريكايين إلى قرص التصوير ؛ خلاف ذلك ، يمكن أن تتحرك الأسماك ببطء أفقيا ومحوريا ، مما يتسبب في انجراف العينة في الفاصل الزمني. - تابع إعداد اكتساب الفاصل الزمني للوقت المطلوب: اضبط دقة الصورة على 1,024 × 1,024 ، بحجم بكسل 0.49 ميكرومتر. اجمع الشرائح الضوئية بزيادات 2-3 ميكرومتر لضمان دقة مقبولة على المحور z. في جنين الزرد ، أرفق القفص البصري في مكدس z 100-150 ميكرومتر ، اعتمادا على مرحلة النمو المستخدمة. لضمان تتبع الخلايا بنجاح ، حافظ على الفاصل الزمني بين الإطارات بين 30 ثانية و 60 ثانية.
3. تحليل التتبع وتصدير البيانات
- قم بتحويل ملف الفاصل الزمني إلى تنسيق IMS باستخدام برنامج محول ملفات Imaris (انظر جدول المواد). عند تشغيل البرنامج ، إما أن تقوم بسحب الملفات وإفلاتها في منطقة الإدخال أو استخدام ملف إضافة ملفات ... لتحديدها يدويا. في قائمة الإخراج ، قم بتعيين موقع الملفات المحولة ، واختر إما نفس المجلد مثل ملفات الإدخال أو تحديد مجلد معين. تأكد من صحة أبعاد حجم voxel المعروض بالنقر فوق الزر Set Voxel وبمجرد التحقق من حجم voxel ، اضغط على الزر Start All لبدء تحويل الملف (انظر الملف التكميلي 1 للحصول على دليل خطوة بخطوة لجميع تحليلات البيانات).
ملاحظة: إذا تم إجراء الفاصل الزمني على جنينين أو أكثر بالتوازي ، تقسيم الملف تلقائيا إلى مواضع فردية ، وفصل كل جنين إلى ملفات مختلفة. من الممكن استخدام البرنامج في وضع الدفعات وتحميل وتحويل ملفات متعددة في نفس الوقت. سيتم إنشاء ملفات IMS وحفظها في مجلد الوجهة المحدد أو المجلد الذي توجد به ملفات الإدخال. - بمجرد إطلاقه ، دع برنامج التحليل يبدأ في الساحة ؛ انقر فوق مجلد المراقبة لفتح الملف المحول مسبقا. بمجرد تحميل الملف في البرنامج ، استخدم عرض الشريحة للتمرير عبر z-stack ، باستخدام شريط التمرير في شريط أدوات الشريحة الموجود على يسار منطقة العرض ، وقم بقياس بعض أقطار الخلايا عن طريق رسم قطر الخلايا المحددة باستخدام المؤشر. انقر واسحب الماوس لرسم جزء يمتد عبر قلب الخلية ؛ لاحظ طول المقطع المرسوم في شريط أدوات القياس ، الموجود على يمين منطقة العرض.
ملاحظة: باستخدام إعدادات التصوير في الخطوة 2.5 ، يمكن توقع أن يكون قطر جسم الخلية بين 6 ميكرومتر و 8 ميكرومتر. - لاكتشاف الخلايا تلقائيا ، ارجع إلى عرض 3D وانقر على أيقونة البقعة في شريط أدوات الكائن لإضافة كائن Spot جديد في قائمة الكائنات وفتح معالج إنشاء البقع التلقائي. في الخطوة الأولى من المعالج ، حدد خيار تقسيم منطقة اهتمام فقط. بعد ذلك ، قم بتمكين خيار تتبع البقع (بمرور الوقت) لحساب بيانات التتبع ، بالإضافة إلى إحصائيات الكائن والكائن للسماح بالمقارنة بين النقاط وتوسيع نطاق البيانات التي ستكون متاحة لاحقا في التحليل. أخيرا ، تابع المعالج بالنقر فوق التالى زر في أسفل يمين نافذة المعالج.
- في الخطوة الثانية ، تابع تحديد منطقة الاهتمام (ROI) التي تحيط بالعصابة البصرية للجنين. قم بتعديل حجم عائد الاستثمار بالنقر فوق الأسهم البيضاء الصغيرة الموجودة على كل وجه منه وسحبها. بمجرد تحديد حجم عائد الاستثمار ، قم بتوسيعه ليشمل جميع الإطارات المسجلة عن طريق ضبط الفاصل الزمني.
- بعد ذلك ، حدد القناة المستخدمة للكشف عن الخلايا كقناة مصدر ، وقم بتعيين قياس قطر الخلية ، الذي تم الحصول عليه مسبقا في الخطوة 3.2 ، كقطر XY المقدر. قم بتمكين خيار الطرح في الخلفية وانقر فوق التالي.
- في هذه المرحلة من معالج إنشاء Spot ، يشتمل البرنامج على خطوة تصفية الجودة حيث يتم تصفية البقع من خلال شدة الإشارة المقاسة في مركز كل بقعة ؛ في القناة حيث تم اكتشاف البقع. اضبط عتبة الكثافة عن طريق إدخال القيمة مباشرة في حقل البيانات لمربعات العتبة السفلية والعليا أو عن طريق سحب الخطوط الملونة المقابلة في الرسم البياني الموضح في أسفل معالج الإنشاء، بحيث يتم الكشف عن جميع الخلايا، بما في ذلك تلك الموجودة بشكل أعمق في النسيج، والتي تظهر عادة كثافة إشارة أقل. كل هذه التغييرات مرئية في وقت واحد في منطقة العرض.
ملاحظة: من الممكن ملاحظة نقاط متعددة تضع علامة على خلية واحدة في هذه المرحلة ، ولكن يمكن تصحيح ذلك لاحقا في التحليل.
في اللقطات المتتابعة الأطول ، إذا شوهد بعض التبييض الضوئي ، تحقق من منطقة العرض لإطارات متعددة قبل تعيين الحد للتأكد من اكتشاف جميع الخلايا أيضا في أحدث الإطارات وبالتالي الإطارات الخافتة. - بمجرد الرضا ، انقر فوق التالي للتحقق من صحة عتبة الجودة المحددة. سيتم تصنيف جميع البقع التي تفي بمعلمة عتبة الجودة والتي لها قطر مطابق لقطر XY المقدر على أنها بقعة. تصور هذا كمعاينة في منطقة العرض ، حيث سيتم فرض النقاط التي تلبي هاتين المعلمتين على قناة المصدر.
- في الخطوة التالية ، حدد حركة الانحدار الذاتي كخوارزمية تتبع لتتبع الخلايا التي لها حركة مستمرة إلى حد ما. احكم على أطول مسافة تقطعها الخلية بين نقطتين زمنيتين من خلال مراقبة حركة البقع بين إطارين بعناية وأدخل رقما تقديريا في حقل المسافة القصوى . هذه هي المسافة التي يسمح فيها للبقعة بالانحراف عن الموضع المستقبلي المتوقع.
- اضبط الحد الأقصى لحجم الفجوة على أقل عدد من النقاط الزمنية التي قد تختفي فيها النقطة دون مقاطعة المسار. إذا كان الفاصل الزمني بين الإطارات أقل من 60 ثانية ، فاستخدم حجما 3. إذا كان الفاصل الزمني بين الإطارات أطول، قم بزيادة الحد الأقصى لحجم الفجوة المسموح به لتقليل تجزئة المسار.
- قم بتمكين ملء الفجوات بجميع الكائنات المكتشفة لإسقاط عتبة الكشف بالقرب من الموضع المتوقع الذي تنبأت به خوارزمية التتبع وتوصيل المسارات التي تمت مقاطعتها بسبب فشل اكتشاف البقعة. أخيرا ، انقر فوق التالي ودع البرنامج يقوم تلقائيا بإنشاء مسارات لجميع المواقع التي تم إنشاؤها مسبقا.
- إذا بدت المسارات التي تم الحصول عليها كثيرة جدا أو مجزأة ، فارجع إلى معالج الإنشاء ، بالنقر فوق الزر السابق ، واضبط المسافة القصوى المحددة مسبقا ، إما زيادة أو تقليل الرقم حتى تمثل معظم المسارات التي تم الحصول عليها حركات الخلية.
ملاحظة: يجب أن يتطابق عدد المسارات تقريبا مع عدد الخلايا الدبقية الصغيرة ، وبالتالي ، يتراوح بين 30 و 50 ، اعتمادا على عمر الجنين. ومع ذلك ، قبل الانتهاء من التحليل ، من المتوقع وجود عدد أكبر بسبب المسارات الخاطئة. - بمجرد حساب المسارات ، يشتمل البرنامج على خطوة تصفية لتصفية جميع المسارات القصيرة جدا لأنها غالبا ما تكون غير دقيقة أو غير مفيدة. استبعاد المسارات الأقصر من 3-8 دقائق (دقيقة) بإدخال القيمة مباشرة في حقل البيانات للحد الأدنى لمرشح مدة المسار، أو بسحب الخطوط الملونة المقابلة في الرسم البياني الموضح في أسفل معالج الإنشاء. انقر فوق التالي للتحقق من صحة الفلتر والانتقال في معالج الإنشاء.
ملاحظة: كما ذكرنا من قبل ، من خلال تعديل الحد الأقصى (الأقصى) والحد الأدنى (الحد الأدنى) لمدة المسار ، من الممكن معاينة المسارات التي سيتم تصفيتها واستبعادها من التحليل. يمكن بعد ذلك تكرار المسارات التي تمت تصفيتها في كائن جديد لمزيد من التحليل. قد يختلف الحد الزمني الدقيق للتصفية استنادا إلى نتائج خطوة معالج الإنشاء السابقة. نوصي بضبط إعدادات الفلتر هذه عن طريق مراجعة المعاينة في منطقة العرض للحصول على أفضل النتائج. - نظرا لأن الخط المعدل وراثيا Tg (mpeg1: eGFP) يسمي جميع الخلايا البلعمية أحادية النواة ، أيضا اكتشاف بلاعم الجلد بالإضافة إلى الخلايا الدبقية الصغيرة في أفلام الفاصل الزمني. قم بإزالة المسارات الناتجة عن الضامة الجلدية يدويا من التحليل للتركيز على الخلايا الدبقية الصغيرة المتنية في الدماغ (الشكل 3).
- قم بتصحيح الأخطاء المحتملة الأخرى يدويا في المسارات في محرر المسار ، حيث يتم عرض كل نقطة بيانات ككائن في المسار. قم بتنشيط زر وضع تحديد الدائرة على يمين منطقة العرض وقم بتمييز المسارات التي تتطلب تعديلات أو تعديلات. بمجرد تحديد المسار الإشكالي ، باستخدام زري الاتصال وقطع الاتصال ، قم بتحريره لتمثيل حركات الخلايا بشكل صحيح. استخدم محرر المسار لتحديد وحذف النقاط المفردة المكررة أو أجزاء المسار الصغيرة التي تمثل نفس الخلية بشكل خاطئ عن طريق تحديدها باستخدام وضع تحديد الدائرة والضغط على Canc أو Delete لإزالتها.
ملاحظة: إذا كانت إعدادات التعقب صحيحة، يجب أن تكون هذه الخطوة مطلوبة لنسبة صغيرة فقط من الخلايا المتعقبة. - إذا تم استخدام خط مراسل الخلايا الدبقية الصغيرة مع علم الجينات الفلورية المحورة الذي يصف أنواع الخلايا الأخرى في الحمة ، فقم بإجراء التجزئة كجسم سطحي جديد أو كائن موضعي لتصورها. للقيام بذلك ، كرر الخطوات المذكورة أعلاه (من الخطوات 3.2 إلى 3.14) ، وتعديل إدخال قناة المصدر في الخطوة 3.5 ، لتكون هي المستخدمة لتصوير محتوى الخلية الثانية ، والاهتمام بتكييف المعلمات الوصفية الخاصة بالخلايا ذات الأهمية مثل قطر XY المقدر (الخطوة 3.5) ، أقصى مسافة (الخطوة 3.8) إلى محتوى الخلية الجديد. يمكن تكرار الخطوات الأخرى دون تغييرات.
ملاحظة: في حالة إنشاء سطح جديد ، يتم استبدال قطر XY المقدر بخيار عتبة يعتمد على طرح الخلفية ، حيث يكون الإدخال الذي سيتم تقديمه هو قطر أكبر كرة تتناسب مع الكائن. يمكن تقدير هذه القيمة من طريقة عرض الشريحة باستخدام شريط أدوات القياس كما هو موضح في الخطوة 3.2. - بمجرد الرضا عن المسارات التي تم الحصول عليها ، قم باستخراج إحصائيات التتبع المطلوبة من علامة التبويب إحصائية . بالنقر فوق زر الإعدادات ، حدد الإحصائيات التي سيتم حسابها لكل كائن موضعي أو كائن سطحي تم إنشاؤه مسبقا. في حالة إنشاء المزيد من الكائنات في نفس التحليل ، كائنان موضعيان أو بقعة وكائن سطحي ، ستكون الإحصاءات التي تصور الموضع النسبي لكائن واحد للآخر ، مثل أقصر مسافة بين الاثنين ، متاحة أيضا للتصدير.
ملاحظة: يمكن أن تكون جميع القيم المطلوبة إما قيما محددة أو متوسطة، ويمكن تنزيل جميع البيانات الأولية كملف قيم مفصولة بفواصل (CSV) باستخدام الأزرار الموجودة أسفل علامة التبويب إحصائيات . شريطة أن يشمل التحليل أيضا أنواعا أخرى من الخلايا ، ستتوفر أيضا إحصائيات إضافية حول المسافة النسبية لكائن واحد إلى الآخر.
النتائج
الخلايا الدبقية الصغيرة التي تعبر عن البروتين الفلوري الأخضر (eGFP) والخلايا البطانية التي تعبر عن DsRed في Tg(mpeg1:eGFPgl22; KDRL: كريS898; actb2: loxP-STOP-loxP-DsRedexpress,sd5) تم تصوير الأجنة المحورة وراثياالثلاثية 14 عند 3 dpf ، وفقا للبروتوكول الموصوف. تم تركيب جنين واحد من الزرد في أغاروز منخفض الذوبان بنسبة 1٪ على صفيحة زجاجية سفلية ولم تعيق عملية التصوير نمو الجنين خلال فترة الاستحواذ. تم تسجيل الفاصل الزمني باستخدام نظام مجهر متحد البؤر لمسح النقاط التجارية مزود بعدسة موضوعية جافة 10x 0.45 NA ، وتم استخدام ليزر إثارة 488 نانومتر و 561 نانومتر لتصوير الخلايا الدبقية الصغيرة والخلايا البطانية ، على التوالي. بالإضافة إلى ذلك ، كان الفاصل الزمني ودقة الصورة وحجم البكسل والخطوة z 30 ثانية (ثوان) و 1024 × 1024 و 0.49 ميكرومتر و 2.5 ميكرومتر على التوالي. استمر تسجيل الفاصل الزمني 3.5 ساعة (ساعة).
غطى مجال الرؤية المكتسب رأس الجنين بالكامل ، لكن التحليل ركز بشكل خاص على القفص البصري ، حيث أنه خلال الأسبوع الأول من التطور ، تقتصر الخلايا الدبقية الصغيرة بشكل أساسي على طبقة سوما العصبية في هذه المنطقة من الدماغ المتوسط الظهري ، مما يسمح للمحققين بتصور جميع السكان في وقت واحد15. تم إجراء تحليل التتبع ثلاثي الأبعاد باستخدام Imaris 10.0 ، كما هو موضح أعلاه. كما هو موضح في الشكل 4 ، كان التتبع ناجحا ، مما أدى إلى 25 مسارا ، مطابقة للعدد المتوقع لخلايا الخلايا الدبقية الصغيرة الموجودة في القفص البصري عند 3 dpf16. كان مطلوبا الحد الأدنى من تصحيح المسارات اليدوية. يوضح الشكل 5 مثالا على البيانات التي يمكن استخراجها من تجربة تتبع ناجحة. يسمح وضع العلامات المتزامنة للبلاعم والخلايا البطانية بتحديد موضع الخلايا الدبقية الصغيرة بالنسبة للأخيرة ، مما يسمح للباحثين بتصور المسافة النسبية لكل خلية إلى أقرب خلية بطانية في الوقت المناسب وفحص تواتر وعدد التفاعلات المحتملة (الشكل 5).
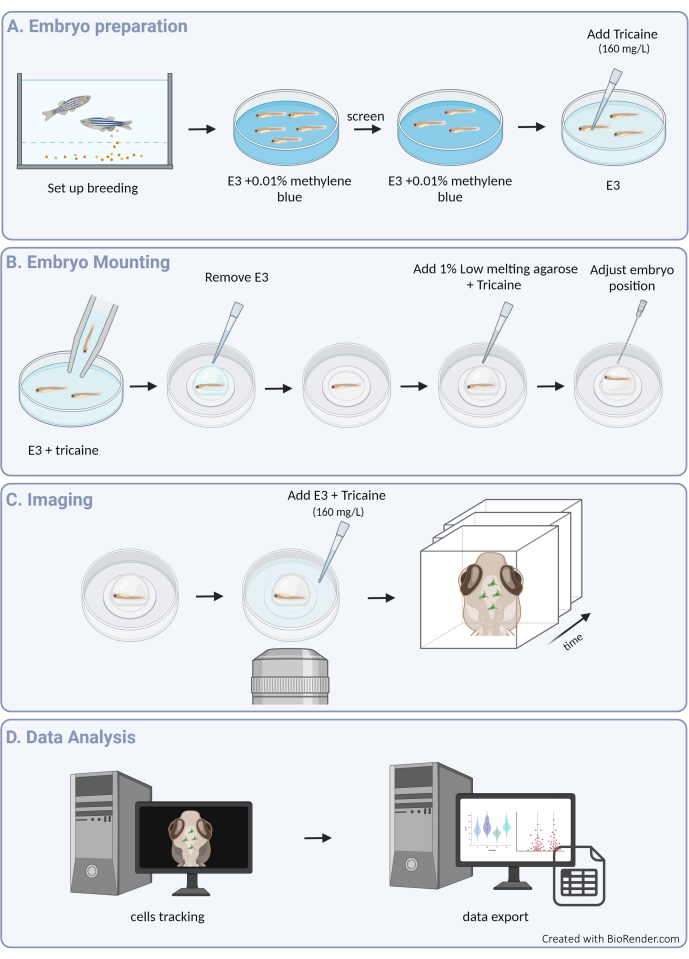
الشكل 1: نظرة عامة على الإجراء التجريبي. أ: تحضير جنين الزرد وتخديره. (ب) تركيب العينة وتحديد موضعها. (ج) الحصول على الصور. (د) معالجة الصور واستخراج بيانات الحركة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
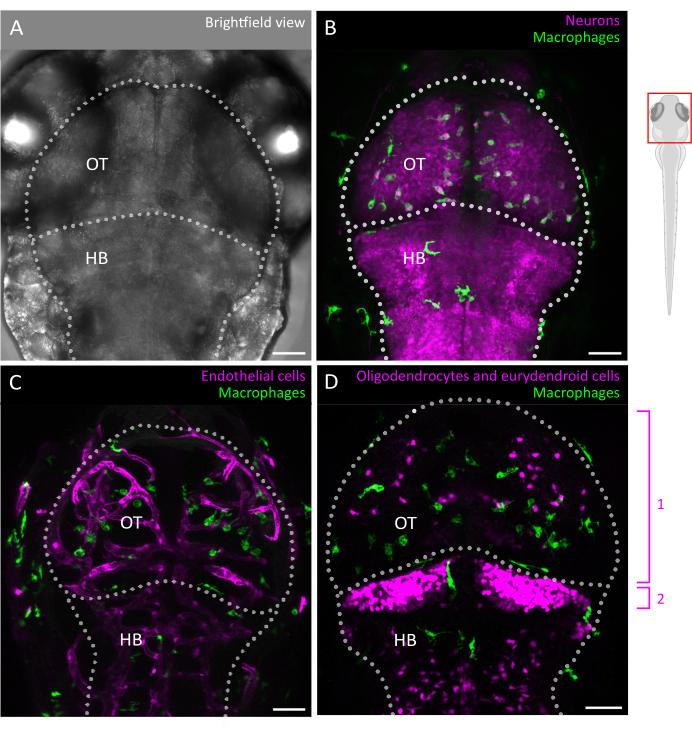
الشكل 2: تصوير الخلايا الدبقية الصغيرة والتفاعلات مع البيئة الخلوية للدماغ في جنين الزرد. (أ) صورة برايتفيلد لرأس ودماغ سمكة الزرد الجنينية 3 dpf (منظر ظهري) ، مع تسمية القفص البصري والدماغ الخلفي. يمكن تصوير دماغ الزرد الجنيني بالكامل في هذه المرحلة نظرا لصغر حجمه وشفافيته البصرية. (ب-د) يمكن تصور موقع الخلايا الدبقية الصغيرة وسلوكها باستخدام خطوط معدلة وراثيا مثل (B ، C) Tg (mpeg1: eGFP) gl22 و (D) Tg (mpeg1: mcherry) gl23 ، والتركيز على OT. (ب) يمكن التعرف على الخلايا العصبية وأجسامها الخلوية باستخدام الخط المراسل Tg(XlTubb:D sRed)zf148 ، ويمكن تصور التفاعلات بين الخلايا الدبقية الصغيرة والخلايا العصبية عن طريق دمج القناتين في خطوط تعبر عن كلا الجينين المحورين. ينظر إلى دمج الإشارات الخضراء (الخلايا الدبقية الصغيرة) والحمراء (الخلايا العصبية ، باللون الأرجواني). (ج، د) يمكن لخطوط المراسل أيضا إلقاء الضوء على تفاعلات الخلايا الدبقية الصغيرة (باللون الأخضر) مع الخلايا البطانية ، هنا باللون الأحمر باستخدام (C) مزدوج Tg(kdrl:cres898; actb2:LOXP-STOP-LOXP-Dsredexpress, sd5) المعدلة وراثيا، أو مع الخلايا الدبقية مثل الخلايا قليلة التغصن وسلائفها، باستخدام (D) مزدوج Tg(olig2:EGFP; MPEG1: mCherry ) خط معدل وراثيا. 1: oligodendrocytes والخلايا السلفية في OT ، 2: الخلايا العصبية eurydendroid في المخيخ. قضبان المقياس = 50 ميكرومتر. الاختصارات: dpf = أيام بعد الإخصاب. OT = القفص البصري ؛ HB = الدماغ الخلفي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
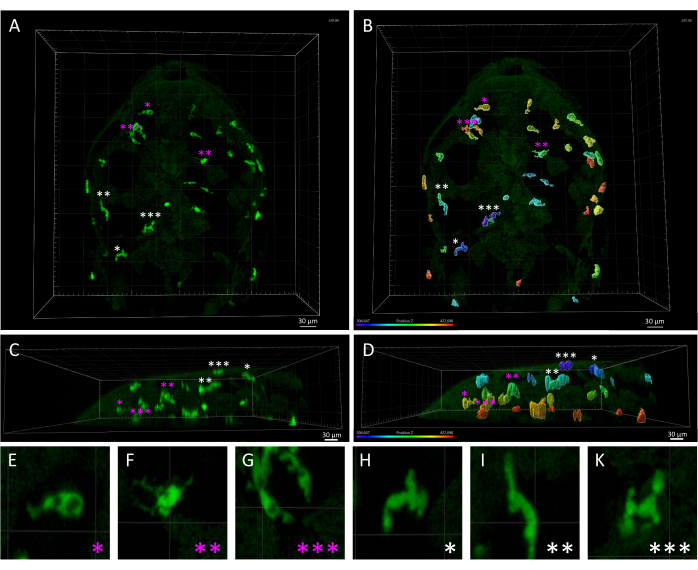
الشكل 3: التباين المورفولوجي والمكاني بين بلاعم الجلد والخلايا الدبقية الصغيرة في جنين الزرد 3 dpf. (أ ، ب) منظر ظهري لجنين الزرد Tg (mpeg1: eGFP) gl22 عند 3 dpf ، يصور (A) خلايا الخلايا الدبقية الصغيرة المتنية (المميزة بالعلامات النجمية الأرجواني) مقابل الضامة الجلدية (العلامات النجمية البيضاء) ، والتي تم تحديدها بناء على موقعها النسبي على طول المحور z ، كما هو موضح في (B) ، والذي يعرض صورة 3D أحادية اللون معروضة مع ترميز ألوان المحور z. (ج، د) منظر جانبي ل (C) A و (D) B ، يعرض أعماق z لخلايا mpeg1: eGFP + داخل رأس الجنين ويسلط الضوء على التوطين السطحي لبلاعم الجلد مقارنة بالخلايا الدبقية الصغيرة. (E-K) تكبير عالي لكل خلية يشار إليها بعلامة النجمة في A و B ، مما يوفر تصورا مفصلا للأشكال المميزة بين الخلايا الدبقية الصغيرة الأميبية (E-G) والبلاعم الجلدية الممدودة (H-K). قضبان المقياس = 30 ميكرومتر. اختصار: dpf = أيام بعد الإخصاب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
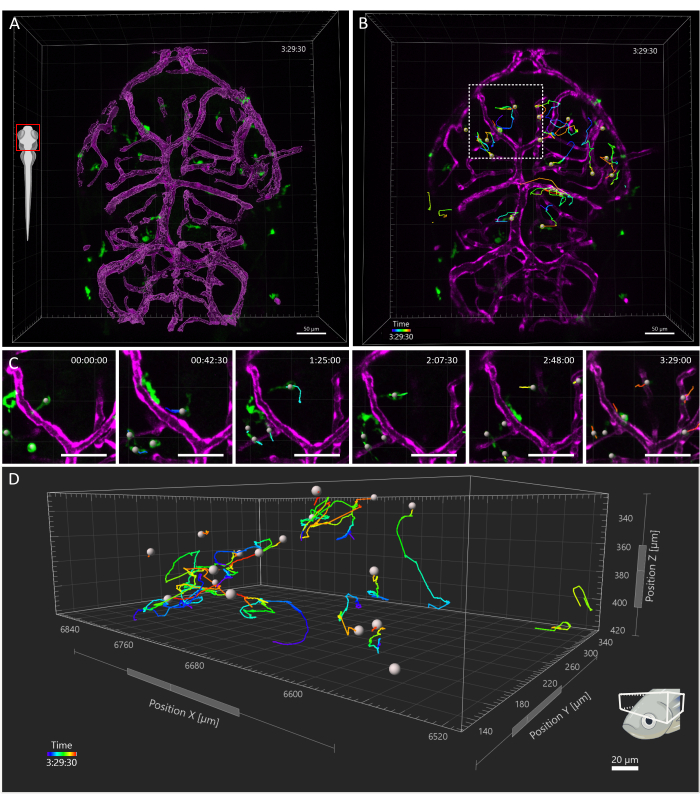
الشكل 4: تتبع الخلايا الدبقية الصغيرة في جنين الزرد 3 dpf. (أ) منظر ظهري للرأس ل 3 dpf Tg(kdrl:cres898; Actb2: لوكسب-ستوب-لوكسب-دسريداكسبرس,SD5; mpeg1: eGFPgl22) جنين ثلاثي معدل وراثيا ، يظهر الخلايا الدبقية الصغيرة (الخضراء) والتجسيد السطحي للأوعية (أرجواني). (ب-د) تتبع تمثيلي لحركات الخلايا الدبقية الصغيرة خلال فترة زمنية (B) 3.5 ساعة. ينظر إلى الخلايا الفردية على أنها تتبع مسارات معقدة. (ج) تفاصيل من الفاصل الزمني، تظهر منظرا مكبرا للمنطقة في B محاطا بالمربع المتقطع. يتم تقديم ستة إطارات من الفيلم (45 دقيقة) ، توثق الخلايا الدبقية الصغيرة التي تنشئ اتصالات عابرة مع الخلايا البطانية في بيئتها المكروية. (د) مسارات هجرة الخلايا الدبقية الصغيرة الفردية داخل الحاجز البصري، حيث تمثل المحاور X وY وZ أبعادا مكانية. شريط المقياس = 50 ميكرومتر. اختصار: dpf = أيام بعد الإخصاب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
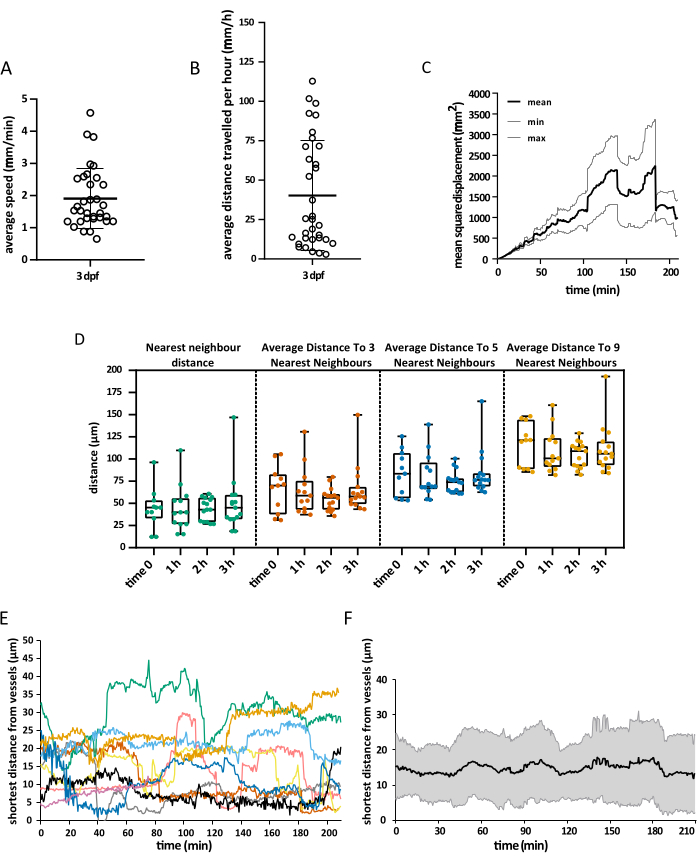
الشكل 5: تصور البيانات التي تم الحصول عليها. مثال على البيانات المكانية التي يمكن الحصول عليها باستخدام البروتوكول الموصوف. توضح التمثيلات البيانية (أ) السرعة المتوسطة للخلايا الدبقية الصغيرة، (ب) متوسط المسافة التي تقطعها في 1 h، (ج) متوسط إزاحتها التربيعية، (د) توزيعها في الفضاء في أزمنة مختلفة. سمح تجسيد سطح الوعاء أيضا بقياس أقصر مسافة بين الخلايا الدبقية الصغيرة والخلايا البطانية في أي وقت ، سواء على مستوى الخلية الواحدة (E) أو كمتوسط عالمي (F). بالنسبة إلى A و B و D ، تمثل كل نقطة خلية فردية. N = جنين واحد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يتيح البروتوكول الحالي التصوير في الجسم الحي لديناميات الخلايا الدبقية الصغيرة في جنين الفقاريات وتصور بيانات الحركة المكتسبة. يحدث استعمار الخلايا الدبقية الصغيرة للدماغ النامي في وقت مبكر جدا أثناء التطور الجنيني ويسبق الأحداث الحرجة مثل قمم تكوين الخلايا العصبية ، وتكوين الخلايا النجمية ، وتكوين القلة ، والعديد من العمليات الخلوية الأخرى17. لذلك ليس من المستغرب أن تلعب الخلايا الدبقية الصغيرة وظائف مهمة في تشكيل جوانب محددة من نمو الدماغ18 ، على سبيل المثال ، من خلال تنظيم التمايز العصبي والهجرة والبقاء على قيد الحياة19،20،21 ، وكذلك التقليم المشبكي5 والميالين22،23،24.
كما يتم التعرف بشكل متزايد على مساهمة الخلايا الدبقية الصغيرة المختلة وظيفيا في التسبب في اضطرابات النمو العصبي و / أو تطورها25. في الواقع ، فإن الوجود المبكر للخلايا الدبقية الصغيرة في الدماغ المتشكل يعرض هذه الخلايا لحالات فسيولوجية مميزة26 والتغيرات البيئية. يمكن أن يكون لهذا تأثير كبير بالنظر إلى أن الخلايا الدبقية الصغيرة هي خلايا طويلة العمر في كل من القوارض والبشر ، ويتم الحفاظ عليها خلال العمر من خلال التجديد الذاتي للأسلاف المحليين27،28،29. نعتقد أن هذا البروتوكول يمكن أن يكون بمثابة أداة قوية لتوصيف سلوك الخلايا الدبقية الصغيرة بشكل أفضل في هذه الحالات الفسيولوجية المتميزة ، حيث تتطور وتنضج وتؤسس شبكتها خلال الخطوات المتتالية لتشكل الدماغ.
باستخدام الإعداد الموصوف هنا ، نجحنا في تصوير واكتساب بيانات عن يرقات الزرد التي يبلغ عمرها 6 dpf. من المحتمل أن ينجح توسيع نطاق التحليل ليشمل مراحل التطوير اللاحقة ولكنه سيتطلب تعديل إعداد التصوير لمراعاة حجم العينة المتزايد ، خاصة على طول المحور z. عند محاولة ذلك ، نقترح التركيز على الحفاظ على نسبة إشارة إلى ضوضاء منخفضة ووقت مسح سريع ، لأنها معلمات أساسية لتحليل ناجح.
نقترح الحد الأدنى من وقت التصوير من 1 ساعة للسماح بتتبع الخلايا الدبقية الصغيرة. أطول نافذة تصوير تم اختبارها باستخدام هذا البروتوكول هي 8 ساعات. علاوة على ذلك ، من المهم أن يحافظ تحليل التتبع على الفاصل الزمني بين الإطارات قصيرا قدر الإمكان ، من الناحية المثالية بين 30 ثانية و 60 ثانية. سيسمح ذلك ببيانات تتبع أكثر دقة وتفصيلا في تحليلات المصب. لذلك ، خاصة في حالة اكتشاف أكثر من فلوروفور واحد ، من الضروري تجنب التداخل الطيفي وضمان الفصل الكافي بين طيفي انبعاث الفلوروفور للسماح باكتساب متزامن ، دون نزيف الإشارة.
تتوفر بروتوكولات أخرى لتسجيل الفاصل الزمني عالي الجودة لدماغ الزرد30 ، ولكن هذا هو البروتوكول الأول الذي يوضح كيفية تتبع جميع حركات الخلايا الدبقية الصغيرة بنجاح أثناء التطور الجنيني على مدى فترة طويلة. على الرغم من أن سير العمل المقدم هنا ركز على تتبع الخلايا الدبقية الصغيرة في سياق فسيولوجي ، إلا أنه يمكن تطبيقه بسهولة على تحليل الخلايا الدبقية الصغيرة في علم الأمراض. في الواقع ، تم إنشاء العديد من نماذج اضطرابات النمو العصبي ، مثل التوحد31 ، والصرع32 ، والفصام33 ، ولكن أيضا التنكس العصبي34 والسرطان35 ، في الزرد التي توفر فرصا فريدة لتحديد الاستجابة والسلوك الدبقي الصغير في حالات المرض.
والجدير بالذكر أن بروتوكول التتبع هذا متعدد الاستخدامات ويمكن أن يكون مفيدا أيضا لإلقاء الضوء على أنماط الهجرة لأنواع مختلفة من الخلايا عبر مناطق تشريحية متنوعة من جنين الزرد ، مما قد يفتح سبلا لتطبيقات إضافية ، خارج نطاق التحقيق الدبقي الصغير الموصوف في هذه المقالة. علاوة على ذلك ، من خلال تسخير القدرة على الجمع بين خطوط محورة وراثيا فلورية متعددة ، نكتسب القدرة على تمييز العلاقة المكانية بين الخلايا الدبقية الصغيرة وأنواع الخلايا الأخرى في البيئة الدقيقة للدماغ ، مع إمكانية تصور التفاعلات الخلوية والمحادثات المتقاطعة عبر تسجيلات الفاصل الزمني ، بطريقة غير جراحية. يمكن أن يكون هذا مفيدا في كشف الأهمية الفسيولوجية لسلوك الخلايا الدبقية الصغيرة والمساهمة في توصيف أعمق لهذه الخلايا شديدة الحركة.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يود المؤلفون أن يعربوا عن خالص امتنانهم للبروفيسور نيكولاس باينز لتوفيره بسخاء الوصول إلى المجهر متحد البؤر الضروري لهذه الدراسة. تم تمويل هذا العمل جزئيا من قبل صناديق البحث العلمي (FNRS) بموجب أرقام المنح F451218F و UG03019F ، ومؤسسة أبحاث الزهايمر (SAO-FRA) (إلى VW) ، يتم دعم AM من خلال زمالة بحثية من FNRS. تم إنشاء الشكل 1 على biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Breeding tanks | Tecniplast | ZB10BTE | |
| 1-phenyl-2-thiourea (PTU) | Sigma-Aldrich | P7629 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| Bottom glass imaging dish | FluoroDish | FD3510-100 | |
| Disposable Graduated transfer pipette | avantor | 16001-188 | |
| Dry block heater | Novolab | Grant QBD4 | To keep low melting agarose at 37 °C |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | E10521-50G | |
| Imaris 10.0 | Oxford Instruments | analysis software | |
| Imaris File Converter | Oxford Instruments | https://imaris.oxinst.com/big-data | |
| Laser-scanning confocal microscope | Nikon | Eclipse Ti2-E | |
| Methylene blue | Sigma-Aldrich | M9140-25G | |
| microloader tips | Eppendorf | 5242956003 | |
| NuSieve GTG Agarose | Lonza | 50081 | |
| Petri dishes (90 mm) | avantor | 391-0559 | |
| Pronase | Sigma-Aldrich | 11459643001 | |
| Stainless Steel Forceps Dumont No. 5 | FineScienceTools | 11254-20 | |
| Stereo microscope | Leica | Leica M80 | To mount the embryos |
| teasing needle | avantor | 76549-024 |
References
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and disease. Annu Rev Physiol. 79, 619-643 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Sci Rep. 308 (5726), 1314-1318 (2005).
- Peri, F., Nusslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133 (5), 916-927 (2008).
- Marın-Teva, J. L., et al. Microglia promote the death of developing Purkinje cells. Neuron. 41 (4), 535-547 (2004).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Hattori, Y. The microglia-blood vessel interactions in the developing brain. Neurosci Res. 187, 58-66 (2023).
- Colonna, M., Butovsky, O. Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 35, 441-468 (2017).
- Xu, H. -T., Pan, F., Yang, G., Gan, W. -B. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nat Neurosci. 10 (5), 549-551 (2007).
- Shin, J., Park, H. -C., Topczewska, J. M., Mawdsley, D. J., Appel, B. Neural cell fate analysis in zebrafish using olig2 BAC transgenics. Methods Cell Sci. 25 (1), 7-14 (2003).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes Dev. 22 (6), 734-739 (2008).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. J Vis Exp. (69), e4196(2012).
- Bohnsack, B. L., Gallina, D., Kahana, A. Phenothiourea sensitizes zebrafish cranial neural crest and extraocular muscle development to changes in retinoic acid and IGF signaling. PLoS ONE. 6 (8), e22991(2011).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor time-lapse imaging of transgenic zebrafish: visualizing retinal stem cells activated by targeted neuronal cell ablation. J Vis Exp. (43), e2093(2010).
- Ferrero, G., et al. Embryonic microglia derive from primitive macrophages and are replaced by cmyb-dependent definitive microglia in zebrafish. Cell Rep. 24 (1), 130-141 (2018).
- Xu, J., Wang, T., Wu, Y., Jin, W., Wen, Z. Microglia colonization of developing zebrafish midbrain is promoted by apoptotic neuron and lysophosphatidylcholine. Dev Cell. 38 (2), 214-222 (2016).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Dev Neurobiol. 73 (1), 60-71 (2013).
- Thion, M. S., Garel, S. Microglial ontogeny, diversity and neurodevelopmental functions. Curr Opin Genet Dev. 65, 186-194 (2020).
- Bohlen, C. J., Friedman, B. A., Dejanovic, B., Sheng, M. Microglia in brain development, homeostasis, and neurodegeneration. Annu Rev Genet. 53, 263-288 (2019).
- Squarzoni, P., et al. Microglia modulate wiring of the embryonic forebrain. Cell Rep. 8 (5), 1271-1279 (2014).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Parkhurst, C. N., et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 155 (7), 1596-1609 (2013).
- Green, L. A., O'Dea, M. R., Hoover, C. A., DeSantis, D. F., Smith, C. J. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1+ microglia precursors. Nat. Neurosci. 25 (7), 849-864 (2022).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23 (9), 1055-1066 (2020).
- Yu, Q., et al. C1q is essential for myelination in the central nervous system (CNS). iScience. 26 (12), 108518(2023).
- Zengeler, K. E., Lukens, J. R. Innate immunity at the crossroads of healthy brain maturation and neurodevelopmental disorders. Nat Rev Immunol. 21 (7), 454-468 (2021).
- Paolicelli, R. C., et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 110 (21), 3458-3483 (2022).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci. 10 (12), 1544-1553 (2007).
- Cook, Z. T., Brockway, N. L., Weissman, T. A. Visualizing the developing brain in living zebrafish using Brainbow and time-lapse confocal imaging. J Vis Exp. (157), e60593(2020).
- Tayanloo-Beik, A., et al. Zebrafish modeling of autism spectrum disorders, current status and future prospective. Front Psychiatry. 13, 911770(2022).
- D'Amora, M., et al. Zebrafish as an innovative tool for epilepsy modeling: State of the art and potential future directions. Int J Mol Sci. 24 (9), 7702(2023).
- Langova, V., Vales, K., Horacek, J. The role of zebrafish and laboratory rodents in schizophrenia research. Front Psychiatry. 11, 549232(2020).
- Chia, K., Klingseisen, A., Sieger, D., Priller, J. Zebrafish as a model organism for neurodegenerative disease. Front Mol Neurosci. 15, 940484(2022).
- Astell, K. R., Sieger, D. Zebrafish in vivo models of cancer and metastasis. Cold Spring Harb Perspect Med. 10 (8), 037077(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved