Method Article
הדמיה חיה ואפיון דינמיקה של תאי מיקרוגליה בעובר דג הזברה
In This Article
Summary
אנו מדגימים שיטה המנצלת סריקה מהירה של מיקרוסקופ קונפוקלי כדי לבצע הדמיה חיה של תאי מיקרוגליה בטקטום האופטי המתפתח של דגי זברה, המאפשר ניתוח של הדינמיקה של תאים אלה in vivo.
Abstract
תאי מיקרוגליה הם תאים דינמיים מאוד ונדידתם והתיישבותם בפרנכימת המוח היא צעד חיוני להתפתחות ותפקוד תקינים של המוח. עוברי דגי זברה המתפתחים חיצונית הם בעלי שקיפות אופטית, אשר יחד עם קווי כתב טרנסגניים מאופיינים היטב המסמנים באופן פלואורסצנטי מיקרוגליה, הופכים את דגי הזברה למודל חולייתי אידיאלי למחקרים כאלה. במאמר זה, אנו מנצלים את התכונות הייחודיות של מודל דג הזברה כדי לדמיין את הדינמיקה של תאי מיקרוגליה in vivo ובתנאים פיזיולוגיים. אנו משתמשים במיקרוסקופ קונפוקלי כדי לתעד חלוף זמן של תאי מיקרוגליה בטקטום האופטי של עובר דג הזברה ולאחר מכן, לחלץ נתוני מעקב באמצעות תוכנת IMARIS 10.0 כדי להשיג את נתיב הנדידה של התאים, מהירות ממוצעת ופיזור בטקטום האופטי בשלבי התפתחות שונים. פרוטוקול זה יכול להיות כלי שימושי להבהרת המשמעות הפיזיולוגית של התנהגות תאי מיקרוגליה בהקשרים שונים, ולתרום לאפיון עמוק יותר של תאים תנועתיים אלה.
Introduction
כמקרופאגים שוכנים במערכת העצבים המרכזית (CNS), תאי מיקרוגליה מייצגים אוכלוסייה לא-עצבית מובהקת המהווה עד 15% מכלל תאי הגליה במוח הבוגר. חקר הביולוגיה של תאי מיקרוגליה זוכה לתשומת לב הולכת וגוברת בשנים האחרונות בשל חשיבותם המבוססת בהתפתחות, פיזיולוגיה ומחלות1. בתנאים פיזיולוגיים, תאי מיקרוגליאה הם דינמיים מאוד, וסוקרים ללא הרף את פרנכימת המוח 2,3. התנהגות זו מאפשרת למיקרוגליה ליישב את המוח ולמלא תפקידים מרכזיים בהתפתחותו כגון עיצוב מעגלים עצביים4, גיזום סינפטי5 וכלי דם6. יתר על כן, הטבע הדינמי הטבוע הזה מאפשר למיקרוגליה לנטר כל הזמן את מערכת העצבים המרכזית עבור סימנים של זיהום, פציעה, או כל סטייה מהומאוסטזיס7. כדי לנתח את הדינמיקה התאית המורכבת הזו, הדמיה חיה של תאי מיקרוגליה על פני מרחב וזמן היא הכרחית. למרבה המזל, השקיפות האופטית של עוברי דגי זברה המתפתחים חיצונית, יחד עם זמינותם של קווי כתב טרנסגניים מאופיינים היטב המסמנים באופן ניאון מיקרוגליה, מציבים את דגי הזברה כמודל חולייתי אידיאלי לחקירות כאלה. הדמיה חיה בעוברים של דגי זברה מציעה גישה לא פולשנית שאינה דורשת ניתוח או מניפולציה נרחבת ברקמות, וממזערת הפרעות פוטנציאליות למצב מערכת העצבים המרכזית. זהו שיקול קריטי בעת חקר תאי מיקרוגליה, שכן הם רגישים מאוד אפילו לשינויים עדינים בסביבה החוץ תאית8.
כאן, אנו מספקים קו מנחה למעקב מוצלח אחר תנועות תאי מיקרוגליאה תלת-ממדיים בעובר דג הזברה, מה שמאפשר מבט חסר תקדים על התנהגות תאי מיקרוגליה בתוך הארכיטקטורה השלמה של פרנכימת המוח המתפתחת (ראו איור 1 לסקירה גרפית של הפרוטוקול). פרוטוקול שלב אחר שלב זה מפרט כיצד להגדיר ולצלם תאי מיקרוגליה של דגי זברה בשלבי התפתחות שונים וכיצד לחלץ נתונים ברזולוציה גבוהה על תנועתיות תאי מיקרוגליה כדי לספק תובנות חשובות לגבי דפוסי הנדידה שלהם ותגובותיהם לרמזים סביבתיים. אנו גם מראים שניתן להתאים את הפרוטוקול הזה לביצוע הדמיה חיה מרובת צבעים, ובכך להרחיב את היישום שלו לחקר תאי מיקרוגליה בשילוב עם קווים טרנסגניים המסמנים תאים שכנים, כולל תאי עצב3, אוליגודנדרוציטים9 ותאי אנדותל10 (כפי שמוצג באיור 2). על ידי הוספה לארגז הכלים המאפשר להתבונן ולאפיין ישירות את הדינמיקה של התנהגות תאי מיקרוגליה בזמן אמת ובסביבתם הטבעית, פרוטוקול זה יתרום ככל הנראה להבהרה טובה יותר של פונקציונליות תאי מיקרוגליה במהלך ההתפתחות המוקדמת, הן בפיזיולוגיה והן במחלות.
Protocol
דגי הזברה הוחזקו בתנאים סטנדרטיים, על פי FELASA42 ומוסדיים (Université Libre de Bruxelles, בריסל, בלגיה; ULB) הנחיות ותקנות. כל הליכי הניסוי אושרו על ידי הוועדה האתית לרווחת בעלי חיים של ULB (CEBEA) מה- ULB.
1. גידול דגי זברה והכנת עוברים
הערה: הקו המהונדס של דג הזברה Tg(mpeg1:eGFP)gl22 המבטא את חלבון ה-eGFP הפלואורסצנטי במקרופאגים, כולל מיקרוגליה, שימש ליצירת נתוני המעקב המוצגים בפרוטוקול זה. קווי כתב מקרופאגים אחרים זמינים מ- ZIRC וניתן להשתמש בהם גם. בבחירת הקו המהונדס, חשוב לקחת בחשבון כי עוצמת אות גבוהה תקל על רכישת תמונה ופילוח תאים.
- לשמור על דגי זברה (Danio rerio) בטמפרטורה של 28 מעלות צלזיוס ולנהל אותם בהתאם לפרוטוקולים שנקבעו11.
- עוררו הזדווגות על ידי הנחת נקבות וזכרים יחד במיכל רבייה, עם תחתית רשת ומפריד, בשעות אחר הצהריים המאוחרות לפני תאריך הלידה של העוברים הרצויים. הסירו את המפריד למחרת בבוקר כדי לתזמן את הזדווגות הדגים.
- אספו את הביציות המופרות באמצעות רשת והעבירו אותן לצלחת פטרי 100 מ"מ המכילה E3 בינוני (5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, 0.33 mM MgSO4) עם 0.01% מתילן כחול. בהתאם לרקע הגנטי של הקו המהונדס של דג הזברה בו נעשה שימוש, אם יש לעכב היווצרות פיגמנט כדי להקל על ההדמיה, הוסף 0.003% של N-phenylthiourea (PTU) למאגר E3 שבו מתפתחים עוברים, החל מ -6 שעות לאחר ההפריה (HPF) ורענן את התמיסה כל יומיים עד שמגיעים לשלב ההתפתחותי הרצוי.
הערה: כדי להימנע מחשיפה ארוכה ל-PTU שעלולה להשפיע על התפתחות העובר12, מומלץ להשתמש, אם קיים, בקו מהונדס על רקע חסר פיגמנט, כגון Casperw2, המאפשר הדמיה ברורה ללא צורך לחשוף עוברים ל-PTU למשך פרק זמן ממושך13. - אם העוברים שיש לצלם הם מתחת ל -3 ימים לאחר ההפריה (dpf), dechorionate אותם ב 24 hpf. השתמש במיקרוסקופ סטריאו כדי לאשר שכל העוברים עברו דה-כוריוניזציה ואינם ניזוקו מהטיפול האנזימטי (ראה שלב 1.4.2).
- במקרה של מספר מוגבל של ביציות, עשו זאת באופן ידני על ידי שימוש במלקחיים מנתחים עדינים כדי לצבוט את הכוריון ולמשוך החוצה, תוך שחרור זהיר של כל עובר מהכוריון שלו.
- במקרה של מספר גבוה יותר של ביציות, בצע את הדכוריונציה באופן אנזימטי על ידי דגירה על הביצים בתפזורת בטמפרטורת החדר (RT) בתמיסת פרונאז 1 מ"ג/מ"ל בתווך E3 לתקופה קצרה (בדרך כלל 5-10 דקות, עד שהכוריון נפתח תחת שטיפה עדינה). לאחר מכן, תמיסת Pronase מושלכת, והעוברים נשטפים ביסודיות 3x עם E3 טרי, כדי להסיר את כל הכוריון שנותר ואנזים שיורי.
2. הרכבה של דגי זברה
- הכינו תמיסת אגרוז בהתכה נמוכה של 1% במאגר E3. מצננים את האגרוז ל-37°C בבלוק חימום ומוסיפים תמיסת טריקאין מתאן-סולפונט טרייה (160 מ"ג/ליטר), שתסייע לשמור על העוברים מורדמים במהלך ההדמיה. מערבולת את הפתרון כדי הומוגניזציה יסודית זה.
- הרדימו את העוברים על ידי הוספת 160 מ"ג/ליטר של טריקאין מתאן-סולפונט לצלחת הפטרי המכילה את העוברים במאגר E3. בדוק כדי לוודא שהתנועה נעצרה ובחר את עוברי דגי הזברה עם הפלואורסצנטיות הרצויה. בדוק את בריאות העובר על ידי הדמיה של פעימות הלב שלו באמצעות מיקרוסקופ סטריאו בהיר. באמצעות פיפטת העברה רחבת קצוות ציירו אחד, או עד שלושה, מהעוברים שנבחרו והעבירו אותם לצלחת הדמיה מזכוכית תחתונה.
- תחת מיקרוסקופ סטריאו, להשתמש פיפטה כדי להסיר מדיום רב ככל האפשר, נזהר לא לגעת או לפגוע בעוברים; לאחר מכן, החלף את המדיום בתמיסת אגרוז נמסה נמוכה שהוכנה בעבר 1%. לאחר מכן, השתמש בקצה פלסטיק דק ומחודד המקובע לקצה מחט מתגרה כדי לדחוף בעדינות כל עובר לתחתית צלחת ההדמיה, לכוון אותו כך שהצד הגבי שלו פונה לזכוכית כדי להבטיח תצוגה טובה של הטקטום האופטי וכמות מינימלית של אגרוז נמס נמוך בין העובר לזכוכית.
- דמיינו את העובר הרכוב מיד באמצעות מיקרוסקופ קונפוקלי הפוך הכולל יעד Plan Apo באיכות גבוהה (10x/0.45 Plan Apo או 20x/0.75 Plan Apo המשמש כאן). אם חלוף הזמן יפעל במשך פרק זמן ממושך (מעל שעה), הוסיפו טיפה אחת או שתיים של חיץ E3 עם טריקאין מתאן-סולפונט (160 מ"ג/ליטר) לצלחת ההדמיה התחתונה של הזכוכית כדי למנוע מהאגרוז הנמס נמוך להתייבש יתר על המידה.
הערה: חיוני להמתין עד שהאגרוז יתמצק לחלוטין לפני הוספת חיץ E3 ומדיה טריקאין מתאן-סולפונט לדיסק ההדמיה; אחרת, הדג יכול לנוע לאט לרוחב ובאופן אקסיאלי, ובכך לגרום להיסחפות דגימה בחלוף הזמן. - המשך כדי להגדיר את רכישת קיטועי הזמן לזמן הרצוי: הגדר את רזולוציית התמונה ל- 1,024 x 1,024, עם גודל פיקסל של 0.49 מיקרומטר. אספו פרוסות אופטיות בדרגות של 2-3 מיקרומטר כדי להבטיח רזולוציה מקובלת על ציר z. בעובר דג הזברה, הקיפו את הטקטום האופטי במחסנית Z של 100-150 מיקרומטר, בהתאם לשלב ההתפתחותי בו נעשה שימוש. כדי להבטיח מעקב מוצלח אחר תאים, שמור על מרווח הזמן בין מסגרות בין 30 שניות ל- 60 שניות.
3. מעקב אחר ניתוח וייצוא נתונים
- המר את קובץ קיטועי הזמן לתבנית IMS באמצעות תוכנת ממיר הקבצים Imaris (ראה טבלת חומרים). עם הפעלת התוכנה, גרור ושחרר את הקבצים לאזור הקלט או השתמש ב- הוסף קבצים... כדי לבחור אותם ידנית. בתפריט פלט , הקצה את המיקום לקבצים שהומרו, ובחר באותה תיקייה כמו קבצי הקלט או ציין תיקייה מסוימת. ודא שהממדים של גודל הווקסל המוצג נכונים על ידי לחיצה על הגדר גודל ווקסל כפתור ולאחר אימות גודל הווקסל, לחץ על התחל הכל כפתור כדי להתחיל את המרת הקובץ (ראה קובץ משלים 1 למדריך שלב אחר שלב של כל ניתוח הנתונים).
הערה: אם חלוף הזמן בוצע על שני עוברים או יותר במקביל, הקובץ יפוצל אוטומטית למיקומים בודדים, תוך הפרדת כל עובר לקבצים שונים. ניתן להשתמש בתוכנה במצב אצווה ולהעלות ולהמיר מספר קבצים בו זמנית. קבצי IMS ייווצרו ויישמרו בתיקיית היעד שנבחרה או בתיקייה שבה ממוקמים קבצי הקלט. - לאחר ההשקה, תן לתוכנת הניתוח להתחיל בזירה; לחץ על Observe Folder כדי לפתוח את הקובץ שהומר בעבר. לאחר טעינת הקובץ לתוכנה, השתמש בתצוגת פרוסה כדי לגלול בערימת z, באמצעות המחוון בסרגל הכלים פרוסה הממוקם משמאל לאזור התצוגה, ולמדוד כמה קטרים של תאים על-ידי ציור קוטר התאים שנבחרו באמצעות המצביע. לחץ וגרור את העכבר כדי לצייר מקטע המשתרע על ליבת התא; שימו לב לאורך המקטע שצויר בסרגל הכלים 'מדידה', הממוקם מימין לאזור התצוגה.
הערה: באמצעות הגדרות ההדמיה בשלב 2.5, ניתן לצפות שקוטר גוף התא יהיה בין 6 מיקרומטר ל-8 מיקרומטר. - כדי לזהות את התאים באופן אוטומטי, חזור לתצוגת התלת-ממד ולחץ על סמל הספוט בסרגל הכלים של האובייקטים כדי להוסיף אובייקט ספוט חדש לרשימת האובייקטים ולפתוח את אשף יצירת הספוטים האוטומטי. בשלב הראשון של האשף, סמן את האפשרות לפלח רק אזור עניין. לאחר מכן, הפעל את האפשרות עקוב אחר נקודות (לאורך זמן) כדי לחשב את נתוני המעקב, וכן את סטטיסטיקת אובייקט-אובייקט כדי לאפשר השוואה בין נקודות ולהרחיב את טווח הנתונים שיהיו זמינים בהמשך הניתוח. לבסוף, המשך באשף על-ידי לחיצה על הלחצן הבא בפינה השמאלית התחתונה של חלון האשף.
- בשלב השני, המשך לציין אזור עניין (ROI) התוחם את הטקטום האופטי של העובר. שנה את גודל החזר ההשקעה על-ידי לחיצה וגרירה של החצים הלבנים הקטנים הקיימים בכל פאה שלו. לאחר הגדרת גודל החזר ההשקעה, הרחב אותו לכל המסגרות המוקלטות על ידי התאמת מרווח הזמן.
- לאחר מכן, בחר כערוץ מקור את הערוץ ששימש לזיהוי התאים והגדר את מדידת קוטר התא, שהתקבלה קודם לכן בשלב 3.2, כקוטר XY משוער. הפעל את האפשרות חיסור רקע ולחץ על הבא.
- בשלב זה באשף יצירת הספוטים, התוכנה משלבת שלב סינון איכותי שבו נקודות מסוננות לפי עוצמת האות הנמדדת במרכז כל נקודה; בערוץ שבו התגלו הכתמים. התאם את סף העוצמה על-ידי הזנת הערך ישירות בשדה הנתונים עבור תיבות סף תחתונות ועליונות או על-ידי גרירת הקווים הצבעוניים המתאימים בהיסטוגרמה המוצגת בתחתית אשף היצירה, כך שכל התאים יזוהו, כולל אלה הממוקמים עמוק יותר ברקמה, המציגים בדרך כלל עוצמת אות נמוכה יותר. כל השינויים הללו גלויים בו-זמנית באזור התצוגה.
הערה: ניתן לצפות במספר כתמים המסמנים תא בודד בשלב זה, אך ניתן לתקן זאת בהמשך הניתוח.
בהפסקות זמן ארוכות יותר, אם רואים הלבנה מסוימת, בדוק את אזור התצוגה של מסגרות מרובות לפני קביעת הסף כדי לוודא שכל התאים מזוהים גם במסגרות האחרונות ולכן חיוורות יותר. - לאחר שביעות רצון, לחץ על הבא כדי לאמת את סף האיכות שנבחר. כל הכתמים העונים על פרמטר סף האיכות ובעלי קוטר תואם לקוטר XY המשוער יסומנו כנקודה. הצג זאת באופן חזותי כתצוגה מקדימה באזור התצוגה, שבו כתמים העונים על שני פרמטרים אלה יוצבו על גבי ערוץ המקור.
- בשלב הבא, בחר את התנועה האוטורגרסיבית כאלגוריתם המעקב כדי לעקוב אחר תאים בעלי תנועה רציפה פחות או יותר. שפטו את המרחק הארוך ביותר שתא נע בין שתי נקודות זמן על ידי התבוננות מדוקדקת בתנועת הכתמים בין שתי מסגרות והזינו מספר משוער בשדה המרחק המרבי . זהו המרחק שבו מותר לכתם לסטות מהמיקום העתידי החזוי.
- הגדר את גודל המרווח המרבי למספר הנמוך ביותר של נקודות זמן שבהן הנקודה עשויה להיעלם מבלי להפריע למסלול. אם מרווח הזמן בין מסגרות נמוך מ- 60 שניות, השתמש בגודל 3. אם מרווח הזמן בין מסגרות ארוך יותר, הגדל את גודל המרווח המרבי המותר כדי להפחית את פיצול הרצועה.
- אפשר לפערי המילוי עם כל האובייקטים שזוהו לשחרר את סף הזיהוי קרוב למיקום הצפוי שנחזה על-ידי אלגוריתם המעקב ולחבר רצועות שנקטעו עקב כשל בזיהוי הנקודה. לבסוף, לחץ על הבא ותן לתוכנה ליצור באופן אוטומטי רצועות עבור כל המקומות שנוצרו בעבר.
- אם הרצועות המתקבלות נראות רבות מדי או מקוטעות, חזור אחורה באשף היצירה, על ידי לחיצה על הלחצן הקודם , והתאם את המרחק המרבי שהוגדר קודם לכן, או להגדיל או להקטין את המספר עד שרוב הרצועות המתקבלות מייצגות את תנועות התא.
הערה: מספר המסלולים צריך להתאים בערך למספר תאי מיקרוגליה, ולכן, נע בין 30 ל -50, בהתאם לגיל העובר. עם זאת, לפני השלמת הניתוח צפוי מספר גבוה יותר בשל מסלולים שגויים. - לאחר חישוב המסלולים, התוכנה משלבת שלב סינון כדי לסנן את כל הרצועות הקצרות מאוד מכיוון שהן לעתים קרובות לא מדויקות או לא אינפורמטיביות. אל תכלול רצועות קצרות מ- 3-8 דקות (דקות) על-ידי הזנת הערך ישירות בשדה הנתונים עבור הגבול התחתון של מסנן משך המסלול, או על-ידי גרירת הקווים הצבעוניים המתאימים בהיסטוגרמה המוצגת בתחתית אשף היצירה. לחץ על הבא כדי לאמת את המסנן ולהמשיך הלאה באשף היצירה.
הערה: כפי שצוין קודם לכן, על ידי שינוי סף משך המסלול המרבי (מקסימום) והמינימלי (מינימום), ניתן להציג תצוגה מקדימה של המסלולים שיסוננו ולא ייכללו בניתוח. לאחר מכן ניתן לשכפל את הרצועות המסוננות באובייקט חדש לצורך ניתוח נוסף. סף הזמן המדויק לסינון עשוי להשתנות בהתאם לתוצאות השלב הקודם של אשף היצירה . מומלץ לכוונן הגדרות מסנן אלה על-ידי סקירת התצוגה המקדימה באזור התצוגה לקבלת תוצאות מיטביות. - מכיוון שהקו המהונדס Tg (mpeg1:eGFP) מסמן את כל הפאגוציטים החד-גרעיניים, מקרופאגים של העור בנוסף למיקרוגליה יזוהו גם בסרטי קיטועי זמן. הסירו ידנית את העקבות שנוצרו ממקרופאגים בעור מהניתוח כדי להתמקד במיקרוגליה פרנכימלית במוח (איור 3).
- תקן ידנית טעויות פוטנציאליות אחרות ברצועות בעורך המסלול, שבו כל נקודת נתונים מוצגת כאובייקט במסלול. הפעילו את לחצן בחירת מצב העיגול מימין לאזור התצוגה וסמנו רצועות הדורשות שינויים או התאמות. לאחר בחירת הרצועה הבעייתית, באמצעות לחצני החיבור והניתוק, ערוך אותה כך שתייצג נכונה את תנועות התא. השתמש בעורך הרצועות גם כדי לבחור ולמחוק נקודות בודדות משוכפלות או קטעי רצועה קטנים המייצגים בטעות את אותו תא על-ידי בחירתם במצב בחירת העיגול והקשה על Canc או Delete כדי לחסל אותם.
הערה: אם הגדרות המעקב נכונות, שלב זה אמור להידרש עבור אחוז קטן בלבד של התאים המסומנים. - אם קו כתב מיקרוגליה משמש בשילוב עם טרנסגניות פלואורסצנטיות המסמנות סוגי תאים אחרים בפרנכימה, בצע סגמנטציה כאובייקט משטח חדש או אובייקט ספוט כדי להמחיש אותם. לשם כך, חזור על השלבים לעיל (משלבים 3.2 עד 3.14), שנה את קלט ערוץ המקור בשלב 3.5, כך שהוא יהיה זה המשמש להדמיה של אוכלוסיית התא השני, ודאג להתאים את הפרמטרים התיאוריים הספציפיים לתאים המעניינים כגון קוטר XY משוער (שלב 3.5), מרחק מרבי (שלב 3.8) לאוכלוסיית התאים החדשה. ניתן לחזור על שלבים אחרים ללא שינויים.
הערה: במקרה של יצירת משטח חדש, קוטר XY משוער מוחלף באפשרות סף המבוססת על חיסור רקע, כאשר הקלט שיש לתת הוא הקוטר של הכדור הגדול ביותר שמתאים לאובייקט. ניתן להעריך ערך זה מתצוגת פרוסה באמצעות סרגל הכלים מדידה , כפי שמוסבר בשלב 3.2. - לאחר שתהיו מרוצים מהמסלולים שהתקבלו, חלצו את סטטיסטיקת המעקב הרצויה מהכרטיסייה סטטיסטיקה . לחיצה על כפתור ההגדרות , בחר אילו נתונים סטטיסטיים יחושבו עבור כל אובייקט ספוט או אובייקט משטח שנוצר בעבר. במקרה שנוצרו עצמים נוספים באותו ניתוח, שני עצמים נקודתיים או עצם ספוט ופני שטח, סטטיסטיקה המתארת את המיקום היחסי של אובייקט אחד למשנהו, כגון המרחק הקצר ביותר בין השניים, תהיה זמינה גם לייצוא.
הערה: כל הערכים הרצויים יכולים להיות ערכים ספציפיים או ממוצעים, וכל הנתונים הגולמיים ניתנים להורדה כקובץ ערכים מופרדים באמצעות פסיקים (CSV) באמצעות הלחצנים בתחתית הכרטיסיה סטטיסטיקה . בתנאי שהניתוח כולל גם סוגי תאים אחרים, נתונים סטטיסטיים נוספים על המרחק היחסי של אובייקט אחד למשנהו יהיו זמינים גם כן.
תוצאות
תאי מיקרוגליאה המבטאים חלבון פלואורסצנטי ירוק (eGFP) ותאי אנדותל המבטאים DsRed ב-Tg(mpeg1:eGFPgl22; KDRL:CRES898; actb2:loxP-STOP-loxP-DsRedexpress,sd5) עוברים טרנסגניים משולשים14 צולמו ב 3 dpf, על פי הפרוטוקול המתואר. עובר בודד של דג זברה הורכב באגרוז נמס נמוך של 1% על צלחת זכוכית תחתונה ותהליך ההדמיה לא הפריע לגדילת העובר בזמן הרכישה. חלוף הזמן תועד באמצעות מערכת מסחרית לסריקה נקודתית של מיקרוסקופ קונפוקלי המצוידת בעדשת מטרה יבשה 10x 0.45 NA, ולייזרים עירור 488 ננומטר ו-561 ננומטר שימשו להדמיית תאי מיקרוגליה ואנדותל, בהתאמה. בנוסף, מרווח הזמן, רזולוציית התמונה, גודל הפיקסלים וצעד z היו 30 שניות, 1024x1024, 0.49 מיקרומטר ו-2.5 מיקרומטר, בהתאמה. הקלטת Timelapse נמשכה 3.5 שעות (שעה).
שדה הראייה הנרכש כיסה את כל ראש העובר, אך הניתוח התמקד במיוחד בטקטום האופטי, שכן במהלך השבוע הראשון להתפתחות, מיקרוגליה מוגבלת בעיקר לשכבת הסומה העצבית באזור זה של המוח התיכון הגבי, מה שמאפשר לחוקרים לדמיין את כל האוכלוסייה בו זמנית15. ניתוח המעקב התלת-ממדי בוצע באמצעות Imaris 10.0, כפי שהוסבר לעיל. כפי שניתן לראות באיור 4, המעקב היה מוצלח, והתוצאה הייתה 25 מסלולים, התואמים את המספר הצפוי של תאי מיקרוגליה הנמצאים בטקטום האופטי ב-3 dpf16. נדרש תיקון מסילה ידני מינימלי. איור 5 מציג דוגמה לנתונים שניתן לחלץ מניסוי מעקב מוצלח. התיוג הסימולטני של מקרופאגים ותאי אנדותל מאפשר לכמת את מיקום תאי המיקרוגליה ביחס לאחרון, ומאפשר לחוקרים לדמיין את המרחק היחסי של כל תא לתא האנדותל הקרוב ביותר בזמן ולבחון את התדירות והמספר של אינטראקציות פוטנציאליות (איור 5).
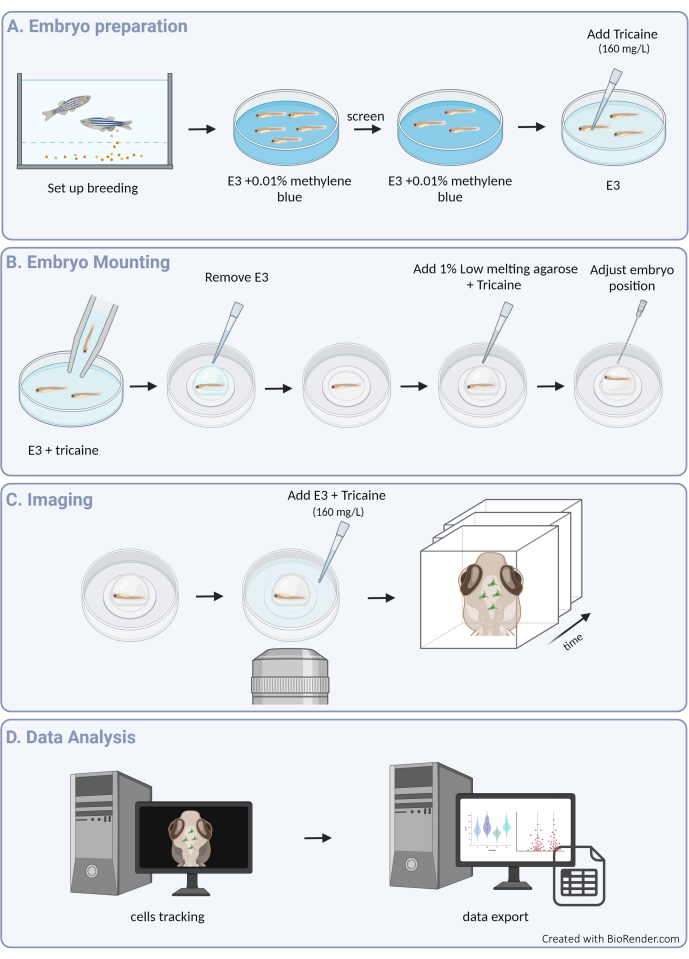
איור 1: סקירה כללית של הליך הניסוי. (A) הכנת עוברים של דגי זברה והרדמה. (B) הרכבה ומיקום לדוגמה. (ג) רכישת תמונה. (D) עיבוד תמונה וחילוץ נתוני תנועתיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
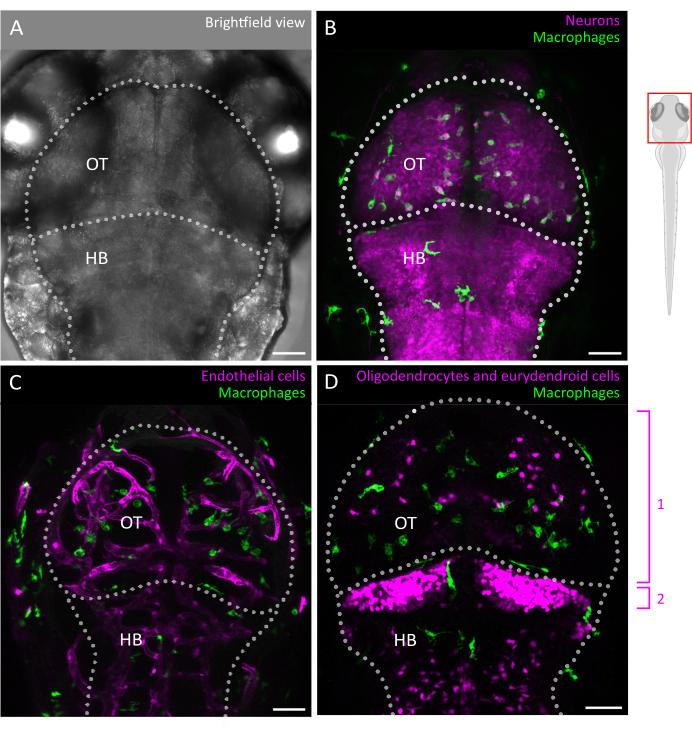
איור 2: דימות מיקרוגליה ואינטראקציות עם הסביבה התאית במוח בעובר דג הזברה. (A) תמונת שדה בהיר של ראש ומוח של דג זברה עוברי 3 dpf (מבט גבי), המסמנת את הטקטום האופטי ואת המוח האחורי. מוחו של דג הזברה העוברי ניתן לצילום בשלמותו בשלב זה בשל גודלו הקטן ושקיפותו האופטית. (ב-ד) ניתן להמחיש מיקום והתנהגות של מיקרוגליה על ידי שימוש בקווים טרנסגניים כגון (B,C) Tg(mpeg1:eGFP)gl22 ו-(D) Tg(mpeg1:mcherry)gl23, והתמקדות ב-OT. (B) תאי עצב וגופי התא שלהם ניתנים לזיהוי באמצעות קו הדיווח Tg(XlTubb:D sRed)zf148, וניתן להמחיש אינטראקציות מיקרוגליה-נוירון על-ידי מיזוג שני הערוצים בקווים המבטאים יחד את שני הטרנסגנים. נראה מיזוג של האותות הירוק (מיקרוגליה) והאדום (נוירונים, במגנטה). (ג,ד) קווי כתב יכולים גם לשפוך אור על אינטראקציות מיקרוגליה (בירוק) עם תאי אנדותל, כאן מסומנים באדום באמצעות Tg כפול (kdrl:cres898; actb2:LOXP-STOP-LOXP-Dsredexpress, SD5) transgenics, או עם תאי גלייה כגון oligodendrocytes ומבשריהם, באמצעות (D) כפול Tg (olig2:EGFP; MPEG1:mcherry ) קו מהונדס. 1: אוליגודנדרוציטים ותאי אב ב- OT, 2: נוירונים eurydendroid במוח הקטן. פסי קנה מידה = 50 מיקרומטר. קיצורים: dpf = ימים לאחר ההפריה; OT = טקטום אופטי; HB = מוח אחורי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
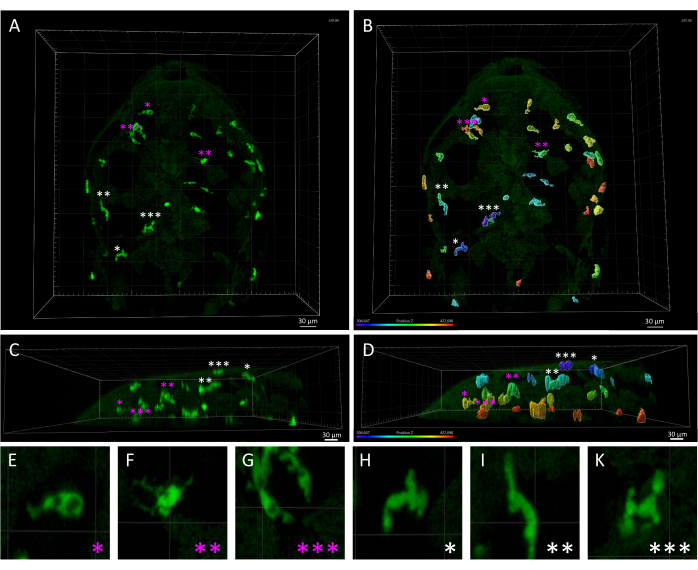
איור 3: פער מורפולוגי ומרחבי בין מקרופאגים בעור לבין מיקרוגליה בעובר של דג זברה 3 dpf. (A,B) מבט גבי על עובר דג זברה Tg(mpeg1:eGFP)gl22 ב-3 dpf, המתאר (A) תאי מיקרוגליה פרנכימליים (מסומנים בכוכביות מגנטה) לעומת מקרופאגים עוריים (כוכביות לבנות), המזוהים על סמך מיקומם היחסי לאורך ציר z, כפי שניתן לראות ב-(B), המציג את התמונה התלת-ממדית בשחור-לבן המעובדת בקידוד צבע של ציר z. (ג,ד) מבט רוחבי על (C) A ו-(D) B, המציג את עומקי z של תאי mpeg1:eGFP+ בתוך ראש העובר ומדגיש את הלוקליזציה השטחית של מקרופאגים בעור בהשוואה לתאי מיקרוגליה. (ה-ק) הגדלה גבוהה של כל תא מסומנת על ידי כוכבית ב- A ו - B, המספקת הדמיה מפורטת של המורפולוגיה הייחודית בין מיקרוגליה אמבואידית (E-G) לבין מקרופאגים מאורכים בעור (H-K). מוטות קנה מידה = 30 מיקרומטר. קיצור: dpf = ימים לאחר ההפריה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
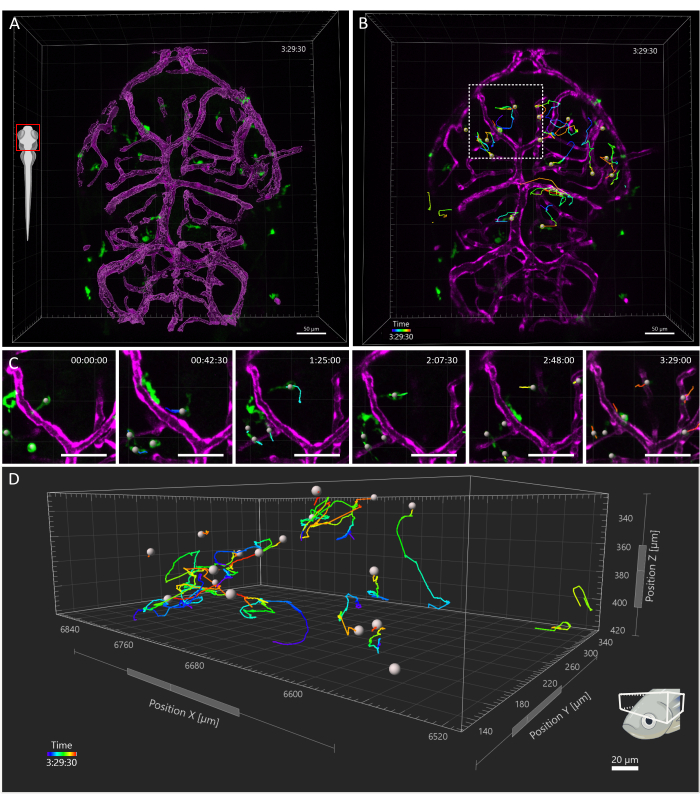
איור 4: מעקב אחר תאי מיקרוגליאה בעובר של דג זברה 3 dpf. (A) מבט גבי ראש של 3 dpf Tg (kdrl:cres898; ACTB2: LOXP-STOP-LOXP-Dsredאקספרס, SD5; mpeg1:eGFPgl22) עובר מהונדס משולש, המראה מיקרוגליה (ירוק) ואת עיבוד פני השטח של כלי הדם (מגנטה). (ב-ד) מעקב מייצג אחר תנועות מיקרוגליה בחלון זמן של 3.5 שעות (B). תאים בודדים נראים לעקוב אחר מסלולים מורכבים. (C) פרט מקיטוע זמן, המציג תצוגה מוגדלת של האזור ב-B התחום בריבוע מקווקו. שישה פריימים מהסרט (בהפרש של 45 דקות זה מזה) מוצגים, המתעדים תאי מיקרוגליה יוצרים קשרים חולפים עם תאי אנדותל במיקרו-סביבה שלהם. (D) מסלולים של נדידת תאי מיקרוגליאה בודדים בתוך הטקטום האופטי, כאשר צירי X, Y ו-Z מייצגים ממדים מרחביים. סרגל קנה מידה = 50 מיקרומטר. קיצור: dpf = ימים לאחר ההפריה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
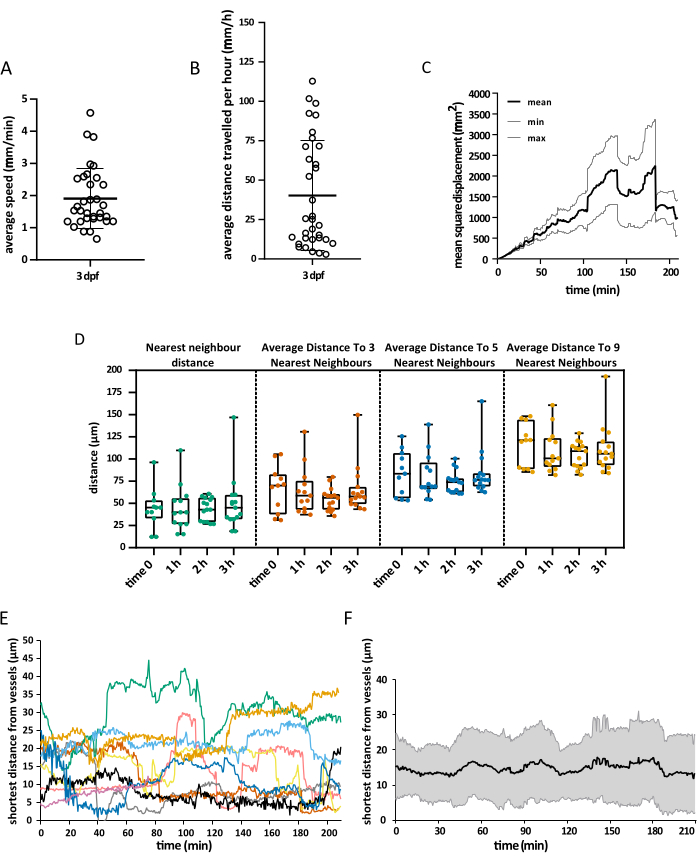
איור 5: תצוגה חזותית של הנתונים המתקבלים. דוגמה לנתונים מרחביים שניתן לקבל באמצעות הפרוטוקול המתואר. הגרפים מתארים (A) את המהירות הממוצעת של תאי מיקרוגליה, (B) את המרחק הממוצע שהם מכסים בשעה אחת, (C) את התזוזה הריבועית הממוצעת שלהם, ו-(D) את התפלגות שלהם במרחב בזמנים שונים. עיבוד פני השטח של כלי השיט איפשר גם למדוד את המרחק הקצר ביותר בין תאי מיקרוגליה לתאי אנדותל בכל זמן נתון, הן ברמת (E) תא בודד והן כממוצע עולמי (F). עבור A, B ו- D, כל נקודה מייצגת תא בודד. N = עובר אחד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
קובץ משלים 1: אנא לחץ כאן להורדת קובץ זה.
Discussion
הפרוטוקול הנוכחי מאפשר הדמיה in vivo של דינמיקת מיקרוגליה בעובר חולייתי והדמיה של נתוני התנועתיות הנרכשים. קולוניזציה של תאי מיקרוגליה במוח המתפתח מתרחשת בשלב מוקדם מאוד במהלך האמבריוגנזה וקודמת לאירועים קריטיים כגון שיאים של נוירוגנזה, אסטרוגליוגנזה, אוליגודנדרוגנזה ותהליכים תאיים רבים אחרים17. לכן אין זה מפתיע שתאי מיקרוגליה ממלאים תפקידים חשובים בעיצוב היבטים ספציפיים של התפתחות המוח18, למשל, באמצעות ויסות התמיינות עצבית, נדידה והישרדות 19,20,21, כמו גם גיזום סינפטי5 ומיאלינציה 22,23,24.
התרומה של מיקרוגליה לא מתפקדת לפתוגנזה ו / או התקדמות של הפרעות נוירו-התפתחותיות מוכרת יותר ויותר25. ואכן, נוכחותם המוקדמת של תאי מיקרוגליה במוח המתהווה חושפת תאים אלה למצבים פיזיולוגיים שונים26 ולשינויים סביבתיים. זה יכול להיות בעל השפעה משמעותית בהתחשב בכך מיקרוגליה הם תאים מאריכי חיים הן מכרסמים ובני אדם, נשמרים במהלך תוחלת החיים באמצעות התחדשות עצמית של אבות מקומיים 27,28,29. אנו מאמינים שפרוטוקול זה יכול לשמש ככלי רב עוצמה לאפיון טוב יותר של התנהגות תאי מיקרוגליה במצבים פיזיולוגיים מובחנים אלה, כאשר הם מתפתחים, מתבגרים ומבססים את הרשת שלהם במהלך השלבים הרצופים של מורפוגנזה מוחית.
באמצעות ההתקנה המתוארת כאן, צילמנו ורכשנו בהצלחה נתונים על זחלי דגי זברה בני 6 dpf. הרחבת הניתוח לשלבים התפתחותיים מאוחרים יותר צפויה להצליח, אך תדרוש התאמת מערך ההדמיה כך שיילקח בחשבון גודל הדגימה המוגדל, במיוחד לאורך ציר z. בניסיון זה, אנו מציעים להתמקד בשמירה על יחס אות לרעש נמוך וזמן סריקה מהיר, מכיוון שהם פרמטרים מרכזיים לניתוח מוצלח.
אנו מציעים זמן הדמיה מינימלי של שעה אחת כדי לאפשר מעקב אחר מיקרוגליה; חלון ההדמיה הארוך ביותר שנבדק עם פרוטוקול זה הוא 8 שעות. יתר על כן, חשוב לניתוח המעקב לשמור על מרווח הזמן בין מסגרות קצר ככל האפשר, באופן אידיאלי בין 30 שניות ל -60 שניות. זה יאפשר נתוני מעקב מדויקים ומפורטים יותר בניתוחים במורד הזרם. לכן, במיוחד אם מזהים יותר מפלואואורופור אחד, חיוני להימנע מחפיפה ספקטרלית ולהבטיח הפרדה מספקת בין שני ספקטרום הפליטה הפלואורופורים כדי לאפשר רכישה בו זמנית, ללא דימום אות.
פרוטוקולים אחרים לרישום באיכות גבוהה של מוח דג הזברה זמינים30, אך זהו הראשון המראה כיצד לעקוב בהצלחה אחר כל תנועת תאי המיקרוגליה במהלך ההתפתחות העוברית לאורך תקופה ממושכת. למרות שזרימת העבודה המוצגת כאן התמקדה במעקב אחר מיקרוגליה בהקשר פיזיולוגי, ניתן ליישם אותה בקלות על ניתוח מיקרוגליה בפתולוגיה. ואכן, מספר מודלים של הפרעות נוירו-התפתחותיות, כגון אוטיזם31, אפילפסיה32 וסכיזופרניה33, אך גם ניוון עצבי34 וסרטן35, נקבעו בדגי זברה המספקים הזדמנויות ייחודיות לקביעת תגובת מיקרוגליה והתנהגות במצבי מחלה.
יש לציין כי פרוטוקול מעקב זה הוא רב-תכליתי ביותר ויכול גם להיות חיוני לשפוך אור על דפוסי הנדידה של סוגי תאים שונים באזורים אנטומיים מגוונים של עובר דג הזברה, ובכך לפתוח אפיקים ליישומים נוספים, מעבר להיקף חקירת המיקרוגליה המתואר במאמר זה. יתר על כן, על ידי רתימת היכולת לשלב קווים טרנסגניים פלואורסצנטיים מרובים, אנו מקבלים את היכולת להבחין בקשר המרחבי בין מיקרוגליה לבין סוגי תאים אחרים של מיקרו-סביבה במוח, עם פוטנציאל לדמיין אינטראקציות תאיות ושיחות צולבות לאורך הקלטות בהילוך מהיר, בדרך לא פולשנית. זה יכול להיות חיוני בחשיפת המשמעות הפיזיולוגית של התנהגות מיקרוגליה ולתרום לאפיון עמוק יותר של תאים תנועתיים מאוד אלה.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
המחברים רוצים להביע את תודתם הכנה לפרופסור ניקולס ביינס על מתן גישה נדיבה למיקרוסקופ הקונפוקלי החיוני למחקר זה. עבודה זו מומנה בחלקה על ידי הקרנות למחקר מדעי (FNRS) תחת מספרי מענקים F451218F ו- UG03019F, הקרן לחקר האלצהיימר (SAO-FRA) (ל- V.W.), A.M. נתמכת על ידי מלגת מחקר מה- FNRS. איור 1 נוצר ב-biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Breeding tanks | Tecniplast | ZB10BTE | |
| 1-phenyl-2-thiourea (PTU) | Sigma-Aldrich | P7629 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| Bottom glass imaging dish | FluoroDish | FD3510-100 | |
| Disposable Graduated transfer pipette | avantor | 16001-188 | |
| Dry block heater | Novolab | Grant QBD4 | To keep low melting agarose at 37 °C |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | E10521-50G | |
| Imaris 10.0 | Oxford Instruments | analysis software | |
| Imaris File Converter | Oxford Instruments | https://imaris.oxinst.com/big-data | |
| Laser-scanning confocal microscope | Nikon | Eclipse Ti2-E | |
| Methylene blue | Sigma-Aldrich | M9140-25G | |
| microloader tips | Eppendorf | 5242956003 | |
| NuSieve GTG Agarose | Lonza | 50081 | |
| Petri dishes (90 mm) | avantor | 391-0559 | |
| Pronase | Sigma-Aldrich | 11459643001 | |
| Stainless Steel Forceps Dumont No. 5 | FineScienceTools | 11254-20 | |
| Stereo microscope | Leica | Leica M80 | To mount the embryos |
| teasing needle | avantor | 76549-024 |
References
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and disease. Annu Rev Physiol. 79, 619-643 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Sci Rep. 308 (5726), 1314-1318 (2005).
- Peri, F., Nusslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133 (5), 916-927 (2008).
- Marın-Teva, J. L., et al. Microglia promote the death of developing Purkinje cells. Neuron. 41 (4), 535-547 (2004).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Hattori, Y. The microglia-blood vessel interactions in the developing brain. Neurosci Res. 187, 58-66 (2023).
- Colonna, M., Butovsky, O. Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 35, 441-468 (2017).
- Xu, H. -. T., Pan, F., Yang, G., Gan, W. -. B. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nat Neurosci. 10 (5), 549-551 (2007).
- Shin, J., Park, H. -. C., Topczewska, J. M., Mawdsley, D. J., Appel, B. Neural cell fate analysis in zebrafish using olig2 BAC transgenics. Methods Cell Sci. 25 (1), 7-14 (2003).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes Dev. 22 (6), 734-739 (2008).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. J Vis Exp. (69), e4196 (2012).
- Bohnsack, B. L., Gallina, D., Kahana, A. Phenothiourea sensitizes zebrafish cranial neural crest and extraocular muscle development to changes in retinoic acid and IGF signaling. PLoS ONE. 6 (8), e22991 (2011).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor time-lapse imaging of transgenic zebrafish: visualizing retinal stem cells activated by targeted neuronal cell ablation. J Vis Exp. (43), e2093 (2010).
- Ferrero, G., et al. Embryonic microglia derive from primitive macrophages and are replaced by cmyb-dependent definitive microglia in zebrafish. Cell Rep. 24 (1), 130-141 (2018).
- Xu, J., Wang, T., Wu, Y., Jin, W., Wen, Z. Microglia colonization of developing zebrafish midbrain is promoted by apoptotic neuron and lysophosphatidylcholine. Dev Cell. 38 (2), 214-222 (2016).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Dev Neurobiol. 73 (1), 60-71 (2013).
- Thion, M. S., Garel, S. Microglial ontogeny, diversity and neurodevelopmental functions. Curr Opin Genet Dev. 65, 186-194 (2020).
- Bohlen, C. J., Friedman, B. A., Dejanovic, B., Sheng, M. Microglia in brain development, homeostasis, and neurodegeneration. Annu Rev Genet. 53, 263-288 (2019).
- Squarzoni, P., et al. Microglia modulate wiring of the embryonic forebrain. Cell Rep. 8 (5), 1271-1279 (2014).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Parkhurst, C. N., et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 155 (7), 1596-1609 (2013).
- Green, L. A., O'Dea, M. R., Hoover, C. A., DeSantis, D. F., Smith, C. J. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1+ microglia precursors. Nat. Neurosci. 25 (7), 849-864 (2022).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23 (9), 1055-1066 (2020).
- Yu, Q., et al. C1q is essential for myelination in the central nervous system (CNS). iScience. 26 (12), 108518 (2023).
- Zengeler, K. E., Lukens, J. R. Innate immunity at the crossroads of healthy brain maturation and neurodevelopmental disorders. Nat Rev Immunol. 21 (7), 454-468 (2021).
- Paolicelli, R. C., et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 110 (21), 3458-3483 (2022).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci. 10 (12), 1544-1553 (2007).
- Cook, Z. T., Brockway, N. L., Weissman, T. A. Visualizing the developing brain in living zebrafish using Brainbow and time-lapse confocal imaging. J Vis Exp. (157), e60593 (2020).
- Tayanloo-Beik, A., et al. Zebrafish modeling of autism spectrum disorders, current status and future prospective. Front Psychiatry. 13, 911770 (2022).
- D'Amora, M., et al. Zebrafish as an innovative tool for epilepsy modeling: State of the art and potential future directions. Int J Mol Sci. 24 (9), 7702 (2023).
- Langova, V., Vales, K., Horacek, J. The role of zebrafish and laboratory rodents in schizophrenia research. Front Psychiatry. 11, 549232 (2020).
- Chia, K., Klingseisen, A., Sieger, D., Priller, J. Zebrafish as a model organism for neurodegenerative disease. Front Mol Neurosci. 15, 940484 (2022).
- Astell, K. R., Sieger, D. Zebrafish in vivo models of cancer and metastasis. Cold Spring Harb Perspect Med. 10 (8), 037077 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved