Method Article
Zebra Balığı Embriyosunda Mikroglia Dinamiğinin Canlı Görüntülenmesi ve Karakterizasyonu
Bu Makalede
Özet
Gelişmekte olan zebra balığı optik tektumunda mikroglia hücrelerinin canlı görüntülemesini gerçekleştirmek için hızlı taramalı konfokal mikroskopiden yararlanan ve bu hücrelerin dinamiklerinin in vivo analizine olanak tanıyan bir yöntem gösteriyoruz.
Özet
Mikroglia oldukça dinamik hücrelerdir ve beyin parankiminin göçü ve kolonizasyonu, uygun beyin gelişimi ve işlevi için çok önemli bir adımdır. Dışarıdan gelişen zebra balığı embriyoları, mikrogliaları floresan olarak etiketleyen iyi karakterize edilmiş transgenik raportör çizgileri ile birlikte, zebra balığını bu tür çalışmalar için ideal bir omurgalı modeli haline getiren optik şeffaflığa sahiptir. Bu yazıda, mikroglia hücrelerinin dinamiklerini in vivo ve fizyolojik koşullar altında görselleştirmek için zebra balığı modelinin benzersiz özelliklerinden yararlanıyoruz. Zebra balığı embriyosunun optik tektumundaki mikroglia hücrelerinin zaman atlamalı bir kaydını kaydetmek için konfokal mikroskopi kullanıyoruz ve daha sonra, hücrelerin göç yolunu, ortalama hızını ve farklı gelişim aşamalarında optik tektumdaki dağılımını elde etmek için IMARIS 10.0 yazılımını kullanarak izleme verilerini çıkarıyoruz. Bu protokol, çeşitli bağlamlarda mikroglia davranışının fizyolojik önemini aydınlatmak için yararlı bir araç olabilir ve bu oldukça hareketli hücrelerin daha derin bir karakterizasyonuna katkıda bulunabilir.
Giriş
Merkezi sinir sisteminde (CNS) yerleşik makrofajlar olarak mikroglia, yetişkin beynindeki tüm glial hücrelerin %15'ini oluşturan nöronal olmayan belirgin bir popülasyonu temsil eder. Mikroglia biyolojisi çalışmak, gelişim, fizyoloji ve hastalıktaki yerleşik önemleri nedeniyle son yıllarda artan bir ilgi kazanmıştır1. Fizyolojik koşullar altında, mikroglial hücreler oldukça dinamiktir ve sürekli olarak beyin parankimini inceler 2,3. Bu davranış, mikroglia'nın beyni kolonize etmesine ve nöronal devreyişekillendirme 4, sinaptik budama5 ve vaskülogenez6 gibi gelişiminde çok önemli roller oynamasına izin verir. Ayrıca, bu doğal dinamik doğa, mikroglia'nın CNS'yi enfeksiyon, yaralanma veya homeostazdan herhangi bir sapma belirtileri açısından sürekli olarak izlemesine izinverir 7. Bu karmaşık hücre dinamiklerini incelemek için, mikroglia'nın uzay ve zaman boyunca canlı görüntülenmesi vazgeçilmezdir. Neyse ki, dışarıdan gelişen zebra balığı embriyolarının optik şeffaflığı, mikrogliaları floresan olarak etiketleyen iyi karakterize edilmiş transgenik raportör hatlarının mevcudiyeti ile birleştiğinde, zebra balığını bu tür araştırmalar için ideal bir omurgalı modeli olarak konumlandırmaktadır. Zebra balığı embriyolarında canlı görüntüleme, ameliyat veya kapsamlı doku manipülasyonu gerektirmeyen, CNS durumundaki olası bozulmaları en aza indiren, invaziv olmayan bir yaklaşım sunar. Bu, mikroglial hücreleri incelerken kritik bir husustur, çünkü hücre dışı ortamdaki ince değişikliklere bile karşı oldukça hassastırlar8.
Burada, zebra balığı embriyosundaki 3D mikroglial hücre hareketlerini başarılı bir şekilde izlemek için bir kılavuz sunuyoruz ve gelişmekte olan beyin parankiminin bozulmamış mimarisi içinde mikroglia davranışının benzeri görülmemiş bir görünümüne izin veriyoruz (protokolün grafiksel bir genel bakışı için Şekil 1'e bakın). Bu adım adım protokol, zebra balığı mikrogliasının farklı gelişim aşamalarında nasıl kurulacağını ve görüntüleneceğini ve göç kalıpları ve çevresel ipuçlarına yanıtları hakkında değerli bilgiler sağlamak için mikroglia hücre motilitesi hakkında yüksek çözünürlüklü verilerin nasıl çıkarılacağını ayrıntılarıyla açıklar. Ayrıca, bu protokolün canlı çok renkli görüntüleme gerçekleştirmek için uyarlanabileceğini ve böylece nöronlar3, oligodendrositler9 ve endotel hücreleri10 dahil olmak üzere komşu hücreleri işaretleyen transgenik çizgilerle kombinasyon halinde mikroglia'yı incelemek için uygulanabilirliğini genişlettiğini gösteriyoruz ( Şekil 2'de gösterildiği gibi). Mikroglia davranışının dinamiklerini gerçek zamanlı olarak ve doğal ortamlarında doğrudan gözlemlemeye ve karakterize etmeye olanak tanıyan araç kutusuna ekleyerek, bu protokol hem fizyoloji hem de hastalıkta erken gelişim sırasında mikroglia işlevselliğinin daha iyi aydınlatılmasına katkıda bulunacaktır.
Protokol
Zebra balığı, FELASA42 ve kurumsal (Université Libre de Bruxelles, Brüksel, Belçika; ULB) yönergeleri ve düzenlemeleri. Tüm deneysel prosedürler ULB'den ULB Hayvan Refahı Etik Komitesi (CEBEA) tarafından onaylanmıştır.
1. Zebra balığı yetiştiriciliği ve embriyo hazırlama
NOT: Mikroglia da dahil olmak üzere makrofajlarda floresan eGFP proteinini eksprese eden zebra balığı transgenik hattı Tg(mpeg1:eGFP)gl22 , bu protokolde gösterilen izleme verilerini oluşturmak için kullanılmıştır. Diğer makrofaj raportör hatları ZIRC'den temin edilebilir ve ayrıca kullanılabilir. Transgenik çizgiyi seçerken, yüksek bir sinyal yoğunluğunun görüntü elde etmeyi ve hücre segmentasyonunu kolaylaştıracağını dikkate almak önemlidir.
- Zebra balıklarını (Danio rerio) 28 °C sıcaklıkta tutun ve bunları belirlenmiş protokollere11 göre yönetin.
- İstenen embriyoların doğum tarihinden önce öğleden sonra geç saatlerde, dişi ve erkek balıkları, ağ tabanlı ve ayırıcı bir üreme tankına yerleştirerek çiftleşmeyi teşvik edin. Balığın çiftleşmesini zamanlamak için ertesi sabah ayırıcıyı çıkarın.
- Döllenmiş yumurtaları bir ağ kullanarak toplayın ve bunları %0,01 Metilen mavisi içeren E3 ortamı (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl2, 0,33 mM MgSO4) içeren 100 mm'lik bir Petri kabına aktarın. Kullanılan zebra balığı transgenik hattının genetik geçmişine bağlı olarak, görüntülemeyi kolaylaştırmak için pigment oluşumu inhibe edilecekse, embriyoların geliştiği E3 tamponuna% 0.003 N-feniltiüre (PTU) ekleyin, döllenmeden 6 saat sonra (hpf) başlayın ve istenen gelişim aşamasına ulaşılana kadar çözeltiyi her 2 günde bir yenileyin.
NOT: Embriyonik gelişimi12 etkileyebilecek PTU'ya uzun süre maruz kalmaktan kaçınmak için, varsa, Casperw2 gibi pigment eksikliği olan bir arka plan üzerinde, embriyoları uzun süre PTU'ya maruz bırakmaya gerek kalmadan net görüntülemeye izin veren bir transgenik çizgi kullanılması önerilir13. - Görüntülenecek embriyolar döllenmeden 3 gün sonra (dpf) daha gençse, onları 24 hpf'de dekoryonlayın. Tüm embriyoların dekoryona uğradığını ve enzimatik tedaviden zarar görmediğini doğrulamak için bir stereo mikroskop kullanın (bkz. adım 1.4.2).
- Sınırlı sayıda yumurta olması durumunda, koryonu sıkıştırmak ve dışarı doğru çekmek için ince diseksiyon forsepsleri kullanarak bunu manuel olarak yapın ve her embriyoyu koryonundan dikkatlice serbest bırakın.
- Daha fazla sayıda yumurta olması durumunda, yumurtaları oda sıcaklığında (RT) E3 ortamında 1 mg / mL Pronaz çözeltisi içinde kısa bir süre için (tipik olarak 5-10 dakika, koryonlar hafifçe çalkalanarak açılana kadar) toplu olarak inkübe ederek enzimatik olarak dekoryonasyonu gerçekleştirin. Daha sonra, Pronaz çözeltisi atılır ve embriyolar, kalan koryon ve kalıntı enzimi çıkarmak için taze E3 ile 3 kez iyice durulanır.
2. Zebra balığı montajı
- E3 tamponunda %1 düşük erime noktalı bir agaroz çözeltisi hazırlayın. Agarozu bir tezgah üstü ısıtma bloğunda 37 ° C'ye soğutun ve görüntüleme sırasında embriyoların uyuşturulmasına yardımcı olacak taze yapılmış Trikain metansülfonat çözeltisi (160 mg / L) ekleyin. Çözeltiyi iyice homojen hale getirmek için girdaplayın.
- E3 tamponundaki embriyoları içeren Petri kabına 160 mg / L Trikain metansülfonat ekleyerek embriyoları uyuşturun. Hareketin durduğunu doğrulamak için kontrol edin ve istenen floresansa sahip zebra balığı embriyolarını seçin. Brightfield stereo mikroskobu kullanarak kalp atışını görselleştirerek embriyonun sağlığını kontrol edin. Geniş uçlu bir transfer pipeti kullanarak, seçilen embriyolardan birini veya en fazla üçünü çekin ve bunları bir alt cam görüntüleme plakasına aktarın.
- Stereo mikroskop altında, embriyolara dokunmamaya veya zarar vermemeye dikkat ederek mümkün olduğunca fazla ortamı çıkarmak için bir pipet kullanın; Ardından, ortamı önceden hazırlanmış% 1 düşük erime noktalı agaroz çözeltisi ile değiştirin. Daha sonra, her bir embriyoyu görüntüleme plakasının altına nazikçe itmek için bir alay iğnesinin ucuna sabitlenmiş plastik ince konik bir uç kullanın, optik tektumun iyi bir görünümünü sağlamak için sırt tarafı cama bakacak şekilde yönlendirin ve embriyo ile cam arasında minimum miktarda düşük erime noktalı agaroz.
- Yüksek kaliteli bir Plan Apo Objektif (burada 10x/0.45 Plan Apo veya 20x/0.75 Plan Apo) içeren ters konfokal bir mikroskop kullanarak monte edilmiş embriyoyu hemen görüntüleyin. Timelapse uzun bir süre (bir saatten fazla) çalışacaksa, düşük erime noktalı agarozun aşırı kurumasını önlemek için alt cam görüntüleme plakasına Trikain metansülfonat (3 mg / L) içeren bir veya iki damla E160 tamponu ekleyin.
NOT: Görüntüleme diskine E3 tamponu ve trikalin metansülfonat ortamı eklemeden önce agarozun tamamen katılaşmasını beklemek çok önemlidir; Aksi takdirde, balık yavaşça yanal ve eksenel olarak hareket edebilir ve böylece zaman atlamalı çekimde bir numune kaymasına neden olabilir. - Timelapse alımını istenen süre için ayarlamaya devam edin: görüntü çözünürlüğünü 1,024 μm piksel boyutuyla 1,024 x 0.49 olarak ayarlayın. Z ekseninde kabul edilebilir bir çözünürlük sağlamak için optik dilimleri 2-3 μm'lik artışlarla toplayın. Zebra balığı embriyosunda, kullanılan gelişim aşamasına bağlı olarak optik tektumu 100-150 μm'lik bir z yığını içine alın. Başarılı hücre takibi sağlamak için, çerçeveler arasındaki zaman aralığını 30 s ile 60 s arasında tutun.
3. İzleme analizi ve veri aktarımı
- Imaris dosya dönüştürücü yazılımını kullanarak timelapse dosyasını IMS formatına dönüştürün (bkz. Yazılımı başlattıktan sonra, dosyaları giriş alanına sürükleyip bırakın veya Dosya Ekle... Bunları manuel olarak seçmek için düğmesine basın. Çıktı menüsünde, giriş dosyalarıyla aynı klasörü seçerek veya belirli bir klasörü belirterek dönüştürülen dosyaların konumunu belirleyin. Voksel Boyutunu Ayarla düğmesine tıklayarak görüntülenen voksel boyutunun boyutlarının doğru olduğundan emin olun ve voksel boyutu doğrulandıktan sonra, dosya dönüştürmeyi başlatmak için Tümünü Başlat düğmesine basın (Tüm veri analizinin adım adım kılavuzu için Ek Dosya 1'e bakın).
NOT: Timelapse paralel olarak iki veya daha fazla embriyo üzerinde gerçekleştirildiyse, dosya otomatik olarak tek pozisyonlara bölünür ve her embriyo farklı dosyalara ayrılır. Yazılımı toplu modda kullanmak ve aynı anda birden fazla dosya yüklemek ve dönüştürmek mümkündür. IMS dosyaları oluşturulur ve seçilen hedef klasörde veya giriş dosyalarının bulunduğu klasörde kaydedilir. - Başlatıldıktan sonra, analiz yazılımının Arena'da başlamasına izin verin; Daha önce dönüştürülen dosyayı açmak için Klasörü Gözlemle'ye tıklayın. Dosya yazılıma yüklendikten sonra, Görünüm Alanı'nın solunda bulunan Dilim Araç Çubuğu'ndaki kaydırıcıyı kullanarak z yığınında gezinmek için Dilim görünümünü kullanın ve işaretçiyi kullanarak seçilen hücrelerin çapını çizerek bazı hücre çaplarını ölçün. Hücre çekirdeğini kapsayan bir segment çizmek için fareyi tıklayın ve sürükleyin; Görünüm Alanı'nın sağında yer alan Ölçü Araç Çubuğu'nda çizilen parçanın uzunluğunu gözlemleyin.
NOT: Adım 2.5'teki görüntüleme ayarları kullanılarak, hücre gövdesi çapının 6 μm ile 8 μm arasında olması beklenebilir. - Hücreleri otomatik olarak algılamak için 3B görünüme geri dönün ve nesne listesine yeni bir Spot nesnesi eklemek için Nesne Araç Çubuğundaki spot simgesini tıklayın ve otomatik Spot oluşturma sihirbazını açın. Sihirbazın ilk adımında, yalnızca ilgilenilen bir bölgeyi segmentlere ayırma seçeneğini işaretleyin. Ardından, izleme verilerini hesaplamak için İzleme Noktaları (zaman içinde) seçeneğinin yanı sıra, noktalar arasında karşılaştırmaya izin vermek ve analizde daha sonra kullanılabilecek veri aralığını genişletmek için Nesne-Nesne İstatistiklerini etkinleştirin. Son olarak, sihirbaz penceresinin sağ alt kısmında bulunan İleri düğmesine tıklayarak sihirbazda ilerleyin.
- İkinci adımda, embriyonun optik tektumunu çevreleyen bir ilgi alanı (ROI) alanı belirlemeye devam edin. Her iki yüzünde bulunan küçük beyaz okları tıklayıp sürükleyerek ROI'nin boyutunu değiştirin. ROI boyutu tanımlandıktan sonra, zaman aralığını ayarlayarak kaydedilen tüm karelere genişletin.
- Ardından, hücreleri algılamak için kullanılan kanalı Kaynak Kanal olarak seçin ve daha önce adım 3.2'de elde edilen hücre çapı ölçümünü Tahmini XY Çapı olarak ayarlayın. Arka Plan Çıkarma seçeneğini etkinleştirin ve İleri'ye tıklayın.
- Spot oluşturma sihirbazının bu noktasında, yazılım, spotların her bir spotun merkezinde ölçülen sinyal yoğunluğuna göre filtrelendiği bir kalite filtreleme adımı içerir; lekelerin tespit edildiği kanalda. Alt ve üst eşik kutuları için değeri doğrudan veri alanına girerek veya oluşturma sihirbazının alt kısmında gösterilen histogramdaki karşılık gelen renkli çizgileri sürükleyerek yoğunluk eşiğini ayarlayın, böylece genellikle daha düşük bir sinyal yoğunluğu gösteren dokuda daha derine yerleşmiş olanlar da dahil olmak üzere tüm hücreler algılanır. Tüm bu değişiklikler aynı anda Görünüm Alanında görülebilir.
NOT: Bu noktada tek bir hücreyi etiketleyen birden fazla noktayı gözlemlemek mümkündür, ancak bu daha sonra analizde düzeltilebilir.
Daha uzun zaman aralıklarında, bir miktar foto ağartma görülürse, tüm hücrelerin en son ve dolayısıyla daha soluk karelerde de algılandığından emin olmak için eşiği ayarlamadan önce birden çok karenin Görüntüleme Alanını kontrol edin. - Memnun kaldığınızda, seçilen kalite eşiğini doğrulamak için İleri'ye tıklayın. Kalite eşikleme parametresini karşılayan ve Tahmini XY Çapı ile eşleşen bir çapa sahip tüm noktalar bir nokta olarak etiketlenecektir. Bunu, bu iki parametreyi karşılayan noktaların Kaynak Kanal'ın üzerine yerleştirileceği Görünüm Alanında bir önizleme olarak görselleştirin.
- Bir sonraki adımda, az ya da çok sürekli harekete sahip hücreleri izlemek için izleme algoritması olarak Otoregresif Hareketi seçin. İki kare arasındaki noktaların hareketini dikkatlice gözlemleyerek bir hücrenin iki zaman noktası arasında hareket ettiği en uzun mesafeyi değerlendirin ve Maksimum Mesafe alanına tahmini bir sayı girin. Bu, bir noktanın tahmin edilen gelecekteki konumundan sapmasına izin verilen mesafedir.
- Maksimum Aralık: Size'ı, parçayı kesintiye uğratmadan noktanın kaybolabileceği en az sayıda zaman noktasına ayarlayın. Çerçeveler arasındaki aralık 60 saniyenin altındaysa, 3 boyutunu kullanın. Çerçeveler arasındaki zaman aralığı daha uzunsa, iz parçalanmasını azaltmak için izin verilen maksimum boşluk boyutunu artırın.
- Algılama eşiğini, izleme algoritması tarafından tahmin edilen beklenen konuma yakın bir yere düşürmek ve nokta algılamanın başarısız olması nedeniyle kesintiye uğrayan izleri bağlamak için Algılanan tüm nesnelerle boşlukları doldur seçeneğini etkinleştirin. Son olarak, İleri'ye tıklayın ve yazılımın önceden oluşturulmuş tüm noktalar için otomatik olarak parçalar oluşturmasına izin verin.
- Elde edilen izler çok sayıda veya parçalanmış gibi görünüyorsa, Önceki düğmesine tıklayarak oluşturma sihirbazına geri dönün ve daha önce tanımlanan maksimum mesafeyi ayarlayın, elde edilen izlerin çoğu hücre hareketlerini temsil edene kadar sayıyı artırın veya azaltın.
NOT: İz sayısı kabaca mikroglia hücrelerinin sayısıyla eşleşmelidir, bu nedenle embriyonun yaşına bağlı olarak 30 ile 50 arasında değişmelidir. Ancak, analiz tamamlanmadan önce, hatalı izler nedeniyle daha yüksek bir sayı beklenir. - Parçalar hesaplandıktan sonra, yazılım, genellikle yanlış oldukları veya bilgilendirici olmadıkları için tüm çok kısa parçaları filtrelemek için bir filtreleme adımı içerir. 3-8 dakikadan (dk) daha kısa parçaları, parça süresi filtresinin alt sınırı için değeri doğrudan veri alanına girerek veya oluşturma sihirbazının alt kısmında gösterilen histogramda karşılık gelen renkli çizgileri sürükleyerek hariç tutun. Filtreyi doğrulamak ve oluşturma sihirbazında devam etmek için İleri'ye tıklayın.
NOT: Daha önce de belirtildiği gibi, maksimum (maks) ve minimum (min) parça süresi eşiğini değiştirerek, filtrelenecek ve analizden çıkarılacak parçaları önizlemek mümkündür. Filtrelenen parçalar daha sonra daha fazla analiz için yeni bir nesnede çoğaltılabilir. Filtreleme için tam zaman eşiği, önceki oluşturma sihirbazı adımının sonuçlarına bağlı olarak değişebilir. En iyi sonuçları elde etmek için Görüntüleme Alanındaki önizlemeyi gözden geçirerek bu filtre ayarlarında ince ayar yapmanızı öneririz. - Tg(mpeg1:eGFP) transgenik hattı tüm mononükleer fagositleri etiketlediğinden, timelapse filmlerde mikrogliaya ek olarak cilt makrofajları da tespit edilecektir. Beyin parankimal mikrogliasına odaklanmak için cilt makrofajlarından üretilen izleri analizden manuel olarak çıkarın (Şekil 3).
- Her veri noktasının parçada bir nesne olarak görüntülendiği parça düzenleyicide parçalardaki diğer olası hataları manuel olarak düzeltin. Görünüm Alanının sağındaki daire seçme modu düğmesini etkinleştirin ve değişiklik veya ayarlama gerektiren parçaları vurgulayın. Sorunlu parça seçildikten sonra, bağlan ve bağlantıyı kes düğmelerini kullanarak, hücre hareketlerini doğru bir şekilde temsil edecek şekilde düzenleyin. Hatalı bir şekilde aynı hücreyi temsil eden yinelenen tek noktaları veya küçük parça parçalarını seçmek ve silmek için parça düzenleyiciyi kullanın, bunları daire seçme moduyla seçerek ve ortadan kaldırmak için Canc veya Delete tuşuna basarak.
NOT: İzleme ayarları doğruysa, bu adım izlenen hücrelerin yalnızca küçük bir yüzdesi için gerekli olmalıdır. - Mikroglia raportör hattı, parankimdeki diğer hücre tiplerini etiketleyen floresan transgeniklerle birlikte kullanılıyorsa, bunları görselleştirmek için yeni bir yüzey nesnesi veya spot nesnesi olarak segmentasyon gerçekleştirin. Bunu yapmak için, yukarıdaki adımları tekrarlayın (adım 3.2'den 3.14'e kadar), adım 3.5'teki Kaynak Kanal girişini, ikinci hücre popülasyonunu görüntülemek için kullanılan kanal olacak şekilde değiştirin ve Tahmini XY Çapı (adım 3.5), Maksimum Mesafe (adım 3.8) gibi ilgili hücrelere özgü tanımlayıcı parametreleri yeni hücre popülasyonuna uyarlamaya özen gösterin. Diğer adımlar değişiklik yapılmadan tekrarlanabilir.
NOT: Yeni bir yüzey oluşturulması durumunda, Tahmini XY Çapı, verilecek girdinin nesneye uyan en büyük kürenin çapı olduğu Arka Plan Çıkarmaya dayalı bir eşik seçeneği ile değiştirilir. Bu değer, adım 3.2'de açıklandığı gibi Ölçü araç çubuğu kullanılarak Dilim görünümünden tahmin edilebilir. - Elde edilen parçalardan memnun kaldığınızda, İstatistik sekmesinden istediğiniz izleme istatistiklerini çıkarın. Ayarlar düğmesine tıklayarak, daha önce oluşturulan her bir spot nesnesi veya yüzey nesnesi için hangi istatistiklerin hesaplanacağını seçin. Aynı analizde daha fazla nesne, iki spot nesne veya bir spot ve bir yüzey nesnesi oluşturulmuşsa, ikisi arasındaki en kısa mesafe gibi bir nesnenin diğerine göreli konumunu gösteren istatistikler de dışa aktarılabilir.
NOT: İstenen tüm değerler belirli veya ortalama değerler olabilir ve tüm ham veriler, İstatistikler sekmesinin altındaki düğmeler kullanılarak Virgülle Ayrılmış Değerler (CSV) dosyası olarak indirilebilir. Analizin diğer hücre tiplerini de içermesi koşuluyla, bir nesnenin diğerine olan göreceli mesafesine ilişkin ek istatistikler de mevcut olacaktır.
Sonuçlar
Yeşil floresan proteini (eGFP) eksprese eden mikroglial hücreler ve Tg(mpeg1:eGFPgl22) cinsinden DsRed eksprese eden endotelyal hücreler; KDRL:CRES898; actb2: loxP-STOP-loxP-DsRedexpress, sd5) üçlü transgenik embriyolar14 , açıklanan protokole göre 3 dpf'de görüntülendi. Tek bir zebra balığı embriyosu, %1 düşük erime noktalı agaroz içine bir alt cam plaka üzerine monte edildi ve görüntüleme işlemi, edinme süresi boyunca embriyonun büyümesini engellemedi. Timelapse, 10x 0.45 NA kuru objektif lensi ile donatılmış ticari bir nokta taramalı konfokal mikroskopi sistemi kullanılarak kaydedildi ve mikroglia ve endotel hücrelerini görüntülemek için sırasıyla 488 nm ve 561 nm uyarma lazerleri kullanıldı. Ek olarak, zaman aralığı, görüntü çözünürlüğü, piksel boyutu ve z adımı sırasıyla 30 saniye (s), 1024x1024, 0.49 μm ve 2.5 μm idi. Timelapse kayıt 3,5 saat (s) sürdü.
Elde edilen görüş alanı, embriyonun tüm başını kapsıyordu, ancak analiz, gelişimin ilk haftasında olduğu gibi, özellikle optik tektuma odaklandı, mikroglia esas olarak dorsal orta beynin bu bölgesinin nöronal soma tabakası ile sınırlıdır ve araştırmacıların tüm popülasyonu aynı anda görselleştirmesine izin verir15. 3D izleme analizi, yukarıda açıklandığı gibi Imaris 10.0 kullanılarak gerçekleştirildi. Şekil 4'te gösterildiği gibi, izleme başarılı oldu ve optik tektumda 3 dpf16'da bulunan beklenen mikroglia hücresi sayısıyla eşleşen 25 parça ile sonuçlandı. Minimum bir manuel iz düzeltmesi gerekliydi. Şekil 5'te , başarılı bir izleme deneyinden çıkarılması mümkün olan verilerin bir örneği gösterilmektedir. Makrofajların ve endotel hücrelerinin eşzamanlı olarak etiketlenmesi, mikroglia'nın ikincisine göre konumunun ölçülmesine izin vererek, araştırmacıların her bir hücrenin zaman içinde en yakın endotel hücresine olan göreceli mesafesini görselleştirmesine ve potansiyel etkileşimlerin sıklığını ve sayısını incelemesine olanak tanır (Şekil 5).
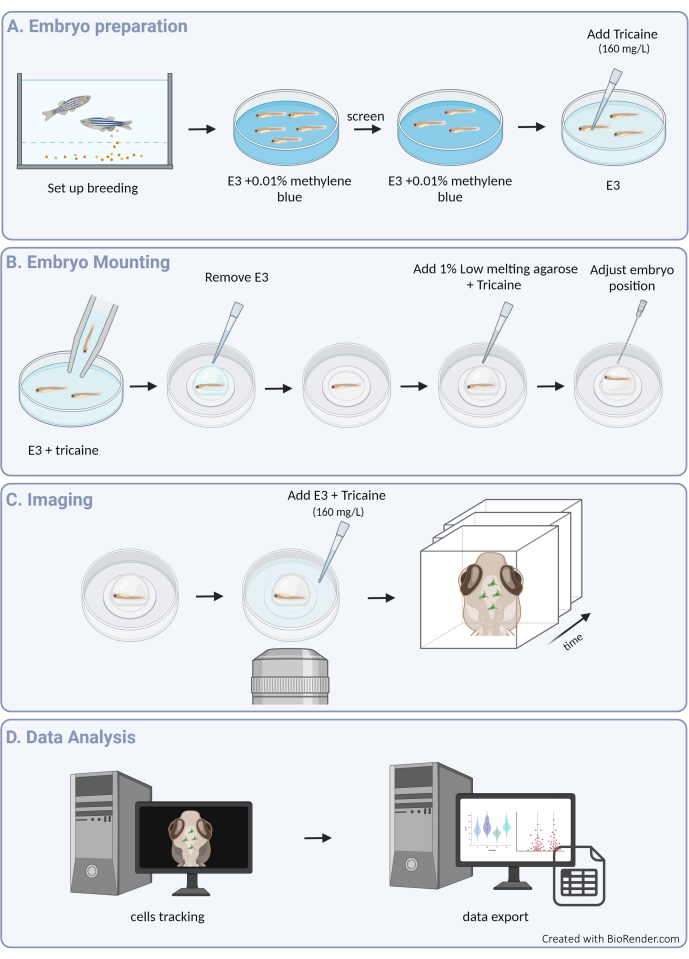
Şekil 1: Deneysel prosedüre genel bakış. (A) Zebra balığı embriyo hazırlığı ve anestezisi. (B) Numune montajı ve konumlandırma. (C) Görüntü elde etme. (D) Görüntü işleme ve hareketlilik verilerinin çıkarılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
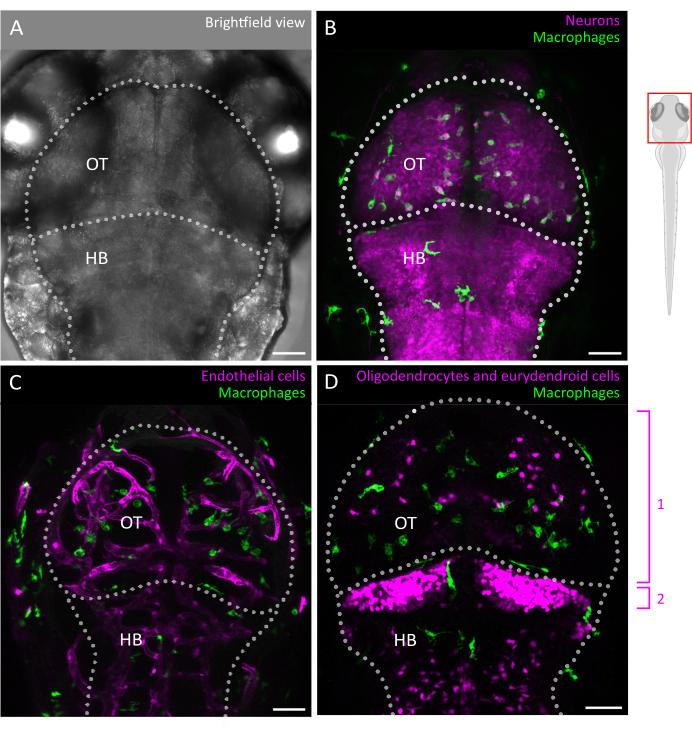
Şekil 2: Zebra balığı embriyosunda mikroglia görüntüleme ve beyin hücresel ortamı ile etkileşimler. (A) 3 dpf embriyonik zebra balığı kafasının ve beyninin (sırt görünümü), optik tektum ve arka beyni etiketleyen parlak alan görüntüsü. Embriyonik zebra balığının beyni, küçük boyutu ve optik şeffaflığı nedeniyle bu aşamada bütünüyle görüntülenebilir. (B-D) Mikroglia konumu ve davranışı, (B,C) Tg(mpeg1:eGFP)gl22 ve (D) Tg(mpeg1:mcherry)gl23 gibi transgenik hatların kullanılması ve OT'ye odaklanılmasıyla görselleştirilebilir. (B) Nöronlar ve hücre gövdeleri, raportör hattı Tg(XlTubb:D sRed)zf148 kullanılarak tanımlanabilir ve mikroglia-nöron etkileşimleri, her iki transgeni birlikte ifade eden çizgilerde iki kanalın birleştirilmesiyle görselleştirilebilir. Görülen, yeşil (mikroglia) ve kırmızı (macenta cinsinden nöronlar) sinyallerin bir birleşimidir. (C,D) Raportör çizgileri ayrıca endotel hücreleri ile mikroglia (yeşil) etkileşimlere ışık tutabilir, burada (C) çift Tg(kdrl:cre s898; actb2: LOXP-STOP-LOXP-Dsredekspres, sd5) transgenikler veya oligodendrositler ve öncüleri gibi glial hücrelerle, (D) çift Tg (olig2: EGFP; mpeg1: mcherry ) transgenik hat. 1: OT'deki oligodendrositler ve progenitör hücreler, 2: beyincikteki eurydendroid nöronları. Ölçek çubukları = 50 μm. Kısaltmalar: dpf = döllenmeden sonraki günler; OT = optik tektum; HB = arka beyin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
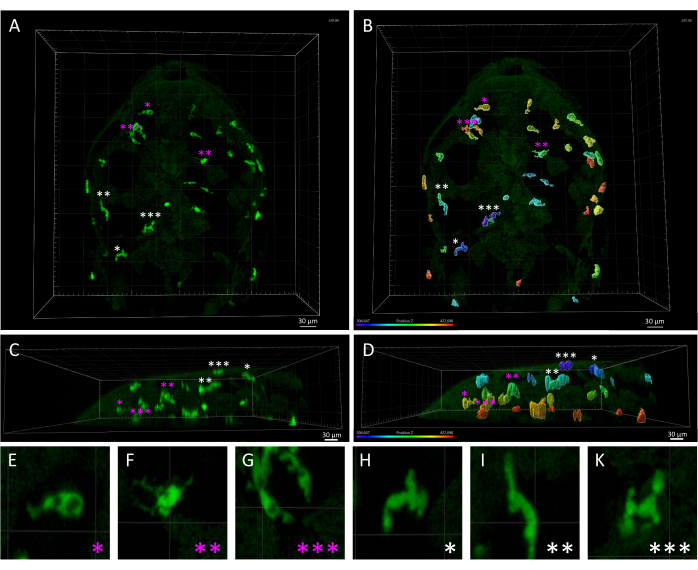
Şekil 3: 3 dpf zebra balığı embriyosunda deri makrofajları ve mikroglia arasındaki morfolojik ve mekansal eşitsizlik. (A,B) (A) parankimal mikroglia hücrelerini (macenta yıldızlarla işaretlenmiş) ve cilt makrofajlarına (beyaz yıldız) karşı (A) parankimal mikroglia hücrelerini (macenta yıldızlarla işaretlenmiş) ve cilt makrofajlarına (beyaz yıldız) gösteren, (B) 'de görüldüğü gibi, z ekseni boyunca göreceli konumlarına göre tanımlanan bir Tg(mpeg1:eGFP)gl22 zebra balığı embriyosunun dorsal görünümü), z ekseni renk kodlamasıyla oluşturulan tek renkli 3D görüntüyü gösterir. (C,D) (C) A ve (D) B'nin, embriyonun kafasındaki mpeg1:eGFP + hücrelerinin z derinliklerini gösteren ve mikroglial hücrelere kıyasla cilt makrofajlarının yüzeysel lokalizasyonunu vurgulayan yanal görünümü. (E-K) A ve B'de bir yıldızla gösterilen her hücrenin yüksek büyütmesi, (EG) amoeboid mikroglia ve (H-K) uzamış cilt makrofajları arasındaki farklı morfolojilerin ayrıntılı bir görselleştirmesini sağlar. Ölçek çubukları= 30 μm. Kısaltma: dpf = döllenmeden sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
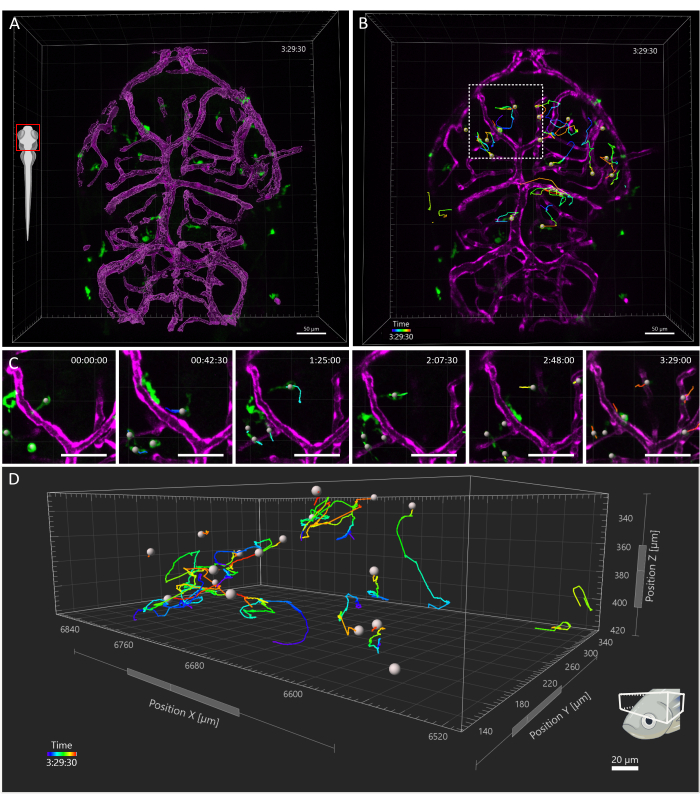
Şekil 4: 3 dpf zebra balığı embriyosunda mikroglial hücrelerin izlenmesi. (A) 3 dpf Tg(kdrl:cres898; actb2: LOXP-STOP-LOXP-Dsredekspres, sd5; mpeg1: eGFPGL22) üçlü transgenik embriyo, mikroglia (yeşil) ve damarların yüzey görüntüsünü (macenta) gösterir. (B-D) (B) 3,5 saatlik bir zaman penceresi boyunca mikroglia hareketlerinin temsili takibi. Bireysel hücrelerin karmaşık yörüngeleri takip ettiği görülmektedir. (C) Kesikli kare ile çevrelenmiş B'deki bölgenin büyütülmüş bir görünümünü gösteren zaman atlamalı çekimden ayrıntı. Filmden altı kare (45 dakika arayla) sunulmakta ve mikrogliaların mikro çevrelerinde endotel hücreleri ile geçici temaslar kurduğunu belgelemektedir. (D) X, Y ve Z eksenleri uzamsal boyutları temsil ederken, optik tektum içindeki bireysel mikroglial hücre göçünün yörüngeleri. Ölçek çubuğu = 50 μm. Kısaltma: dpf = döllenmeden sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
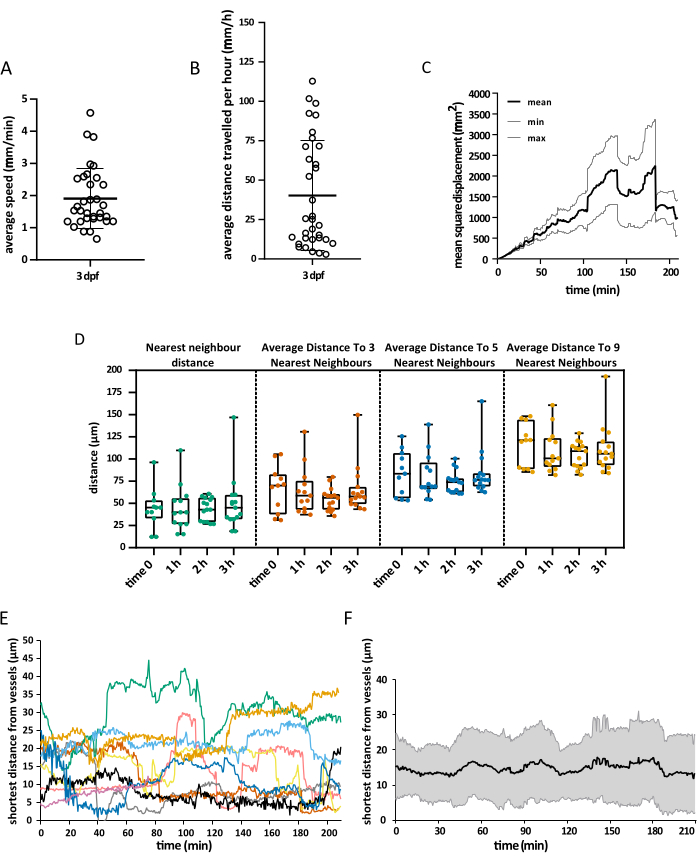
Şekil 5: Elde edilen verilerin görselleştirilmesi. Açıklanan protokol kullanılarak elde edilebilecek uzamsal veri örneği. Grafikler (A) mikroglial hücrelerin ortalama hızını, (B) 1 saatte kat ettikleri ortalama mesafeyi, (C) ortalama kare yer değiştirmelerini ve (D) farklı zamanlarda uzaydaki dağılımlarını göstermektedir. Damarın yüzey oluşturması, herhangi bir zamanda mikroglia ve endotel hücreleri arasındaki en kısa mesafenin, hem (E) tek hücre düzeyinde hem de (F) küresel ortalama olarak ölçülmesine de izin verdi. A, B ve D için her nokta tek bir hücreyi temsil eder. N = bir embriyo. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Mevcut protokol, omurgalı bir embriyoda mikroglia dinamiklerinin in vivo olarak görüntülenmesini ve elde edilen motilite verilerinin görselleştirilmesini sağlar. Gelişmekte olan beynin mikroglia kolonizasyonu, embriyogenez sırasında çok erken gerçekleşir ve nörojenez, astrogliogenez, oligodendrogenez ve diğer birçok hücresel süreç gibi kritik olaylardan önce gelir17. Bu nedenle, mikroglia'nın beyin gelişiminin18 belirli yönlerini şekillendirmede önemli işlevler oynaması şaşırtıcı değildir, örneğin, nöronal farklılaşma, göç ve hayatta kalma 19,20,21'in yanı sıra sinaptik budama5 ve miyelinasyon 22,23,24.
Disfonksiyonel mikroglia'nın nörogelişimsel bozuklukların patogenezine ve/veya ilerlemesine katkısı da giderek daha fazla kabul görmektedir25. Gerçekten de, oluşan beyinde mikroglia'nın erken varlığı, bu hücreleri farklı fizyolojik durumlara26 ve çevresel değişikliklere maruz bırakır. Mikroglia'nın hem kemirgenlerde hem de insanlarda uzun ömürlü hücreler olduğu ve yerel ataların 27,28,29 kendini yenilemesi yoluyla yaşam boyu korunduğu göz önüne alındığında, bunun önemli bir etkisi olabilir. Bu protokolün, beyin morfogenezinin ardışık adımları sırasında geliştikçe, olgunlaştıkça ve ağlarını kurdukça, bu farklı fizyolojik durumlarda mikroglia'nın davranışını daha iyi karakterize etmek için güçlü bir araç olarak hizmet edebileceğine inanıyoruz.
Burada açıklanan kurulumu kullanarak, 6 dpf kadar eski zebra balığı larvaları hakkında başarılı bir şekilde görüntüledik ve veri elde ettik. Analizin daha sonraki gelişim aşamalarına genişletilmesi büyük olasılıkla başarılı olacaktır, ancak görüntüleme kurulumunun, özellikle z ekseni boyunca artan örneklem boyutunu dikkate alacak şekilde ayarlanmasını gerektirecektir. Bunu denerken, başarılı bir analiz için temel parametreler oldukları için düşük sinyal-gürültü oranını ve hızlı tarama süresini korumaya odaklanmanızı öneririz.
Mikroglia takibine izin vermek için minimum 1 saatlik bir görüntüleme süresi öneriyoruz; Bu protokolle test edilen en uzun görüntüleme penceresi 8 saattir. Ayrıca, izleme analizinin çerçeveler arasındaki zaman aralığını mümkün olduğunca kısa, ideal olarak 30 sn ile 60 sn arasında tutması önemlidir. Bu, aşağı akış analizlerinde daha doğru ve ayrıntılı izleme verilerine olanak tanır. Bu nedenle, özellikle birden fazla florofor tespit ediliyorsa, spektral örtüşmeyi önlemek ve sinyal sızıntısı olmadan eşzamanlı bir edinime izin vermek için iki florofor emisyon spektrumu arasında yeterli ayrımı sağlamak esastır.
Zebra balığı beyninin yüksek kaliteli timelapse kaydı için başka protokoller de mevcuttur30, ancak bu, embriyonik gelişim sırasında tüm mikroglia hareketinin uzun bir süre boyunca nasıl başarılı bir şekilde izleneceğini gösteren ilk protokoldür. Burada sunulan iş akışı fizyolojik bir bağlamda mikroglia'nın izlenmesine odaklanmış olsa da, patolojide mikroglia analizine kolayca uygulanabilir. Gerçekten de, otizm31, epilepsi32 ve şizofreni33 gibi çeşitli nörogelişimsel bozukluk modelleri, aynı zamanda nörodejenerasyon34 ve kanser35, zebra balıklarında hastalık koşullarında mikroglial yanıtı ve davranışı belirlemek için benzersiz fırsatlar sağlayan oluşturulmuştur.
Özellikle, bu izleme protokolü çok yönlüdür ve zebra balığı embriyosunun çeşitli anatomik bölgeleri boyunca çeşitli hücre tiplerinin göç modellerine ışık tutmak için etkili olabilir, böylece bu makalede açıklanan mikroglial araştırma kapsamının ötesinde ek uygulamalar için potansiyel olarak yollar açabilir. Ayrıca, birden fazla floresan transgenik çizgiyi birleştirme yeteneğinden yararlanarak, mikroglia ile beyin mikroçevresinin diğer hücre tipleri arasındaki uzamsal ilişkiyi ayırt etme yeteneği kazanırız ve timelapse kayıtları boyunca hücresel etkileşimleri ve çapraz konuşmaları görselleştirme potansiyeli ile invaziv olmayan bir şekilde. Bu, mikroglia davranışının fizyolojik önemini çözmede etkili olabilir ve bu oldukça hareketli hücrelerin daha derin bir karakterizasyonuna katkıda bulunabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Yazarlar, bu çalışma için gerekli olan konfokal mikroskoba cömertçe erişim sağladığı için Profesör Nicolas Bayens'e içten şükranlarını sunarlar. Bu çalışma kısmen Bilimsel Araştırma Fonları (FNRS) tarafından Hibe Numaraları F451218F ve UG03019F altında finanse edilmiştir, Alzheimer Araştırma Vakfı (SAO-FRA) (VW'ye),, FNRS'den bir Araştırma Bursu tarafından desteklenmektedir. Şekil 1, biorender.com tarihinde oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 L Breeding tanks | Tecniplast | ZB10BTE | |
| 1-phenyl-2-thiourea (PTU) | Sigma-Aldrich | P7629 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| Bottom glass imaging dish | FluoroDish | FD3510-100 | |
| Disposable Graduated transfer pipette | avantor | 16001-188 | |
| Dry block heater | Novolab | Grant QBD4 | To keep low melting agarose at 37 °C |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | E10521-50G | |
| Imaris 10.0 | Oxford Instruments | analysis software | |
| Imaris File Converter | Oxford Instruments | https://imaris.oxinst.com/big-data | |
| Laser-scanning confocal microscope | Nikon | Eclipse Ti2-E | |
| Methylene blue | Sigma-Aldrich | M9140-25G | |
| microloader tips | Eppendorf | 5242956003 | |
| NuSieve GTG Agarose | Lonza | 50081 | |
| Petri dishes (90 mm) | avantor | 391-0559 | |
| Pronase | Sigma-Aldrich | 11459643001 | |
| Stainless Steel Forceps Dumont No. 5 | FineScienceTools | 11254-20 | |
| Stereo microscope | Leica | Leica M80 | To mount the embryos |
| teasing needle | avantor | 76549-024 |
Referanslar
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and disease. Annu Rev Physiol. 79, 619-643 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Sci Rep. 308 (5726), 1314-1318 (2005).
- Peri, F., Nusslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133 (5), 916-927 (2008).
- Marın-Teva, J. L., et al. Microglia promote the death of developing Purkinje cells. Neuron. 41 (4), 535-547 (2004).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Hattori, Y. The microglia-blood vessel interactions in the developing brain. Neurosci Res. 187, 58-66 (2023).
- Colonna, M., Butovsky, O. Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 35, 441-468 (2017).
- Xu, H. -T., Pan, F., Yang, G., Gan, W. -B. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nat Neurosci. 10 (5), 549-551 (2007).
- Shin, J., Park, H. -C., Topczewska, J. M., Mawdsley, D. J., Appel, B. Neural cell fate analysis in zebrafish using olig2 BAC transgenics. Methods Cell Sci. 25 (1), 7-14 (2003).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes Dev. 22 (6), 734-739 (2008).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. J Vis Exp. (69), e4196(2012).
- Bohnsack, B. L., Gallina, D., Kahana, A. Phenothiourea sensitizes zebrafish cranial neural crest and extraocular muscle development to changes in retinoic acid and IGF signaling. PLoS ONE. 6 (8), e22991(2011).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor time-lapse imaging of transgenic zebrafish: visualizing retinal stem cells activated by targeted neuronal cell ablation. J Vis Exp. (43), e2093(2010).
- Ferrero, G., et al. Embryonic microglia derive from primitive macrophages and are replaced by cmyb-dependent definitive microglia in zebrafish. Cell Rep. 24 (1), 130-141 (2018).
- Xu, J., Wang, T., Wu, Y., Jin, W., Wen, Z. Microglia colonization of developing zebrafish midbrain is promoted by apoptotic neuron and lysophosphatidylcholine. Dev Cell. 38 (2), 214-222 (2016).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Dev Neurobiol. 73 (1), 60-71 (2013).
- Thion, M. S., Garel, S. Microglial ontogeny, diversity and neurodevelopmental functions. Curr Opin Genet Dev. 65, 186-194 (2020).
- Bohlen, C. J., Friedman, B. A., Dejanovic, B., Sheng, M. Microglia in brain development, homeostasis, and neurodegeneration. Annu Rev Genet. 53, 263-288 (2019).
- Squarzoni, P., et al. Microglia modulate wiring of the embryonic forebrain. Cell Rep. 8 (5), 1271-1279 (2014).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Parkhurst, C. N., et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 155 (7), 1596-1609 (2013).
- Green, L. A., O'Dea, M. R., Hoover, C. A., DeSantis, D. F., Smith, C. J. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1+ microglia precursors. Nat. Neurosci. 25 (7), 849-864 (2022).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23 (9), 1055-1066 (2020).
- Yu, Q., et al. C1q is essential for myelination in the central nervous system (CNS). iScience. 26 (12), 108518(2023).
- Zengeler, K. E., Lukens, J. R. Innate immunity at the crossroads of healthy brain maturation and neurodevelopmental disorders. Nat Rev Immunol. 21 (7), 454-468 (2021).
- Paolicelli, R. C., et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 110 (21), 3458-3483 (2022).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci. 10 (12), 1544-1553 (2007).
- Cook, Z. T., Brockway, N. L., Weissman, T. A. Visualizing the developing brain in living zebrafish using Brainbow and time-lapse confocal imaging. J Vis Exp. (157), e60593(2020).
- Tayanloo-Beik, A., et al. Zebrafish modeling of autism spectrum disorders, current status and future prospective. Front Psychiatry. 13, 911770(2022).
- D'Amora, M., et al. Zebrafish as an innovative tool for epilepsy modeling: State of the art and potential future directions. Int J Mol Sci. 24 (9), 7702(2023).
- Langova, V., Vales, K., Horacek, J. The role of zebrafish and laboratory rodents in schizophrenia research. Front Psychiatry. 11, 549232(2020).
- Chia, K., Klingseisen, A., Sieger, D., Priller, J. Zebrafish as a model organism for neurodegenerative disease. Front Mol Neurosci. 15, 940484(2022).
- Astell, K. R., Sieger, D. Zebrafish in vivo models of cancer and metastasis. Cold Spring Harb Perspect Med. 10 (8), 037077(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır