Method Article
Zebrafish 배아에서 Microglia Dynamics의 실시간 이미징 및 특성 분석
요약
우리는 빠른 스캐닝 컨포칼 현미경을 활용하여 개발 중인 제브라피시 시신경 구조에서 미세아교세포의 실시간 이미징을 수행하는 방법을 시연하여 생체 내에서 이러한 세포의 역학을 분석할 수 있습니다.
초록
미세아교세포는 매우 역동적인 세포이며 이들의 이동과 뇌 실질의 집락화는 적절한 뇌 발달과 기능을 위한 중요한 단계입니다. 외부에서 발달하는 제브라피시 배아는 광학적 투명성을 가지고 있으며, 이는 미세아교세포를 형광으로 라벨링하는 잘 특성화된 형질전환 리포터 라인과 함께 제브라피시를 이러한 연구에 이상적인 척추동물 모델로 만듭니다. 이 논문에서는 제브라피시 모델의 고유한 기능을 활용하여 생체 내 및 생리학적 조건에서 미세아교세포의 역학을 시각화합니다. 우리는 컨포칼 현미경을 사용하여 제브라피시 배아의 시신경 지각에서 미세아교세포의 타임랩스를 기록한 다음 IMARIS 10.0 소프트웨어를 사용하여 추적 데이터를 추출하여 세포의 이동 경로, 평균 속도 및 다양한 발달 단계에서 시신경 지각의 분포를 얻습니다. 이 프로토콜은 다양한 상황에서 미세아교세포의 생리학적 중요성을 규명하는 데 유용한 도구가 될 수 있으며, 이러한 고운동성 세포의 심층적인 특성 규명에 기여할 수 있습니다.
서문
중추신경계(CNS)에 상주하는 대식세포인 미세아교세포는 성인 뇌의 모든 신경교세포의 최대 15%를 차지하는 뚜렷한 비신경세포 집단을 나타냅니다. 미세아교세포 생물학 연구는 발달, 생리학 및 질병에 대한 중요성이 확립되어 최근 몇 년 동안 점점 더 주목을 받고 있습니다1. 생리학적 조건에서 미세아교세포는 매우 역동적이며 뇌 실질 2,3을 지속적으로 조사합니다. 이러한 행동을 통해 미세아교세포는 뇌에 서식하고 신경 회로 형성4, 시냅스 가지치기5 및 혈관 형성6과 같은 뇌 발달에 중추적인 역할을 할수 있습니다. 또한, 이러한 고유한 동적 특성으로 인해 미세아교세포는 감염, 부상 또는 항상성에서 벗어난 징후가 있는지 CNS를 지속적으로 모니터링할 수 있습니다7. 이러한 복잡한 세포 역학을 해부하기 위해서는 시공간을 가로지르는 미세아교세포의 실시간 이미징이 필수적입니다. 다행히도, 외부에서 발달하는 제브라피시 배아의 광학적 투명성과 미세아교세포를 형광으로 라벨링하는 잘 특성화된 형질전환 리포터 라인의 가용성이 결합되어 제브라피쉬는 이러한 연구를 위한 이상적인 척추동물 모델로 자리매김하고 있습니다. 제브라피시 배아의 실시간 이미징은 수술이나 광범위한 조직 조작이 필요 없는 비침습적 접근 방식을 제공하여 CNS 상태에 대한 잠재적 교란을 최소화합니다. 이는 미세아교세포(microglial cell)를 연구할 때 매우 중요한 고려사항인데, 이는 미세아교세포(microglial cell)가 세포외 환경의 미묘한 변화에도 매우 민감하기 때문이다8.
여기에서는 제브라피시 배아에서 3D 미세아교세포 움직임을 성공적으로 추적하기 위한 지침을 제공하여 발달 중인 뇌 실질의 온전한 구조 내에서 미세아교세포의 행동에 대한 전례 없는 관점을 제공합니다(프로토콜의 그래픽 개요는 그림 1 참조). 이 단계별 프로토콜은 다양한 발달 단계에서 제브라피시 미세아교세포를 설정하고 이미지화하는 방법과 미세아교세포의 이동성에 대한 고해상도 데이터를 추출하여 제브라피시의 이동 패턴과 환경 신호에 대한 반응에 대한 귀중한 통찰력을 제공하는 방법을 자세히 설명합니다. 또한 이 프로토콜이 실시간 다색 이미징을 수행하도록 조정될 수 있음을 보여주며, 따라서 뉴런3, 희소돌기아교세포9 및 내피 세포10을 포함한 인접 세포를 표시하는 형질전환 라인과 함께 미세아교세포를 연구하는 데 적용 가능성을 확장합니다( 그림 2 참조). 이 프로토콜은 자연 환경에서 실시간으로 미세아교세포 행동의 역학을 직접 관찰하고 특성화할 수 있는 도구 상자에 추가됨으로써, 생리학 및 질병 모두에서 초기 개발 기간 동안 미세아교세포의 기능을 더 잘 규명하는 데 기여할 것입니다.
프로토콜
제브라피쉬는 FELASA42 및 기관(Université Libre de Bruxelles, Brussels, Belgium; ULB) 지침 및 규정. 모든 실험 절차는 ULB의 ULB 동물 복지 윤리 위원회(CEBEA)의 승인을 받았습니다.
1. 제브라피시 사육 및 배아 준비
참고: 미세아교세포를 포함한 대식세포에서 형광 eGFP 단백질을 발현하는 제브라피시 형질전환 라인 Tg(mpeg1:eGFP)gl22 를 사용하여 이 프로토콜에 표시된 추적 데이터를 생성했습니다. 다른 대식세포 리포터 라인은 ZIRC에서 구할 수 있으며 사용할 수도 있습니다. 형질전환 라인을 선택할 때 높은 신호 강도가 이미지 획득 및 세포 분할을 용이하게 한다는 점을 고려하는 것이 중요합니다.
- 제브라피시(Danio rerio)를 28°C의 온도로 유지하고 확립된 프로토콜11에 따라 관리합니다.
- 원하는 배아의 생년월일 전 늦은 오후에 암컷과 수컷 물고기를 메쉬 바닥과 분리기가 있는 번식 탱크에 함께 배치하여 짝짓기를 자극합니다. 다음 날 아침에 분리기를 제거하여 물고기의 짝짓기 시간을 정하십시오.
- 메쉬를 사용하여 수정란을 수집하고 0.01% 메틸렌 블루와 함께 E3 배지(5mM NaCl, 0.17mM KCl, 0.33mM CaCl2, 0.33mM MgSO4)가 포함된 100mm 페트리 접시로 옮깁니다. 사용된 제브라피시 형질전환 계통의 유전적 배경에 따라, 이미징을 용이하게 하기 위해 색소 형성을 억제하려면 배아가 발달하는 E3 완충액에 N-페닐티오우레아(PTU) 0.003%를 첨가하고, 수정 후 6시간(hpf)부터 시작하여 원하는 발달 단계에 도달할 때까지 2일마다 용액을 새로 고칩니다.
주의: 배아 발달에 영향을 미칠 수 있는 PTU에 장기간 노출되는 것을 피하기 위해12, 가능한 경우, 배아를 PTU에 장기간 노출시킬 필요 없이 선명한 이미징을 가능하게 하는 Casperw2와 같은 색소 결핍 배경에 형질전환 라인을 사용하는 것이 제안된다13. - 이미징할 배아가 수정 후 3일(dpf) 미만인 경우 24hpf에서 탈렴구화합니다. 실체 현미경을 사용하여 모든 배아가 탈렴되었고 효소 처리에 의해 손상되지 않았는지 확인합니다(1.4.2단계 참조).
- 난자의 수가 제한되어 있는 경우, 미세한 절개 겸자를 사용하여 융모막을 집어넣고 바깥쪽으로 당겨 각 배아를 융모막에서 조심스럽게 분리하여 수동으로 수행합니다.
- 난자 수가 더 많은 경우, E3 배지의 1mg/mL 프로나제 용액에 실온(RT)에서 알을 대량으로 배양하여 짧은 기간(일반적으로 5-10분, 부드럽게 휘젓는 동안 융모가 열릴 때까지)하여 효소적으로 탈코리온화를 수행합니다. 다음으로, Pronase 용액을 버리고 배아를 신선한 E3로 3배 철저히 헹구어 남아 있는 융모막과 잔류 효소를 제거합니다.
2. 제브라피시 마운팅
- E3 완충액에 1% 저용융 아가로스 용액을 준비합니다. 탁상용 가열 블록에서 아가로스를 37°C로 냉각하고 갓 만든 트리카인 메탄설포네이트 용액(160mg/L)을 추가하면 이미징 중에 배아를 마취시키는 데 도움이 됩니다. 솔루션을 Vortex하여 완전히 균질화합니다.
- E3 완충액에 배아가 들어 있는 페트리 접시에 160mg/L의 트리케인 메탄설포네이트를 첨가하여 배아를 마취합니다. 움직임이 멈췄는지 확인하고 원하는 형광을 가진 제브라피시 배아를 선택합니다. 명시야 실체 현미경을 사용하여 심장 박동을 시각화하여 배아의 건강을 확인합니다. 끝이 넓은 전사 피펫을 사용하여 선택한 배아 중 하나 또는 최대 3개를 추출하고 하단 유리 이미징 플레이트로 옮깁니다.
- 실체 현미경 아래에서 피펫을 사용하여 가능한 한 많은 매체를 제거하고 배아를 만지거나 손상시키지 않도록 주의하십시오. 그런 다음 매체를 이전에 준비된 1% 저융점 아가로스 용액으로 교체합니다. 다음으로, 바늘 끝에 고정된 플라스틱의 얇고 가늘어진 팁을 사용하여 각 배아를 이미징 플레이트의 바닥으로 부드럽게 밀어 올리고, 배아와 유리 사이에 시신경 구조가 잘 보이고 배아와 유리 사이에 최소한의 낮은 용융 아가로스가 있도록 등쪽이 유리를 향하도록 방향을 지정합니다.
- 고품질 Plan Apo Objective(10x/0.45 Plan Apo 또는 여기에 사용된 20x/0.75 Plan Apo)를 특징으로 하는 도립 컨포칼 현미경을 사용하여 장착된 배아를 즉시 이미징합니다. 타임랩스가 장시간(한 시간 이상) 실행되는 경우 트리케인 메탄설포네이트(160mg/L)가 포함된 E3 완충액 1-2방울을 하단 유리 이미징 플레이트에 추가하여 저융점 아가로스가 과도하게 건조되지 않도록 합니다.
참고: E3 완충액과 트리카인 메탄설포네이트 매체를 이미징 디스크에 추가하기 전에 아가로스가 완전히 응고될 때까지 기다리는 것이 중요합니다. 그렇지 않으면 물고기가 측면 및 축 방향으로 천천히 움직여 타임랩스에서 샘플 드리프트를 유발할 수 있습니다. - 원하는 시간에 대한 타임랩스 획득 설정 진행: 이미지 해상도를 1,024 x 1,024로 설정하고 픽셀 크기는 0.49 μm로 설정합니다. 광학 슬라이스를 2-3 μm 단위로 수집하여 z축에서 허용 가능한 해상도를 보장합니다. 제브라피시 배아에서는 사용되는 발달 단계에 따라 시신경을 100-150 μm z-stack으로 둘러쌉니다. 성공적인 셀 추적을 위해 프레임 사이의 시간 간격을 30초에서 60초 사이로 유지합니다.
3. 추적 분석 및 데이터 내보내기
- Imaris 파일 변환기 소프트웨어를 사용하여 타임랩스 파일을 IMS 형식으로 변환합니다( 재료 표 참조). 소프트웨어를 시작할 때 파일을 입력 영역으로 끌어다 놓거나 파일 추가... 버튼을 눌러 수동으로 선택합니다. [출력 ] 메뉴에서 변환된 파일의 위치를 지정하고 입력 파일과 동일한 폴더를 선택하거나 특정 폴더를 지정합니다. Set Voxel Size 버튼을 클릭하여 표시된 복셀 크기의 치수가 올바른지 확인하고 Voxel 크기가 확인되면 Start All 버튼을 눌러 파일 변환을 시작합니다(모든 데이터 분석에 대한 단계별 가이드는 보충 파일 1 참조).
참고: 두 개 이상의 배아에서 병렬로 타임랩스를 수행한 경우 파일은 자동으로 단일 위치로 분할되어 각 배아를 다른 파일로 분리합니다. 배치 모드에서 소프트웨어를 사용하고 동시에 여러 파일을 업로드 및 변환 할 수 있습니다. IMS 파일은 선택한 대상 폴더 또는 입력 파일이 있는 폴더에 생성되고 저장됩니다. - 실행되면 아레나에서 분석 소프트웨어를 시작합니다. Observe Folder를 클릭하여 이전에 변환된 파일을 엽니다. 파일이 소프트웨어에 로드되면 슬라이스 보기를 사용하여 보기 영역 왼쪽에 있는 슬라이스 도구 모음의 슬라이더를 사용하여 z 스택을 스크롤하고 포인터를 사용하여 선택한 셀의 지름을 그려 일부 셀 지름을 측정합니다. 마우스를 클릭하고 끌어 셀 코어에 걸쳐 있는 세그먼트를 그립니다. View Area의 오른쪽에 있는 Measure Toolbar에 그려진 세그먼트의 길이를 관찰합니다.
참고: 2.5단계의 이미징 설정을 사용하면 세포체 직경이 6μm에서 8μm 사이로 예상할 수 있습니다. - 셀을 자동으로 감지하려면 3D 보기로 돌아가서 개체 도구 모음에서 별색 아이콘을 클릭하여 개체 목록에 새 별점 개체를 추가하고 자동 별점 생성 마법사를 엽니다. 마법사의 첫 번째 단계에서 관심 영역만 분할하는 옵션을 선택합니다. 그런 다음 스폿 추적(시간 경과에 따라) 옵션을 활성화하여 추적 데이터를 계산하고, 오브젝트-개체 통계를 활성화하여 스폿 간 비교를 허용하고 나중에 분석에서 사용할 수 있는 데이터 범위를 확장합니다. 마지막으로 마법사 창의 오른쪽 하단에 있는 다음 버튼을 클릭하여 마법사를 진행합니다.
- 두 번째 단계에서는 배아의 시신경을 둘러싸는 관심 영역(ROI) 영역을 지정합니다. ROI의 각 면에 있는 작은 흰색 화살표를 클릭하고 끌어서 ROI의 크기를 수정합니다. ROI 크기가 정의되면 시간 간격을 조정하여 기록된 모든 프레임으로 확장합니다.
- 그런 다음 셀을 감지하는 데 사용되는 채널을 소스 채널 로 선택하고 이전에 3.2단계에서 얻은 셀 직경 측정값을 예상 XY 지름으로 설정합니다. Background Subtraction(배경 빼기 ) 옵션을 활성화하고 Next(다음)를 클릭합니다.
- 스폿 생성 마법사의 이 시점에서, 소프트웨어는 각 스폿의 중심에서 측정된 신호 강도에 의해 스폿을 필터링하는 품질 필터링 단계를 통합합니다. 반점이 감지된 채널에서. 하한 및 상한 임계값 상자의 데이터 필드에 직접 값을 입력하거나 생성 마법사 하단에 표시된 히스토그램의 해당 색상 선을 드래그하여 강도 임계값을 조정하면 일반적으로 더 낮은 신호 강도를 보이는 조직 깊숙한 곳에 국한된 세포를 포함하여 모든 세포가 감지됩니다. 이러한 모든 변경 사항은 보기 영역에서 동시에 볼 수 있습니다.
참고: 이 시점에서 단일 셀에 라벨을 붙이는 여러 지점을 관찰할 수 있지만 이는 나중에 분석에서 수정할 수 있습니다.
더 긴 타임랩스에서 약간의 광표백이 보이면 임계값을 설정하기 전에 여러 프레임의 보기 영역을 확인하여 모든 셀이 가장 최근의 프레임에서도 감지되므로 더 희미한 프레임에서도 감지되는지 확인하십시오. - 만족스러우면 다음을 클릭하여 선택한 품질 임계값을 검증합니다. 품질 임계값 매개변수를 충족하고 예상 XY 지름과 일치하는 지름을 가진 모든 스폿은 스폿으로 라벨이 지정됩니다. 이를 뷰 영역의 미리보기로 시각화하면 이 두 매개변수를 충족하는 스폿이 소스 채널에 중첩됩니다.
- 다음 단계에서 Autoregressive Motion 을 추적 알고리즘으로 선택하여 더 많거나 적은 연속 모션이 있는 셀을 추적합니다. 두 프레임 사이의 지점의 움직임을 주의 깊게 관찰하여 두 시점 사이의 셀이 이동하는 가장 긴 거리를 판단하고 최대 거리 필드에 예상 숫자를 입력합니다. 이것은 스폿이 예측된 미래 위치에서 벗어날 수 있는 거리입니다.
- 최대 간격 크기를 트랙을 방해하지 않고 스폿이 사라질 수 있는 최소 시점 수로 설정합니다. 프레임 사이의 간격이 60초 미만인 경우 크기 3을 사용합니다. 프레임 사이의 시간 간격이 더 긴 경우 트랙 조각화를 줄이기 위해 허용되는 최대 간격 크기를 늘립니다.
- 감지된 모든 물체로 틈 채우기를 활성화하여 추적 알고리즘에 의해 예측된 예상 위치에 가깝게 감지 임계값을 떨어뜨리고 스폿 감지 실패로 인해 중단된 추적을 연결합니다. 마지막으로 다음을 클릭하고 소프트웨어가 이전에 생성된 모든 스폿에 대한 트랙을 자동으로 생성하도록 합니다.
- 얻은 트랙이 너무 많거나 단편화된 것 같으면 이전 버튼을 클릭하여 생성 마법사로 돌아가서 이전에 정의된 최대 거리를 조정하고 얻은 트랙의 대부분이 셀 움직임을 나타낼 때까지 수를 늘리거나 줄입니다.
참고: 트랙의 수는 미세아교세포의 수와 대략 일치해야 하며, 따라서 배아의 나이에 따라 30개에서 50개 사이입니다. 그러나 분석이 완료되기 전에 잘못된 트랙으로 인해 더 높은 숫자가 예상됩니다. - 트랙이 계산되면 소프트웨어는 종종 부정확하거나 유익하지 않은 매우 짧은 트랙을 모두 필터링하는 필터링 단계를 통합합니다. 추적 기간 필터의 하한 에 대한 데이터 필드에 직접 값을 입력하거나 생성 마법사 하단에 표시된 히스토그램에서 해당 색상의 선을 드래그하여 3-8분(분)보다 짧은 트랙을 제외합니다. 다음을 클릭하여 필터의 유효성을 검사하고 생성 마법사로 이동합니다.
참고: 앞서 언급했듯이 최대(최대) 및 최소(최소) 추적 기간 임계값을 수정하면 필터링하고 분석에서 제외할 추적을 미리 볼 수 있습니다. 그런 다음 추가 분석을 위해 필터링된 트랙을 새 개체에 복제할 수 있습니다. 필터링에 대한 정확한 시간 임계값은 이전 생성 마법사 단계의 결과에 따라 달라질 수 있습니다. 최적의 결과를 위해 보기 영역에서 미리보기를 검토하여 이러한 필터 설정을 미세 조정하는 것이 좋습니다. - Tg(mpeg1:eGFP) 형질전환 라인은 모든 단핵 식세포를 표지하기 때문에 미세아교세포 외에 피부 대식세포도 타임랩스 동영상에서 검출됩니다. 피부 대식세포에서 생성된 트랙을 분석에서 수동으로 제거하여 뇌 실질 미세아교세포에 초점을 맞춥니다(그림 3).
- 트랙 편집기에서 트랙의 다른 잠재적 실수를 수동으로 수정하면 각 데이터 포인트가 트랙에 객체로 표시됩니다. 보기 영역 오른쪽에 있는 서클 선택 모드 버튼을 활성화하고 수정 또는 조정이 필요한 트랙을 강조 표시합니다. 문제가 있는 트랙이 선택되면 연결 및 연결 끊기 버튼을 사용하여 셀 이동을 올바르게 나타내도록 편집합니다. 트랙 에디터를 사용하여 동일한 셀을 잘못 나타내는 중복된 단일 지점 또는 작은 트랙 조각을 선택하고 삭제할 수도 있습니다. 원 선택 모드로 해당 지점을 선택하고 Canc 또는 Delete를 눌러 제거합니다.
참고: 추적 설정이 올바른 경우 추적된 셀의 작은 비율에만 이 단계가 필요합니다. - microglia 리포터 라인이 실질의 다른 세포 유형을 라벨링하는 형광 형질전환학과 함께 사용되는 경우, 새로운 표면 객체 또는 스폿 객체로 분할을 수행하여 시각화합니다. 이렇게 하려면 위의 단계(3.2단계에서 3.14단계까지)를 반복하여 3.5단계에서 소스 채널 입력을 수정하여 두 번째 세포 집단을 이미지화하는 데 사용되는 입력으로 만들고, 예상 XY 지름 (단계 3.5), 최대 거리 (단계 3.8)와 같은 관심 세포에 특정한 설명 매개변수를 새 세포 집단에 적용합니다. 다른 단계는 변경하지 않고 반복할 수 있습니다.
참고: 새로운 표면 생성의 경우, Estimated XY Diameter 는 Background Subtraction 을 기반으로 하는 임계값 옵션으로 대체되며, 여기서 제공될 입력은 오브젝트에 맞는 가장 큰 구의 지름입니다. 이 값은 3.2단계에서 설명한 대로 측정 도구 모음 을 사용하여 슬라이스 보기에서 추정할 수 있습니다. - 얻은 추적이 만족스러우면 Statistic 탭에서 원하는 추적 통계를 추출합니다. 설정 버튼을 클릭하고, 이전에 생성된 각 스폿 오브젝트 또는 표면 오브젝트에 대해 계산할 통계를 선택합니다. 동일한 분석에서 더 많은 객체가 생성된 경우, 두 개의 특색 객체 또는 한 개의 특공 객체 또는 한 개의 특공 객체와 표면 객체, 한 객체와 다른 객체 간의 상대적 위치를 나타내는 통계(예: 두 객체 사이의 최단 거리)도 내보낼 수 있습니다.
참고: 원하는 모든 값은 특정 값 또는 평균 값일 수 있으며, 모든 원시 데이터는 통계 탭 하단의 버튼을 사용하여 CSV(Comma Separated Values) 파일로 다운로드할 수 있습니다. 분석에 다른 셀 유형도 포함되는 경우, 한 개체에서 다른 개체까지의 상대적 거리에 대한 추가 통계도 사용할 수 있게 됩니다.
결과
녹색 형광 단백질(eGFP)을 발현하는 미세아교세포와 Tg에서 DsRed를 발현하는 내피세포(mpeg1:eGFPgl22; KDRL: CRES898; actb2:loxP-STOP-loxP-DsRedexpress,sd5) 삼중 형질전환 배아(14 )를 설명된 프로토콜에 따라 3 dpf에서 이미징하였다. 단일 제브라피시 배아를 바닥 유리판에 1% 저용융 아가로스에 장착했으며 이미징 과정은 획득 시간 동안 배아의 성장을 방해하지 않았습니다. 타임랩스는 10x 0.45 NA 건식 대물 렌즈가 장착된 상용 포인트 스캐닝 컨포칼 현미경 시스템을 사용하여 기록되었으며, 488nm 및 561nm 여기 레이저는 각각 미세아교세포와 내피세포를 이미징하는 데 사용되었습니다. 또한, 시간 간격, 이미지 해상도, 픽셀 크기 및 z 단계는 각각 30초(s), 1024x1024, 0.49μm 및 2.5μm였습니다. 타임랩스 녹화는 3.5시간(h) 동안 지속되었습니다.
획득된 시야는 배아의 머리 전체를 포함했지만, 발달 첫 주 동안 미세아교세포는 주로 등쪽 중뇌의 이 영역의 뉴런 소마층으로 제한되어 조사관이 전체 인구를 동시에 시각화할 수 있기 때문에 분석은 특히 시신경에 초점을 맞췄습니다15. 3D 추적 분석은 위에서 설명한 대로 Imaris 10.0을 사용하여 수행되었습니다. 그림 4에서 볼 수 있듯이 추적이 성공적이었으며, 그 결과 3dpf16에서 시신경에 존재하는 미세아교세포의 예상 수와 일치하는 25개의 추적이 생성되었습니다. 최소한의 수동 트랙 수정이 필요했습니다. 그림 5 는 성공적인 추적 실험에서 추출할 수 있는 데이터의 예를 보여줍니다. 대식세포와 내피세포의 동시 표지를 통해 미세아교세포에 대한 미세아교세포의 상대적 위치를 정량화할 수 있으며, 이를 통해 연구자들은 가장 가까운 내피세포까지의 각 세포의 상대적 거리를 시각화하고 잠재적인 상호 작용의 빈도와 수를 조사할 수 있습니다(그림 5).
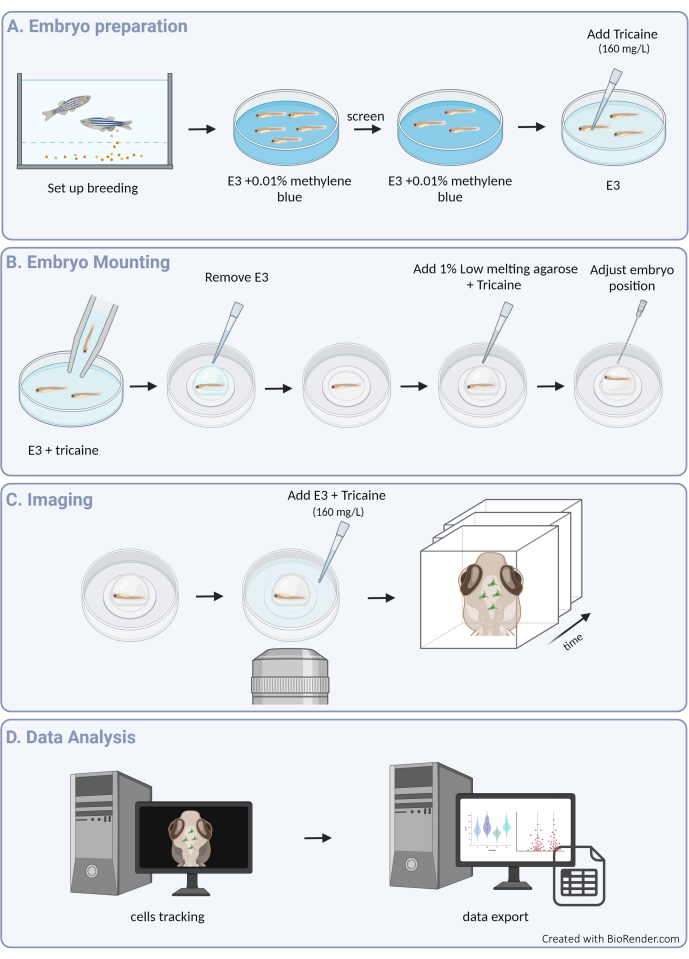
그림 1: 실험 절차의 개요. (A) 제브라피시 배아 준비 및 마취. (B) 샘플 장착 및 위치 지정. (C) 이미지 획득. (D) 이미지 처리 및 운동성 데이터 추출. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
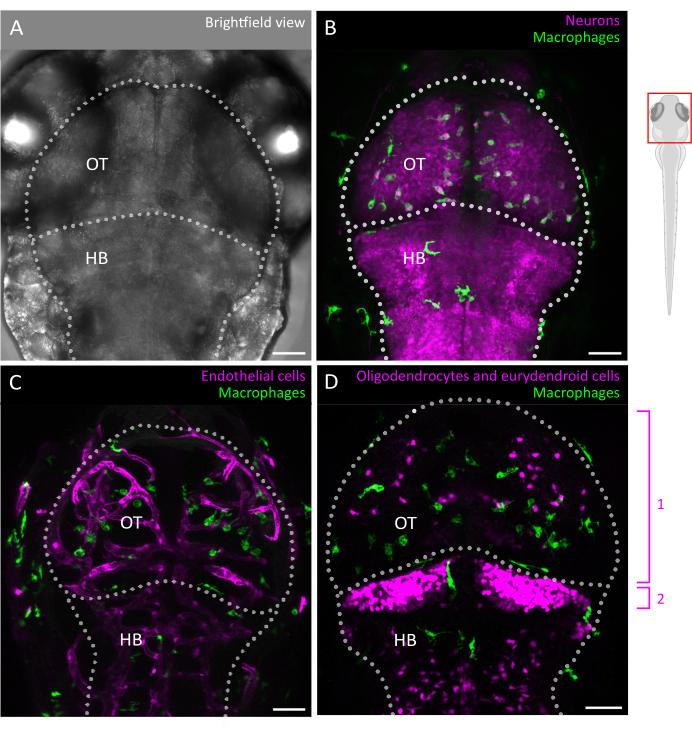
그림 2: 제브라피시 배아의 미세아교세포 이미징 및 뇌 세포 환경과의 상호 작용. (A) 3 dpf 배아 제브라피시 머리와 뇌의 명시야 이미지(등쪽 보기), 시신경 및 뒷뇌 라벨링. 배아 제브라피시의 뇌는 작은 크기와 광학적 투명성으로 인해 이 단계에서 전체를 이미지화할 수 있습니다. (B-D) 미세아교세포의 위치와 거동은 (B,C) Tg(mpeg1:eGFP)gl22 및 (D) Tg(mpeg1:mcherry)gl23과 같은 형질전환 라인을 사용하고 OT에 초점을 맞춰 시각화할 수 있습니다. (B) 리포터 라인 Tg(XlTubb:D sRed)zf148 을 사용하여 뉴런과 그 세포체를 식별할 수 있으며, 미세아교세포-뉴런 상호 작용은 두 전이유전자를 함께 발현하는 라인으로 두 채널을 병합하여 시각화할 수 있습니다. 녹색(미세아교세포)과 빨간색(뉴런, 자홍색) 신호의 병합이 보입니다. (씨,디) 리포터 라인은 또한 내피 세포와의 미세아교세포(녹색) 상호 작용을 밝힐 수 있으며, 여기서는 (C) 이중 Tg(kdrl:cres898; actb2:LOXP-STOP-LOXP-Dsredexpress, SD5) 형질전환, 또는 희소돌기아교세포와 같은 신경교세포와 그 전구체를 이용하여 (D) 이중 Tg(olig2:EGFP; MPEG1:mCHERRY) 형질전환 라인. 1: OT의 희소돌기아교세포 및 전구세포, 2: 소뇌의 eurydendroid 뉴런. 스케일 바 = 50 μm. 약어: dpf = 수정 후 일수; OT = 시신경 tectum; HB = 후뇌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
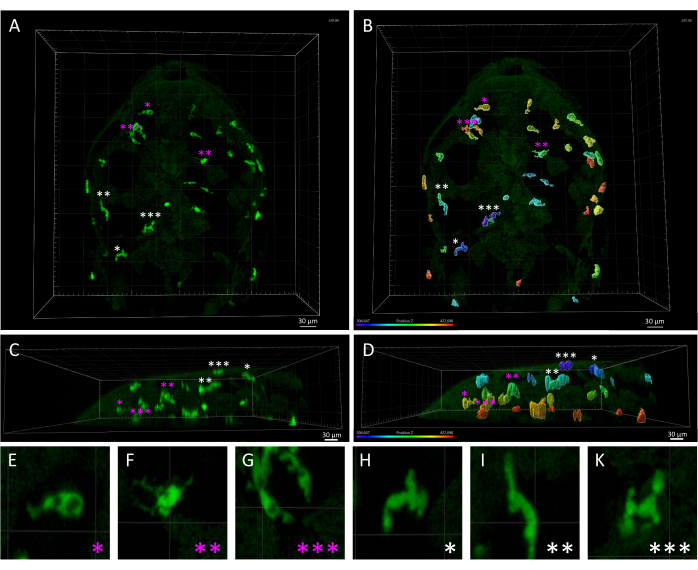
그림 3: 3 dpf 제브라피시 배아에서 피부 대식세포와 미세아교세포의 형태학적, 공간적 차이. (A,B) Tg(mpeg1:eGFP)gl22 제브라피시 배아의 3 dpf에서의 등쪽 모습, (A) 실질 미세아교세포(자홍색 별표로 표시) 대 피부 대식세포(흰색 별표)를 묘사한 모습으로, (B)에서 볼 수 있듯이 z축을 따라 상대적인 위치를 기준으로 식별되었습니다.)은 z축 색상 코딩으로 렌더링된 단색 3D 이미지를 보여줍니다. (씨,디) (C) A 및 (D) B의 측면도, 배아의 머리 내 mpeg1:eGFP+ 세포의 z-깊이를 보여주고 미세아교세포와 비교하여 피부 대식세포의 표면 국소화를 강조합니다. (E-K) A 와 B에 별표로 표시된 각 세포의 고배율로 (E-G) 아메바이드 미세아교세포와 (H-K) 길쭉한 피부 대식세포 사이의 뚜렷한 형태에 대한 자세한 시각화를 제공합니다. 눈금 막대 = 30 μm. 약어: dpf = 수정 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
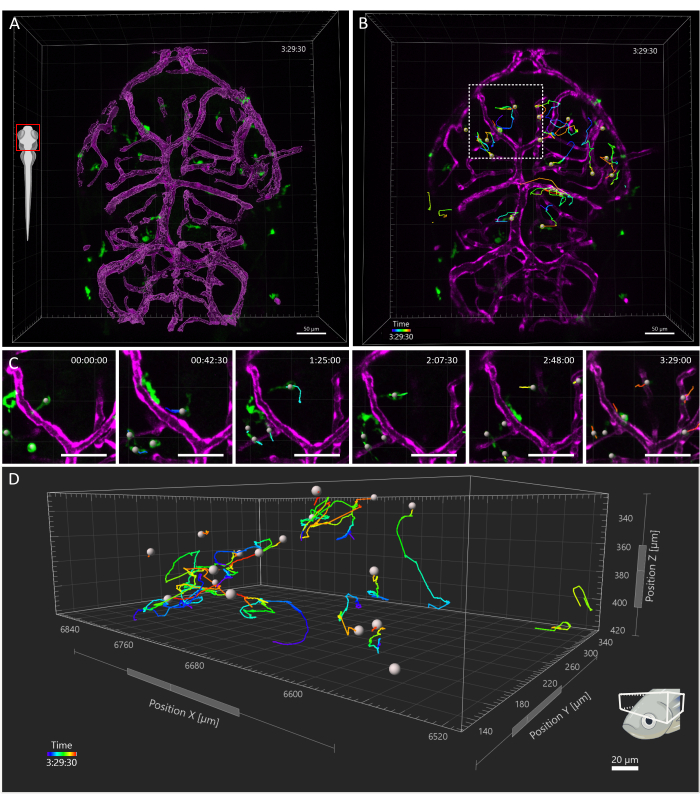
그림 4: 3 dpf 제브라피시 배아의 미세아교세포 추적. (A) 3 dpf Tg의 머리 등쪽 모습(kdrl:cres898; actb2 : LOXP - 정지 - LOXP - Dsred익스프레스, SD5; MPEG1:eGFPgl22) 미세아교세포(녹색) 및 혈관의 표면 렌더링(자홍색)을 보여주는 삼중 형질전환 배아. (B-D) (B) 3.5시간 동안 미세아교세포의 대표적인 움직임 추적. 개별 세포는 복잡한 궤적을 따르는 것으로 보입니다. (C) 점선 사각형으로 둘러싸인 B 영역의 확대 보기를 보여주는 타임랩스의 세부 정보. 영화의 6개 프레임(45분 간격)이 제시되어 미세아교세포가 미세환경에서 내피세포와 일시적인 접촉을 설정하는 것을 문서화합니다. (D) 시신경 구조 내 개별 소교세포 이동의 궤적으로, X, Y, Z축은 공간 차원을 나타냅니다. 눈금 막대 = 50 μm. 약어: dpf = 수정 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
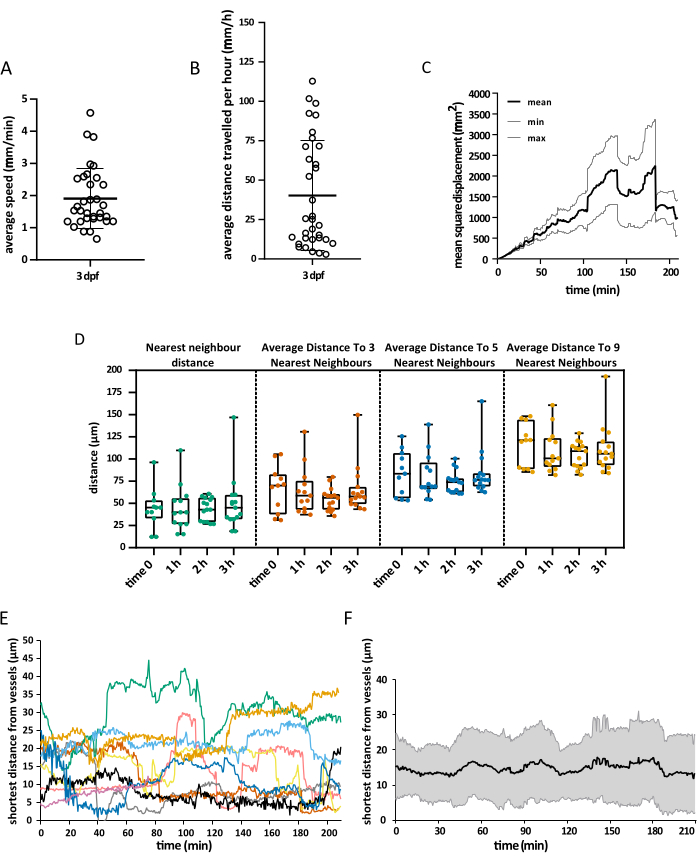
그림 5: 얻은 데이터의 시각화. 설명된 프로토콜을 사용하여 얻을 수 있는 공간 데이터의 예입니다. 그래프는 (A) 미세아교세포의 평균 속도, (B) 1시간 동안 커버하는 평균 거리, (C) 평균 제곱 변위, (D) 서로 다른 시간에서의 공간 분포를 나타냅니다. 또한 용기의 표면 렌더링을 통해 주어진 시간에 미세아교세포와 내피세포 사이의 최단 거리를 (E) 단일 세포 수준과 (F) 전체 평균으로 측정할 수 있었습니다. A, B 및 D의 경우 각 점은 개별 셀을 나타냅니다. N = 하나의 배아. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
추가 파일 1: 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
현재 프로토콜은 척추동물 배아의 미세아교세포 역학에 대한 in vivo 이미징과 획득된 운동성 데이터의 시각화를 가능하게 합니다. 발달 중인 뇌의 미세아교세포(microglia) 집락화는 배발생(embryogenesis) 동안 매우 초기에 발생하며, 신경발생(neurogenesis), 성상교세포형성(astrogliogenesis), 희소돌기아교형성(oligodendrogenesis) 및 기타 여러 세포 과정의 피크(peaks of neurogenesis)와 같은 중요한 사건에 선행한다17. 따라서 미세아교세포(microglia)가 뇌 발달(neuronal differentiation), 이동(migration), 생존(survival)19,20,21, 시냅스 가지치기(synaptic pruning)5 및 수초화(myelination)22,23,24)의 조절을 통해 뇌 발달(18)의 특정 측면을 형성하는 데 중요한 기능을 하는 것은 놀라운 일이 아니다.
신경발달 장애의 발병 기전 및/또는 진행에 대한 기능 장애 미세아교세포의 기여도 점점 더 많이 인식되고 있다25. 실제로, 형성되는 뇌에서 미세아교세포의 초기 존재는 이들 세포를 뚜렷한 생리적 상태(26)와 환경 변화에 노출시킨다. 이는 미세아교세포가 설치류와 인간 모두에서 수명이 긴 세포라는 점을 감안할 때 상당한 영향을 미칠 수 있으며, 국소 전구세포의 자가 재생을 통해 수명 동안 유지된다는 점을 감안할 때 27,28,29. 우리는 이 프로토콜이 뇌 형태 형성의 연속적인 단계에서 네트워크를 형성, 성숙 및 구축함에 따라 이러한 뚜렷한 생리적 상태에서 미세아교세포의 행동을 더 잘 특성화하는 강력한 도구 역할을 할 수 있다고 믿습니다.
여기에 설명된 설정을 사용하여 6dpf 된 제브라피시 유충에 대한 데이터를 성공적으로 이미지화하고 획득했습니다. 분석을 후기 개발 단계로 확장하면 성공할 가능성이 높지만 특히 z축을 따라 증가된 샘플 크기를 고려하여 이미징 설정을 조정해야 합니다. 이를 시도할 때 성공적인 분석을 위한 핵심 매개변수인 낮은 신호 대 잡음비와 빠른 스캔 시간을 유지하는 데 초점을 맞추는 것이 좋습니다.
미세아교세포 추적을 위해 최소 1시간의 이미징 시간을 권장합니다. 이 프로토콜로 테스트된 가장 긴 이미징 창은 8시간입니다. 또한 추적 분석에서는 프레임 사이의 시간 간격을 가능한 한 짧게, 이상적으로는 30초에서 60초 사이로 유지하는 것이 중요합니다. 이를 통해 다운스트림 분석에서 보다 정확하고 상세한 추적 데이터를 얻을 수 있습니다. 따라서 특히 두 개 이상의 형광단을 검출하는 경우 스펙트럼 중복을 피하고 신호 블리드스루 없이 동시 획득을 허용하기 위해 두 형광단 방출 스펙트럼 간의 충분한 분리를 보장하는 것이 중요합니다.
제브라피시 뇌의 고품질 타임랩스 기록을 위한 다른 프로토콜도 사용할 수 있지만, 이것은 장기간에 걸쳐 배아 발달 중 모든 미세아교세포의 움직임을 성공적으로 추적하는 방법을 보여주는 첫 번째 프로토콜입니다. 여기에 제시된 워크플로우는 생리학적 맥락에서 미세아교세포를 추적하는 데 중점을 두었지만 병리학에서 미세아교세포를 분석하는 데 쉽게 적용할 수 있습니다. 실제로, 자폐증31, 간질32, 정신 분열증33, 신경 퇴행34 및 암35과 같은 신경 발달 장애의 여러 모델이 제브라피시에서 확립되었으며, 이는 질병 상태에서 미세아교세포 반응과 행동을 결정할 수 있는 독특한 기회를 제공합니다.
특히, 이 추적 프로토콜은 매우 다재다능하며 제브라피시 배아의 다양한 해부학적 영역에 걸쳐 다양한 세포 유형의 이동 패턴을 밝히는 데 도움이 될 수 있으므로 이 기사에서 설명하는 미세아교세포 조사 범위를 넘어 추가 응용 분야를 위한 길을 열 수 있습니다. 또한, 여러 형광 형질전환 라인을 결합할 수 있는 능력을 활용하여 미세아교세포와 뇌 미세환경의 다른 세포 유형 간의 공간적 관계를 식별할 수 있는 능력을 얻게 되며, 비침습적 방식으로 타임랩스 기록 전반에 걸쳐 세포 상호 작용 및 누화를 시각화할 수 있습니다. 이는 미세아교세포의 생리학적 중요성을 밝히는 데 도움이 될 수 있으며 이러한 운동성이 높은 세포의 더 깊은 특성화에 기여할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
저자들은 이 연구에 필수적인 컨포칼 현미경을 아낌없이 제공해 준 Nicolas Bayens 교수에게 진심 어린 감사를 표하고자 합니다. 이 연구는 보조금 번호 F451218F 및 UG03019F에 따른 FNRS(Funds for Scientific Research), 알츠하이머 연구 재단(SAO-FRA)(VW.까지), AM은 FNRS의 Research Fellowship의 지원을 받습니다. 그림 1은 biorender.com 에 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 L Breeding tanks | Tecniplast | ZB10BTE | |
| 1-phenyl-2-thiourea (PTU) | Sigma-Aldrich | P7629 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| Bottom glass imaging dish | FluoroDish | FD3510-100 | |
| Disposable Graduated transfer pipette | avantor | 16001-188 | |
| Dry block heater | Novolab | Grant QBD4 | To keep low melting agarose at 37 °C |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | E10521-50G | |
| Imaris 10.0 | Oxford Instruments | analysis software | |
| Imaris File Converter | Oxford Instruments | https://imaris.oxinst.com/big-data | |
| Laser-scanning confocal microscope | Nikon | Eclipse Ti2-E | |
| Methylene blue | Sigma-Aldrich | M9140-25G | |
| microloader tips | Eppendorf | 5242956003 | |
| NuSieve GTG Agarose | Lonza | 50081 | |
| Petri dishes (90 mm) | avantor | 391-0559 | |
| Pronase | Sigma-Aldrich | 11459643001 | |
| Stainless Steel Forceps Dumont No. 5 | FineScienceTools | 11254-20 | |
| Stereo microscope | Leica | Leica M80 | To mount the embryos |
| teasing needle | avantor | 76549-024 |
참고문헌
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and disease. Annu Rev Physiol. 79, 619-643 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Sci Rep. 308 (5726), 1314-1318 (2005).
- Peri, F., Nusslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133 (5), 916-927 (2008).
- Marın-Teva, J. L., et al. Microglia promote the death of developing Purkinje cells. Neuron. 41 (4), 535-547 (2004).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Hattori, Y. The microglia-blood vessel interactions in the developing brain. Neurosci Res. 187, 58-66 (2023).
- Colonna, M., Butovsky, O. Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 35, 441-468 (2017).
- Xu, H. -T., Pan, F., Yang, G., Gan, W. -B. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nat Neurosci. 10 (5), 549-551 (2007).
- Shin, J., Park, H. -C., Topczewska, J. M., Mawdsley, D. J., Appel, B. Neural cell fate analysis in zebrafish using olig2 BAC transgenics. Methods Cell Sci. 25 (1), 7-14 (2003).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes Dev. 22 (6), 734-739 (2008).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. J Vis Exp. (69), e4196(2012).
- Bohnsack, B. L., Gallina, D., Kahana, A. Phenothiourea sensitizes zebrafish cranial neural crest and extraocular muscle development to changes in retinoic acid and IGF signaling. PLoS ONE. 6 (8), e22991(2011).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor time-lapse imaging of transgenic zebrafish: visualizing retinal stem cells activated by targeted neuronal cell ablation. J Vis Exp. (43), e2093(2010).
- Ferrero, G., et al. Embryonic microglia derive from primitive macrophages and are replaced by cmyb-dependent definitive microglia in zebrafish. Cell Rep. 24 (1), 130-141 (2018).
- Xu, J., Wang, T., Wu, Y., Jin, W., Wen, Z. Microglia colonization of developing zebrafish midbrain is promoted by apoptotic neuron and lysophosphatidylcholine. Dev Cell. 38 (2), 214-222 (2016).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Dev Neurobiol. 73 (1), 60-71 (2013).
- Thion, M. S., Garel, S. Microglial ontogeny, diversity and neurodevelopmental functions. Curr Opin Genet Dev. 65, 186-194 (2020).
- Bohlen, C. J., Friedman, B. A., Dejanovic, B., Sheng, M. Microglia in brain development, homeostasis, and neurodegeneration. Annu Rev Genet. 53, 263-288 (2019).
- Squarzoni, P., et al. Microglia modulate wiring of the embryonic forebrain. Cell Rep. 8 (5), 1271-1279 (2014).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Parkhurst, C. N., et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 155 (7), 1596-1609 (2013).
- Green, L. A., O'Dea, M. R., Hoover, C. A., DeSantis, D. F., Smith, C. J. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1+ microglia precursors. Nat. Neurosci. 25 (7), 849-864 (2022).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23 (9), 1055-1066 (2020).
- Yu, Q., et al. C1q is essential for myelination in the central nervous system (CNS). iScience. 26 (12), 108518(2023).
- Zengeler, K. E., Lukens, J. R. Innate immunity at the crossroads of healthy brain maturation and neurodevelopmental disorders. Nat Rev Immunol. 21 (7), 454-468 (2021).
- Paolicelli, R. C., et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 110 (21), 3458-3483 (2022).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci. 10 (12), 1544-1553 (2007).
- Cook, Z. T., Brockway, N. L., Weissman, T. A. Visualizing the developing brain in living zebrafish using Brainbow and time-lapse confocal imaging. J Vis Exp. (157), e60593(2020).
- Tayanloo-Beik, A., et al. Zebrafish modeling of autism spectrum disorders, current status and future prospective. Front Psychiatry. 13, 911770(2022).
- D'Amora, M., et al. Zebrafish as an innovative tool for epilepsy modeling: State of the art and potential future directions. Int J Mol Sci. 24 (9), 7702(2023).
- Langova, V., Vales, K., Horacek, J. The role of zebrafish and laboratory rodents in schizophrenia research. Front Psychiatry. 11, 549232(2020).
- Chia, K., Klingseisen, A., Sieger, D., Priller, J. Zebrafish as a model organism for neurodegenerative disease. Front Mol Neurosci. 15, 940484(2022).
- Astell, K. R., Sieger, D. Zebrafish in vivo models of cancer and metastasis. Cold Spring Harb Perspect Med. 10 (8), 037077(2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유