A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم مقاييس نتائج اتصال وحدة محرك الحجاب الحاجز للفئران كمؤشرات حيوية كمية لتنكس الخلايا العصبية الحركية الحجابي والتعويض
* These authors contributed equally
In This Article
Summary
في هذه الدراسة ، نقدم طريقة في الجسم الحي لتقدير عدد وحجم الوحدة الحركية لتحديد اتصال الوحدة الحركية للغشاء الفئران. يتم وصف نهج خطوة بخطوة لهذه التقنيات.
Abstract
فقدان وظيفة العضلات التنفسية هو نتيجة لإصابة الخلايا العصبية الحركية والتنكس العصبي (على سبيل المثال ، إصابة الحبل الشوكي العنقي والتصلب الجانبي الضموري ، على التوالي). الخلايا العصبية الحركية الحجابي هي الرابط الأخير بين الجهاز العصبي المركزي والعضلات ، وتمثل الوحدات الحركية الخاصة بكل منها (مجموعات من الألياف العضلية المعصبة بواسطة خلية عصبية حركية واحدة) أصغر وحدة وظيفية في الجهاز التنفسي العصبي العضلي. جهد عمل العضلات المركبة (CMAP) ، جهد الوحدة الحركية المفردة (SMUP) ، وتقدير عدد الوحدات الحركية (MUNE) هي مناهج فيزيولوجية كهربية تم إنشاؤها لتمكين التقييم الطولي لسلامة الوحدة الحركية في النماذج الحيوانية بمرور الوقت ولكن تم تطبيقها في الغالب على عضلات الأطراف. لذلك ، فإن أهداف هذه الدراسة هي وصف نهج في دراسات القوارض قبل السريرية التي يمكن استخدامها طوليا لتحديد كمية MUNE الحجابي ، وحجم الوحدة الحركية (الممثلة باسم SMUP) ، و CMAP ، ثم لإثبات فائدة هذه الأساليب في نموذج فقدان الخلايا العصبية الحركية. يمكن للمؤشرات الحيوية الحساسة والموضوعية وذات الصلة بالترجمة لإصابة الخلايا العصبية والتنكس والتجديد في إصابة الخلايا العصبية الحركية وأمراضها أن تساعد بشكل كبير وتسريع اكتشافات الأبحاث التجريبية للاختبارات السريرية.
Introduction
تشكل الخلايا العصبية الحركية الحجابي (MNs) ، التي تمتد من مستويات بضع العضل C3 إلى C6 ، الرابط النهائي من الجهاز العصبي المركزي (CNS) إلى عضلة الحجاب الحاجز1. تتكون الوحدات الحركية الحجيبية (MUs) من MN واحد في العمود الفقري وألياف عضلات الحجاب الحاجز المعصبة التي تشكل أصغر وحدة وظيفية في الجهاز العصبي العضلي التنفسي. تتطلب وظيفة التهوية تقلصا كافيا لعضلة الحجاب الحاجز يتحقق من خلال التنشيط المنسق لتجمع MU الحجابي 2,3. تؤدي العديد من الأمراض العصبية ، بما في ذلك التصلب الجانبي الضموري (ALS) ، إلى ضعف شديد في التهوية ، مما يساهم في النهاية في سبب الوفاة4.
يمكن استخدام العديد من الأساليب الفيزيولوجية الكهربية لتقييم ومراقبة سلامة تجمع الوحدة الحركية (MU) في الجسم الحي. تعكس إمكانات عمل العضلات المركبة (CMAP) إزالة الاستقطاب المجمعة لجميع ألياف العضلات في عضلة معينة أو مجموعة عضلية بعد تحفيز الأعصاب الطرفية وهي حساسة لمجموعة من الحالات العصبية العضلية ، بما في ذلك ALS 5,6 وضمور العضلات الشوكي (SMA)7,8,9. يتمثل أحد قيود تقييم CMAP في أن تنبت الضمانات يمكن أن يؤدي إلى الحفاظ على سعة CMAP ومساحتها حتى في وجود خسارة MU10. للتغلب على هذا القيد ، تم إجراء تعديلات على تقنية CMAP لتقييم كل من رقم الوحدة الحركية والحجم11. بالإضافة إلى ذلك ، اقترحت دراسة في الجسم الحي تبحث في التقييم الوظيفي للحجاب الحاجز CMAP بواسطة نظام فيزيولوجي كهربية أنه قد يكون من الممكن أيضا استخدام تقنية تسجيل CMAP للحجاب الحاجز الموصوفة لتقدير رقم الوحدة الحركية12.
تم تقديم تقنية تقدير عدد الوحدات الحركية الإضافية (MUNE) في البداية في أوائل سبعينيات القرن العشرين من قبل McComas et al. لعضلة الباسطة digitorum brevis في البشر13. كان نهج MUNE التدريجي عبارة عن تعديل لتقنية تسجيل CMAP التقليدية التي تم خلالها تقديم تحفيز متزايد تدريجيا لتسجيل الزيادات الكمية ، كل شيء أو لا شيء دون الحد الأقصى كمؤشرات لاستجابات الوحدة الحركية الواحدة. تم استخدام الزيادات المجمعة والمتوسطة لحساب تقدير لحجم جهد وحدة محرك واحدة (SMUP). ثم تم تقسيم هذا الحجم المحسوب إلى سعة CMAP لتقدير عدد MUs التي تعصب العضلات قيد الفحص11. يظهر MUNE حساسية عالية في اكتشاف ومراقبة فقدان الوحدة الحركية ، مما يسمح بتحديد خلل الوحدة الحركية قبل التغييرات الملحوظة في التدابير مثل سعة CMAP أو المنطقة14,15. في مرضى ALS ، أثبت MUNE أنه حساس بشكل استثنائي ، حيث يعمل كعلامة حيوية بارزة لبداية المرض وتطوره وتشخيصه16،17.
تم تطوير العديد من التعديلات على MUNE واستخدامها على نطاق واسع لتقييم وظيفة MU في حالات مثل التنكس العصبي والإصابة العصبية وعملية الشيخوخة الطبيعية18،19،20،21. منذ الوصف الأولي ، تم استخدام العديد من التكيفات باستخدام كل من الاستجابات الكهربية وقياسات القوة الإضافية (الميكانيكية) في كل من الدراسات البشرية والنماذج الحيوانية22. يوفر MUNE تقييما وظيفيا غير جراحي لاتصال الخلايا العصبية الحركية بالعضلات. يتيح تطبيق MUNE طوليا فهم المرض أو تطور النمط الظاهري المستحث وتقييم التأثيرات الوقائية أو التجديدية للتدخلات العلاجية ، سواء في البيئات السريرية أو قبل السريرية. بغض النظر عن فعالية مقاييس MUNE للتكاثر والأهمية السريرية لتقنية حمامات MU في معظم أنحاء جسم الإنسان ، فقد ركزت الجهود إلى حد كبير على عضلات الأطراف في عضلات القوارض10،23،24،25.
لذلك ، كانت أهداف هذه الدراسة هي وصف نهج للحصول على إمكانات عمل العضلات المركبة (CMAP) ، SMUP ، ورقم الوحدة الحركية الحجيبية (MUNE) كما هو الحال في تقييمات الجسم الحي التي يمكن استخدامها طوليا في دراسات القوارض قبل السريرية لتحديد حجم MUNE وحجم الوحدة الحركية (ممثلة باسم SMUP) و CMAP. علاوة على ذلك ، نقدم بيانات تمثيلية تسلط الضوء على فقدان رقم MU الحجاب الحاجز بعد إعطاء عامل تنكسي MN محموم داخل الجنبة ، شظية سم الكوليرا B مترافقة مع سابورين (CTB-SAP).
Protocol
تمت الموافقة على جميع الإجراءات وتنفيذها وفقا للمبادئ التوجيهية التي وضعتها اللجنة المؤسسية لرعاية واستخدام في جامعة ميسوري. أجريت التجارب على ذكور الفئران البالغة Sprague-Dawley ، الذين تتراوح أعمارهم بين 11 و 15 أسبوعا. تم إيواء هذه الفئران في أزواج وتم الاحتفاظ بها تحت دورة 12:12 من الضوء والظلام ، مع إمكانية الوصول إلى الأغذية التجارية القياسية والمياه المعالجة بحمض الهيدروكلوريك المتاحة في جميع الأوقات.
1. إعداد وتسليم التخدير
- ارتداء معدات الحماية الشخصية المناسبة أثناء التعامل مع الفئران.
- تطبيق التخدير بالاستنشاق مع 3-5٪ إيزوفلوران ، مما يضمن الحث المناسب. بمجرد تخدير الفئران بشكل كاف ، ضعه في وضع ضعيف وحافظ على التخدير مع 1-3٪ من الأيزوفلوران المستنشق. تحقق من كفاية عمق التخدير عن طريق الضغط برفق على وسادة القدم الخلفية باستخدام ملقط لضمان عدم وجود استجابة انسحاب.
ملاحظة: بناء على حجم الفئران ووزنها ، راقب عمق التخدير ، واضبط تركيز الأيزوفلوران وفقا لذلك. - حافظ على درجة حرارة 37 درجة مئوية باستخدام لوحة تسخين ثرموستاتية لمنع التغيرات في درجة الحرارة التي يمكن أن تؤثر على سعة CMAP وزمن الوصول.
- ضع مرهما بيطريا قائما على البترول على العينين لمنع الجفاف. راقب عمق التخدير من خلال مراقبة معدل التنفس والتحقق من استجابات الانسحاب عند الضغط على وسادة القدم بالملقط.
- إزالة الشعر من الثلث السفلي من الصدر والرقبة لدراسته باستخدام كليبرز . مراقبة تنفس الفئران خلال التجربة بأكملها.
ملاحظة: بعد تسجيلات CMAP و MUNE والتوقف عن التخدير ، لا تترك الجرذ دون مراقبة حتى يستعيد وعيه الكافي. لا تعيد إلى قفص المنزل حتى يتعافى تماما.
2. وضع القطب والإعداد
- ضع زوجا من أقطاب إبرة أحادية القطب 28 G لتسجيل CMAP و SMUP و MUNE كما هو موضح في الشكل 1.
- ضع قطب الإبرة النشط (E1) تحت الجلد فوق خط الترقوة الأوسط السفلي من الحد الأخير للضلع ، وقطب الإبرة المرجعي (E2) تحت الجلد في الزاوية بين عملية xyphoid والغضروف القصي الضلعي الأخير.
ملاحظة: لا ينبغي إدخال أقطاب الإبرة في عضلة الحجاب الحاجز. بدلا من ذلك ، يجب وضعها في المنطقة تحت الجلد.
- ضع قطب الإبرة النشط (E1) تحت الجلد فوق خط الترقوة الأوسط السفلي من الحد الأخير للضلع ، وقطب الإبرة المرجعي (E2) تحت الجلد في الزاوية بين عملية xyphoid والغضروف القصي الضلعي الأخير.
- لتحفيز العصب الحجابي في الصفيحة السباتية ، استخدم زوجا من أقطاب إبرة أحادية القطب 28 G ككاثود وأنود لتحفيز الأعصاب وتوضع تحت الجلد فوق الرقبة الجانبية بين العضلات الأمامية والمتوسطة ، مفصولة بحوالي 1 سم. تأكد من أن وضع الإبر المحفزة في المستوى تحت الفقرات العنقية الرابعة (C4).
ملاحظة: تجنب إدخال الأقطاب الكهربائية المحفزة عميقا جدا لتجنب إصابة العصب الحجابي أو أي بنية أخرى. يوضح الشكل 1 موضع القطب. - بالنسبة للقطب الأرضي ، ضع قطبا سطحيا يمكن التخلص منه على الذيل.
3. الحصول على البيانات
- CMAP المحموم
- سجل استجابات CMAP الحجيبية من خلال تطبيق نبضات الموجة المربعة الكاثودية أحادية الطور لمدة 0.1 مللي ثانية وشدة تتراوح من 60 إلى 100 مللي أمبير لتحفيز العصب الحجابي.
- احصل على استجابات CMAP مع زيادة شدة التحفيز تدريجيا حتى تتوقف سعة الاستجابة عن إظهار أي زيادة أخرى. لضمان التحفيز فوق الأقصى ، ارفع شدة التحفيز إلى ما يقرب من 120٪ من المستوى المستخدم لاستنباط استجابة قصوى ، وسجل استجابة إضافية. إذا لم يعد حجم CMAP يزداد، فاعتبر هذه الاستجابة الحد الأقصى ل CMAP.
ملاحظة: يفضل تقديم التحفيز أثناء الزفير لتقليل ضوضاء نشاط العضلات المتزامنة أثناء تسجيل CMAP. - قم بقياس وتوثيق السعات من الذروة إلى الذروة ل CMAP بالمللي فولت (mV) (الشكل 2).
ملاحظة: يمكن تقييم سعة CMAP من القاعدة إلى الذروة ومن الذروة إلى الذروة. غالبا ما يتم تقصير أنظمة التشخيص الكهربائي السريري لتقييم القاعدة إلى الذروة التي يتم حسابها من خط الأساس متساوي الكهربية إلى الذروة السلبية الأولية.
- متوسط حجم جهد وحدة المحرك الفردي (SMUP) وحساب MUNE
- احسب متوسط حجم SMUP باستخدام تقنية التحفيز التزايدي.
- لاستنباط استجابات تدريجية ، قم بإدارة التحفيز دون الحد الأقصى لمدة 0.1 مللي ثانية بتردد 1 هرتز ، مع زيادة الشدة تدريجيا بزيادات 0.03 مللي أمبير حتى يتم تحقيق الحد الأدنى من استجابة الكل أو لا شيء. احصل على الاستجابة الأولية بشدة تحفيز تتراوح بين 2 مللي أمبير و10 مللي أمبير.
- إذا لم تحدث الاستجابة الأولية مع شدة التحفيز بين 2 مللي أمبير و 10 مللي أمبير ، فقم بتعديل موضع الكاثود المنبه ، إما تقريبه أو تحريكه بعيدا عن العصب الحجابي في الرقبة ، لتقليل أو زيادة شدة التحفيز اللازمة ، على التوالي.
- إذا تحققت الاستجابة الإضافية الأولى بكثافة تحفيز تتراوح من 2 مللي أمبير إلى 10 مللي أمبير ، احفظ الاستجابة الأولى واكتسب زيادات إضافية ذات كثافة تحفيز أعلى تدريجيا ، مع تعديلها بزيادات قدرها 0.03 مللي أمبير ، لتحقيق ما مجموعه 9 زيادات إضافية تفي بالمعايير التالية في الخطوة 3.2.2.
ملاحظة: يتم تحديد كل SMUP عن طريق طرح كل زيادة من الزيادة السابقة.
- أثناء قياس الاستجابات التزايدية، تأكد من أن كل زيادة تفي بالمعايير التالية:
- تأكد من أن الذروة السلبية الأولية للاستجابات الإضافية تتماشى مؤقتا مع الذروة السلبية لاستجابة CMAP القصوى.
ملاحظة: الحركات الطفيفة التي لوحظت بسبب ضوضاء الخلفية من دورات التنفس متأصلة في طبيعة التجربة. ومع ذلك ، فإن الوجود المستمر ل SMUPs أثناء المراقبة الحية يؤكد هويتهم لهذا CMAP المحدد. - وبما أن الحجاب الحاجز عضلة ديناميكية تشارك في التنفس، فقد تحفز كل دورة تنفس حركة خط الأساس. وبالتالي ، تحقق من استقرار وغياب التجزئة في كل استجابة تدريجية من خلال تأكيد الاتساق عبر ثلاث استجابات مكررة.
ملاحظة: لتمييز الإمكانات المستثارة منخفضة السعة ، وخاصة SMUP الأول ، من ضوضاء الخلفية بسبب النشاط التنفسي ، من المهم أن تظل متيقظا ومراقبا لمدة 3-4 دورات تنفسية. تأكد أيضا من محاذاة القمم مع تلك الموجودة في CMAP للتأكد من دقتها. - تأكد من أن كل زيادة مميزة وأكبر من سابقتها. لذلك ، قم بتمييز الاستجابات الإضافية بصريا في الوقت الفعلي ، مع مراقبتها أثناء تراكبها على الزيادات المسجلة مسبقا.
ملاحظة: يمكن إجراء نسخ متعددة من التحفيز عند كل سعة لضمان الاتساق في الزيادات والامتثال للمعايير المحددة مسبقا. - بعد التحقق بصريا من كل زيادة بالمعايير المذكورة أعلاه ، تأكد من أن سعة الزيادة لا تقل عن 25 μV. إذا كانت الزيادة أقل من 25 ميكروفولت ، فتجاهل القياس وأعد تقييم الاستجابة.
- بعد تسجيل 10 استجابات تزايدية ، تحقق من أن سعة كل استجابة زيادة لا تزيد عن ثلث السعة المجمعة لجميع الزيادات العشر ، والتي تمثل السعة الإجمالية للاستجابة النهائية. إذا لم يتم استيفاء هذا المعيار ، كرر قياس الاستجابات الإضافية ال 10.
ملاحظة: تعتمد عتبة الثلث على افتراض أن كل استجابة تزايدية تمثل تنشيط وحدة حركية واحدة. إذا تجاوزت سعة أي استجابة إضافية ثلث السعة المجمعة لجميع الزيادات العشر ، فهذا يشير إلى أن الاستجابة قد لا تعزى فقط إلى تنشيط وحدة محرك واحدة. بدلا من ذلك ، يمكن أن يتأثر بتوظيف وحدات حركية إضافية أو وجود نشاط غير محدد ، مثل الضوضاء الكهربائية أو القطع الأثرية22,26. - لتقدير متوسط سعة SMUPs ، قم بحساب متوسط قيم الزيادات 10. هناك طريقة أخرى لقياس متوسط سعة SMUP وهي قسمة السعة الكاملة للاستجابة الإضافية النهائية على إجمالي عدد الزيادات11.
- تأكد من أن الذروة السلبية الأولية للاستجابات الإضافية تتماشى مؤقتا مع الذروة السلبية لاستجابة CMAP القصوى.
- حدد MUNE بقسمة السعة القصوى ل CMAP (من الذروة إلى الذروة) على متوسط سعة SMUP (من الذروة إلى الذروة). في بعض الأنظمة الفيزيولوجية الكهربية ، يتم تسجيل SMUPs بالميكروفولت (μV) ، بينما يتم التعبير عن CMAP عادة بالمللي فولت (mV). إذا لزم الأمر ، قم بتحويل قياسات CMAP و SMUP إلى نفس الوحدات قبل حساب MUNE.
ملاحظة: عادة ما يتم حساب CMAP من الذروة إلى الذروة ومتوسط SMUP و MUNE تلقائيا بواسطة أنظمة تخطيط كهربية العضل في العيادة):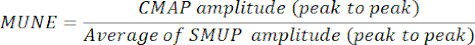
CMAP = جهد عمل العضلات المركب
SMUP = إمكانات وحدة محرك واحد
MUNE = تقدير رقم وحدة المحرك
- احسب متوسط حجم SMUP باستخدام تقنية التحفيز التزايدي.
النتائج
تتيح تقنيات CMAP و SMUP و MUNE الموضحة في هذا التقرير تسجيل الوظيفة العصبية العضلية في عضلة الحجاب الحاجز باستخدام وضع قطب كهربائي طفيف التوغل (الشكل 1). يمكن استخدام معلمات السعة والمساحة لتوصيف حجم CMAP فوق الأقصى ، مما يوفر مقياسا شاملا لإخراج مجموعة العضلات (
Discussion
في الأمراض التنكسية MN ، مثل ALS ، من الأهمية بمكان تقييم MUs المشاركة في التهوية28. على الرغم من حدوث تنكس MN التنفسي في مرضى ALS ، إلا أن البداية المحددة وتطور وفاة MN لا تزال غير مفهومة بشكل كامل29،30،31. وإدراكا لأهم...
Disclosures
تلقت WDA تمويلا بحثيا من NMD Pharma و Avidity Biosciences ورسوم استشارية من NMD Pharma و Avidity Biosciences و Dyne Therapeutics و Novartis و Design Therapeutics و Catalyst Pharmaceuticals و Novartis.
Acknowledgements
تم تمويل هذا العمل من خلال منحة برنامج أبحاث إصابات / أمراض الحبل الشوكي من برنامج أبحاث إصابات / أمراض الحبل الشوكي في ميسوري (NLN و WDA).
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| 50 mL, Model 705 RN syringe | Hamilton Company | 7637-01 | Utilized to conduct intrapleural injection |
| 5008 - Formulab Diet | LabDiet | 0001325 | |
| Autoclavable 26 G needles (26S RN 9.52 mm 40°) | Hamilton Company | 7804-04 | Utilized to conduct intrapleural injection |
| Cholera toxin B-subunit (CTB) | MilliporeSigma | C9903 | Utilized for intrapleural injection to label surviving motor neurons |
| Cholera toxin B-subunit conjugated to saporin (CTB-SAP) | Advanced Targeting Systems | IT-14 | Utilized for intrapleural injection to cause motor neuron death |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes- recording electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | ||
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Saporin (SAP) | Advanced Targeting Systems | PR-01 | Utilized for intrapleural injection (control agent when injected by itself) |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | portable electrodiagnostic system | |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Sprague-Dawley rat | Envigo colony 208a, Indianapolis, IN | ||
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
References
- Mantilla, C. B., Zhan, W. -. Z., Sieck, G. C. Retrograde labeling of phrenic motoneurons by intrapleural injection. J Neurosci Methods. 182 (2), 244-249 (2009).
- Nichols, N. L., Satriotomo, I., Harrigan, D. J., Mitchell, G. S. Acute intermittent hypoxia induced phrenic long-term facilitation despite increased sod1 expression in a rat model of als. Exp Neurol. 273, 138-150 (2015).
- Nichols, N. L., Craig, T. A., Tanner, M. A. Phrenic long-term facilitation following intrapleural ctb-sap-induced respiratory motor neuron death. Respir Physiol Neurobiol. 256, 43-49 (2018).
- Kiernan, M. C., et al. Amyotrophic lateral sclerosis. Lancet. 377 (9769), 942-955 (2011).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant sod1g93a model of amyotrophic lateral sclerosis. Muscle Nerve. 41 (6), 774-784 (2010).
- Shibuya, K., et al. Motor cortical function determines prognosis in sporadic als. Neurology. 87 (5), 513-520 (2016).
- Lewelt, A., et al. Compound muscle action potential and motor function in children with spinal muscular atrophy. Muscle Nerve. 42 (5), 703-708 (2010).
- Mcgovern, V. L., et al. Smn expression is required in motor neurons to rescue electrophysiological deficits in the smnδ7 mouse model of sma. Hum Mol Genet. 24 (19), 5524-5541 (2015).
- Arnold, W. D., et al. Electrophysiological biomarkers in spinal muscular atrophy: Preclinical proof of concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
- Harrigan, M. E., et al. Assessing rat forelimb and hindlimb motor unit connectivity as objective and robust biomarkers of spinal motor neuron function. Sci Rep. 9 (1), 16699 (2019).
- Arnold, W. D., et al. Electrophysiological motor unit number estimation (mune) measuring compound muscle action potential (cmap) in mouse hindlimb muscles. J. Vis. Exp: JoVE. (103), e52899 (2015).
- Martin, M., Li, K., Wright, M. C., Lepore, A. C. Functional and morphological assessment of diaphragm innervation by phrenic motor neurons. J. Vis. Exp: JoVE. (99), e52605 (2015).
- Mccomas, A., Fawcett, P. R. W., Campbell, M., Sica, R. Electrophysiological estimation of the number of motor units within a human muscle. J Neurol Neurosurg Psychiatry. 34 (2), 121-131 (1971).
- Felice, K. J. A longitudinal study comparing thenar motor unit number estimates to other quantitative tests in patients with amyotrophic lateral sclerosis. Muscle Nerve. 20 (2), 179-185 (1997).
- Vucic, S., Rutkove, S. B. Neurophysiological biomarkers in amyotrophic lateral sclerosis. Curr Opin Neurol. 31 (5), 640-647 (2018).
- Carleton, S., Brown, W. Changes in motor unit populations in motor neurone disease. J Neurol Neurosurg Psychiatry. 42 (1), 42-51 (1979).
- Yuen, E. C., Olney, R. K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis. Neurology. 49 (2), 573-578 (1997).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Henderson, R. D., Ridall, P. G., Hutchinson, N. M., Pettitt, A. N., Mccombe, P. A. Bayesian statistical mune method. Muscle Nerve. 36 (2), 206-213 (2007).
- Shefner, J., et al. Multipoint incremental motor unit number estimation as an outcome measure in als. Neurology. 77 (3), 235-241 (2011).
- Stein, R. B., Yang, J. F. Methods for estimating the number of motor units in human muscles. Ann Neurol. 28 (4), 487-495 (1990).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clin Neurophysiol. 112 (6), 955-964 (2001).
- Ahad, M., Rutkove, S. Correlation between muscle electrical impedance data and standard neurophysiologic parameters after experimental neurogenic injury. Physiol Meas. 31 (11), 1437 (2010).
- Kasselman, L. J., Shefner, J. M., Rutkove, S. B. Motor unit number estimation in the rat tail using a modified multipoint stimulation technique. Muscle Nerve. 40 (1), 115-121 (2009).
- Ngo, S., et al. The relationship between bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and sod1g93a mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Feasby, T., Brown, W. Variation of motor unit size in the human extensor digitorum brevis and thenar muscles. J Neurol Neurosurg Psychiatry. 37 (8), 916-926 (1974).
- Nichols, N. L., Vinit, S., Bauernschmidt, L., Mitchell, G. S. Respiratory function after selective respiratory motor neuron death from intrapleural ctb-saporin injections. Exp Neurol. 267, 18-29 (2015).
- Nichols, N. L., et al. Ventilatory control in als. Respir Physiol Neurobiol. 189 (2), 429-437 (2013).
- Cifra, A., Nani, F., Nistri, A. Respiratory motoneurons and pathological conditions: Lessons from hypoglossal motoneurons challenged by excitotoxic or oxidative stress. Respir Physiol Neurobiol. 179 (1), 89-96 (2011).
- Kobayashi, Z., et al. Fals with gly72ser mutation in sod1 gene: Report of a family including the first autopsy case. J Neurol Sci. 300 (1), 9-13 (2011).
- Su, M., Wakabayashi, K., Tanno, Y., Inuzuka, T., Takahashi, H. An autopsy case of amyotrophic lateral sclerosis with concomitant alzheimer's and incidental lewy body diseases. No to shinkei= Brain and nerve. 48 (10), 931-936 (1996).
- Lladó, J., et al. Degeneration of respiratory motor neurons in the sod1 g93a transgenic rat model of als. Neurobiol Dis. 21 (1), 110-118 (2006).
- Borkowski, L. F., Smith, C. L., Keilholz, A. N., Nichols, N. L. Divergent receptor utilization is necessary for phrenic long-term facilitation over the course of motor neuron loss following ctb-sap intrapleural injections. J Neurophysiol. 126 (3), 709-722 (2021).
- Nicolopoulos-Stournaras, S., Iles, J. F. Motor neuron columns in the lumbar spinal cord of the rat. J Comp Neurol. 217 (1), 75-85 (1983).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: An approach to maximize uptake and transduction of spinal cord motor neurons. Sci Rep. 6 (1), 33058 (2016).
- Mchanwell, S., Biscoe, T. The localization of motoneurons supplying the hindlimb muscles of the mouse. Phil. Trans. R. , 477-508 (1981).
- Nair, J., et al. Histological identification of phrenic afferent projections to the spinal cord. Respir Physiol Neurobiol. 236, 57-68 (2017).
- Courtine, G., et al. Can experiments in nonhuman primates expedite the translation of treatments for spinal cord injury in humans. Nat Med. 13 (5), 561-566 (2007).
- Friedli, L., et al. Pronounced species divergence in corticospinal tract reorganization and functional recovery after lateralized spinal cord injury favors primates. Sci Transl Med. 7 (302), 134 (2015).
- Arnold, R., et al. Nerve excitability in the rat forelimb: A technique to improve translational utility. J Neurosci Methods. 275, 19-24 (2017).
- Boriek, A., Rodarte, J., Reid, M. Shape and tension distribution of the passive rat diaphragm. Am J Physiol Regul Integr Comp Physiol. 280, R33-R41 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved