A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת תוצאות הקישוריות של יחידת הקישוריות המוטורית של דיאפרגמה חולדה מודדת כסמנים ביולוגיים כמותיים של ניוון ופיצוי של נוירונים מוטוריים פרניים
* These authors contributed equally
In This Article
Summary
במחקר זה אנו מציגים שיטת in vivo להערכת מספר היחידה המוטורית וגודלה כדי לכמת את קישוריות היחידה המוטורית של דיאפרגמה חולדה. מתוארת גישה שלב אחר שלב לטכניקות אלה.
Abstract
אובדן תפקוד שרירי ההנשמה הוא תוצאה של פגיעה בנוירונים מוטוריים וניוון עצבי (למשל, פגיעה בעמוד השדרה הצווארי וטרשת אמיוטרופית צידית, בהתאמה). נוירונים מוטוריים פרניים הם החוליה המקשרת הסופית בין מערכת העצבים המרכזית לשריר, והיחידות המוטוריות שלהם בהתאמה (קבוצות של סיבי שריר המעצבבים על ידי נוירון מוטורי יחיד) מייצגות את היחידה התפקודית הקטנה ביותר של מערכת האוורור העצבית-שרירית. פוטנציאל פעולת שרירים מורכבים (CMAP), פוטנציאל יחידה מוטורית יחידה (SMUP) והערכת מספר יחידה מוטורית (MUNE) הן גישות אלקטרופיזיולוגיות מבוססות המאפשרות הערכה אורכית של שלמות היחידה המוטורית במודלים של בעלי חיים לאורך זמן, אך יושמו בעיקר על שרירי הגפיים. לכן, מטרות מחקר זה הן לתאר גישה במחקרי מכרסמים פרה-קליניים שניתן להשתמש בה לאורך זמן כדי לכמת את MUNE הפרני, גודל היחידה המוטורית (המיוצגת כ-SMUP) ו-CMAP, ולאחר מכן להדגים את התועלת של גישות אלה במודל אובדן נוירונים מוטוריים. סמנים ביולוגיים רגישים, אובייקטיביים ורלוונטיים מבחינה תרגומית לפגיעה עצבית, ניוון והתחדשות בפגיעות ומחלות של נוירונים מוטוריים יכולים לסייע באופן משמעותי ולהאיץ תגליות מחקריות ניסיוניות לבדיקות קליניות.
Introduction
נוירונים מוטוריים פרניים (MNs), המשתרעים מרמות C3 עד C6 מיוטומיים, יוצרים את הקישור הסופי ממערכת העצבים המרכזית (CNS) לשריר הסרעפת1. יחידות מוטוריות פרניות (MUs) מורכבות מ- MN יחיד בעמוד השדרה וסיבי שריר הסרעפת העצביים שלו יוצרים את היחידה התפקודית הקטנה ביותר של המערכת העצבית-שרירית הנשימתית. תפקוד האוורור דורש כיווץ נאות של שריר הסרעפת המושג באמצעות הפעלה מתואמת של בריכת MU פרנית 2,3. מחלות נוירולוגיות רבות, כולל טרשת אמיוטרופית צידית (ALS), גורמות לפגיעה חמורה בהנשמה, ובסופו של דבר תורמות לסיבת המוות4.
ניתן להשתמש במספר גישות אלקטרופיזיולוגיות כדי להעריך ולנטר את שלמות מאגר היחידה המוטורית (MU) in vivo. פוטנציאל פעולת שריר מורכב (CMAP) משקף את הדפולריזציה המסוכמת של כל סיבי השריר בשריר מסוים או בקבוצת שרירים מסוימת לאחר גירוי עצבי היקפי והוא רגיש למגוון מצבים עצביים-שריריים, כולל ALS 5,6 וניוון שרירים בעמוד השדרה (SMA)7,8,9. מגבלה של הערכת CMAP היא שהנבטה בטחונית יכולה להוביל לשמירה על משרעת CMAP ושטח גם בנוכחות אובדן MU10. כדי להתגבר על מגבלה זו, נעשו שינויים בטכניקת CMAP כדי להעריך הן את מספר היחידה המוטורית והן את גודל11. בנוסף, מחקר in vivo שחקר את ההערכה התפקודית של CMAP בסרעפת על ידי מערכת אלקטרופיזיולוגית הציע כי ייתכן שיהיה אפשרי גם להשתמש בטכניקת ההקלטה CMAP של הסרעפת המתוארת להערכת מספר יחידה מוטורית12.
טכניקת הערכת מספר היחידה המוטורית המצטברת (MUNE) הוצגה לראשונה בתחילת שנות השבעים על ידי McComas et al. עבור שריר extensor digitorum brevis בבני אדם13. גישת MUNE המצטברת הייתה שינוי של טכניקת ההקלטה המסורתית CMAP, שבמהלכה הועבר גירוי הולך וגובר כדי להקליט הפרשים תת-מקסימליים קוונטיים, הכל או אף אחד כמדדים של תגובות יחידה מוטורית יחידה. ההפרשים המסוכמים והממוצעים שימשו לחישוב אומדן לגודל פוטנציאל יחידת מנוע יחידה (SMUP). גודל מחושב זה חולק לאחר מכן למשרעת CMAP כדי להעריך את מספר MUs המעצבבים את השריר הנבדק11. MUNE מדגים רגישות גבוהה באיתור וניטור אובדן יחידות מוטוריות, ומאפשר זיהוי של תפקוד לקוי של היחידה המוטורית לפני שינויים נצפים במדדים כגון משרעת CMAP או שטח14,15. בחולי ALS, MUNE הוכח כרגיש במיוחד, ומשמש סמן ביולוגי בולט להופעת המחלה, התקדמות ופרוגנוזה16,17.
התאמות רבות של MUNE פותחו ונעשה בהן שימוש נרחב כדי להעריך את תפקוד MU במצבים כגון ניוון עצבי, פגיעה עצבית ותהליך ההזדקנות הטבעי 18,19,20,21. מאז התיאור הראשוני, התאמות שונות המשתמשות הן בתגובות אלקטרופיזיולוגיות והן במדידות כוח מצטבר (מכני) שימשו הן במחקרים בבני אדם והן במודלים של בעלי חיים22. MUNE מספק הערכה תפקודית לא פולשנית של קישוריות נוירון מוטורי עם השריר. יישום אורכי של MUNE מאפשר הבנה של התקדמות המחלה או הפנוטיפ המושרה והערכת ההשפעות המגינות או המתחדשות של התערבויות טיפוליות, הן במסגרות קליניות והן במסגרות פרה-קליניות. ללא קשר ליעילות של MUNE מודד את יכולת השחזור ואת הרלוונטיות הקלינית של הטכניקה עבור בריכות MU בכל הגוף האנושי, המאמצים התמקדו בעיקר בשרירי הגפיים בשרירי מכרסמים 10,23,24,25.
לכן, מטרות מחקר זה היו לתאר גישה להשגת פוטנציאל פעולה מורכב של שרירים (CMAP), SMUP ומספר יחידה מוטורית פרנית (MUNE) כהערכות in vivo שניתן להשתמש בהן לאורך זמן במחקרי מכרסמים פרה-קליניים כדי לכמת את MUNE, גודל היחידה המוטורית (המיוצגת כ-SMUP) ו-CMAP. יתר על כן, אנו מציגים נתונים מייצגים המדגישים את אובדן מספר MU של הסרעפת בעקבות מתן intrapleural של סוכן ניווני MN פרני, רעלן כולרה B מקטע מצומד לספורין (CTB-SAP).
Protocol
כל הנהלים אושרו ונערכו בהתאם להנחיות שנקבעו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מיזורי. ניסויים בוצעו על חולדות Sprague-Dawley זכרים בוגרים, בגילאי 11 עד 15 שבועות. חולדות אלה שוכנו בזוגות והוחזקו תחת מחזור בהיר-חושך ביחס של 12:12, עם גישה למזון מסחרי סטנדרטי ומים שטופלו ב-HCl זמינים בכל עת.
1. הכנת בעלי חיים והרדמה
- יש ללבוש ציוד הגנה אישי מתאים בעת הטיפול בחולדות.
- מתן הרדמה אינהלציה עם 3-5% איזופלורן, הבטחת אינדוקציה נכונה. לאחר שהחולדה מורדמת כראוי, הניחו אותה במצב שכיבה ושמרו על ההרדמה עם איזופלורן בשאיפה של 1-3%. בדוק את עומק ההרדמה על ידי הפעלת לחץ עדין על כרית כף הרגל האחורית באמצעות מלקחיים כדי לוודא שאין תגובת נסיגה.
הערה: בהתבסס על גודלה ומשקלה של החולדה, יש לעקוב אחר עומק ההרדמה ולהתאים את ריכוז האיזופלורן בהתאם. - שמור על טמפרטורה של 37 ° C באמצעות לוח התחממות תרמוסטטי כדי למנוע שינויים בטמפרטורה שיכולים להשפיע על משרעת CMAP והשהיה.
- יש למרוח משחה וטרינרית על בסיס נפט על העיניים למניעת יובש. עקוב אחר עומק ההרדמה על ידי התבוננות בקצב הנשימה ובדיקת תגובות נסיגה בעת הפעלת לחץ על כרית כף הרגל עם מלקחיים.
- הסר שיער מהשליש התחתון של החזה והצוואר כדי להיחקר באמצעות קוצץ. עקוב אחר נשימת החולדה במהלך כל הניסוי.
הערה: לאחר רישומי CMAP ו-MUNE והפסקת ההרדמה, אין להשאיר את החולדה ללא השגחה עד שהיא חזרה להכרה מספקת. אין להחזיר את בעל החיים לכלוב הביתי עד להחלמה מלאה.
2. מיקום אלקטרודות והגדרתן
- הניחו זוג אלקטרודות מחט מונופולריות של 28 G כדי להקליט את CMAP, SMUP ו-MUNE כפי שמתואר באיור 1.
- מניחים את אלקטרודת המחט הפעילה (E1) תת עורית מעל הקו הקלאוויקולרי האמצעי נחות מגבול הצלע האחרון, ואת אלקטרודת מחט הייחוס (E2) תת עורית בזווית שבין תהליך הקסיפואיד לסחוס הסטרנוקוסטלי האחרון.
הערה: אין להחדיר את אלקטרודות המחט לשריר הסרעפת; במקום זאת, הם צריכים להיות ממוקמים באזור תת עורי.
- מניחים את אלקטרודת המחט הפעילה (E1) תת עורית מעל הקו הקלאוויקולרי האמצעי נחות מגבול הצלע האחרון, ואת אלקטרודת מחט הייחוס (E2) תת עורית בזווית שבין תהליך הקסיפואיד לסחוס הסטרנוקוסטלי האחרון.
- לגירוי העצב הפרני ביריעת התרדמה, השתמש בזוג אלקטרודות מחט מונופולר 28 G כקתודה ואנודה לגירוי עצבי והניח תת עורית על הצוואר הצידי בין שרירי הקשקשים הקדמיים והאמצעיים, מופרדים בכ -1 ס"מ. ודא שמיקום המחטים המעוררות הוא ברמה מתחת לחוליות הצוואר הרביעית (C4).
הערה: הימנע מהחדרת האלקטרודות המעוררות עמוק מדי כדי למנוע פגיעה בעצב הפרני או במבנה אחר. איור 1 מדגים את מיקום האלקטרודות. - עבור אלקטרודת הקרקע, הניחו אלקטרודת משטח חד פעמית על הזנב.
3. רכישת נתונים
- Phrenic CMAP
- הקלט תגובות CMAP פרניות על ידי הפעלת פולסים מונופאזיים של גל מרובע קתודי עם משך של 0.1 אלפיות השנייה ועוצמה הנעה בין 60 ל -100 mA כדי לעורר את העצב הפרני.
- קבל תגובות CMAP תוך הגדלה הדרגתית של עוצמת הגירוי עד שהמשרעת של התגובה מפסיקה להראות עלייה נוספת. כדי להבטיח גירוי על-מקסימלי, יש להעלות את עוצמת הגירוי לכ-120% מהרמה המשמשת ליצירת תגובה מרבית, ולתעד תגובה נוספת. אם גודל CMAP אינו גדל עוד, שקול תגובה זו כ- CMAP המרבי.
הערה: מתן גירוי במהלך נשיפה עדיף כדי למזער רעשי פעילות שרירים בו זמנית במהלך הקלטת CMAP. - מדדו ותעדו את המשרעת משיא לשיא של CMAP במיליוולטים (mV) (איור 2).
הערה: ניתן להעריך את משרעת CMAP מבסיס לשיא ומשיא לשיא. מערכות אלקטרודיאגנוסטיות קליניות הן לעתים קרובות ברירת מחדל להעריך בסיס לשיא אשר מחושב מקו הבסיס האיזואלקטרי לשיא השלילי הראשוני.
- גודל ממוצע של יחידת מנוע בודדת (SMUP) וחישוב MUNE
- חשב את גודל SMUP הממוצע באמצעות טכניקת גירוי מצטבר.
- כדי לעורר תגובות מצטברות, יש לתת גירוי תת-מקסימלי עם משך זמן של 0.1 מילישניות בתדר 1 הרץ, ולהגדיל בהדרגה את העוצמה במרווחים של 0.03 mA עד להשגת תגובה מינימלית של הכל או אף אחד. לרכוש את התגובה הראשונית עם עוצמת גירוי הנע בין 2 mA ו 10 mA.
- אם התגובה הראשונית אינה מתרחשת בעוצמת גירוי בין 2 mA ל -10 mA, שנה את המיקום של הקתודה המעוררת, או לקרב אותה או להרחיק אותה מהעצב הפרני בצוואר, כדי להקטין או להגדיל את עוצמת הגירוי הדרושה, בהתאמה.
- אם התגובה המצטברת הראשונה מושגת בעוצמת גירוי הנעה בין 2 mA ל- 10 mA, שמור את התגובה הראשונה ורכוש מרווחים נוספים עם עוצמות גירוי גבוהות יותר ויותר, תוך התאמה במרווחים של 0.03 mA, כדי להשיג סך של 9 תוספות נוספות העונות על הקריטריונים הבאים בשלב 3.2.2.
הערה: כל SMUP מכומת על-ידי חיסור כל הפרש קבוע מההפרש הקודם.
- בעת מדידת התגובות המצטברות, ודא שכל תוספת עומדת בקריטריונים הבאים:
- ודא שהשיא השלילי הראשוני של התגובות המצטברות מיושר באופן זמני עם השיא השלילי של תגובת CMAP המקסימלית.
הערה: התנועות הקלות שנצפו עקב רעשי רקע ממחזורי נשימה טבועות באופי הניסוי. עם זאת, הנוכחות העקבית של SMUPs במהלך תצפית חיה מאשרת את זהותם עבור CMAP ספציפי זה. - מכיוון שהסרעפת היא שריר דינמי המעורב בנשימה, כל מחזור נשימה עשוי לגרום לתנועה בסיסית. לכן, ודא את היציבות והיעדר השבר בכל תגובה מצטברת על ידי אישור עקביות על פני שלוש תגובות כפולות.
הערה: כדי להבחין בין פוטנציאלים מעוררי אמפליטודה נמוכה, במיוחד SMUP הראשון, לבין רעשי רקע כתוצאה מפעילות נשימתית, חשוב להישאר ערניים ולהתבונן במשך 3-4 מחזורי נשימה. כמו כן, ודא את יישור הפסגות עם אלה של CMAP לדיוק. - ודא שכל הפרש נפרד וגדול יותר מההפרש הקודם. לכן, להבחין חזותית בין תגובות מצטברות בזמן אמת, התבוננות בהם כפי שהם כיסוי על הפרשים שנרשמו בעבר.
הערה: ניתן לבצע העתקים מרובים של הגירוי בכל משרעת כדי להבטיח עקביות במרווחים ועמידה בקריטריונים שהוגדרו מראש. - לאחר אימות חזותי של כל תוספת עם הקריטריונים הנ"ל, ודא כי משרעת ההפרש היא לפחות 25 μV. אם התוספת נמוכה מ-25 μV, מחק את המדידה והערך מחדש את התגובה.
- לאחר רישום של 10 תגובות מצטברות, ודא שהמשרעת של כל תגובת תוספת אינה גדולה משליש מהמשרעת המשולבת של כל 10 ההפרשים, המייצגת את המשרעת הכוללת של התגובה הסופית. אם קריטריון זה אינו מתקיים, חזור על מדידת 10 התגובות המצטברות.
הערה: הסף של שליש מבוסס על ההנחה שכל תגובה מצטברת מייצגת הפעלה של יחידה מוטורית אחת. אם המשרעת של תגובה מצטברת כלשהי עולה על שליש מהמשרעת המשולבת של כל עשר ההפרשים, הדבר מצביע על כך שלא ניתן לייחס את התגובה אך ורק להפעלה של יחידה מוטורית יחידה. במקום זאת, זה יכול להיות מושפע על ידי גיוס של יחידות מוטוריות נוספות או נוכחות של פעילות לא ספציפית, כגון רעש חשמלי או חפצים22,26. - כדי להעריך את המשרעת הממוצעת של SMUPs, ממוצע את הערכים של 10 הפרשים. שיטה נוספת למדידת משרעת SMUP ממוצעת היא לחלק את כל המשרעת של התגובה המצטברת הסופית במספר הכולל של הפרשים11.
- ודא שהשיא השלילי הראשוני של התגובות המצטברות מיושר באופן זמני עם השיא השלילי של תגובת CMAP המקסימלית.
- קבע MUNE על ידי חלוקת משרעת CMAP המרבית (שיא לשיא) באמפליטודת SMUP ממוצעת (שיא לשיא). במערכות אלקטרופיזיולוגיות מסוימות, SMUPs נרשמים במיקרו-וולטים (μV), בעוד CMAP מבוטא בדרך כלל במיליוולטים (mV). במידת הצורך, המר מדידות CMAP ו- SMUP לאותן יחידות לפני חישוב MUNE.
הערה: CMAP משיא לשיא, SMUP ממוצע ו- MUNE מחושבים בדרך כלל באופן אוטומטי על-ידי מערכות אלקטרומיוגרפיה במרפאה):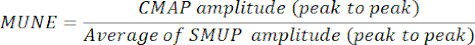
CMAP = פוטנציאל פעולה מורכב של שרירים
SMUP = פוטנציאל יחידה מוטורית יחידה יחידה
MUNE = הערכת מספר יחידת מנוע
- חשב את גודל SMUP הממוצע באמצעות טכניקת גירוי מצטבר.
תוצאות
טכניקות CMAP, SMUP ו-MUNE המתוארות בדו"ח זה מאפשרות רישום של תפקוד עצבי-שרירי בשריר הסרעפת תוך שימוש במיקום אלקטרודות זעיר פולשני (איור 1). ניתן להשתמש בפרמטרים של משרעת ושטח כדי לאפיין את גודל CMAP העל-מקסימלי, ולספק מדד כולל של תפוקת קבוצת השרירים (איו?...
Discussion
במחלות ניווניות של MN, כגון ALS, חיוני להעריך את MUs המעורבים בהנשמה28. למרות התרחשות של ניוון MN נשימתי בחולי ALS, ההתחלה וההתקדמות הספציפיות של מוות MN עדיין לא מובנות לחלוטין 29,30,31. מתוך הכרה בחשיבותו של היבט זה, מו...
Disclosures
WDA קיבלה מימון מחקר מ-NMD Pharma, Avidity Biosciences ודמי ייעוץ מ-NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics, Catalyst Pharmaceuticals ו-Novartis.
Acknowledgements
עבודה זו מומנה על ידי מענק של תוכנית המחקר לפגיעות בחוט השדרה / מחלות מיזורי (NLN ו- WDA).
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| 50 mL, Model 705 RN syringe | Hamilton Company | 7637-01 | Utilized to conduct intrapleural injection |
| 5008 - Formulab Diet | LabDiet | 0001325 | |
| Autoclavable 26 G needles (26S RN 9.52 mm 40°) | Hamilton Company | 7804-04 | Utilized to conduct intrapleural injection |
| Cholera toxin B-subunit (CTB) | MilliporeSigma | C9903 | Utilized for intrapleural injection to label surviving motor neurons |
| Cholera toxin B-subunit conjugated to saporin (CTB-SAP) | Advanced Targeting Systems | IT-14 | Utilized for intrapleural injection to cause motor neuron death |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes- recording electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | ||
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Saporin (SAP) | Advanced Targeting Systems | PR-01 | Utilized for intrapleural injection (control agent when injected by itself) |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | portable electrodiagnostic system | |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Sprague-Dawley rat | Envigo colony 208a, Indianapolis, IN | ||
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
References
- Mantilla, C. B., Zhan, W. -. Z., Sieck, G. C. Retrograde labeling of phrenic motoneurons by intrapleural injection. J Neurosci Methods. 182 (2), 244-249 (2009).
- Nichols, N. L., Satriotomo, I., Harrigan, D. J., Mitchell, G. S. Acute intermittent hypoxia induced phrenic long-term facilitation despite increased sod1 expression in a rat model of als. Exp Neurol. 273, 138-150 (2015).
- Nichols, N. L., Craig, T. A., Tanner, M. A. Phrenic long-term facilitation following intrapleural ctb-sap-induced respiratory motor neuron death. Respir Physiol Neurobiol. 256, 43-49 (2018).
- Kiernan, M. C., et al. Amyotrophic lateral sclerosis. Lancet. 377 (9769), 942-955 (2011).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant sod1g93a model of amyotrophic lateral sclerosis. Muscle Nerve. 41 (6), 774-784 (2010).
- Shibuya, K., et al. Motor cortical function determines prognosis in sporadic als. Neurology. 87 (5), 513-520 (2016).
- Lewelt, A., et al. Compound muscle action potential and motor function in children with spinal muscular atrophy. Muscle Nerve. 42 (5), 703-708 (2010).
- Mcgovern, V. L., et al. Smn expression is required in motor neurons to rescue electrophysiological deficits in the smnδ7 mouse model of sma. Hum Mol Genet. 24 (19), 5524-5541 (2015).
- Arnold, W. D., et al. Electrophysiological biomarkers in spinal muscular atrophy: Preclinical proof of concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
- Harrigan, M. E., et al. Assessing rat forelimb and hindlimb motor unit connectivity as objective and robust biomarkers of spinal motor neuron function. Sci Rep. 9 (1), 16699 (2019).
- Arnold, W. D., et al. Electrophysiological motor unit number estimation (mune) measuring compound muscle action potential (cmap) in mouse hindlimb muscles. J. Vis. Exp: JoVE. (103), e52899 (2015).
- Martin, M., Li, K., Wright, M. C., Lepore, A. C. Functional and morphological assessment of diaphragm innervation by phrenic motor neurons. J. Vis. Exp: JoVE. (99), e52605 (2015).
- Mccomas, A., Fawcett, P. R. W., Campbell, M., Sica, R. Electrophysiological estimation of the number of motor units within a human muscle. J Neurol Neurosurg Psychiatry. 34 (2), 121-131 (1971).
- Felice, K. J. A longitudinal study comparing thenar motor unit number estimates to other quantitative tests in patients with amyotrophic lateral sclerosis. Muscle Nerve. 20 (2), 179-185 (1997).
- Vucic, S., Rutkove, S. B. Neurophysiological biomarkers in amyotrophic lateral sclerosis. Curr Opin Neurol. 31 (5), 640-647 (2018).
- Carleton, S., Brown, W. Changes in motor unit populations in motor neurone disease. J Neurol Neurosurg Psychiatry. 42 (1), 42-51 (1979).
- Yuen, E. C., Olney, R. K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis. Neurology. 49 (2), 573-578 (1997).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Henderson, R. D., Ridall, P. G., Hutchinson, N. M., Pettitt, A. N., Mccombe, P. A. Bayesian statistical mune method. Muscle Nerve. 36 (2), 206-213 (2007).
- Shefner, J., et al. Multipoint incremental motor unit number estimation as an outcome measure in als. Neurology. 77 (3), 235-241 (2011).
- Stein, R. B., Yang, J. F. Methods for estimating the number of motor units in human muscles. Ann Neurol. 28 (4), 487-495 (1990).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clin Neurophysiol. 112 (6), 955-964 (2001).
- Ahad, M., Rutkove, S. Correlation between muscle electrical impedance data and standard neurophysiologic parameters after experimental neurogenic injury. Physiol Meas. 31 (11), 1437 (2010).
- Kasselman, L. J., Shefner, J. M., Rutkove, S. B. Motor unit number estimation in the rat tail using a modified multipoint stimulation technique. Muscle Nerve. 40 (1), 115-121 (2009).
- Ngo, S., et al. The relationship between bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and sod1g93a mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Feasby, T., Brown, W. Variation of motor unit size in the human extensor digitorum brevis and thenar muscles. J Neurol Neurosurg Psychiatry. 37 (8), 916-926 (1974).
- Nichols, N. L., Vinit, S., Bauernschmidt, L., Mitchell, G. S. Respiratory function after selective respiratory motor neuron death from intrapleural ctb-saporin injections. Exp Neurol. 267, 18-29 (2015).
- Nichols, N. L., et al. Ventilatory control in als. Respir Physiol Neurobiol. 189 (2), 429-437 (2013).
- Cifra, A., Nani, F., Nistri, A. Respiratory motoneurons and pathological conditions: Lessons from hypoglossal motoneurons challenged by excitotoxic or oxidative stress. Respir Physiol Neurobiol. 179 (1), 89-96 (2011).
- Kobayashi, Z., et al. Fals with gly72ser mutation in sod1 gene: Report of a family including the first autopsy case. J Neurol Sci. 300 (1), 9-13 (2011).
- Su, M., Wakabayashi, K., Tanno, Y., Inuzuka, T., Takahashi, H. An autopsy case of amyotrophic lateral sclerosis with concomitant alzheimer's and incidental lewy body diseases. No to shinkei= Brain and nerve. 48 (10), 931-936 (1996).
- Lladó, J., et al. Degeneration of respiratory motor neurons in the sod1 g93a transgenic rat model of als. Neurobiol Dis. 21 (1), 110-118 (2006).
- Borkowski, L. F., Smith, C. L., Keilholz, A. N., Nichols, N. L. Divergent receptor utilization is necessary for phrenic long-term facilitation over the course of motor neuron loss following ctb-sap intrapleural injections. J Neurophysiol. 126 (3), 709-722 (2021).
- Nicolopoulos-Stournaras, S., Iles, J. F. Motor neuron columns in the lumbar spinal cord of the rat. J Comp Neurol. 217 (1), 75-85 (1983).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: An approach to maximize uptake and transduction of spinal cord motor neurons. Sci Rep. 6 (1), 33058 (2016).
- Mchanwell, S., Biscoe, T. The localization of motoneurons supplying the hindlimb muscles of the mouse. Phil. Trans. R. , 477-508 (1981).
- Nair, J., et al. Histological identification of phrenic afferent projections to the spinal cord. Respir Physiol Neurobiol. 236, 57-68 (2017).
- Courtine, G., et al. Can experiments in nonhuman primates expedite the translation of treatments for spinal cord injury in humans. Nat Med. 13 (5), 561-566 (2007).
- Friedli, L., et al. Pronounced species divergence in corticospinal tract reorganization and functional recovery after lateralized spinal cord injury favors primates. Sci Transl Med. 7 (302), 134 (2015).
- Arnold, R., et al. Nerve excitability in the rat forelimb: A technique to improve translational utility. J Neurosci Methods. 275, 19-24 (2017).
- Boriek, A., Rodarte, J., Reid, M. Shape and tension distribution of the passive rat diaphragm. Am J Physiol Regul Integr Comp Physiol. 280, R33-R41 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved