JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Assessing Rat Diaphragm Motor Unit Connectivity Outcome Measures: as Quantitative Biomarkers of Phrenic Motor Neuron Degeneration and Compensation(쥐 다이어프램 운동 단위 연결성 결과 측정, 골격막 운동 뉴런 퇴행 및 보상의 정량적 바이오마커로서의 측정)
* 이 저자들은 동등하게 기여했습니다
요약
본 연구에서는 랫트 다이어프램 모터 유닛 연결성을 정량화하기 위해 모터 유닛 수와 크기를 추정하는 in vivo 방법을 제시합니다. 이러한 기술에 대한 단계별 접근 방식에 대해 설명합니다.
초록
인공호흡근 기능의 상실은 운동 뉴런 손상 및 신경 퇴행(예: 각각 경추 척수 손상 및 근위축성 측삭 경화증)의 결과입니다. 횡격막 운동 뉴런은 중추 신경계와 근육 사이의 최종 연결 고리이며, 각각의 운동 단위(단일 운동 뉴런에 의해 신경이 분포된 근육 섬유 그룹)는 신경근 환기 시스템의 가장 작은 기능 단위를 나타냅니다. 복합 근육 활동 전위(CMAP), 단일 운동 단위 전위(SMUP) 및 운동 단위 수 추정(MUNE)은 시간이 지남에 따라 동물 모델에서 운동 단위 무결성을 종단적으로 평가할 수 있도록 확립된 전기생리학적 접근 방식이지만 대부분 사지 근육에 적용되었습니다. 따라서 이 연구의 목적은 횡격상 MUNE, 모터 단위 크기(SMUP로 표시) 및 CMAP를 종단적으로 정량화하는 데 사용할 수 있는 전임상 설치류 연구의 접근 방식을 설명한 다음 운동 뉴런 손실 모델에서 이러한 접근 방식의 유용성을 입증하는 것입니다. 운동 뉴런 손상 및 질병의 신경 손상, 퇴행 및 재생에 대한 민감하고 객관적이며 번역 관련성이 높은 바이오마커는 실험 연구 발견을 임상 테스트에 크게 지원하고 가속화할 수 있습니다.
서문
횡격막 운동 뉴런(Phrenic motor neuron, MN)은 C3에서 C6 근육 수준까지 확장되며, 중추신경계(CNS)에서 횡격막근(diaphragm muscle)1까지의 최종 연결을 형성한다. 횡격막 운동 단위(MU)는 단일 척추 MN과 신경 분포된 횡격막 근육 섬유로 구성되어 호흡 신경근계의 가장 작은 기능 단위를 형성합니다. 환기 기능은 횡격막 MU 풀 2,3의 협응 활성화를 통해 달성되는 횡격막 근육의 적절한 수축을 필요로 합니다. 근위축성 측삭 경화증(ALS)을 포함한 많은 신경계 질환은 심각한 환기 장애를 초래하며, 궁극적으로 사망 원인에 기여한다4.
생체 내 운동 단위(MU) 풀의 무결성을 평가하고 모니터링하기 위해 여러 전기생리학적 접근 방식을 사용할 수 있습니다. 복합 근육 활동 전위(CMAP)는 말초 신경 자극 후 특정 근육 또는 근육 그룹의 모든 근육 섬유의 합산된 탈분극을 반영하며 ALS 5,6 및 척수성 근위축증(SMA)7,8,9을 포함한 다양한 신경근 상태에 민감합니다. CMAP 평가의 한계는 부수적 발아가 MU 손실10이 존재하는 경우에도 CMAP 진폭과 면적을 유지할 수 있다는 것이다. 이러한 제한을 극복하기 위해 모터 단위 번호와 크기11을 모두 평가하기 위해 CMAP 기술이 수정되었습니다. 또한, 전기생리학적 시스템에 의한 다이어프램 CMAP의 기능적 평가를 조사하는 생체 내 연구는 모터 단위 수 추정을 위해 설명된 다이어프램 CMAP 기록 기법을 활용하는 것이 또한 실현 가능할 수 있음을 시사했다12.
증분 운동 단위 수 추정(MUNE) 기법은 1970년대 초 McComas et al.에 의해 인간의 신전근 digitorum brevis 근육에 대해 처음 소개되었습니다13. 증분 MUNE 접근법은 단일 모터 단위 반응의 지표로 양적, 전부 또는 전혀 없는 준최대값 증분을 기록하기 위해 점진적으로 증가하는 자극이 전달되는 기존 CMAP 기록 기법을 수정한 것입니다. 합산된 증분과 평균화된 증분은 단일 모터 단위 전위(SMUP)의 크기에 대한 추정치를 계산하는 데 사용되었습니다. 이 계산된 크기는 그런 다음 검사11에서 근육을 자극하는 MU의 수를 추정하기 위해 CMAP 진폭으로 나누어졌다. MUNE는 모터 단위 손실을 감지하고 모니터링하는 데 있어 높은 감도를 보여주므로 CMAP 진폭 또는 영역14,15와 같은 측정에서 관찰 가능한 변화가 발생하기 전에 모터 단위 기능 장애를 식별할 수 있습니다. ALS 환자에서 MUNE는 질병 발병, 진행 및 예후에 대한 중요한 바이오마커 역할을 하는 매우 민감성이 입증되었습니다16,17.
MUNE의 수많은 적응이 개발되어 신경 퇴행, 신경 손상 및 자연적인 노화 과정과 같은 조건에서 MU 기능을 평가하는 데 널리 사용됩니다 18,19,20,21. 초기 설명 이후, 전기생리학적 반응과 증분력(기계적) 측정을 모두 활용하는 다양한 적응이 인간 연구와 동물 모델 모두에서 사용되어 왔다22. MUNE는 근육과 운동 뉴런 연결성에 대한 비침습적 기능 평가를 제공합니다. MUNE를 종단적으로 적용하면 임상 및 전임상 환경 모두에서 질병 또는 유도된 표현형 진행을 이해하고 치료 중재의 보호 또는 재생 효과를 평가할 수 있습니다. MUNE 측정의 효과, 재현성 및 대부분의 인체에 걸친 MU 풀에 대한 기술의 임상적 관련성에 관계없이, 노력은 주로 설치류 근육 10,23,24,25의 사지 근육에 집중되어 왔다.
따라서 본 연구의 목적은 전임상 설치류 연구에서 MUNE, 운동 단위 크기(SMUP로 표시) 및 CMAP를 정량화하기 위해 종단적으로 사용할 수 있는 생체 내 평가로 복합 근육 활동 전위(CMAP), SMUP 및 횡상막 운동 단위 수(MUNE)를 얻는 접근 방식을 설명하는 것이었습니다. 또한, 횡격막 MN 퇴행성 제제인 콜레라 독소 B 단편이 사포린에 접합된 것(CTB-SAP)의 흉막 내 투여 후 횡격막 MU 수의 손실을 강조하는 대표적인 데이터를 제시합니다.
프로토콜
모든 절차는 미주리 대학교의 기관 동물 보호 및 사용 위원회(Institutional Animal Care and Use Committee)에서 수립한 지침에 따라 승인되고 수행되었습니다. 실험은 11주에서 15주 사이의 성인 수컷 Sprague-Dawley 쥐를 대상으로 수행되었습니다. 이 쥐들은 쌍으로 수용되어 12:12 연암 주기에 따라 유지되었으며 표준 상업용 펠릿 식품과 HCl 처리된 물을 항상 이용할 수 있었습니다.
1. 동물 준비 및 마취 전달
- 쥐를 다루는 동안 적절한 개인 보호 장비를 착용하십시오.
- 3-5% 이소플루란으로 흡입 마취제를 투여하여 적절한 유도를 보장합니다. 쥐가 적절하게 마취되면 누운 자세로 놓고 1-3% 흡입 이소플루란으로 마취를 유지합니다. 집게를 사용하여 뒷다리 발패드에 부드럽게 압력을 가하여 금단 반응이 없는지 확인하여 마취 깊이가 충분한지 확인합니다.
알림: 쥐의 크기와 체중에 따라 마취 깊이를 모니터링하고 그에 따라 이소플루란 농도를 조정합니다. - 자동 온도 조절 가열판을 사용하여 37°C의 온도를 유지하여 CMAP 진폭 및 대기 시간에 영향을 줄 수 있는 온도 변화를 방지합니다.
- 동물용 석유 성분의 연고를 눈에 바르면 눈이 건조해지는 것을 방지할 수 있습니다. 호흡수를 관찰하고 집게로 발패드에 압력을 가할 때 철수 반응을 확인하여 마취 깊이를 모니터링합니다.
- 가위를 사용하여 연구할 가슴과 목의 아래쪽 3분의 1에서 머리카락을 제거합니다. 전체 실험 동안 쥐의 호흡을 모니터링합니다.
알림: CMAP 및 MUNE 녹음 및 마취 중단 후 쥐가 충분한 의식을 회복할 때까지 쥐를 방치하지 마십시오. 완전히 회복될 때까지 동물을 홈 케이지에 반환하지 마십시오.
2. 전극 배치 및 설정
- 그림 28과 같이 한 쌍의 단극 바늘 전극을 배치하여 CMAP, SMUP 및 MUNE를 기록합니다.
- 활성(E1) 바늘 전극을 마지막 늑골 경계선보다 아래쪽인 중간 쇄골선 위에 피하로 배치하고 기준(E2) 바늘 전극을 xyphoid process와 마지막 흉골 연골 사이의 각도로 피하로 배치합니다.
알림: 바늘 전극은 횡격막 근육에 삽입되어서는 안 됩니다. 대신, 그들은 피하 부위에 위치해야 합니다.
- 활성(E1) 바늘 전극을 마지막 늑골 경계선보다 아래쪽인 중간 쇄골선 위에 피하로 배치하고 기준(E2) 바늘 전극을 xyphoid process와 마지막 흉골 연골 사이의 각도로 피하로 배치합니다.
- 경동맥 시트에서 횡격막 신경을 자극하기 위해 한 쌍의 28G 단극 바늘 전극을 신경 자극을 위한 음극 및 양극으로 사용하고 약 1cm 떨어진 전방근과 중간 비늘근 사이의 외측 목에 피하로 배치합니다. 자극 바늘의 위치가 네 번째 경추(C4) 아래 높이에 있는지 확인하십시오.
알림: 횡격막 신경 또는 기타 구조의 손상을 방지하기 위해 자극 전극을 너무 깊게 삽입하지 마십시오. 그림 1 은 전극 배치를 보여줍니다. - 접지 전극의 경우 꼬리에 일회용 표면 전극을 놓습니다.
3. 데이터 수집
- 프레닉 CMAP
- 0.1ms의 지속 시간과 60에서 100mA 범위의 강도를 가진 단상 음극 구형파 펄스를 적용하여 횡격막 CMAP 반응을 기록하여 횡격막 CMAP 반응을 기록합니다.
- 반응의 진폭이 더 이상 증가를 보이지 않을 때까지 자극 강도를 점진적으로 증가시키면서 CMAP 반응을 얻습니다. 초최대대 자극을 보장하려면 자극 강도를 최대 반응을 이끌어내는 데 사용되는 수준의 약 120%로 높이고 추가 반응을 기록합니다. CMAP 크기가 더 이상 증가하지 않으면 이 응답을 최대 CMAP로 간주합니다.
알림: CMAP 기록 중 동시 근육 활동 소음을 최소화하려면 호기 중에 자극을 전달하는 것이 좋습니다. - CMAP의 피크 대 피크 진폭을 밀리볼트(mV) 단위로 측정하고 문서화합니다(그림 2).
참고: CMAP 진폭은 베이스-피크 및 피크-피크로 평가할 수 있습니다. 임상 전기 진단 시스템은 등전 기준선에서 초기 음의 피크까지 계산되는 베이스-피크를 평가하기 위해 기본적으로 설정되는 경우가 많습니다.
- 평균 단일 모터 단위 전위(SMUP) 크기 및 MUNE 계산
- 증분 자극 기법을 사용하여 평균 SMUP 크기를 계산합니다.
- 증분 반응을 이끌어내려면 1Hz 주파수에서 0.1ms 지속 시간으로 준최대값 자극을 투여하고 최소 전부 또는 전무 반응이 달성될 때까지 0.03mA 단위로 강도를 점진적으로 증가시킵니다. 2mA에서 10mA 사이의 자극 강도로 초기 반응을 얻습니다.
- 초기 반응이 2mA에서 10mA 사이의 자극 강도로 발생하지 않는 경우 자극 음극의 위치를 수정하여 목의 횡격막에서 더 가깝게 또는 더 멀리 이동하여 필요한 자극 강도를 각각 줄이거나 높입니다.
- 첫 번째 증분 응답이 2mA에서 10mA 범위의 자극 강도로 달성되는 경우 첫 번째 반응을 저장하고 점진적으로 더 높은 자극 강도로 추가 증분을 획득하여 0.03mA 단위로 조정하여 3.2.2단계에서 다음 기준을 충족하는 총 9개의 추가 증분을 달성합니다.
참고: 각 SMUP는 이전 증분에서 각 증분을 빼서 정량화됩니다.
- 증분 반응을 측정하는 동안 각 증분이 다음 기준을 충족하는지 확인하십시오.
- 증분 응답의 초기 음수 피크가 최대 CMAP 응답의 음수 피크와 시간적으로 일치하는지 확인합니다.
참고: 호흡 주기의 배경 소음으로 인해 관찰된 미세한 움직임은 실험의 특성에 내재되어 있습니다. 그러나 실시간 관찰 중에 SMUP가 일관되게 존재하면 특정 CMAP에 대한 SMUP의 신원을 확인할 수 있습니다. - 횡격막은 호흡에 관여하는 동적 근육이기 때문에 각 호흡 주기는 기본 움직임을 유도할 수 있습니다. 따라서 세 개의 중복 반응에서 일관성을 확인하여 각 증분 반응에서 분획의 안정성과 부재를 확인합니다.
알림: 낮은 진폭으로 유발된 전위, 특히 첫 번째 SMUP를 호흡 활동으로 인한 배경 소음과 구별하려면 경계를 늦추지 않고 3-4번의 호흡 주기를 관찰하는 것이 중요합니다. 또한 정확도를 위해 피크를 CMAP의 피크와 정렬해야 합니다. - 각 증분이 뚜렷하고 이전 증분보다 커야 합니다. 따라서 증분 응답을 실시간으로 시각적으로 구별하여 이전에 기록된 증분 위에 겹쳐지는 것을 관찰할 수 있습니다.
참고: 각 진폭에서 자극을 여러 번 반복하여 증분의 일관성을 보장하고 사전 정의된 기준을 준수하도록 할 수 있습니다. - 앞서 언급한 기준에 따라 각 증분을 육안으로 확인한 후 증분 진폭이 25μV 이상인지 확인합니다. 증분이 25μV 미만인 경우 측정값을 버리고 응답을 다시 평가합니다.
- 10개의 증분 응답을 기록한 후 각 증분 응답의 진폭이 10개 증분 모두의 결합된 진폭의 1/3보다 크지 않은지(최종 응답의 총 진폭을 나타냄)를 확인합니다. 이 기준이 충족되지 않으면 10개의 증분 반응에 대한 측정을 반복합니다.
알림: 1/3의 임계값은 각 증분 응답이 단일 모터 장치의 활성화를 나타낸다는 가정을 기반으로 합니다. 증분 응답의 진폭이 10개 증분 모두의 결합된 진폭의 1/3을 초과하는 경우, 이는 응답이 단일 모터 장치의 활성화에만 전적으로 기인하지 않을 수 있음을 시사합니다. 대신, 추가 모터 단위의 모집 또는 전기 노이즈 또는 인공물과 같은 비특이적 활동의 존재에 의해 영향을 받을 수 있습니다22,26. - SMUP의 평균 진폭을 추정하려면 10개 증분의 값의 평균을 구하십시오. 평균 SMUP 진폭을 측정하는 또 다른 방법은 최종 증분 응답의 전체 진폭을 총 증분 수11로 나누는 것입니다.
- 증분 응답의 초기 음수 피크가 최대 CMAP 응답의 음수 피크와 시간적으로 일치하는지 확인합니다.
- 최대 CMAP 진폭(피크-피크)을 평균 SMUP 진폭(피크-피크)으로 나누어 MUNE를 결정합니다. 특정 전기생리학 시스템에서 SMUP는 마이크로볼트(μV)로 기록되는 반면 CMAP는 일반적으로 밀리볼트(mV)로 표시됩니다. 필요한 경우 MUNE를 계산하기 전에 CMAP 및 SMUP 측정값을 동일한 단위로 변환합니다.
참고: 피크 투 피크 CMAP, 평균 SMUP 및 MUNE는 일반적으로 클리닉 근전도 시스템에 의해 자동으로 계산됩니다.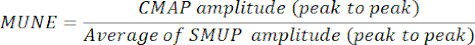
CMAP = 복합 근육 활동 전위
SMUP = 단일 모터 단위 전위
MUNE = 모터 단위 번호 추정
- 증분 자극 기법을 사용하여 평균 SMUP 크기를 계산합니다.
결과
이 보고서에 요약된 CMAP, SMUP 및 MUNE 기술을 사용하면 최소 침습 전극 배치를 사용하여 횡격막 근육의 신경근 기능을 기록할 수 있습니다(그림 1). 진폭 및 면적의 매개변수는 최대 CMAP 크기를 특성화하는 데 사용할 수 있으며, 근육 그룹 출력의 전반적인 측정을 제공합니다(그림 2). 그러나 현재 방법에서는 CMAP와 SMUP 크기를 모두...
토론
ALS와 같은 MN 퇴행성 질환에서는 환기에 관여하는 MU를 평가하는 것이 중요하다28. ALS 환자에서 호흡기 MN 변성이 발생함에도 불구하고, MN 사망의 구체적인 발병 및 진행은 불완전하게 이해되고 있다 29,30,31. 이러한 측면의 중요성을 인식하여, 신경퇴행성 질환의 동물 모델에서 호흡 장...
공개
WDA는 NMD Pharma, Avidity Biosciences로부터 연구 자금을 지원받았으며 NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics, Catalyst Pharmaceuticals 및 Novartis로부터 컨설팅 비용을 받았습니다.
감사의 말
이 연구는 미주리 척수 손상/질병 연구 프로그램(NLN 및 WDA)의 척수 손상/질병 연구 프로그램 보조금으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| 50 mL, Model 705 RN syringe | Hamilton Company | 7637-01 | Utilized to conduct intrapleural injection |
| 5008 - Formulab Diet | LabDiet | 0001325 | |
| Autoclavable 26 G needles (26S RN 9.52 mm 40°) | Hamilton Company | 7804-04 | Utilized to conduct intrapleural injection |
| Cholera toxin B-subunit (CTB) | MilliporeSigma | C9903 | Utilized for intrapleural injection to label surviving motor neurons |
| Cholera toxin B-subunit conjugated to saporin (CTB-SAP) | Advanced Targeting Systems | IT-14 | Utilized for intrapleural injection to cause motor neuron death |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes- recording electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | ||
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Saporin (SAP) | Advanced Targeting Systems | PR-01 | Utilized for intrapleural injection (control agent when injected by itself) |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | portable electrodiagnostic system | |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Sprague-Dawley rat | Envigo colony 208a, Indianapolis, IN | ||
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
참고문헌
- Mantilla, C. B., Zhan, W. -. Z., Sieck, G. C. Retrograde labeling of phrenic motoneurons by intrapleural injection. J Neurosci Methods. 182 (2), 244-249 (2009).
- Nichols, N. L., Satriotomo, I., Harrigan, D. J., Mitchell, G. S. Acute intermittent hypoxia induced phrenic long-term facilitation despite increased sod1 expression in a rat model of als. Exp Neurol. 273, 138-150 (2015).
- Nichols, N. L., Craig, T. A., Tanner, M. A. Phrenic long-term facilitation following intrapleural ctb-sap-induced respiratory motor neuron death. Respir Physiol Neurobiol. 256, 43-49 (2018).
- Kiernan, M. C., et al. Amyotrophic lateral sclerosis. Lancet. 377 (9769), 942-955 (2011).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant sod1g93a model of amyotrophic lateral sclerosis. Muscle Nerve. 41 (6), 774-784 (2010).
- Shibuya, K., et al. Motor cortical function determines prognosis in sporadic als. Neurology. 87 (5), 513-520 (2016).
- Lewelt, A., et al. Compound muscle action potential and motor function in children with spinal muscular atrophy. Muscle Nerve. 42 (5), 703-708 (2010).
- Mcgovern, V. L., et al. Smn expression is required in motor neurons to rescue electrophysiological deficits in the smnδ7 mouse model of sma. Hum Mol Genet. 24 (19), 5524-5541 (2015).
- Arnold, W. D., et al. Electrophysiological biomarkers in spinal muscular atrophy: Preclinical proof of concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
- Harrigan, M. E., et al. Assessing rat forelimb and hindlimb motor unit connectivity as objective and robust biomarkers of spinal motor neuron function. Sci Rep. 9 (1), 16699 (2019).
- Arnold, W. D., et al. Electrophysiological motor unit number estimation (mune) measuring compound muscle action potential (cmap) in mouse hindlimb muscles. J. Vis. Exp: JoVE. (103), e52899 (2015).
- Martin, M., Li, K., Wright, M. C., Lepore, A. C. Functional and morphological assessment of diaphragm innervation by phrenic motor neurons. J. Vis. Exp: JoVE. (99), e52605 (2015).
- Mccomas, A., Fawcett, P. R. W., Campbell, M., Sica, R. Electrophysiological estimation of the number of motor units within a human muscle. J Neurol Neurosurg Psychiatry. 34 (2), 121-131 (1971).
- Felice, K. J. A longitudinal study comparing thenar motor unit number estimates to other quantitative tests in patients with amyotrophic lateral sclerosis. Muscle Nerve. 20 (2), 179-185 (1997).
- Vucic, S., Rutkove, S. B. Neurophysiological biomarkers in amyotrophic lateral sclerosis. Curr Opin Neurol. 31 (5), 640-647 (2018).
- Carleton, S., Brown, W. Changes in motor unit populations in motor neurone disease. J Neurol Neurosurg Psychiatry. 42 (1), 42-51 (1979).
- Yuen, E. C., Olney, R. K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis. Neurology. 49 (2), 573-578 (1997).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Henderson, R. D., Ridall, P. G., Hutchinson, N. M., Pettitt, A. N., Mccombe, P. A. Bayesian statistical mune method. Muscle Nerve. 36 (2), 206-213 (2007).
- Shefner, J., et al. Multipoint incremental motor unit number estimation as an outcome measure in als. Neurology. 77 (3), 235-241 (2011).
- Stein, R. B., Yang, J. F. Methods for estimating the number of motor units in human muscles. Ann Neurol. 28 (4), 487-495 (1990).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clin Neurophysiol. 112 (6), 955-964 (2001).
- Ahad, M., Rutkove, S. Correlation between muscle electrical impedance data and standard neurophysiologic parameters after experimental neurogenic injury. Physiol Meas. 31 (11), 1437 (2010).
- Kasselman, L. J., Shefner, J. M., Rutkove, S. B. Motor unit number estimation in the rat tail using a modified multipoint stimulation technique. Muscle Nerve. 40 (1), 115-121 (2009).
- Ngo, S., et al. The relationship between bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and sod1g93a mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Feasby, T., Brown, W. Variation of motor unit size in the human extensor digitorum brevis and thenar muscles. J Neurol Neurosurg Psychiatry. 37 (8), 916-926 (1974).
- Nichols, N. L., Vinit, S., Bauernschmidt, L., Mitchell, G. S. Respiratory function after selective respiratory motor neuron death from intrapleural ctb-saporin injections. Exp Neurol. 267, 18-29 (2015).
- Nichols, N. L., et al. Ventilatory control in als. Respir Physiol Neurobiol. 189 (2), 429-437 (2013).
- Cifra, A., Nani, F., Nistri, A. Respiratory motoneurons and pathological conditions: Lessons from hypoglossal motoneurons challenged by excitotoxic or oxidative stress. Respir Physiol Neurobiol. 179 (1), 89-96 (2011).
- Kobayashi, Z., et al. Fals with gly72ser mutation in sod1 gene: Report of a family including the first autopsy case. J Neurol Sci. 300 (1), 9-13 (2011).
- Su, M., Wakabayashi, K., Tanno, Y., Inuzuka, T., Takahashi, H. An autopsy case of amyotrophic lateral sclerosis with concomitant alzheimer's and incidental lewy body diseases. No to shinkei= Brain and nerve. 48 (10), 931-936 (1996).
- Lladó, J., et al. Degeneration of respiratory motor neurons in the sod1 g93a transgenic rat model of als. Neurobiol Dis. 21 (1), 110-118 (2006).
- Borkowski, L. F., Smith, C. L., Keilholz, A. N., Nichols, N. L. Divergent receptor utilization is necessary for phrenic long-term facilitation over the course of motor neuron loss following ctb-sap intrapleural injections. J Neurophysiol. 126 (3), 709-722 (2021).
- Nicolopoulos-Stournaras, S., Iles, J. F. Motor neuron columns in the lumbar spinal cord of the rat. J Comp Neurol. 217 (1), 75-85 (1983).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: An approach to maximize uptake and transduction of spinal cord motor neurons. Sci Rep. 6 (1), 33058 (2016).
- Mchanwell, S., Biscoe, T. The localization of motoneurons supplying the hindlimb muscles of the mouse. Phil. Trans. R. , 477-508 (1981).
- Nair, J., et al. Histological identification of phrenic afferent projections to the spinal cord. Respir Physiol Neurobiol. 236, 57-68 (2017).
- Courtine, G., et al. Can experiments in nonhuman primates expedite the translation of treatments for spinal cord injury in humans. Nat Med. 13 (5), 561-566 (2007).
- Friedli, L., et al. Pronounced species divergence in corticospinal tract reorganization and functional recovery after lateralized spinal cord injury favors primates. Sci Transl Med. 7 (302), 134 (2015).
- Arnold, R., et al. Nerve excitability in the rat forelimb: A technique to improve translational utility. J Neurosci Methods. 275, 19-24 (2017).
- Boriek, A., Rodarte, J., Reid, M. Shape and tension distribution of the passive rat diaphragm. Am J Physiol Regul Integr Comp Physiol. 280, R33-R41 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유