Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation des mesures de résultats de la connectivité des unités motrices du diaphragme du rat en tant que biomarqueurs quantitatifs de la dégénérescence et de la compensation des motoneurones phréniques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans cette étude, nous présentons une méthode in vivo d’estimation du nombre et de la taille de l’unité motrice afin de quantifier la connectivité de l’unité motrice à diaphragme de rat. Une approche étape par étape de ces techniques est décrite.
Résumé
La perte de la fonction du muscle ventilatoire est une conséquence d’une lésion des motoneurones et de la neurodégénérescence (par exemple, une lésion de la moelle épinière cervicale et une sclérose latérale amyotrophique, respectivement). Les motoneurones phréniques sont le lien final entre le système nerveux central et le muscle, et leurs unités motrices respectives (groupes de fibres musculaires innervées par un seul motoneurone) représentent la plus petite unité fonctionnelle du système ventilatoire neuromusculaire. Le potentiel d’action musculaire composé (CMAP), le potentiel d’unité motrice unique (SMUP) et l’estimation du nombre d’unités motrices (MUNE) sont des approches électrophysiologiques établies qui permettent l’évaluation longitudinale de l’intégrité des unités motrices dans des modèles animaux au fil du temps, mais ont principalement été appliquées aux muscles des membres. Par conséquent, les objectifs de cette étude sont de décrire une approche dans les études précliniques sur les rongeurs qui peut être utilisée longitudinalement pour quantifier la MUNE phrénique, la taille de l’unité motrice (représentée par SMUP) et la CMAP, puis de démontrer l’utilité de ces approches dans un modèle de perte de motoneurones. Des biomarqueurs sensibles, objectifs et pertinents sur le plan translationnel pour les lésions neuronales, la dégénérescence et la régénération dans les lésions et les maladies des motoneurones peuvent considérablement aider et accélérer les découvertes de la recherche expérimentale jusqu’aux tests cliniques.
Introduction
Les motoneurones phréniques (MN), s’étendant des niveaux de myotome C3 à C6, forment le lien final entre le système nerveux central (SNC) et le muscle du diaphragme1. Les unités motrices phréniques (UM) sont composées d’une seule MN spinale et de ses fibres musculaires diaphragmales innervées, formant la plus petite unité fonctionnelle du système neuromusculaire respiratoire. La fonction ventilatoire nécessite une contraction adéquate du muscle du diaphragme obtenue par l’activation coordonnée de la piscine phrénique MU 2,3. De nombreuses maladies neurologiques, y compris la sclérose latérale amyotrophique (SLA), entraînent une insuffisance ventilatoire sévère, contribuant finalement à la cause du décès4.
Plusieurs approches électrophysiologiques peuvent être utilisées pour évaluer et surveiller l’intégrité du pool d’unités motrices (UM) in vivo. Le potentiel d’action musculaire composé (CMAP) reflète la dépolarisation totale de toutes les fibres musculaires d’un muscle ou d’un groupe musculaire spécifique après une stimulation nerveuse périphérique et est sensible à une gamme d’affections neuromusculaires, y compris la SLA 5,6 et l’amyotrophie spinale (SMA)7,8,9. Une limite de l’évaluation CMAP est que la germination collatérale peut conduire au maintien de l’amplitude et de la surface du CMAP même en présence d’une perte MU10. Pour surmonter cette limitation, des modifications ont été apportées à la technique CMAP afin d’évaluer à la fois le nombre d’unités motrices et la taille11. De plus, une étude in vivo portant sur l’évaluation fonctionnelle du CMAP du diaphragme par un système électrophysiologique a suggéré qu’il pourrait également être possible d’utiliser la technique d’enregistrement du CMAP du diaphragme décrite pour l’estimation du nombre d’unités motrices12.
La technique d’estimation incrémentielle du nombre d’unités motrices (MUNE) a été initialement introduite au début des années 1970 par McComas et al. pour le muscle extenseur digitorum brevis chez l’homme13. L’approche MUNE incrémentielle était une modification de la technique d’enregistrement CMAP traditionnelle au cours de laquelle une stimulation progressivement croissante était délivrée pour enregistrer des incréments sous-maximaux quantiques, tout ou rien, comme indices des réponses d’une seule unité motrice. Les incréments additionnés et moyennés ont été utilisés pour calculer une estimation de la taille du potentiel d’une seule unité motrice (SMUP). Cette taille calculée a ensuite été divisée en amplitude CMAP pour estimer le nombre d’UM innervant le muscle examiné11. MUNE fait preuve d’une grande sensibilité dans la détection et la surveillance de la perte d’unité motrice, ce qui permet d’identifier le dysfonctionnement de l’unité motrice avant les changements observables dans des mesures telles que l’amplitude CMAP ou l’aire14,15. Chez les patients atteints de SLA, MUNE s’est avéré exceptionnellement sensible, servant de biomarqueur important pour l’apparition, la progression et le pronostic de la maladie16,17.
De nombreuses adaptations de MUNE ont été développées et largement utilisées pour évaluer la fonction de l’UM dans des conditions telles que la neurodégénérescence, les lésions neuronales et le processus de vieillissement naturel 18,19,20,21. Depuis la description initiale, diverses adaptations utilisant à la fois des réponses électrophysiologiques et des mesures de force incrémentielle (mécaniques) ont été employées dans des études humaines et des modèles animaux22. MUNE fournit une évaluation fonctionnelle non invasive de la connectivité des motoneurones avec le muscle. L’application longitudinale de MUNE permet de comprendre la progression de la maladie ou du phénotype induit et d’évaluer les effets protecteurs ou régénératifs des interventions thérapeutiques, tant dans des contextes cliniques que précliniques. Indépendamment de l’efficacité de la reproductibilité des mesures MUNE et de la pertinence clinique de la technique pour les flaques d’UM dans la majeure partie du corps humain, les efforts se sont largement concentrés sur les muscles des membres dans les muscles des rongeurs 10,23,24,25.
Par conséquent, les objectifs de cette étude étaient de décrire une approche pour obtenir le potentiel d’action musculaire composé (CMAP), le SMUP et le nombre d’unités motrices phréniques (MUNE) en tant qu’évaluations in vivo qui peuvent être utilisées longitudinalement dans les études précliniques sur les rongeurs pour quantifier le MUNE, la taille de l’unité motrice (représentée par SMUP) et le CMAP. De plus, nous présentons des données représentatives qui mettent en évidence la perte du nombre de MU du diaphragme suite à l’administration intrapleurale d’un agent dégénératif phrénique MN, un fragment de toxine B du choléra conjugué à la saporine (CTB-SAP).
Protocole
Toutes les procédures ont été approuvées et menées conformément aux directives établies par le Comité institutionnel de protection et d’utilisation des animaux de l’Université du Missouri. Les expériences ont été réalisées sur des rats Sprague-Dawley mâles adultes, âgés de 11 à 15 semaines. Ces rats ont été logés par paires et gardés sous un cycle lumière-obscurité de 12:12, avec un accès à de la nourriture commerciale standard en granulés et à de l’eau traitée au HCl disponible en tout temps.
1. Préparation de l’animal et administration de l’anesthésie
- Portez un équipement de protection individuelle approprié lorsque vous manipulez des rats.
- Administrer un anesthésique par inhalation avec 3 à 5 % d’isoflurane, en assurant une bonne induction. Une fois que le rat est correctement anesthésié, placez-le en position couchée et maintenez l’anesthésie avec 1 à 3% d’isoflurane inhalé. Vérifiez la suffisance de la profondeur de l’anesthésie en appliquant doucement une pression sur le coussinet du pied postérieur à l’aide d’une pince pour s’assurer qu’il n’y a pas de réponse de retrait.
REMARQUE : En fonction de la taille et du poids du rat, surveillez la profondeur de l’anesthésie et ajustez la concentration d’isoflurane en conséquence. - Maintenez la température de 37 °C à l’aide d’une plaque chauffante thermostatique pour éviter les variations de température qui peuvent affecter l’amplitude et la latence du CMAP.
- Appliquez une pommade vétérinaire à base de pétrole sur les yeux pour prévenir la sécheresse. Surveillez la profondeur de l’anesthésie en observant la fréquence respiratoire et en vérifiant les réponses de retrait lors de l’application d’une pression sur le repose-pieds à l’aide d’une pince.
- Retirez les poils du tiers inférieur de la poitrine et du cou à étudier à l’aide d’une tondeuse. Surveillez la respiration du rat pendant toute la durée de l’expérience.
REMARQUE : Après les enregistrements CMAP et MUNE et l’arrêt de l’anesthésie, ne laissez pas le rat sans surveillance jusqu’à ce qu’il ait repris suffisamment de conscience. Ne retournez pas l’animal dans la cage familiale avant d’être complètement rétabli.
2. Placement et configuration des électrodes
- Placez une paire d’électrodes-aiguilles monopolaires de 28 G pour enregistrer le CMAP, le SMUP et le MUNE comme illustré à la figure 1.
- Placez l’électrode de l’aiguille active (E1) par voie sous-cutanée sur la ligne claviculaire médiane inférieure au dernier bord de la côte, et l’électrode de l’aiguille de référence (E2) par voie sous-cutanée dans l’angle entre l’apophyse xyphoïde et le dernier cartilage sternocostal.
REMARQUE : Les électrodes de l’aiguille ne doivent pas être insérées dans le muscle du diaphragme ; Au lieu de cela, ils doivent être positionnés dans la zone sous-cutanée.
- Placez l’électrode de l’aiguille active (E1) par voie sous-cutanée sur la ligne claviculaire médiane inférieure au dernier bord de la côte, et l’électrode de l’aiguille de référence (E2) par voie sous-cutanée dans l’angle entre l’apophyse xyphoïde et le dernier cartilage sternocostal.
- Pour la stimulation du nerf phrénique au niveau de la feuille carotidienne, utilisez une paire d’électrodes à aiguille monopolaires de 28 G comme cathode et anode pour la stimulation nerveuse et placées sous-cutanéement sur le cou latéral entre les muscles scalènes antérieur et moyen, séparés d’environ 1 cm. Assurez-vous que le placement des aiguilles de stimulation se fait au niveau inférieur à la quatrième vertèbre cervicale (C4).
REMARQUE : Évitez d’insérer les électrodes de stimulation trop profondément pour éviter de blesser le nerf phrénique ou une autre structure. La figure 1 illustre le placement des électrodes. - Pour l’électrode de terre, placez une électrode de surface jetable sur la queue.
3. Acquisition de données
- Phrénique CMAP
- Enregistrez les réponses CMAP phréniques en appliquant des impulsions cathodiques monophasiques à ondes carrées d’une durée de 0,1 ms et d’une intensité allant de 60 à 100 mA pour stimuler le nerf phrénique.
- Obtenir des réponses CMAP tout en augmentant progressivement l’intensité du stimulus jusqu’à ce que l’amplitude de la réponse cesse de montrer une augmentation supplémentaire. Pour assurer une stimulation supramaximale, augmentez l’intensité du stimulus à environ 120 % du niveau utilisé pour provoquer une réponse maximale et enregistrez une réponse supplémentaire. Si la taille du CMAP n’augmente plus, considérez cette réponse comme le CMAP maximal.
REMARQUE : Il est préférable de fournir une stimulation pendant l’expiration pour minimiser le bruit de l’activité musculaire simultanée pendant l’enregistrement CMAP. - Mesurez et documentez les amplitudes crête à crête du CMAP en millivolts (mV) (Figure 2).
REMARQUE : L’amplitude CMAP peut être évaluée de base à crête et de crête à crête. Les systèmes d’électrodiagnostic clinique sont souvent conçus par défaut pour évaluer la base au pic, qui est calculée à partir de la ligne de base isoélectrique jusqu’au pic négatif initial.
- Taille moyenne du potentiel d’unité de moteur unique (SMUP) et calcul de MUNE
- Calculez la taille moyenne du SMUP à l’aide d’une technique de stimulation incrémentale.
- Pour susciter des réponses incrémentielles, administrez une stimulation sous-maximale d’une durée de 0,1 ms à une fréquence de 1 Hz, en augmentant progressivement l’intensité par incréments de 0,03 mA jusqu’à ce qu’une réponse minimale tout ou rien soit obtenue. Acquérez la réponse initiale avec une intensité de stimulus comprise entre 2 mA et 10 mA.
- Si la réponse initiale ne se produit pas avec une intensité de stimulus comprise entre 2 mA et 10 mA, modifiez la position de la cathode de stimulation, soit en la rapprochant, soit en l’éloignant du nerf phrénique dans le cou, pour diminuer ou augmenter l’intensité du stimulus nécessaire, respectivement.
- Si la première réponse incrémentielle est obtenue avec une intensité de stimulus allant de 2 mA à 10 mA, enregistrez la première réponse et acquérez des incréments supplémentaires avec des intensités de stimulus progressivement plus élevées, en ajustant par incréments de 0,03 mA, pour obtenir un total de 9 incréments supplémentaires qui satisfont aux critères suivants à l’étape 3.2.2.
REMARQUE : Chaque SMUP est quantifié en soustrayant chaque incrément de l’incrément précédent.
- Lorsque vous mesurez les réponses incrémentielles, assurez-vous que chaque incrément répond aux critères suivants :
- Assurez-vous que le pic négatif initial des réponses incrémentielles s’aligne temporellement sur le pic négatif de la réponse CMAP maximale.
REMARQUE : Les légers mouvements observés en raison du bruit de fond des cycles respiratoires sont inhérents à la nature de l’expérience. Cependant, la présence constante de SMUP pendant l’observation en direct confirme leur identité pour ce CMAP spécifique. - Comme le diaphragme est un muscle dynamique impliqué dans la respiration, chaque cycle respiratoire peut induire un mouvement de base. Ainsi, vérifiez la stabilité et l’absence de fractionnement dans chaque réponse incrémentielle en confirmant la cohérence entre trois réponses dupliquées.
REMARQUE : Pour distinguer les potentiels évoqués de faible amplitude, en particulier le premier SMUP, du bruit de fond dû à l’activité respiratoire, il est important de rester vigilant et d’observer pendant 3 à 4 cycles respiratoires. Assurez-vous également de l’alignement des pics avec ceux du CMAP pour plus de précision. - Assurez-vous que chaque incrément est distinct et plus grand que le précédent. Par conséquent, distinguez visuellement les réponses incrémentielles en temps réel, en les observant lorsqu’elles se superposent aux incréments précédemment enregistrés.
REMARQUE : Plusieurs répétitions du stimulus à chaque amplitude peuvent être effectuées pour assurer l’uniformité des incréments et la conformité aux critères prédéfinis. - Après avoir vérifié visuellement chaque incrément à l’aide des critères susmentionnés, confirmez que l’amplitude d’incrément est d’au moins 25 μV. Si l’incrément est inférieur à 25 μV, écartez la mesure et réévaluez la réponse.
- Après l’enregistrement de 10 réponses incrémentielles, vérifiez que l’amplitude de chaque réponse d’incrément n’est pas supérieure au tiers de l’amplitude combinée des 10 incréments, représentant l’amplitude totale de la réponse finale. Si ce critère n’est pas satisfait, répétez la mesure des 10 réponses incrémentielles.
REMARQUE : Le seuil d’un tiers est basé sur l’hypothèse que chaque réponse incrémentielle représente l’activation d’une seule unité motrice. Si l’amplitude d’une réponse incrémentielle dépasse un tiers de l’amplitude combinée des dix incréments, cela suggère que la réponse peut ne pas être uniquement attribuable à l’activation d’une seule unité motrice. Au lieu de cela, il pourrait être influencé par le recrutement d’unités motrices supplémentaires ou la présence d’activités non spécifiques, telles que le bruit électrique ou des artefacts22,26. - Pour estimer l’amplitude moyenne des SMUP, faites la moyenne des valeurs des 10 incréments. Une autre méthode pour mesurer l’amplitude moyenne du SMUP consiste à diviser l’amplitude totale de la réponse incrémentielle finale par le nombre total d’incréments11.
- Assurez-vous que le pic négatif initial des réponses incrémentielles s’aligne temporellement sur le pic négatif de la réponse CMAP maximale.
- Déterminez MUNE en divisant l’amplitude maximale du CMAP (crête à crête) par l’amplitude moyenne du SMUP (crête à crête). Dans certains systèmes électrophysiologiques, les SMUP sont enregistrés en microvolts (μV), tandis que le CMAP est généralement exprimé en millivolts (mV). Si nécessaire, convertissez les mesures CMAP et SMUP dans les mêmes unités avant de calculer MUNE.
REMARQUE : Les CMAP de crête à crête, les SMUP moyens et les MUNE sont généralement calculés automatiquement par les systèmes d’électromyographie des cliniques) :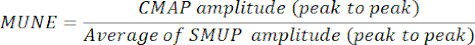
CMAP = Potentiel d’action musculaire composé
SMUP = Potentiel d’unité de moteur unique
MUNE = Estimation du nombre d’unités motrices
- Calculez la taille moyenne du SMUP à l’aide d’une technique de stimulation incrémentale.
Résultats
Les techniques CMAP, SMUP et MUNE décrites dans ce rapport permettent d’enregistrer la fonction neuromusculaire dans le muscle du diaphragme en utilisant le placement d’électrodes peu invasif (Figure 1). Les paramètres d’amplitude et de surface peuvent être utilisés pour caractériser la taille supramaximale du CMAP, fournissant une mesure globale de la production du groupe musculaire (Figure 2). Cependant, dans nos m...
Discussion
Dans les maladies dégénératives MN, telles que la SLA, il est crucial d’évaluer les MU impliquées dans la ventilation28. Malgré l’apparition d’une dégénérescence respiratoire de la MN chez les patients atteints de SLA, l’apparition et la progression spécifiques de la mort par MN restent incomplètement comprises 29,30,31. Reconnaissant l’importance de ...
Déclarations de divulgation
WDA a reçu des fonds de recherche de NMD Pharma, Avidity Biosciences et des honoraires de consultation de NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics, Catalyst Pharmaceuticals et Novartis.
Remerciements
Ce travail a été financé par une subvention du programme de recherche sur les lésions et les maladies de la moelle épinière du programme de recherche sur les lésions et les maladies de la moelle épinière du Missouri (NLN et WDA).
matériels
| Name | Company | Catalog Number | Comments |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| 50 mL, Model 705 RN syringe | Hamilton Company | 7637-01 | Utilized to conduct intrapleural injection |
| 5008 - Formulab Diet | LabDiet | 0001325 | |
| Autoclavable 26 G needles (26S RN 9.52 mm 40°) | Hamilton Company | 7804-04 | Utilized to conduct intrapleural injection |
| Cholera toxin B-subunit (CTB) | MilliporeSigma | C9903 | Utilized for intrapleural injection to label surviving motor neurons |
| Cholera toxin B-subunit conjugated to saporin (CTB-SAP) | Advanced Targeting Systems | IT-14 | Utilized for intrapleural injection to cause motor neuron death |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes- recording electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | ||
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Saporin (SAP) | Advanced Targeting Systems | PR-01 | Utilized for intrapleural injection (control agent when injected by itself) |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | portable electrodiagnostic system | |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Sprague-Dawley rat | Envigo colony 208a, Indianapolis, IN | ||
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Références
- Mantilla, C. B., Zhan, W. -. Z., Sieck, G. C. Retrograde labeling of phrenic motoneurons by intrapleural injection. J Neurosci Methods. 182 (2), 244-249 (2009).
- Nichols, N. L., Satriotomo, I., Harrigan, D. J., Mitchell, G. S. Acute intermittent hypoxia induced phrenic long-term facilitation despite increased sod1 expression in a rat model of als. Exp Neurol. 273, 138-150 (2015).
- Nichols, N. L., Craig, T. A., Tanner, M. A. Phrenic long-term facilitation following intrapleural ctb-sap-induced respiratory motor neuron death. Respir Physiol Neurobiol. 256, 43-49 (2018).
- Kiernan, M. C., et al. Amyotrophic lateral sclerosis. Lancet. 377 (9769), 942-955 (2011).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant sod1g93a model of amyotrophic lateral sclerosis. Muscle Nerve. 41 (6), 774-784 (2010).
- Shibuya, K., et al. Motor cortical function determines prognosis in sporadic als. Neurology. 87 (5), 513-520 (2016).
- Lewelt, A., et al. Compound muscle action potential and motor function in children with spinal muscular atrophy. Muscle Nerve. 42 (5), 703-708 (2010).
- Mcgovern, V. L., et al. Smn expression is required in motor neurons to rescue electrophysiological deficits in the smnδ7 mouse model of sma. Hum Mol Genet. 24 (19), 5524-5541 (2015).
- Arnold, W. D., et al. Electrophysiological biomarkers in spinal muscular atrophy: Preclinical proof of concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
- Harrigan, M. E., et al. Assessing rat forelimb and hindlimb motor unit connectivity as objective and robust biomarkers of spinal motor neuron function. Sci Rep. 9 (1), 16699 (2019).
- Arnold, W. D., et al. Electrophysiological motor unit number estimation (mune) measuring compound muscle action potential (cmap) in mouse hindlimb muscles. J. Vis. Exp: JoVE. (103), e52899 (2015).
- Martin, M., Li, K., Wright, M. C., Lepore, A. C. Functional and morphological assessment of diaphragm innervation by phrenic motor neurons. J. Vis. Exp: JoVE. (99), e52605 (2015).
- Mccomas, A., Fawcett, P. R. W., Campbell, M., Sica, R. Electrophysiological estimation of the number of motor units within a human muscle. J Neurol Neurosurg Psychiatry. 34 (2), 121-131 (1971).
- Felice, K. J. A longitudinal study comparing thenar motor unit number estimates to other quantitative tests in patients with amyotrophic lateral sclerosis. Muscle Nerve. 20 (2), 179-185 (1997).
- Vucic, S., Rutkove, S. B. Neurophysiological biomarkers in amyotrophic lateral sclerosis. Curr Opin Neurol. 31 (5), 640-647 (2018).
- Carleton, S., Brown, W. Changes in motor unit populations in motor neurone disease. J Neurol Neurosurg Psychiatry. 42 (1), 42-51 (1979).
- Yuen, E. C., Olney, R. K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis. Neurology. 49 (2), 573-578 (1997).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Henderson, R. D., Ridall, P. G., Hutchinson, N. M., Pettitt, A. N., Mccombe, P. A. Bayesian statistical mune method. Muscle Nerve. 36 (2), 206-213 (2007).
- Shefner, J., et al. Multipoint incremental motor unit number estimation as an outcome measure in als. Neurology. 77 (3), 235-241 (2011).
- Stein, R. B., Yang, J. F. Methods for estimating the number of motor units in human muscles. Ann Neurol. 28 (4), 487-495 (1990).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clin Neurophysiol. 112 (6), 955-964 (2001).
- Ahad, M., Rutkove, S. Correlation between muscle electrical impedance data and standard neurophysiologic parameters after experimental neurogenic injury. Physiol Meas. 31 (11), 1437 (2010).
- Kasselman, L. J., Shefner, J. M., Rutkove, S. B. Motor unit number estimation in the rat tail using a modified multipoint stimulation technique. Muscle Nerve. 40 (1), 115-121 (2009).
- Ngo, S., et al. The relationship between bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and sod1g93a mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Feasby, T., Brown, W. Variation of motor unit size in the human extensor digitorum brevis and thenar muscles. J Neurol Neurosurg Psychiatry. 37 (8), 916-926 (1974).
- Nichols, N. L., Vinit, S., Bauernschmidt, L., Mitchell, G. S. Respiratory function after selective respiratory motor neuron death from intrapleural ctb-saporin injections. Exp Neurol. 267, 18-29 (2015).
- Nichols, N. L., et al. Ventilatory control in als. Respir Physiol Neurobiol. 189 (2), 429-437 (2013).
- Cifra, A., Nani, F., Nistri, A. Respiratory motoneurons and pathological conditions: Lessons from hypoglossal motoneurons challenged by excitotoxic or oxidative stress. Respir Physiol Neurobiol. 179 (1), 89-96 (2011).
- Kobayashi, Z., et al. Fals with gly72ser mutation in sod1 gene: Report of a family including the first autopsy case. J Neurol Sci. 300 (1), 9-13 (2011).
- Su, M., Wakabayashi, K., Tanno, Y., Inuzuka, T., Takahashi, H. An autopsy case of amyotrophic lateral sclerosis with concomitant alzheimer's and incidental lewy body diseases. No to shinkei= Brain and nerve. 48 (10), 931-936 (1996).
- Lladó, J., et al. Degeneration of respiratory motor neurons in the sod1 g93a transgenic rat model of als. Neurobiol Dis. 21 (1), 110-118 (2006).
- Borkowski, L. F., Smith, C. L., Keilholz, A. N., Nichols, N. L. Divergent receptor utilization is necessary for phrenic long-term facilitation over the course of motor neuron loss following ctb-sap intrapleural injections. J Neurophysiol. 126 (3), 709-722 (2021).
- Nicolopoulos-Stournaras, S., Iles, J. F. Motor neuron columns in the lumbar spinal cord of the rat. J Comp Neurol. 217 (1), 75-85 (1983).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: An approach to maximize uptake and transduction of spinal cord motor neurons. Sci Rep. 6 (1), 33058 (2016).
- Mchanwell, S., Biscoe, T. The localization of motoneurons supplying the hindlimb muscles of the mouse. Phil. Trans. R. , 477-508 (1981).
- Nair, J., et al. Histological identification of phrenic afferent projections to the spinal cord. Respir Physiol Neurobiol. 236, 57-68 (2017).
- Courtine, G., et al. Can experiments in nonhuman primates expedite the translation of treatments for spinal cord injury in humans. Nat Med. 13 (5), 561-566 (2007).
- Friedli, L., et al. Pronounced species divergence in corticospinal tract reorganization and functional recovery after lateralized spinal cord injury favors primates. Sci Transl Med. 7 (302), 134 (2015).
- Arnold, R., et al. Nerve excitability in the rat forelimb: A technique to improve translational utility. J Neurosci Methods. 275, 19-24 (2017).
- Boriek, A., Rodarte, J., Reid, M. Shape and tension distribution of the passive rat diaphragm. Am J Physiol Regul Integr Comp Physiol. 280, R33-R41 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon