Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Frenik Motor Nöron Dejenerasyonu ve Kompanzasyonunun Kantitatif Biyobelirteçleri Olarak Sıçan Diyafram Motor Ünitesi Bağlantı Sonuç Ölçütlerinin Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışmada, sıçan diyaframlı motor ünitesi bağlantısını ölçmek için motor ünite sayısını ve boyutunu tahmin etmek için in vivo bir yöntem sunuyoruz. Bu tekniklere adım adım bir yaklaşım açıklanmaktadır.
Özet
Ventilasyon kas fonksiyonunun kaybı, motor nöron hasarı ve nörodejenerasyonun bir sonucudur (ör., sırasıyla, servikal omurilik yaralanması ve amyotrofik lateral skleroz). Frenik motor nöronlar, merkezi sinir sistemi ile kas arasındaki son bağlantıdır ve ilgili motor birimleri (tek bir motor nöron tarafından innerve edilen kas lifi grupları), nöromüsküler ventilasyon sisteminin en küçük fonksiyonel birimini temsil eder. Bileşik kas aksiyon potansiyeli (CMAP), tek motor ünite potansiyeli (SMUP) ve motor ünite sayısı tahmini (MUNE), hayvan modellerinde zaman içinde motor ünite bütünlüğünün uzunlamasına değerlendirilmesini sağlayan yerleşik elektrofizyolojik yaklaşımlardır, ancak çoğunlukla ekstremite kaslarına uygulanmıştır. Bu nedenle, bu çalışmanın amacı, preklinik kemirgen çalışmalarında, frenik MUNE, motor ünite boyutu (SMUP olarak temsil edilir) ve CMAP'yi ölçmek için uzunlamasına kullanılabilecek bir yaklaşımı tanımlamak ve daha sonra bu yaklaşımların bir motor nöron kaybı modelinde faydasını göstermektir. Motor nöron hasarı ve hastalıklarında nöronal hasar, dejenerasyon ve rejenerasyon için hassas, objektif ve translasyonel olarak ilgili biyobelirteçler, deneysel araştırma keşiflerine klinik testlere önemli ölçüde yardımcı olabilir ve hızlandırabilir.
Giriş
C3'ten C6 miyotom seviyelerine kadar uzanan frenik motor nöronlar (MN'ler), merkezi sinir sisteminden (MSS) diyafram kasına1 son bağlantıyı oluşturur. Frenik motor üniteler (MU), solunumsal nöromusküler sistemin en küçük fonksiyonel ünitesini oluşturan tek bir spinal MN ve onun innerve diyafram kas liflerinden oluşur. Ventilasyon fonksiyonu, frenik MU havuzunun koordineli aktivasyonu ile elde edilen diyafram kasının yeterli kasılmasını gerektirir 2,3. Amyotrofik lateral skleroz (ALS) dahil olmak üzere birçok nörolojik hastalık, ciddi ventilasyon bozukluğuna neden olur ve sonuçta ölüm nedenine katkıda bulunur4.
Motor ünitesi (MU) havuzunun bütünlüğünü in vivo olarak değerlendirmek ve izlemek için çeşitli elektrofizyolojik yaklaşımlar kullanılabilir. Bileşik kas aksiyon potansiyeli (CMAP), periferik sinir stimülasyonundan sonra belirli bir kas veya kas grubundaki tüm kas liflerinin toplam depolarizasyonunu yansıtır ve ALS 5,6 ve spinal müsküler atrofi (SMA) dahil olmak üzere bir dizi nöromüsküler duruma duyarlıdır7,8,9. CMAP değerlendirmesinin bir sınırlaması, teminat filizlenmesinin, MU kaybı10 varlığında bile CMAP genliğinin ve alanının korunmasına yol açabilmesidir. Bu sınırlamanın üstesinden gelmek için, hem motor ünite numarasını hem de11 boyutunu değerlendirmek için CMAP tekniğinde değişiklikler yapılmıştır. Ek olarak, diyafram CMAP'nin bir elektrofizyolojik sistem tarafından fonksiyonel değerlendirmesini araştıran bir in vivo çalışma, motor ünite numarası tahmini12 için açıklanan diyafram CMAP kayıt tekniğinin kullanılmasının da mümkün olabileceğini düşündürmektedir.
Artımlı motor birim sayısı tahmini (MUNE) tekniği ilk olarak 1970'lerin başında McComas ve ark. insanlarda ekstansör digitorum brevis kası için13. Artımlı MUNE yaklaşımı, tek motor ünite tepkilerinin indeksleri olarak nicel, ya hep ya hiç submaksimal artışları kaydetmek için kademeli olarak artan bir stimülasyonun sağlandığı geleneksel CMAP kayıt tekniğinin bir modifikasyonuydu. Toplanan ve ortalaması alınan artışlar, tek bir motor birim potansiyelinin (SMUP) boyutu için bir tahmin hesaplamak için kullanıldı. Hesaplanan bu boyut daha sonra incelenen kası innerve eden MU'ların sayısını tahmin etmek için CMAP genliğine bölündü11. MUNE, motor ünite kaybını tespit etmede ve izlemede yüksek hassasiyet gösterir ve CMAP genliği veya alan14,15 gibi ölçümlerde gözlemlenebilir değişikliklerden önce motor ünite disfonksiyonunun tanımlanmasına olanak tanır. ALS hastalarında, MUNE'nin son derece hassas olduğu kanıtlanmıştır ve hastalık başlangıcı, ilerlemesi ve prognozu için önemli bir biyobelirteç olarak hizmet etmektedir 16,17.
Nörodejenerasyon, nöral yaralanma ve doğal yaşlanma süreci gibi durumlarda MU fonksiyonunu değerlendirmek için çok sayıda MUNE adaptasyonu geliştirilmiş ve yaygın olarak kullanılmıştır 18,19,20,21. İlk tanımlamadan bu yana, hem insan çalışmalarında hem de hayvan modellerinde hem elektrofizyolojik tepkileri hem de artımlı kuvvet (mekanik) ölçümlerini kullanan çeşitli uyarlamalar kullanılmıştır22. MUNE, kas ile motor nöron bağlantısının non-invaziv fonksiyonel bir değerlendirmesini sağlar. Uzunlamasına MUNE uygulamak, hem klinik hem de klinik öncesi ortamlarda hastalık veya indüklenmiş fenotip ilerlemesinin anlaşılmasını ve terapötik müdahalelerin koruyucu veya rejeneratif etkilerinin değerlendirilmesini sağlar. MUNE ölçümlerinin etkinliğinden bağımsız olarak, tekrarlanabilirlik ve tekniğin insan vücudunun çoğu boyunca MU havuzları için klinik önemi ne olursa olsun, çabalar büyük ölçüde kemirgen kaslarındaki uzuv kaslarına odaklanmıştır 10,23,24,25.
Bu nedenle, bu çalışmanın amaçları, MUNE, motor ünite boyutu (SMUP olarak temsil edilir) ve CMAP'yi ölçmek için klinik öncesi kemirgen çalışmalarında uzunlamasına kullanılabilecek in vivo değerlendirmeler olarak bileşik kas aksiyon potansiyeli (CMAP), SMUP ve frenik motor ünite numarası (MUNE) elde etmeye yönelik bir yaklaşımı tanımlamaktı. Ayrıca, frenik bir MN dejeneratif ajan olan saporine konjuge kolera toksin B fragmanının (CTB-SAP) intraplevral uygulamasını takiben diyafram MU sayısı kaybını vurgulayan temsili veriler sunuyoruz.
Protokol
Tüm prosedürler, Missouri Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından belirlenen yönergelere uygun olarak onaylandı ve yürütüldü. Deneyler, 11 ila 15 haftalık yetişkin erkek Sprague-Dawley sıçanları üzerinde yapıldı. Bu sıçanlar çiftler halinde barındırıldı ve 12:12 aydınlık-karanlık döngüsü altında tutuldu, standart ticari peletlenmiş gıdalara ve HCl ile arıtılmış suya her zaman erişim sağlandı.
1. Hayvan hazırlama ve anestezi verme
- Fareleri tutarken uygun kişisel koruyucu ekipman giyin.
- Uygun indüksiyonu sağlamak için% 3-5 izofluran ile inhalasyon anestezisi uygulayın. Sıçan yeterince uyuşturulduktan sonra, sırtüstü pozisyona getirin ve% 1-3 inhale izofluran ile anesteziyi sürdürün. Geri çekilme yanıtı olmadığından emin olmak için forseps kullanarak arka bacak ayak pedine hafifçe baskı uygulayarak anestezi derinliğinin yeterliliğini kontrol edin.
NOT: Sıçanın büyüklüğüne ve ağırlığına bağlı olarak, anestezi derinliğini izleyin ve izofluran konsantrasyonunu buna göre ayarlayın. - CMAP genliğini ve gecikmesini etkileyebilecek sıcaklık değişikliklerini önlemek için termostatik bir ısıtma plakası kullanarak sıcaklığı 37 °C'de tutun.
- Kuruluğu önlemek için gözlere veteriner petrol bazlı bir merhem sürün. Solunum hızını gözlemleyerek ve forseps ile ayak tabanına baskı uyguladıktan sonra geri çekilme tepkilerini kontrol ederek anestezi derinliğini izleyin.
- Makas kullanarak incelenecek olan göğsün ve boynun alt üçte birlik kısmından tüyleri alın. Tüm deney boyunca farenin solunumunu izleyin.
NOT: CMAP ve MUNE kayıtlarını ve anestezinin kesilmesini takiben, yeterli bilinci yeniden kazanana kadar fareyi gözetimsiz bırakmayın. Tamamen iyileşene kadar hayvanı ev kafesine geri koymayın.
2. Elektrot yerleşimi ve kurulumu
- Şekil 28'de gösterildiği gibi CMAP, SMUP ve MUNE'yi kaydetmek için bir çift 1 G monopolar iğne elektrodu yerleştirin.
- Aktif (E1) iğne elektrodunu, son kaburga sınırının altındaki orta klaviküler çizginin üzerine deri altına ve referans (E2) iğne elektrodunu ksifoid işlemi ile son sternokostal kıkırdak arasındaki açıya deri altına yerleştirin.
NOT: İğne elektrotları diyafram kasına yerleştirilmemelidir; bunun yerine deri altı bölgeye yerleştirilmelidirler.
- Aktif (E1) iğne elektrodunu, son kaburga sınırının altındaki orta klaviküler çizginin üzerine deri altına ve referans (E2) iğne elektrodunu ksifoid işlemi ile son sternokostal kıkırdak arasındaki açıya deri altına yerleştirin.
- Karotis tabakasındaki frenik sinirin uyarılması için, sinir stimülasyonu için katot ve anot olarak bir çift 28 G monopolar iğne elektrotu kullanın ve yaklaşık 1 cm ile ayrılarak ön ve orta skalen kasları arasında lateral boynun üzerine deri altına yerleştirin. Uyarıcı iğnelerin yerleşiminin dördüncü boyun omurlarının (C4) altındaki seviyede olduğundan emin olun.
NOT: Frenik sinirin veya başka bir yapının yaralanmasını önlemek için uyarıcı elektrotları çok derine yerleştirmekten kaçının. Şekil 1'de elektrot yerleşimi gösterilmektedir. - Toprak elektrodu için kuyruğa tek kullanımlık bir yüzey elektrodu yerleştirin.
3. Veri toplama
- Frenik CMAP
- Frenik siniri uyarmak için 0.1 ms süreli ve 60 ila 100 mA arasında değişen yoğunluğa sahip monofazik katodik kare dalga darbeleri uygulayarak frenik CMAP yanıtlarını kaydedin.
- Yanıtın genliği daha fazla artış göstermeyi bırakana kadar uyaran yoğunluğunu aşamalı olarak artırırken CMAP yanıtları elde edin. Supramaksimal stimülasyonu sağlamak için, uyaran yoğunluğunu maksimum bir yanıt ortaya çıkarmak için kullanılan seviyenin yaklaşık% 120'sine yükseltin ve ek bir yanıt kaydedin. CMAP boyutu artık artmıyorsa, bu yanıtı en yüksek CMAP olarak düşünün.
NOT: CMAP kaydı sırasında eşzamanlı kas aktivitesi gürültüsünü en aza indirmek için ekshalasyon sırasında stimülasyon verilmesi tercih edilir. - CMAP'nin tepeden tepeye genliklerini milivolt (mV) cinsinden ölçün ve belgeleyin (Şekil 2).
NOT: CMAP genliği, tabandan tepeye ve tepeden tepeye değerlendirilebilir. Klinik elektrodiagnostik sistemler genellikle, izoelektrik taban çizgisinden ilk negatif tepe noktasına kadar hesaplanan tabandan tepeye değerlendirmek için varsayılan olarak kullanılır.
- Ortalama tek motor ünitesi potansiyeli (SMUP) boyutu ve MUNE hesaplaması
- Artımlı bir stimülasyon tekniği kullanarak ortalama SMUP boyutunu hesaplayın.
- Artımlı yanıtları ortaya çıkarmak için, 1 Hz frekansında 0.1 ms'lik bir süre ile submaksimal stimülasyon uygulayın, minimal ya hep ya hiç yanıtı elde edilene kadar yoğunluğu 0.03 mA'lık artışlarla kademeli olarak artırın. 2 mA ile 10 mA arasında değişen bir uyaran yoğunluğu ile ilk yanıtı elde edin.
- İlk yanıt 2 mA ile 10 mA arasında bir uyaran yoğunluğu ile gerçekleşmezse, gerekli uyaran yoğunluğunu azaltmak veya artırmak için uyarıcı katodun pozisyonunu değiştirin, boyundaki frenik sinire yaklaştırın veya uzaklaştırın, sırasıyla.
- İlk artımlı yanıt, 2 mA ila 10 mA arasında değişen bir uyaran yoğunluğu ile elde edilirse, ilk yanıtı kaydedin ve adım 3.2.2'de aşağıdaki kriterleri karşılayan toplam 9 ek artış elde etmek için 0,03 mA'lık artışlarla ayarlayarak giderek daha yüksek uyaran yoğunluklarına sahip ek artışlar elde edin.
NOT: Her SMUP, her bir artışın bir önceki artıştan çıkarılmasıyla ölçülür.
- Artımlı yanıtları ölçerken, her bir artışın aşağıdaki ölçütleri karşıladığından emin olun:
- Artımlı yanıtların ilk negatif tepe noktasının, maksimum CMAP yanıtının negatif tepe noktasıyla zamansal olarak hizalandığından emin olun.
NOT: Solunum döngülerinden kaynaklanan arka plan gürültüsü nedeniyle gözlemlenen hafif hareketler, deneyin doğası gereğidir. Bununla birlikte, canlı gözlem sırasında SMUP'ların tutarlı bir şekilde bulunması, söz konusu belirli CMAP için kimliklerini doğrular. - Diyafram solunumla ilgili dinamik bir kas olduğundan, her solunum döngüsü temel hareketi indükleyebilir. Bu nedenle, üç yinelenen yanıtta tutarlılığı onaylayarak her artımlı yanıtta kararlılığı ve fraksiyonlama olmadığını doğrulayın.
NOT: Düşük genlikli uyarılmış potansiyelleri, özellikle ilk SMUP'u, solunum aktivitesine bağlı arka plan gürültüsünden ayırt etmek için, uyanık kalmak ve 3-4 solunum döngüsü boyunca gözlemlemek önemlidir. Ayrıca, doğruluk için tepe noktalarının CMAP'ninkilerle hizalandığından emin olun. - Her artışın farklı ve bir öncekinden daha büyük olduğundan emin olun. Bu nedenle, artımlı yanıtları gerçek zamanlı olarak görsel olarak ayırt edin ve bunları daha önce kaydedilen artışların üzerine binerken gözlemleyin.
NOT: Artışlarda tutarlılığı ve önceden tanımlanmış kriterlere uygunluğu sağlamak için her genlikte uyaranın birden fazla kopyası gerçekleştirilebilir. - Her bir artışı yukarıda belirtilen kriterlerle görsel olarak doğruladıktan sonra, artış genliğinin en az 25 μV olduğunu onaylayın. Artış 25 μV'nin altındaysa, ölçümü atın ve yanıtı yeniden değerlendirin.
- 10 artımlı yanıtın kaydedilmesini takiben, her bir artış yanıtının genliğinin, son yanıtın toplam genliğini temsil eden 10 artışın tümünün birleşik genliğinin üçte birinden büyük olmadığını doğrulayın. Bu kriter karşılanmazsa, 10 artımlı yanıtın ölçümünü tekrarlayın.
NOT: Üçte bir eşiği, her bir artımlı yanıtın tek bir motor ünitesinin aktivasyonunu temsil ettiği varsayımına dayanmaktadır. Herhangi bir artımlı yanıtın genliği, on artışın tümünün birleşik genliğinin üçte birini aşarsa, yanıtın yalnızca tek bir motor ünitesinin aktivasyonuna atfedilemeyebileceğini düşündürür. Bunun yerine, ek motor ünitelerin işe alınmasından veya elektriksel gürültü veya artefaktlar gibi spesifik olmayan aktivitelerin varlığından etkilenebilir22,26. - SMUP'ların ortalama genliğini tahmin etmek için, 10 artışın değerlerinin ortalamasını alın. Ortalama SMUP genliğini ölçmenin başka bir yöntemi, son artımlı yanıtın tüm genliğini toplam artış sayısına11 bölmektir.
- Artımlı yanıtların ilk negatif tepe noktasının, maksimum CMAP yanıtının negatif tepe noktasıyla zamansal olarak hizalandığından emin olun.
- Maksimum CMAP genliğini (tepeden tepeye) ortalama SMUP genliğine (tepeden tepeye) bölerek MUNE'yi belirleyin. Bazı elektrofizyolojik sistemlerde, SMUP'lar mikrovolt (μV) cinsinden kaydedilirken, CMAP genellikle milivolt (mV) cinsinden ifade edilir. Gerekirse, MUNE'yi hesaplamadan önce CMAP ve SMUP ölçümlerini aynı birimlere dönüştürün.
NOT: Tepeden tepeye CMAP, ortalama SMUP ve MUNE tipik olarak klinik elektromiyografi sistemleri tarafından otomatik olarak hesaplanır: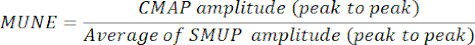
CMAP = Bileşik Kas Aksiyon Potansiyeli
SMUP = Tek Motor Ünite Potansiyeli
MUNE = Motor Birim Sayısı Tahmini
- Artımlı bir stimülasyon tekniği kullanarak ortalama SMUP boyutunu hesaplayın.
Sonuçlar
Bu raporda özetlenen CMAP, SMUP ve MUNE teknikleri, minimal invaziv elektrot yerleştirilerek diyafram kasındaki nöromüsküler fonksiyonun kaydedilmesini sağlar (Şekil 1). Genlik ve alan parametreleri, supramaksimal CMAP boyutunu karakterize etmek için kullanılabilir ve kas grubu çıktısının genel bir ölçüsünü sağlar (Şekil 2). Bununla birlikte, mevcut yöntemlerimizde, hem CMAP hem de SMUP boyutlarını ölç...
Tartışmalar
ALS gibi MN dejeneratif hastalıklarda, ventilasyonda yer alan MU'ların değerlendirilmesi çok önemlidir28. ALS hastalarında respiratuar MN dejenerasyonu ortaya çıkmasına rağmen, MN ölümünün spesifik başlangıcı ve ilerlemesi tam olarak anlaşılamamıştır 29,30,31. Bu yönün önemini kabul ederek, hem genetik temelli (örneğin, SOD1
Açıklamalar
WDA, NMD Pharma, Avidity Biosciences'tan araştırma fonu ve NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics, Catalyst Pharmaceuticals ve Novartis'ten danışmanlık ücretleri aldı.
Teşekkürler
Bu çalışma, Missouri Omurilik Yaralanması/Hastalığı Araştırma Programı'ndan (NLN ve WDA) Omurilik Yaralanması/Hastalığı Araştırma Programı Hibesi ile finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| 50 mL, Model 705 RN syringe | Hamilton Company | 7637-01 | Utilized to conduct intrapleural injection |
| 5008 - Formulab Diet | LabDiet | 0001325 | |
| Autoclavable 26 G needles (26S RN 9.52 mm 40°) | Hamilton Company | 7804-04 | Utilized to conduct intrapleural injection |
| Cholera toxin B-subunit (CTB) | MilliporeSigma | C9903 | Utilized for intrapleural injection to label surviving motor neurons |
| Cholera toxin B-subunit conjugated to saporin (CTB-SAP) | Advanced Targeting Systems | IT-14 | Utilized for intrapleural injection to cause motor neuron death |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes- recording electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | ||
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Saporin (SAP) | Advanced Targeting Systems | PR-01 | Utilized for intrapleural injection (control agent when injected by itself) |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | portable electrodiagnostic system | |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Sprague-Dawley rat | Envigo colony 208a, Indianapolis, IN | ||
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Referanslar
- Mantilla, C. B., Zhan, W. -. Z., Sieck, G. C. Retrograde labeling of phrenic motoneurons by intrapleural injection. J Neurosci Methods. 182 (2), 244-249 (2009).
- Nichols, N. L., Satriotomo, I., Harrigan, D. J., Mitchell, G. S. Acute intermittent hypoxia induced phrenic long-term facilitation despite increased sod1 expression in a rat model of als. Exp Neurol. 273, 138-150 (2015).
- Nichols, N. L., Craig, T. A., Tanner, M. A. Phrenic long-term facilitation following intrapleural ctb-sap-induced respiratory motor neuron death. Respir Physiol Neurobiol. 256, 43-49 (2018).
- Kiernan, M. C., et al. Amyotrophic lateral sclerosis. Lancet. 377 (9769), 942-955 (2011).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant sod1g93a model of amyotrophic lateral sclerosis. Muscle Nerve. 41 (6), 774-784 (2010).
- Shibuya, K., et al. Motor cortical function determines prognosis in sporadic als. Neurology. 87 (5), 513-520 (2016).
- Lewelt, A., et al. Compound muscle action potential and motor function in children with spinal muscular atrophy. Muscle Nerve. 42 (5), 703-708 (2010).
- Mcgovern, V. L., et al. Smn expression is required in motor neurons to rescue electrophysiological deficits in the smnδ7 mouse model of sma. Hum Mol Genet. 24 (19), 5524-5541 (2015).
- Arnold, W. D., et al. Electrophysiological biomarkers in spinal muscular atrophy: Preclinical proof of concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
- Harrigan, M. E., et al. Assessing rat forelimb and hindlimb motor unit connectivity as objective and robust biomarkers of spinal motor neuron function. Sci Rep. 9 (1), 16699 (2019).
- Arnold, W. D., et al. Electrophysiological motor unit number estimation (mune) measuring compound muscle action potential (cmap) in mouse hindlimb muscles. J. Vis. Exp: JoVE. (103), e52899 (2015).
- Martin, M., Li, K., Wright, M. C., Lepore, A. C. Functional and morphological assessment of diaphragm innervation by phrenic motor neurons. J. Vis. Exp: JoVE. (99), e52605 (2015).
- Mccomas, A., Fawcett, P. R. W., Campbell, M., Sica, R. Electrophysiological estimation of the number of motor units within a human muscle. J Neurol Neurosurg Psychiatry. 34 (2), 121-131 (1971).
- Felice, K. J. A longitudinal study comparing thenar motor unit number estimates to other quantitative tests in patients with amyotrophic lateral sclerosis. Muscle Nerve. 20 (2), 179-185 (1997).
- Vucic, S., Rutkove, S. B. Neurophysiological biomarkers in amyotrophic lateral sclerosis. Curr Opin Neurol. 31 (5), 640-647 (2018).
- Carleton, S., Brown, W. Changes in motor unit populations in motor neurone disease. J Neurol Neurosurg Psychiatry. 42 (1), 42-51 (1979).
- Yuen, E. C., Olney, R. K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis. Neurology. 49 (2), 573-578 (1997).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Henderson, R. D., Ridall, P. G., Hutchinson, N. M., Pettitt, A. N., Mccombe, P. A. Bayesian statistical mune method. Muscle Nerve. 36 (2), 206-213 (2007).
- Shefner, J., et al. Multipoint incremental motor unit number estimation as an outcome measure in als. Neurology. 77 (3), 235-241 (2011).
- Stein, R. B., Yang, J. F. Methods for estimating the number of motor units in human muscles. Ann Neurol. 28 (4), 487-495 (1990).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clin Neurophysiol. 112 (6), 955-964 (2001).
- Ahad, M., Rutkove, S. Correlation between muscle electrical impedance data and standard neurophysiologic parameters after experimental neurogenic injury. Physiol Meas. 31 (11), 1437 (2010).
- Kasselman, L. J., Shefner, J. M., Rutkove, S. B. Motor unit number estimation in the rat tail using a modified multipoint stimulation technique. Muscle Nerve. 40 (1), 115-121 (2009).
- Ngo, S., et al. The relationship between bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and sod1g93a mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Feasby, T., Brown, W. Variation of motor unit size in the human extensor digitorum brevis and thenar muscles. J Neurol Neurosurg Psychiatry. 37 (8), 916-926 (1974).
- Nichols, N. L., Vinit, S., Bauernschmidt, L., Mitchell, G. S. Respiratory function after selective respiratory motor neuron death from intrapleural ctb-saporin injections. Exp Neurol. 267, 18-29 (2015).
- Nichols, N. L., et al. Ventilatory control in als. Respir Physiol Neurobiol. 189 (2), 429-437 (2013).
- Cifra, A., Nani, F., Nistri, A. Respiratory motoneurons and pathological conditions: Lessons from hypoglossal motoneurons challenged by excitotoxic or oxidative stress. Respir Physiol Neurobiol. 179 (1), 89-96 (2011).
- Kobayashi, Z., et al. Fals with gly72ser mutation in sod1 gene: Report of a family including the first autopsy case. J Neurol Sci. 300 (1), 9-13 (2011).
- Su, M., Wakabayashi, K., Tanno, Y., Inuzuka, T., Takahashi, H. An autopsy case of amyotrophic lateral sclerosis with concomitant alzheimer's and incidental lewy body diseases. No to shinkei= Brain and nerve. 48 (10), 931-936 (1996).
- Lladó, J., et al. Degeneration of respiratory motor neurons in the sod1 g93a transgenic rat model of als. Neurobiol Dis. 21 (1), 110-118 (2006).
- Borkowski, L. F., Smith, C. L., Keilholz, A. N., Nichols, N. L. Divergent receptor utilization is necessary for phrenic long-term facilitation over the course of motor neuron loss following ctb-sap intrapleural injections. J Neurophysiol. 126 (3), 709-722 (2021).
- Nicolopoulos-Stournaras, S., Iles, J. F. Motor neuron columns in the lumbar spinal cord of the rat. J Comp Neurol. 217 (1), 75-85 (1983).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: An approach to maximize uptake and transduction of spinal cord motor neurons. Sci Rep. 6 (1), 33058 (2016).
- Mchanwell, S., Biscoe, T. The localization of motoneurons supplying the hindlimb muscles of the mouse. Phil. Trans. R. , 477-508 (1981).
- Nair, J., et al. Histological identification of phrenic afferent projections to the spinal cord. Respir Physiol Neurobiol. 236, 57-68 (2017).
- Courtine, G., et al. Can experiments in nonhuman primates expedite the translation of treatments for spinal cord injury in humans. Nat Med. 13 (5), 561-566 (2007).
- Friedli, L., et al. Pronounced species divergence in corticospinal tract reorganization and functional recovery after lateralized spinal cord injury favors primates. Sci Transl Med. 7 (302), 134 (2015).
- Arnold, R., et al. Nerve excitability in the rat forelimb: A technique to improve translational utility. J Neurosci Methods. 275, 19-24 (2017).
- Boriek, A., Rodarte, J., Reid, M. Shape and tension distribution of the passive rat diaphragm. Am J Physiol Regul Integr Comp Physiol. 280, R33-R41 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır