A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج الأمعاء على الرقاقة المناعي لتحليل الاستجابات المناعية المخاطية للأمعاء
* These authors contributed equally
In This Article
Summary
يحدد بروتوكولنا التفصيلي إنشاء واستخدام نموذج الأمعاء على الرقاقة المتقدم ، والذي يحاكي الغشاء المخاطي المعوي البشري مع هياكل 3D وأنواع الخلايا المختلفة ، مما يتيح التحليل المتعمق للاستجابات المناعية والوظائف الخلوية استجابة للاستعمار الميكروبي.
Abstract
تم تطوير نموذج متقدم للأمعاء على الرقاقة يعيد إنشاء هياكل ظهارية 3D تشبه الزغابات العضوية وتشبه السرداب. يشمل نموذج الكفاءة المناعية الخلايا البطانية للوريد السري البشري (HUVEC) ، والخلايا الظهارية المعوية Caco-2 ، والبلاعم المقيمة في الأنسجة ، والخلايا المتغصنة ، التي تنظم نفسها ذاتيا داخل الأنسجة ، وتعكس خصائص الغشاء المخاطي المعوي البشري. يتمثل أحد الجوانب الفريدة لهذه المنصة في قدرتها على دمج الخلايا المناعية الأولية البشرية المنتشرة ، مما يعزز الأهمية الفسيولوجية. تم تصميم النموذج للتحقيق في استجابة الجهاز المناعي المعوي للاستعمار والعدوى البكتيرية والفطرية. نظرا لحجم تجويفه الموسع ، يقدم النموذج قراءات وظيفية متنوعة مثل مقايسات التخلل ، وإطلاق السيتوكين ، وتسلل الخلايا المناعية ، وهو متوافق مع قياس التألق المناعي لهياكل 3D التي شكلتها طبقة الخلايا الظهارية. يوفر بموجب هذا رؤى شاملة حول تمايز الخلايا ووظيفتها. أثبتت منصة الأمعاء على الرقاقة إمكاناتها في توضيح التفاعلات المعقدة بين بدائل الجراثيم الحية والأنسجة المضيفة البشرية داخل منصة رقاقة حيوية فسيولوجية دقيقة.
Introduction
تمثل أنظمة Organ-on-Chip (OoC) تقنية ناشئة لثقافة الخلايا 3D القادرة على سد الفجوة بين زراعة الخلايا 2D التقليدية والنماذج الحيوانية. تتكون منصات OoC عادة من حجرة واحدة أو أكثر تحتوي على خلايا خاصة بالأنسجة تنمو على مجموعة واسعة من السقالات مثل الأغشية أو الهلاميات المائية1. النماذج قادرة على محاكاة واحدة أو أكثر من وظائف النمط العضوي المحددة. تتيح المضخات التروية الدقيقة المستمرة لوسط زراعة الخلايا لإزالة الفضلات الخلوية ، وتزويدها بعوامل التغذية والنمو لتحسين التمايز الخلوي ، وإعادة إنشاء الظروف الأساسية في الجسم الحي. مع تكامل الخلايا المناعية ، يمكن لأنظمة OoC محاكاة الاستجابة المناعية البشرية في المختبر2. حتى الآن ، تم تقديم مجموعة واسعة من الأجهزة والوحدات الوظيفية1. وتشمل هذه الأنظمة نماذج من الأوعية الدموية3 والرئة4 والكبد 2,5 والأمعاء6 التي يمكن تسهيلها لاختبار المخدرات 5,7 ودراسات العدوى 6,8.
نقدم هنا نموذجا للأمعاء البشرية على الرقاقة يدمج الخلايا الظهارية البشرية التي تشكل تضاريس 3D العضوية للهياكل الشبيهة بالزغابات والشبيهة بالقبو جنبا إلى جنب مع بطانة البطانة والبلاعم المقيمة في الأنسجة. يتم استزراع النموذج في رقاقة حيوية مائعة دقيقة في شكل شريحة مجهرية. تتكون كل رقاقة حيوية من تجويفين منفصلين للسوائع الدقيقة. ينقسم كل تجويف بواسطة غشاء بولي إيثيلين تيريفثاليت مسامي (PET) إلى غرفة علوية وسفلية. يعمل الغشاء نفسه أيضا كسقالة لنمو الخلايا على كل جانب. تتيح مسام الغشاء الحديث الخلوي وهجرة الخلايا بين طبقات الخلايا. يمكن الوصول إلى كل غرفة عن طريق منفذين بحجم قفل luer. اختياريا ، يمكن أن يوفر منفذ إضافي بحجم قفل صغير الوصول إلى الغرفة العلوية أو السفلية (الشكل 1).
تقدم منصة OoC عددا من القراءات التي يمكن الحصول عليها من تجربة واحدة. تم تصميم الأمعاء على الرقاقة من أجل الجمع بين ثقافة الخلايا ثلاثية الأبعاد المثقوبة ، وتحليل النفايات السائلة ، والفحص المجهري الفلوري لتقييم تعبير علامة الخلية ، ومعدلات الأيض ، والاستجابة المناعية ، والاستعمار الميكروبي والعدوى ، ووظيفة الحاجز3،6،8. يتضمن النموذج الخلايا المناعية المقيمة في الأنسجة والاتصال المباشر للكائنات الحية الدقيقة مع الأنسجة المضيفة ، وهي فائدة مقارنة بالنماذج المنشورةالأخرى 9. علاوة على ذلك ، تنظم الخلايا الظهارية نفسها في هياكل ثلاثية الأبعاد توفر واجهة ذات صلة من الناحية الفسيولوجية للاستعمار مع ميكروبيوتا حية6.
Access restricted. Please log in or start a trial to view this content.
Protocol
يتطلب هذا البروتوكول الوصول إلى ~ 20 مل من الدم الطازج لكل رقاقة حيوية من المتبرعين الأصحاء لعزل الخلايا الوحيدة البشرية الأولية. أعطى جميع المتبرعين موافقة خطية مستنيرة للمشاركة في هذه الدراسة ، والتي تمت الموافقة عليها من قبل لجنة الأخلاقيات في مستشفى جامعة جينا (رقم الإذن 2018-1052-BO). للحصول على تفاصيل حول المواد، راجع جدول المواد. للحصول على تفاصيل حول تكوين جميع الحلول والوسائط ، راجع الجدول 1.
1. ملاحظات عامة للتعامل مع الرقاقة الحيوية
- افصل شريط من الخزانات بعناية وافصل الأغطية باستخدام سكين ساخن للحصول على خزانات وأغطية مفردة. قم بتوسيع فتحة الغطاء بحيث يتناسب أنبوب السيليكون بشكل مريح.
- يبلغ قطر أنبوب السيليكون الداخلي 0.5 مم ، وهو غير متماثل ، ويتم فصله إلى جوانب أطول (20 سم) وأقصر (12 سم) بواسطة سدادتين للمضخة التمعجية. قم بتجميع أنبوبين من كل تناظر لكل رقاقة حيوية عن طريق ربط أنبوب بوصلة قفل luer ذكر والغطاء على الجانب المقابل من الأنبوب. أيضا تجميع أربعة خزانات لكل رقاقة حيوية.
ملاحظة: تحضير الأنابيب والخزانات مسبقا وتعقيمها عن طريق التعقيم قبل الاستخدام. نظرا لأن أنبوب السيليكون له عمر محدود ، قم بتبادل الأنبوب بعد 3-5 تجارب. بالنسبة لبعض الاهتمامات البحثية ، مثل اختبار الأدوية ، ينصح بإعداد أنابيب جديدة لكل تجربة. تعمل العديد من خطوات هذا البروتوكول بالتوازي. ارجع إلى الشكل العام ، الذي يسلط الضوء على الخطوات المختلفة التي تم تنفيذها في يوم واحد كما هو موضح في الشكل 2.
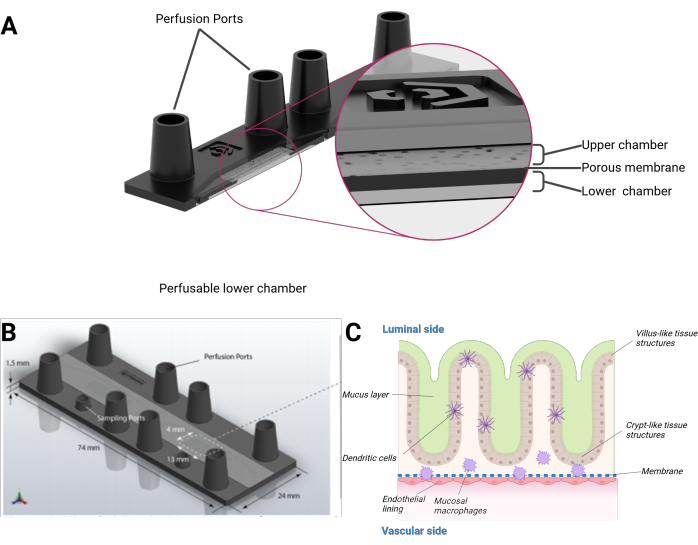
الشكل 1: تمثيل تخطيطي لنموذج الأمعاء على الرقاقة. (أ) تعرض الرقاقة الحيوية في عرض مقطعي. (ب) يكون بعد الرقاقة الحيوية بأكملها وكذلك غشاء PET المسطح القابل للإزالة مرئيا. الحجم الإجمالي للغرفة العلوية بما في ذلك منافذ حجم قفل luer الأنثوية هو 290 ميكرولتر و 270 ميكرولتر للغرفة السفلية على التوالي. (ج) يمكن رؤية التركيب التخطيطي للرقاقة الحيوية المعوية، وهي ظهارة نتوء ثلاثية الأبعاد تشبه التراكيب الشبيهة بالزغابات والتراكيب الشبيهة بالسرداب، بما في ذلك الخلايا المناعية المتمايزة وطبقة مخاطية. الجانب الآخر من غشاء PET مغطى بطبقة أحادية البطانية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
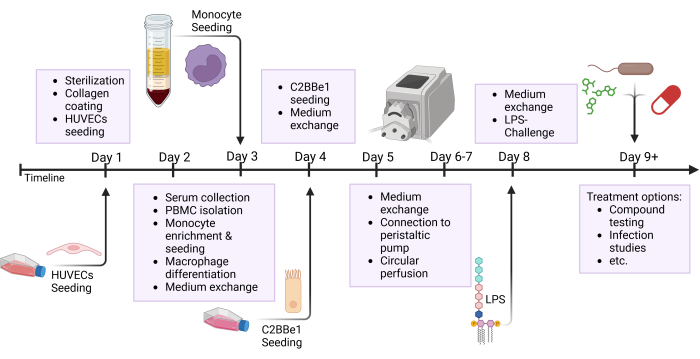
الشكل 2: نظرة عامة تخطيطية على الجدول الزمني لبناء النموذج والإعداد التجريبي. يوضح هذا الشكل النظرة العامة التخطيطية للبروتوكول المقدم. يشار إلى الإجراءات الهامة ، مثل بذر الخلايا والتحدي الظهاري مع LPS بواسطة الأسهم. الاختصارات: HUVECs = الخلايا البطانية الوريدية السرية البشرية. LPS = عديد السكاريد الشحمي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تعقيم الرقائق الحيوية
- ملء طبق بتري الزجاج المعقم ، التي يبلغ قطرها 15 سم ، مع 70 ٪ من الإيثانول غير المشوه. ضع الرقاقة الحيوية بالداخل بحيث يتم تغطية جميع منافذ الرقاقة الحيوية بالكامل بمحلول الإيثانول.
- مرتين لكل منفذ ، اسحب 1 مل من الإيثانول بنسبة 70٪ عبر جميع غرف الشريحة. احتضان لمدة 45-60 دقيقة في درجة حرارة الغرفة (RT).
ملاحظة: تأكد من عدم وجود هواء محاصر داخل الرقاقة الحيوية. من هذه النقطة فصاعدا ، يجب ألا يدخل أي هواء إلى نظام الرقاقة الحيوية ، ويجب أن تظل التجاويف مملوءة بالسائل. - قم بإزالة الإيثانول في طبق بتري واستبدله بالماء المقطر المزدوج المعقم (ddH2O) حتى يتم تغطية جميع المنافذ بالكامل. مرة أخرى ، مرتين لكل منفذ ، ارسم 1 مل من ddH2O من خلال تجويف الرقاقة الحيوية. قم بتحديث ddH2O في طبق بتري وكرر الإجراء.
- إزالة كل السائل من طبق بتري. بعد ذلك ، احتفظ بالرقائق الحيوية المعقمة بالكامل داخل طبق بتري المغلق كلما كانت خارج بيئة معقمة. أضف خزانا صغيرا (على سبيل المثال ، غطاء أنبوب سعة 50 مل) من 2-5 مل ddH2O إلى طبق بتري لتقليل تبخر السائل داخل الرقاقة الحيوية.
ملاحظة: يمكن تعقيم الرقائق الحيوية حتى 3 أيام مقدما إذا تم الاحتفاظ بها في بيئة معقمة حتى الاستخدام. وهذا يسمح بالمرونة في عبء العمل في يوم واحد.
3. حصاد HUVECs والبذر
ملاحظة: تم عزل الخلايا البطانية الوريدية السرية البشرية (HUVECs) من الحبال السرية كما تم نشره قبل10.
- قبل بذر HUVECs ، قم بتغطية الغشاء بالكولاجين البشري الوريدي. لهذا ، قم بإعداد تخفيف 1: 100 من محلول مخزون الكولاجين (الجدول 1) في محلول ملحي مخزن بالفوسفات من Dulbecco يحتوي على المغنيسيوم والكالسيوم (PBS +/+). أضف 350 ميكرولتر من محلول المخزون المخفف إلى الغرفة المعنية. احتضان لمدة 5 دقائق في RT.
ملاحظة: في حالة التعامل مع الرقاقة الحيوية في الغطاء المعقم ، نوصي بوضع نسيج معقم تحتها لجمع الوسط الزائد. - اغسل جميع الغرف مرتين باستخدام 350 ميكرولتر من PBS +/+ لغسل الكولاجين المتبقي وحمض الخليك. ثم أضف 350 ميكرولتر من وسط نمو الخلايا البطانية (EC) إلى كل غرفة.
ملاحظة: من هنا ، تكون الرقائق الحيوية جاهزة لبذر الخلايا ويمكن تخزينها عند 37 درجة مئوية حتى الاستخدام. - استخدم HUVECs في الممرات 1-3 عند التقاء الخلايا بنسبة 80-90٪. قم بزراعة HUVECs في وسط EC يحتوي على مزيج مكمل محدد توفره الشركة المصنعة. يتم عرض صورة برايت فيلد تمثيلية لمزرعة خلايا HUVEC في الشكل 3A.
ملاحظة: اعتمادا على الجهة المانحة ، يمكن أن تبدأ HUVECs للممرات الأعلى في عدم التمايز ولا يمكنها تشكيل طبقة أحادية كثيفة ومتقاربة بشكل موثوق داخل الرقاقة الحيوية. استخدام المضادات الحيوية ، أي 100 وحدة / مل من البنسلين و 100 ميكروغرام / مل من الستربتومايسين ، اختياري ولكن يوصى به كمكمل لوسط EC لمنع التلوث الميكروبي. - قم بإزالة وسط زراعة الخلايا من قارورة زراعة الخلايا T25 واغسل الخلايا برفق باستخدام 3-5 مل من محلول ملحي مخزن بالفوسفات من Dulbecco بدون المغنيسيوم والكالسيوم (PBS -/-). قم بإزالة PBS -/- وأضف 1 مل من كاشف تفكك التربسين (الجدول 1). احتضان لمدة 5 دقائق عند 37 درجة مئوية حتى تنفصل الخلايا عن دورق زراعة الخلايا.
- انقل الخلايا المنفصلة إلى أنبوب باستخدام 9 مل من مصل بقري الجنين 5٪ (FBS) في PBS -/-. أجهزة الطرد المركزي في 350 × غرام لمدة 5 دقائق في RT. إزالة طاف، وإعادة تعليق في 1 مل من EC- المتوسطة ، وتحديد عدد الخلايا. اضبط تركيز الخلية على 0.4 × 106 خلايا لكل 150 ميكرولتر (البذر في الغرفة السفلية) أو لكل 250 ميكرولتر (البذر في الغرفة العلوية).
- أضف حجم الخلايا المعنية إلى الغرفة. في حالة البذر في الغرفة السفلية ، أغلق جميع المنافذ وضع الرقاقة الحيوية على الفور رأسا على عقب حتى تسقط الخلايا على غشاء PET. احتضان الرقائق الحيوية في حاضنة مرطبة عند 37 درجة مئوية و 5٪ CO2.
- قم بإجراء تبادل متوسط للغرفة المحتوية على HUVEC مع 350 ميكرولتر من وسط EC بعد 24 ساعة. لا يلزم استبدال الوسيط الموجود في الغرفة المعارضة.
4. جمع المصل البشري وعزل الخلايا الوحيدة المشتقة من خلايا الدم أحادية النواة المحيطية (PBMC)
ملاحظة: تم عزل PBMCs كما هو موضح في Mosig et al.11.
- سحب الدم الوريدي البشري من المتبرعين الأصحاء. لكل رقاقة حيوية ، قم بشراء ما لا يقل عن 10 مل من الدم الكامل في أنابيب جمع الدم المحتوية على السيليكات لجمع المصل. بعد التخثر الكامل ، قم بطرد أنابيب جمع الدم عند 2500 × جم لمدة 10 دقائق في RT. اجمع المصل والقسمة واحفظها في -20 درجة مئوية حتى الاستخدام مرة أخرى.
- شراء ما لا يقل عن 10 مل من الدم الكامل من نفس المتبرع في أنابيب جمع الدم المحتوية على EDTA لعزل PBMC. امزج الدم غير المتخثر برفق 1: 1 مع المخزن المؤقت ISO (الجدول 1) عن طريق الانقلاب وقم ببطء بوضع طبقة 35 مل من هذا الخليط فوق 15 مل من وسط تدرج الكثافة بكثافة 1.077 جم / مل في أنبوب سعة 50 مل.
- جهاز طرد مركزي عند 800 × جم لمدة 20 دقيقة بدون فرامل في RT. اسحب بعناية طبقة الخلايا المناعية الناتجة ، التي تظهر أعلى وسط تدرج الكثافة ، وانقلها إلى أنبوب جديد سعة 50 مل. املأ ما يصل إلى 50 مل بمحلول iso بارد واغسل الخلايا عن طريق الانقلاب اللطيف.
- جهاز طرد مركزي عند 200 × جم لمدة 8 دقائق بدون فرامل عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليقها في 10 مل من المخزن المؤقت iso لكل تدرج كثافة. اختياري: قم بتجميع PBMCs لمتبرع واحد إذا تم تشغيل عدة تدرجات بالتوازي.
- جهاز طرد مركزي عند 150 × جم لمدة 8 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليق الحبيبات في 10 مل من المخزن المؤقت iso لكل تدرج كثافة. كرر خطوة الطرد المركزي 4.4. أخيرا ، تخلص من المادة الطافية وأعد تعليق الخلايا في 2 مل من وسط تمايز الوحيدات (الجدول 1).
ملاحظة: تؤدي إضافة M-CSF و GM-CSF إلى فرض تمايز الخلايا الوحيدة المعزولة نحو الضامة المشتقة من الخلايا الوحيدة والخلايا المتغصنة المشتقة من الخلايا الوحيدة (بالاشتراك مع عديد السكاريد الدهني [LPS] ، والذي تمت إضافته في نقطة لاحقة من هذا البروتوكول). استخدام المضادات الحيوية ، أي 100 وحدة / مل من البنسلين و 100 ميكروغرام / مل من الستربتومايسين ، اختياري ولكن يوصى به كمكمل للوسط لمنع التلوث الميكروبي. - تحديد عدد الخلايا والبذور ~ 10 × 106 خلايا لكل بئر من صفيحة 6 آبار في 2 مل من وسط تمايز الخلايا الوحيدة (الجدول 1). احتضان في حاضنة مرطبة عند 37 درجة مئوية لمدة 1 ساعة للسماح بربط الخلايا الوحيدة ببلاستيك اللوحة المكونة من 6 آبار.
- تخلص بعناية من المادة الطافية واغسل 2x باستخدام 2 مل مسخن مسبقا من وسط الخلية المكونة للدم لإزالة الخلايا غير المنضمة. احتضان عند 37 درجة مئوية لمدة 24 ساعة أخرى في وسط تمايز وحيدات.
- لحصاد الخلايا الوحيدة ، تخلص بعناية من المادة الطافية واغسلها مرة واحدة باستخدام 2 مل من برنامج تلفزيوني مسخن -/-. انظر الشكل 3B للحصول على مثال لصورة حقل ساطع لثقافة الوحيدات في هذه المرحلة. بعد ذلك ، احتضان الخلايا لمدة 7 دقائق في 1 مل من كاشف انفصال الخلايا الوحيدة المسخن مسبقا (الجدول 1) عند 37 درجة مئوية لفرض انفصال الخلايا الوحيدة عن بلاستيك اللوحة المكونة من 6 آبار.
- نقل الوحيدات المنفصلة إلى أنبوب منخفض الربط. اختياري: لتحقيق إنتاجية أعلى للخلية ، اغسل بعناية اللوحة المكونة من 6 آبار عدة مرات باستخدام PBS -/-.
- جهاز طرد مركزي عند 300 × جم لمدة 8 دقائق في RT. تخلص من المادة الطافية وأعد تعليقها في وسط مكيف EC (الجدول 1). حدد رقم الخلية واضبط تركيز الخلية على 0.1 × 106 خلايا لكل 150 ميكرولتر (البذر في التجويف السفلي) أو لكل 250 ميكرولتر (البذر في التجويف العلوي).
ملاحظة: كن لطيفا في جميع خطوات عزل الخلايا المناعية وقلل من قوى القص لمنع تنشيط الخلايا المناعية. عند إنشاء هذا العزل ، تحقق من نقاء الخلايا الوحيدة المشتقة من PBMC (على سبيل المثال ، عن طريق قياس التدفق الخلوي). يجب أن يكون أكثر من 95٪ من جميع الخلايا إيجابيا لعلامات الوحيدات النموذجية مثل CD14.
5. البذر وحيدات
- قم بإجراء تبادل متوسط في الغرفة المحتوية على HUVEC مع 350 ميكرولتر من الوسط المكيف EC المسخن مسبقا.
- أضف 150 ميكرولتر (الغرفة السفلية) أو 250 ميكرولتر (الغرفة العلوية) من تعليق الوحيدات المحضر (انظر الخطوة 4.10) إلى نفس الغرفة. في حالة البذر في الغرفة السفلية ، أغلق جميع المنافذ وضع الرقاقة الحيوية على الفور رأسا على عقب حتى تسقط الخلايا على طبقة HUVEC. احتضان الرقاقة الحيوية في حاضنة مرطبة عند 37 درجة مئوية و 5٪ CO2.
- قم بإجراء تبادل متوسط في الغرفة المحتوية على HUVEC + monocyte مع 350 ميكرولتر من الوسط المكيف EC كل 24 ساعة.
6. C2BBe1 الحصاد والبذر
ملاحظة: تستخدم خلايا التعبير عن حدود فرشاة Caco-2 1 (C2BBe1) 12 حتى الممر 35 وهي مأخوذة من قوارير التقاء 80-90٪. يتم عرض صورة برايت فيلد تمثيلية لثقافة C2BBe1 في الشكل 3C.
- زراعة خلايا C2BBe1 في وسط C2 (الجدول 1).
ملاحظة: استخدام المضادات الحيوية ، أي 20 ميكروغرام / مل جنتاميسين ، اختياري ولكن يوصى به كمكمل لوسط C2 لمنع التلوث الميكروبي. - قم بإزالة وسط زراعة الخلايا في قارورة زراعة الخلايا T25 واغسل الخلايا برفق باستخدام 3-5 مل من PBS -/-. قم بإزالة PBS -/- وأضف 1 مل من كاشف تفكك التربسين (الجدول 1). احتضان لمدة 5 دقائق عند 37 درجة مئوية حتى تنفصل الخلايا عن دورق زراعة الخلايا.
- نقل الخلايا المنفصلة إلى أنبوب باستخدام 9 مل من 5٪ مصل بقري جنيني (FBS) في PBS -/-. أجهزة الطرد المركزي في 350 × غرام لمدة 5 دقائق في RT. إزالة طاف، وإعادة تعليق في 1 مل من C2-medium، وتحديد عدد الخلايا. اضبط تركيز الخلية على 0.5 × 106 خلايا لكل 150 ميكرولتر (البذر في الغرفة السفلية) أو لكل 250 ميكرولتر (البذر في الغرفة العلوية).
- قبل بذر C2BBe1 ، اغسل الغرفة المعنية برفق ب 350 ميكرولتر من C2-medium.
- أضف 150 ميكرولتر (الغرفة السفلية) أو 250 ميكرولتر (الغرفة العلوية) من تعليق C2BBe1 المجهز (انظر الخطوة 6.3) إلى الغرفة المعنية. في حالة البذر في الغرفة السفلية ، أغلق جميع المنافذ وضع الرقاقة الحيوية على الفور رأسا على عقب حتى تسقط الخلايا على غشاء PET. احتضان الرقائق الحيوية في حاضنة مرطبة عند 37 درجة مئوية و 5٪ CO2.

الشكل 3: مورفولوجيا الخلية ل HUVECs والوحيدات و C2BBe1 قبل البذر في الرقاقة الحيوية. يوضح هذا الشكل صورا تمثيلية لمصادر الخلايا المختلفة المستخدمة في جميع أنحاء البروتوكول. تم التقاط الصور باستخدام مجهر برايت فيلد العكسي باستخدام تكبير 10x. تمت زراعة جميع أنواع الخلايا ، (أ) HUVECs ، (B) وحيدات ، و (C) C2BBe1 في زراعة الخلايا أحادية الطبقة ثنائية الأبعاد كما هو موضح في أقسام البروتوكول الخاصة بها. قضبان المقياس = 200 ميكرومتر. الاختصارات: HUVECs = الخلايا البطانية الوريدية السرية البشرية. PBMCs = خلايا الدم أحادية النواة المحيطية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. اتصال لمضخة التمعج والتروية الدائرية
- تحضير حاضنة فارغة مع إضافة مضخة تمعجية. قم بتنظيف جميع مناطق الحاضنة تماما والمضخة بمطهر لتوفير بيئة شبه معقمة.
ملاحظة: يمكن أن تنتج المضخات التمعجية الكثير من الحرارة أثناء العمل. في الحاضنات المعزولة جيدا أو المختبرات سيئة التكييف ، قد يكون عدد المضخات القابلة للاستخدام لكل حاضنة محدودا لأن الحاضنات تميل إلى ارتفاع درجة الحرارة. يجب أن تكون مضختان تمعجيتان لكل حاضنة كافية. - قبل توصيل الأنابيب المعقمة بالرقاقة الحيوية ، اغسل كل أنبوب ب 700 ميكرولتر من PBS +/+ متبوعا ب 500 ميكرولتر من وسط C2 أو وسط مكيف EC. قم بإعداد أنبوب واحد من كل تناظر لكل وسيط (انظر الخطوة 1.2). استخدم الأنبوب بمسافة قصيرة من قفل luer إلى سدادة المضخة التمعجية للتجويف الأيسر والأنبوب مع التماثل الآخر للتجويف الأيمن.
- استرجع الرقاقة الحيوية من الحاضنة وقم بإجراء تبادل متوسط مع 350 ميكرولتر لكل غرفة. قم بإزالة جميع المقابس واملأ جميع المنافذ إلى الأعلى.
- بدءا من التجويف الأيسر ، قم بتوصيل الأنبوب الأول بالمنفذ الأيمن للغرفة العلوية عن طريق إدخال محول قفل luer في منفذ الرقاقة الحيوية. ثم قم بتوصيل الأنبوب الثاني بالمنفذ الأيسر للغرفة السفلية. كرر هذا الإجراء لتجويف الموائع الدقيقة الصحيح.
- خذ خزانا وأضف قطرة صغيرة من وسط زراعة الخلايا إلى قاع الخزان. ثم أدخل الخزان على الجانب الآخر من الأنبوب الأول وكرر للغرفة الأخرى. بمجرد توصيل جميع المنافذ بأنبوب أو خزان ، املأ الخزانات ب 3.5 مل من وسط زراعة الخلايا.
- ضع الجانب السائب من الأنبوب ، الذي يحتوي على غطاء متصل به ، أعلى الخزان لإغلاق نظام الموائع الدقيقة لكل غرفة. في هذه الحالة ، انقل الرقاقة الحيوية إلى المضخة التمعجية.
ملاحظة: اعتمادا على المسافة إلى الحاضنة ومحيط المختبر ، يمكن استخدام صندوق تم تنظيفه وتعقيمه مسبقا لنقل الرقائق إلى الحاضنة. - استخدم سدادات المضخة التمعجية لتوصيل الأنبوب بالمضخة. قم بتوصيل كل أنبوب بالمضخة التمعجية بحيث يتدفق الوسط من الخزان إلى التجويف ، إلى الأنبوب ، وعبر المضخة مرة أخرى إلى الخزان (الشكل 4). يعمل الخزان كمصيدة فقاعات في التروية الدائرية ويمنع الهواء من الوقوع في النظام. قم بتهوية كل غرفة بمعدل تدفق 50 ميكرولتر / دقيقة مما أدى إلى إجهاد قص قدره 0.013 داين / سم2 في الغرفة العلوية و 0.006 داين / سم2 في الغرفة السفلية8.
ملاحظة: إذا تم تحريك وسط التجاويف السفلية والعلوية في اتجاهين متعاكسين ، فيمكن تحقيق نمو ثلاثي الأبعاد أعلى للأنسجة المعوية13. ومن ثم ، يتم وضع خزانات التجاويف العلوية والسفلية على جوانب متعارضة (الشكل 4). يقلل التروية الدائرية من كمية وسط زراعة الخلايا اللازمة ولكن يمكن أن يؤدي إلى إثراء السيتوكينات والمستقلبات. إذا رغبت في ذلك ، من الممكن أيضا التروية الخطية للرقاقة الحيوية. - قم بتغذية الرقاقة الحيوية لمدة 72 ساعة عند 37 درجة مئوية و 5٪ CO2.

الشكل 4: رقاقة حيوية متصلة بالمضخة التمعجية. يتم تقديم مثال على رقاقة حيوية متصلة بمضخة تمعجية. تزرع خلايا C2BBe1 الظهارية في الغرفة السفلية (يوجد وسط C2 أحمر في الخزانات في المقدمة) بينما تزرع HUVECs في الغرفة العلوية (يوجد وسط مصفر مشروط EC في الخزانات في الخلف). لا تختلط وسائط زراعة الخلايا المختلفة بسبب وظيفة الحاجز الواقي للأنسجة المزروعة. يتم توصيل الرقاقة الحيوية بالمضخة التمعجية بحيث يتدفق الوسيط من الخزان إلى التجويف. من هنا ، يتدفق الوسيط مرة أخرى إلى الخزان عبر الأنبوب عبر المضخة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. تكييف LPS للحاجز الظهاري
- بعد 72 ساعة من التروية المسبقة ، أوقف المضخة التمعجية وأزل الغطاء المتصل بأنبوب كل خزان. ضعه على منديل معقم بجوار المضخة.
- قم بإزالة كل الوسط واملأ الخزانات ب 2 مل من الوسط الطازج. بالنسبة للجانب الظهاري الذي يحتوي على خلايا C2BBe1 ، أضف 100 نانوغرام / مل LPS إلى الوسط.
ملاحظة: يزيد LPS من وظيفة الحاجز الواقي للأنسجة ، ويحفز الضامة المشتقة من الخلايا الوحيدة للهجرة إلى النسيج الظهاري ، ويسمح بتمايز الخلايا المتغصنة المشتقة من الخلايا الوحيدة. - أعد توصيل الأنبوب والأغطية بالخزان واستمر في التروية الدائرية بمعدل تدفق 50 ميكرولتر / دقيقة لمدة 24 ساعة إضافية.
ملاحظة: من هذه النقطة فصاعدا ، يمكن استخدام نموذج الرقاقة في اختبار مركب التجارب أو دراسات العدوى. نوصي بتبادل متوسط قدره 2 مل لكل خزان كل 24 ساعة.
9. الوصول إلى الأنسجة لطرق القراءة المختلفة
- جمع المواد الطافية المتوسطة لزراعة الخلايا من الخزانات في جميع أوقات التروية. افتح الخزان واجمع الحجم المطلوب (انظر الخطوات 8.1-8.3). استخدم هذه المواد الطافية للكشف عن المستقلبات أو السيتوكينات أو الجزيئات الأخرى.
- للوصول إلى الأنسجة ، استخدم مشرطا لإجراء قطع دقيق على طول الجزء الخارجي من الغرفة العلوية وإزالة رقائق الترابط لفتح تجويف الموائع الدقيقة. يمكن الآن الوصول إلى أنسجة نموذج الرقاقة المعوية الحيوية. قطع بعناية على طول الجزء الخارجي من غرفة الموائع الدقيقة لفصل الغشاء عن الرقاقة الحيوية. جمع الغشاء المحتوي على الأنسجة باستخدام ملاقط.
تنبيه: كن على دراية بوضع الإصبع خلال هذه الخطوة واعمل بعناية لمنع الحوادث. يوصى باستخدام قفازات مقاومة للقطع. - بدلا من ذلك ، قم بحصاد الخلايا من طبقات منفصلة داخل الرقاقة الحيوية باستخدام محاليل الإنزيم ، أي التربسين أو الخلايا المحللة باستخدام المخازن المؤقتة المحتوية على Triton X-100.
10. تقييم النفاذية عبر نشر FITC-dextran
ملاحظة: يمكن تحليل وظيفة الحاجز الواقي للأنسجة عن طريق مقايسة نفاذية FITC-dextran بعد فصل المضخة التمعجية. تم تكييف تقييم نفاذية FITC-dextran من Deinhardt-Emmer et al.4.
- تحضير محلول مخزون من الفلوريسئين إيزوثيوسيانات (FITC) -ديكستران (الوزن الجزيئي من 3-5 كيلو دالتون ، الجدول 1).
- أفرغ الخزانات وافصل الشريحة عن التروية.
- قم بإجراء تبادل متوسط في الغرفة العلوية والسفلية باستخدام وسط خال من الفينول الأحمر.
ملاحظة: هذه الخطوة ليست ضرورية إذا تم استخدام وسيط خال من الفينول الأحمر بالفعل أثناء التجربة. - أضف 350 ميكرولتر من محلول FITC-dextran سعة 1 مجم / مل إلى الحجرة التي تحتوي على خلايا C2BBe1.
- أغلق المنافذ واحتضان الشريحة لمدة 60 دقيقة عند 37 درجة مئوية مع توجيه الجانب الظهاري لأعلى.
- بعد وقت الحضانة ، اجمع وسط الاستزراع من غرفتي الرقاقة بشكل منفصل واحفظه عند 4 درجات مئوية ، محميا من الضوء حتى القياس.
- للقياس ، قم بإعداد منحنى قياسي في C2-medium والوسط المكيف EC بدون الفينول الأحمر في نطاق 1000 ميكروغرام / مل إلى 0 ميكروغرام / مل FITC-dextran مع 11 تخفيفا تسلسليا متتاليا 1: 2.
- انقل 200 ميكرولتر من كل عينة إلى صفيحة سوداء ذات 96 بئرا ذات قاع شفاف. قم بقياس التألق باستخدام قارئ صفيحة مجهرية بطول موجة إثارة يبلغ 495 نانومتر وطول موجة انبعاث يبلغ 517 نانومتر.
- استخدم المنحنى القياسي لحساب تركيز FITC-dextran للعينات وبالتالي معامل النفاذية.
11. تلطيخ المناعي
ملاحظة: يمكن فحص الأنسجة الحية مجهريا. لتسهيل التعامل ، نوصي بفصل الرقاقة الحيوية عن المضخة التمعجية واستخدام أهداف بعيدة المدى على مجهر مقلوب. كتحليل لنقطة النهاية ، يمكن تثبيت الأنسجة داخل الرقاقة الحيوية لإجراءات مثل تلطيخ التألق المناعي.
- أوقف المضخة التمعجية وافتح خزانات جميع التجاويف. إفراغ الخزانات وفصل الأنبوب ، وكذلك الخزانات من الرقاقة الحيوية.
- مرتين لكل غرفة ، اغسل تجاويف الموائع الدقيقة ب 500 ميكرولتر من PBS +/+ البارد. أضف 500 ميكرولتر من الميثانول المثلج البارد إلى جميع التجاويف واحتضانها لمدة 15 دقيقة عند -20 درجة مئوية. ثم ، مرتين لكل تجويف ، اغسل غرفة الموائع الدقيقة ب 500 ميكرولتر من PBS +/+.
ملاحظة: طرق التثبيت الأخرى ، مثل التثبيت بنسبة 4٪ بارافورمالدهايد أو مثبت كارنوي ، مناسبة أيضا. بعد التثبيت ، يمكن تخزين الرقائق عند 4 درجات مئوية أو المتابعة مباشرة إلى تلطيخ مضان المناعة. تنبيه: المواد الكيميائية المثبتة مثل الميثانول أو البارافورمالدهايد سامة. أداء المهام ذات الصلة تحت غطاء الدخان وجمع النفايات وفقا لذلك. - افتح الشريحة كما هو موضح في الخطوة 9.2 للوصول إلى الأنسجة. قطع غشاء PET المحتوي على الأنسجة إلى ما يصل إلى ثلاث قطع لتلطيخها بالتوازي مع الألواح المناعية المختلفة.
- انقل كل قطعة من قطع الغشاء إلى صفيحة منفصلة مكونة من 24 بئرا تحتوي على محلول مانع ونفاذ (الجدول 1) باستخدام ملاقط دقيقة. تأكد من أن طبقة الخلية محل الاهتمام تواجه دائما لأعلى أثناء عملية التلوين بأكملها. احتضان قطع الغشاء لمدة 30 دقيقة في RT.
ملاحظة: يتم الحصول على أفضل نتائج التلوين عند مطابقة المصل مع الجسم المضاد الثانوي. على سبيل المثال ، إذا تم الحصول على الأجسام المضادة الثانوية من أنواع الماعز ، فإننا نوصي باستخدام مصل الماعز الطبيعي. - انقل قطع الغشاء إلى شريحة زجاجية نظيفة داخل غرفة رطبة. قم بإعداد لوحة الأجسام المضادة الأولية في محلول التلوين (الجدول 1) وأضف 50 ميكرولتر إلى كل قطعة غشاء. احتضان بين عشية وضحاها في 4 درجة مئوية.
ملاحظة: يمكن أن يختلف التركيز الأمثل للأجسام المضادة وفعالية تلطيخ بين الشركات المصنعة المستنسخة. نوصي باختبار ألواح التلوين مسبقا في ثقافة خلية 2D. - بعد الحضانة ، انقل العينات إلى صفيحة 24 بئرا واغسل الأغشية برفق لمدة 3 × 5 دقائق بمحلول الغسيل (الجدول 1).
- مرة أخرى ، انقل قطع الغشاء إلى شريحة زجاجية نظيفة داخل غرفة رطبة. قم بإعداد لوحة الأجسام المضادة الثانوية في محلول تلطيخ (الجدول 1) وأضف 50 ميكرولتر إلى كل قطعة غشاء. إذا لزم الأمر ، أضف صبغة مضادة نووية مثل 4 '، 6-دياميدينو-2-فينيليندول (DAPI) أو Hoechst. احتضان لمدة 30 دقيقة في RT.
ملاحظة: أثناء العمل مع الفلوروفور، احتفظ بالعينات محمية من الضوء لمنع التبييض الضوئي لزيادة جودة الصورة. - بعد الحضانة ، انقل العينات إلى صفيحة 24 بئرا واغسل الأغشية برفق 2 × 5 دقائق بمحلول الغسيل (الجدول 1). ثم اغسل مرة واحدة باستخدام برنامج تلفزيوني +/+ لمدة 5 دقائق.
- قم بتركيب قطع الغشاء على شريحة زجاجية نظيفة باستخدام وسيط تثبيت مضان وغطاء زجاجي. يحفظ في درجة حرارة 4 درجات مئوية حتى التصوير المجهري.
Access restricted. Please log in or start a trial to view this content.
النتائج
تظهر هذه النتائج التمثيلية طبقات الأنسجة المميزة لنموذج الأمعاء على الرقاقة. وهي ملطخة بالفلورسنت المناعي كما هو موضح في قسم البروتوكول 11. تم التقاط الصور باستخدام مجهر مضان أو مضان متحد البؤر كمداخن z ومعالجتها إلى إسقاط متعامد. راجع جدول المواد للحصول على تفاصيل حول الإعداد ال?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يفصل البروتوكول المقدم الخطوات اللازمة لتوليد نموذج الأمعاء على الرقاقة المناعي. وصفنا تقنيات محددة وطرق قراءات محتملة مثل الفحص المجهري المناعي ، وتحليل السيتوكين والأيض ، وقياس التدفق الخلوي ، والبروتين والتحليل الجيني ، وقياس النفاذية.
يتكون النموذج الموصوف من HUVECs ال?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
M.R. هو الرئيس التنفيذي لشركة Dynamic42 GmbH ويمتلك أسهما في الشركة. A.S.M. هو مستشار علمي لشركة Dynamic 42 GmbH ويمتلك أسهما في الشركة.
Acknowledgements
تم دعم العمل ماليا من قبل مركز الأبحاث التعاونية PolyTarget 1278 (رقم المشروع 316213987) إلى V.D.W. و A.S.M. A.F. و A.S.M. كما أقر بالدعم المالي من قبل مجموعة التميز "توازن الكون الدقيق" في إطار استراتيجية التميز الألمانية - EXC 2051 - Project-ID 690 390713860. نود أن نعرب عن تقديرنا لأستريد تانرت ومختبر جينا للتصوير الحيوي والتصوير (JBIL) لتزويدنا بالوصول إلى مجهر المسح بالليزر متحد البؤر ZEISS LSM980. تم إنشاء الشكل 1C والشكل 2 باستخدام Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
References
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved