需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于分析肠道粘膜免疫反应的免疫活性肠芯片模型
* 这些作者具有相同的贡献
摘要
我们的详细方案概述了高级肠芯片模型的创建和使用,该模型模拟具有 3D 结构和各种细胞类型的人类肠粘膜,能够深入分析响应微生物定植的免疫反应和细胞功能。
摘要
已经开发了一种先进的肠芯片模型,可重建上皮 3D 器官型绒毛样和隐窝样结构。免疫活性模型包括人脐静脉内皮细胞 (HUVEC)、Caco-2 肠上皮细胞、组织驻留巨噬细胞和树突状细胞,它们在组织内自组织,反映了人肠粘膜的特征。该平台的一个独特之处在于它能够整合循环的人类原代免疫细胞,增强生理相关性。该模型旨在研究肠道免疫系统对细菌和真菌定植和感染的反应。由于其扩大的腔体尺寸,该模型提供了多种功能读数,例如渗透分析、细胞因子释放和免疫细胞浸润,并且与上皮细胞层形成的 3D 结构的免疫荧光测量兼容。因此,它提供了对细胞分化和功能的全面见解。在微生理灌注生物芯片平台中,肠道芯片平台已证明其在阐明活微生物群的替代物与人类宿主组织之间的复杂相互作用方面的潜力。
引言
器官芯片 (OoC) 系统代表了一种新兴的 3D 细胞培养技术,能够弥合传统 2D 细胞培养和动物模型之间的差距。OoC 平台通常由一个或多个隔室组成,这些隔室包含在各种支架(如膜或水凝胶)上生长的组织特异性细胞1。这些模型能够模拟一个或多个定义的器官型功能。泵能够对细胞培养基进行连续微流控灌流,以去除细胞废物,提供营养和生长因子以改善细胞分化,并重建必要的体内条件。随着免疫细胞的整合,OoC 系统可以在体外模拟人类免疫反应 2。迄今为止,已经提出了广泛的器官和功能单位1。这些系统包括脉管系统3(vaschorue)、肺4(lung)、肝脏2(h)2,5和肠道6(intestine 6)的模型,可用于药物检测5,7和感染研究6,8。
我们在这里提出了一个人肠芯片模型,该模型整合了人上皮细胞,形成了绒毛样和隐窝样结构的器官型 3D 地形,并结合了内皮衬里和组织驻留的巨噬细胞。该模型以显微载玻片的形式在微流体灌注的生物芯片中培养。每个生物芯片由两个独立的微流体腔组成。每个腔体由多孔聚对苯二甲酸乙二醇酯 (PET) 膜分为上腔室和下腔室。膜本身也充当细胞在每一侧生长的支架。膜的孔隙使细胞串扰和细胞层之间的细胞迁移成为可能。每个腔室都可以通过两个母鲁尔锁大小的端口进入。或者,一个额外的微型鲁尔锁大小的端口可以提供对上腔室或下腔室的访问(图 1)。
OoC 平台提供了许多可以从单个实验中获得的读数。肠芯片专为结合灌注 3D 细胞培养、流出物分析和荧光显微镜检查而设计,以评估细胞标志物表达、代谢率、免疫反应、微生物定植和感染以及屏障功能 3,6,8。该模型包括组织驻留的免疫细胞和活微生物与宿主组织的直接接触,与其他已发表的模型相比,这是一个优势9。此外,上皮细胞自组织成三维结构,为活微生物群的定植提供生理相关的界面6。
Access restricted. Please log in or start a trial to view this content.
研究方案
该方案要求每个生物芯片从健康供体那里获得 ~20 mL 的新鲜血液,以分离原代人单核细胞。所有捐献者都书面知情同意参与这项研究,该研究得到了耶拿大学医院伦理委员会的批准(许可号 2018-1052-BO)。有关材料的详细信息,请参阅 材料表。有关所有解决方案和介质的组成的详细信息,请参阅 表 1。
1. 一般生物芯片处理备注
- 小心地分离一条储液槽,并使用加热的刀拆下盖子,以获得单个储液槽和盖子。加宽盖子的孔,使硅胶管紧密贴合。
- 硅胶管的内径为 0.5 mm,不对称,由两个蠕动泵塞分隔成较长 (20 cm) 和较短 (12 cm) 的侧面。通过将管子连接到公鲁尔锁连接器和管子另一侧的盖子,每个生物芯片组装两个每种对称的管子。每个生物芯片还要组装四个储液槽。
注:提前准备管路和储液槽,并在使用前通过高压灭菌进行消毒。由于硅胶管的使用寿命有限,请在 3-5 次实验后更换管。对于某些研究兴趣,例如药物测试,建议为每个实验准备新的管路。该协议的许多步骤并行运行;请参阅概述图,该图突出显示了在一天内执行的不同步骤,如图 2 所示。
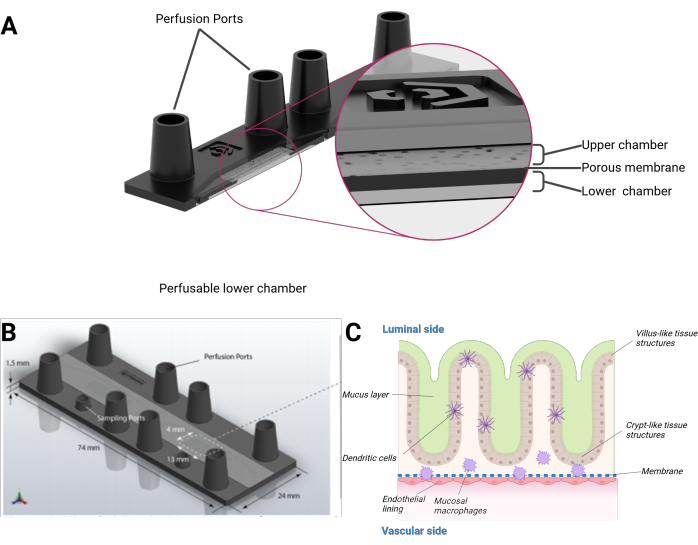
图 1:肠芯片模型的示意图。 (A) 生物芯片以横截面视图呈现。(B) 整个生物芯片以及平坦、可拆卸的 PET 膜的尺寸是可见的。上腔室(包括母鲁尔锁大小端口)的总体积分别为 290 μL 和 270 μL(下腔)。(C) 肠道生物芯片的示意图组成,可以看到类似于绒毛状和隐窝状结构的三维生长上皮,包括分化的免疫细胞和粘液层。PET 膜的另一侧被内皮单层覆盖。 请单击此处查看此图的较大版本。
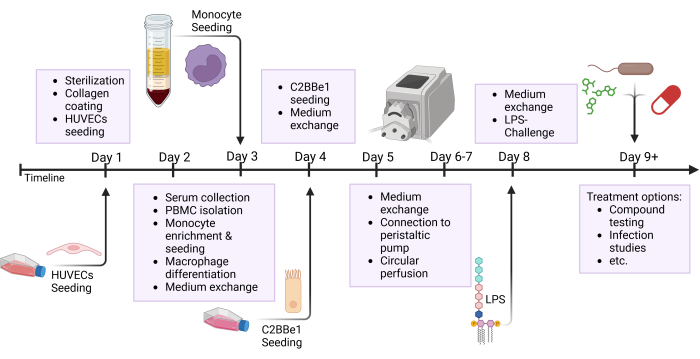
图 2:模型构建时间表和实验设置的示意图概述。 该图显示了所提出协议的示意图概述。重要的程序,例如细胞接种和用 LPS 进行上皮攻击,用箭头表示。缩写:HUVECs = 人脐静脉内皮细胞;LPS = 脂多糖。 请单击此处查看此图的较大版本。
2. 生物芯片灭菌
- 用 70% 未变性的乙醇填充直径为 15 厘米的无菌玻璃培养皿。将生物芯片放入其中,使生物芯片的所有端口完全被乙醇溶液覆盖。
- 每个端口两次,将 1 mL 70% 乙醇拉过芯片的所有腔室。在室温 (RT) 下孵育 45-60 分钟。
注意:确保生物芯片内没有空气。从这一点开始,不应有空气进入生物芯片系统,空腔应保持充满液体。 - 去除培养皿中的乙醇,并用无菌双蒸水 (ddH2O) 替换,直到所有端口都完全覆盖。同样,每个端口两次,通过生物芯片腔抽取 1 mL ddH2O。在培养皿中刷新 ddH2O 并重复该过程。
- 从培养皿中取出所有液体。此后,只要完全灭菌的生物芯片在无菌环境之外,就将其保存在密闭的培养皿内。在培养皿中加入一个 2-5 mL ddH2O 的小储液器(例如,50 mL 试管的盖子),以减少生物芯片内液体的蒸发。
注意:如果生物芯片在使用前一直保存在无菌环境中,则可以提前 3 天进行消毒。这允许在一天内灵活地处理工作负载。
3. HUVEC 收获和播种
注:人脐静脉内皮细胞 (HUVEC) 是从10 之前发表的脐带中分离出来的。
- 在接种 HUVEC 之前,用人胶原蛋白 IV 包被膜。为此,在含有镁和钙 (PBS +/+) 的 Dulbecco 磷酸盐缓冲盐水中制备胶原蛋白原液(表 1)的 1:100 稀释液。将 350 μL 稀释的储备液添加到相应的腔室中。在 RT 孵育 5 分钟。
注意:如果在无菌罩中处理生物芯片,我们建议在其下方放置无菌组织以收集过量的培养基。 - 用 350 μL PBS +/+ 冲洗所有腔室两次,以洗掉剩余的胶原蛋白和乙酸。然后,向每个腔室中加入 350 μL 内皮细胞生长 (EC) 培养基。
注意:从这里开始,生物芯片已准备好用于细胞接种,并且可以在 37 °C 下储存直至使用。 - 在第 1-3 代使用 HUVEC,细胞汇合度为 80-90%。在含有制造商提供的确定补充剂混合物的 EC 培养基中培养 HUVEC。HUVEC 细胞培养物的代表性明场图像如图 3A 所示。
注意:根据供体的不同,较高通道的 HUVEC 可以开始去分化,并且不能可靠地在生物芯片内形成致密而汇合的单层。抗生素的使用,即 100 U/mL 青霉素和 100 μg/mL 链霉素,是可选的,但建议作为 EC 培养基的补充,以防止微生物污染。 - 从 T25 细胞培养瓶中取出细胞培养基,并用 3-5 mL 不含镁和钙的 Dulbecco 磷酸盐缓冲盐水 (PBS -/-) 轻轻洗涤细胞。去除 PBS -/- 并加入 1 mL 胰蛋白酶解离试剂(表 1)。在 37 °C 下孵育 5 分钟,直到细胞从细胞培养瓶中分离。
- 使用 9 mL 的 5% 胎牛血清 (FBS) 的 PBS -/- 溶液将分离的细胞转移到试管中。在 RT 下以 350 × g 离心 5 分钟。去除上清液,重悬于 1 mL EC 培养基中,并确定细胞数。将细胞浓度调整为每 150 μL 0.4 × 106 个细胞(在下腔接种)或每 250 μL(在上腔接种)。
- 将相应体积的细胞添加到腔室中。如果在下腔室接种,请关闭所有端口并立即将生物芯片倒置,以便细胞落到 PET 膜上。将生物芯片在 37 °C 和 5% CO2 的加湿培养箱中孵育。
- 24 小时后,用 350 μL EC 培养基更换含 HUVEC 的腔室。不需要更换对侧腔室中的培养基。
4. 人血清采集和外周血单核细胞 (PBMC) 来源的单核细胞分离
注:如 Mosig 等人 11 所述分离 PBMC。
- 从健康供体中提取人静脉血。每个生物芯片,在含硅酸盐的采血管中采购至少 10 mL 全血用于血清采集。完全凝固后,在 RT 下以 2,500 × g 离心采血管 10 分钟。收集血清,等分试样,并储存在 -20 °C 直至进一步使用。
- 在含 EDTA 的采血管中从同一供体处获取至少 10 mL 全血,用于 PBMC 分离。通过倒置将未凝固的血液与等缓冲液(表 1)以 1:1 的比例轻轻混合,然后在 50 mL 试管中缓慢地将 35 mL 这种混合物铺在 15 mL 密度为 1.077 g/mL 的密度梯度培养基上。
- 在 RT 下以 800 × g 离心 20 分钟,不制动。小心地取出出现在密度梯度培养基顶部的免疫细胞层,并将其转移到新的 50 mL 试管中。用冷 iso 缓冲液填充至 50 mL,然后轻轻倒置洗涤细胞。
- 在 4 °C 下以 200 × g 离心 8 分钟,无需制动。 弃去上清液,按密度梯度重悬于 10 mL iso 缓冲液中。可选:如果多个梯度并行运行,则汇集一个供体的 PBMC。
- 在 4 °C 下以 150 × g 离心 8 分钟。 弃去上清液,将沉淀重悬于每个密度梯度的 10 mL iso 缓冲液中。重复离心步骤 4.4。最后,弃去上清液,将细胞重悬于 2 mL 单核细胞分化培养基中(表 1)。
注意:添加 M-CSF 和 GM-CSF 可强制分离的单核细胞分化为单核细胞衍生的巨噬细胞和单核细胞衍生的树突状细胞(与脂多糖 [LPS] 结合,其在本方案的后面添加)。抗生素的使用,即 100 U/mL 青霉素和 100 μg/mL 链霉素,是可选的,但建议作为培养基的补充,以防止微生物污染。 - 在 2 mL 单核细胞分化培养基中测定细胞数量并接种 6 孔板每孔 ~10 ×10 6 个细胞(表 1)。在 37 °C 的加湿培养箱中孵育 1 小时,以使单核细胞附着在 6 孔板的塑料上。
- 小心丢弃上清液,用预热的 2 mL 造血细胞培养基洗涤 2 次,以去除未结合的细胞。在37°C下在单核细胞分化培养基中再孵育24小时。
- 要收获单核细胞,请小心丢弃上清液,并用 2 mL 预热的 PBS -/- 洗涤一次。参见 图 3B 以获取此时单核细胞培养物的明场图像示例。然后,在 37 °C 下将细胞在 1 mL 预热的单核细胞分离试剂(表 1)中孵育 7 分钟,以强制单核细胞从 6 孔板的塑料中分离。
- 将分离的单核细胞转移到低结合管中。可选:为了获得更高的细胞产量,请用 PBS -/- 小心洗涤 6 孔板数次。
- 在 RT 下以 300 × g 离心 8 分钟。弃去上清液并重悬于 EC 条件培养基中(表 1)。确定细胞数量并将细胞浓度调整为每 150 μL 0.1 ×10 6 个细胞(在下腔中接种)或每 250 μL(在上腔接种)。
注:在免疫细胞分离的所有步骤中都要轻柔,并减少剪切力以防止免疫细胞活化。建立此分离时,检查 PBMC 衍生的单核细胞的纯度(例如,通过流式细胞术)。超过 95% 的细胞应为典型单核细胞标志物(如 CD14)阳性。
5. 单核细胞接种
- 在含 HUVEC 的腔室中用 350 μL 预热的 EC 条件培养基进行培养基更换。
- 将 150 μL(下腔室)或 250 μL(上腔室)制备的单核细胞悬液(参见步骤 4.10)添加到同一腔室中。如果接种到下腔室中,请关闭所有端口并立即将生物芯片倒置,以便细胞落到 HUVEC 层上。将生物芯片在 37 °C 和 5% CO2 的加湿培养箱中孵育。
- 每 24 小时在 HUVEC + 含单核细胞的腔室中用 350 μL EC 条件培养基进行一次培养基更换。
6. C2BBe1 收获和播种
注:表达 Caco-2 刷缘的细胞 1 (C2BBe1)12 使用至第 35 代,并从汇合度为 80-90% 的培养瓶中取出。 图 3C 显示了 C2BBe1 培养物的代表性明场图像。
- 在 C 2 培养基中培养 C2BBe1 细胞(表 1)。
注:使用抗生素,即 20 μg/mL 庆大霉素,是可选的,但建议作为 C2 培养基的补充,以防止微生物污染。 - 取出 T25 细胞培养瓶的细胞培养基,用 3-5 mL PBS -/- 轻轻洗涤细胞。去除 PBS -/- 并加入 1 mL 胰蛋白酶解离试剂(表 1)。在 37 °C 下孵育 5 分钟,直到细胞从细胞培养瓶中分离。
- 使用 9 mL 的 5% 胎牛血清 (FBS) 的 PBS -/- 溶液将分离的细胞转移到试管中。在 RT 下以 350 × g 离心 5 分钟。去除上清液,重悬于 1 mL C 2 培养基中,并确定细胞数。将细胞浓度调整为每 150 μL 0.5 × 106 个细胞(在下腔室接种)或每 250 μL(在上腔室接种)。
- 在 C2BBe1 接种之前,用 350 μL 的 C2 培养基轻轻洗涤相应的腔室。
- 将 150 μL(下腔室)或 250 μL(上腔室)制备的 C2BBe1 悬浮液(参见步骤 6.3)添加到相应的腔室中。如果接种到下腔室中,请关闭所有端口并立即将生物芯片倒置,以便细胞落到 PET 膜上。将生物芯片在 37 °C 和 5% CO2 的加湿培养箱中孵育。

图 3:在生物芯片中接种前 HUVEC、单核细胞和 C2BBe1 的细胞形态。 该图显示了整个方案中使用的不同细胞源的代表性明场图像。使用反向明场显微镜使用 10 倍放大倍率拍摄图像。所有细胞类型,(A) HUVECs,(B) 单核细胞和 (C) C2BBe1 均按照其特定方案部分所述在 2D 单层细胞培养物中培养。比例尺 = 200 μm。缩写:HUVECs = 人脐静脉内皮细胞;PBMC = 外周血单核细胞。 请单击此处查看此图的较大版本。
7. 连接蠕动泵和循环灌注
- 准备一个空的培养箱,并添加蠕动泵。彻底清洁培养箱的所有区域,并用消毒剂泵送,以提供准无菌环境。
注意:蠕动泵在工作时会产生大量热量。在隔热良好的培养箱或空调较差的实验室中,每个培养箱的可用泵数量可能会受到限制,因为培养箱容易过热。每个培养箱两个蠕动泵就足够了。 - 在将灭菌管连接到生物芯片之前,用 700 μL PBS +/+ 冲洗每根管子,然后用 500 μL C2 培养基或 EC 条件培养基冲洗。每种培养基准备一条每种对称性的管路(参见步骤 1.2)。对于左侧腔,使用从鲁尔锁到蠕动泵塞的短距离的管道,对于右侧腔,使用与另一个对称的管道。
- 从培养箱中取出生物芯片,并为每个腔室进行 350 μL 的培养基更换。取下所有插头并将所有端口填充到最顶部。
- 从左腔开始,通过将鲁尔锁适配器插入生物芯片的端口,将第一根管路连接到上腔室的右端口。然后,将第二根管路连接到下腔室的左端口。对正确的微流体腔重复此过程。
- 取储液槽,在储液槽底部加入一小滴细胞培养基。然后,将储液槽插入第一根管路的另一侧,并对另一个腔室重复此操作。将所有端口连接到管道或储液槽后,用 3.5 mL 细胞培养基填充储液槽。
- 将装有盖子的管路松散侧放在储液槽顶部,以关闭每个腔室的微流体系统。在这种状态下,将生物芯片输送到蠕动泵。
注意:根据与培养箱的距离和实验室周围环境,可以使用先前清洁和高压灭菌的盒子将芯片转移到培养箱中。 - 使用蠕动泵塞将管道连接到泵。将每根管路连接到蠕动泵上,使介质从储液罐流入腔体,流入管路,然后通过泵流回储液罐(图 4)。储液罐在循环灌注中用作气泡阱,防止空气滞留在系统中。以 50 μL/min 的流速灌注每个腔室,导致上腔室的剪切应力为 0.013 dyn/cm2,下腔室的剪切应力为 0.006 dyn/cm2 8。
注意:如果下腔和上腔的介质沿相反的方向移动,则可以实现肠道组织更高的三维生长13。因此,上下腔的储液器放置在相对的两侧(图 4)。循环灌流减少了所需的细胞培养基量,但可能导致细胞因子和代谢物的富集。如果需要,生物芯片的线性灌注也是可能的。 - 将生物芯片在 37 °C 和 5% CO2 下灌注 72 小时。

图 4:连接到蠕动泵的生物芯片。 提出了一个连接到蠕动泵的生物芯片的例子。上皮 C2BBe1 细胞在下腔室中培养(红色 C2 培养基位于前面的储液槽中),而 HUVEC 在上腔室中培养(淡黄色的 EC 条件培养基在后面的储液槽中)。由于生长组织的屏障功能,不同的细胞培养基不会混合。生物芯片连接到蠕动泵,使介质从储液槽流入腔体。从这里,介质通过泵通过管道流回储液罐。 请单击此处查看此图的较大版本。
8. 上皮屏障的 LPS 调节
- 预灌注 72 小时后,停止蠕动泵并取下连接到每个储液器管的盖子。将其放在泵旁边的无菌纸巾上。
- 去除所有培养基,用 2 mL 新鲜制备的培养基填充储液槽。对于含有 C2BBe1 细胞的上皮侧,向培养基中加入 100 ng/mL LPS。
注:LPS 增加组织的屏障功能,刺激单核细胞衍生的巨噬细胞迁移到上皮组织中,并允许单核细胞衍生的树突状细胞分化。 - 将管道和盖子重新连接到储液槽,并以 50 μL/min 的流速继续循环灌注 24 小时。
注意:从这一点开始,芯片模型可用于化合物测试或感染研究实验。我们建议每个储液槽每 24 小时更换 2 mL 培养基。
9. 访问组织以获得不同的读数方法
- 在灌注的所有时间从储液槽中收集细胞培养基上清液。打开储液罐并收集所需的体积(参见步骤 8.1-8.3)。使用这些上清液检测代谢物、细胞因子或其他分子。
- 要进入组织,请使用手术刀沿上腔室的外部进行精确切割,然后取下粘合箔以打开微流体腔。肠道生物芯片模型的组织现在可以访问。沿着微流体室的外部小心切割,以将膜从生物芯片上分离。用镊子收集含有组织的膜。
注意: 在此步骤中请注意手指的位置,并小心工作以防止发生意外。建议使用防割手套。 - 或者,使用酶溶液(即胰蛋白酶或使用含有 Triton X-100 的缓冲液裂解的细胞)从生物芯片内的单独层中收获细胞。
10. 通过 FITC-葡聚糖扩散进行渗透性评估
注意:在断开蠕动泵后,可以通过 FITC-葡聚糖通透性测定来分析组织的屏障功能。FITC-葡聚糖通透性评估改编自 Deinhardt-Emmer 等人4。
- 制备异硫氰酸荧光素 (FITC) - 葡聚糖的储备溶液(分子量为 3-5 kDa, 表 1)。
- 清空储液槽并断开芯片与灌注的连接。
- 在上腔室和下腔室中用不含酚红的培养基进行培养基更换。
注:如果在实验过程中已经使用了不含酚红的培养基,则无需此步骤。 - 将 350 μL 1 mg/mL FITC-葡聚糖溶液添加到含有 C2BBe1 细胞的腔室中。
- 关闭端口,将芯片在 37 °C 下孵育 60 分钟,上皮面朝上。
- 孵育时间后,分别从芯片的两个腔室收集培养基并储存在 4 °C,避光直至测量。
- 为了进行测量,在 C2 培养基和不含酚红的 EC 条件培养基中制备 1,000 μg/mL 至 0 μg/mL FITC-葡聚糖的标准曲线,并连续 11 次 1:2 连续稀释。
- 将每个样品的 200 μL 转移到底部透明的黑色 96 孔板中。使用酶标仪在 495 nm 的激发波长和 517 nm 的发射波长下测量荧光。
- 使用标准曲线计算样品的 FITC-葡聚糖浓度,从而计算渗透系数。
11. 免疫荧光染色
注意:可以在显微镜下研究活组织。为了便于操作,我们建议将生物芯片从蠕动泵上拆下,并在倒置显微镜上使用远距离物镜。作为终点分析,可以将组织固定在生物芯片内,用于免疫荧光染色等程序。
- 停止蠕动泵并打开所有腔体的储液罐。清空储液槽并断开管道以及储液槽与生物芯片的连接。
- 每个腔室两次,用 500 μL 冷 PBS +/+ 清洗微流体腔。向所有腔体中加入 500 μL 冰冷的甲醇,并在 -20 °C 下孵育 15 分钟。 然后,每个腔体两次,用 500 μL PBS +/+ 清洗微流体室。
注:其他固定方法,例如用 4% 多聚甲醛或 Carnoy 固定剂固定,也适用。固定后,芯片可以储存在 4 °C 或直接进行免疫荧光染色。注意:甲醇或多聚甲醛等固定化学品有毒。在通风橱下执行相应的任务并相应地收集废物。 - 按照步骤 9.2 中的说明打开芯片以接触组织。将含有组织的 PET 膜切成最多三块,与不同的免疫面板平行染色。
- 使用精密镊子将每个膜片转移到单独的 24 孔板中,该板包含封闭和透化溶液(表 1)。确保在整个染色过程中,感兴趣的细胞层始终朝上。将膜块在 RT 下孵育 30 分钟。
注:将血清与二抗匹配时,可获得最佳染色结果。例如,如果从山羊物种中获得二抗,我们建议使用正常山羊血清。 - 将膜片转移到潮湿室内的干净载玻片上。在染色溶液中准备一抗面板(表 1),并向每个膜片中加入 50 μL。在 4 °C 下孵育过夜。
注:最佳抗体浓度和染色效果可能因制造商和克隆而异。我们建议事先在 2D 细胞培养物中测试染色组合。 - 孵育后,将样品转移到 24 孔板中,并用洗涤液轻轻洗涤膜 3 x 5 分钟(表 1)。
- 同样,将膜片转移到潮湿室内的干净载玻片上。在染色溶液中制备二抗面板(表 1),并向每个膜片中加入 50 μL。如果需要,添加核复染剂,例如 4',6-二脒基-2-苯基吲哚 (DAPI) 或 Hoechst。在 RT 孵育 30 分钟。
注:使用荧光基团时,请避光保存样品以防止光漂白,从而提高图像质量。 - 孵育后,将样品转移到 24 孔板中,并用洗涤液轻轻洗涤膜 2 x 5 分钟(表 1)。然后,用 PBS +/+ 洗涤一次,持续 5 分钟。
- 使用荧光封固剂和盖玻片将膜片安装在干净的载玻片上。储存在 4 °C 直至显微镜成像。
Access restricted. Please log in or start a trial to view this content.
结果
这些代表性结果显示了 intestine-on-chip 模型的不同组织层。它们按照方案第 11 节中的说明进行免疫荧光染色。用落射荧光或共聚焦荧光显微镜作为 z 堆栈拍摄图像,并处理为正交投影。有关显微镜设置和软件的详细信息,请参阅 材料表 。 图 5 显示了血管层,一种形成屏障的内皮单层,由 HUVEC 和巨噬细胞组成。对代表性细胞标志物如内皮细胞的 VE-钙粘蛋白和血?...
Access restricted. Please log in or start a trial to view this content.
讨论
所提出的协议详细介绍了生成免疫活性肠芯片模型的必要步骤。我们描述了特定的技术和可能的读出方法,例如免疫荧光显微镜、细胞因子和代谢物分析、流式细胞术、蛋白质和遗传分析以及通透性测量。
所描述的模型由原代 HUVEC、单核细胞衍生的巨噬细胞和单核细胞衍生的树突状细胞组成,与代表粘液分泌、吸收、肠内分泌和 Paneth 细胞样群体的各个方面的肠上皮细胞 3D ?...
Access restricted. Please log in or start a trial to view this content.
披露声明
M.R. 是 Dynamic42 GmbH 的首席执行官,并持有该公司的股权。A.S.M. 是 Dynamic 42 GmbH 的科学顾问,并持有该公司的股权。
致谢
这项工作得到了合作研究中心 PolyTarget 1278(项目编号 316213987)对 V.D.W. 和 A.S.M. A.F. 和 A.S.M. 的财政支持,进一步感谢德国卓越战略 - EXC 2051 - 项目 ID 690 390713860 下卓越集群“微宇宙平衡”的财政支持。我们要感谢 Astrid Tannert 和 Jena 生物光子学和成像实验室 (JBIL) 为我们提供他们的共聚焦激光扫描显微镜蔡司 LSM980。 图 1C 和 图 2 是使用 Biorender.com 创建的。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
参考文献
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。