É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo Intestino em Chip Imunocompetente para Análise das Respostas Imunes da Mucosa Intestinal
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nosso protocolo detalhado descreve a criação e o uso do modelo avançado de intestino em chip, que simula a mucosa intestinal humana com estruturas 3D e vários tipos de células, permitindo uma análise aprofundada das respostas imunes e funções celulares em resposta à colonização microbiana.
Resumo
Um modelo avançado de intestino em chip recriando estruturas epiteliais 3D organotípicas semelhantes a vilosidades e criptas foi desenvolvido. O modelo imunocompetente inclui células endoteliais da veia umbilical humana (HUVEC), células epiteliais intestinais Caco-2, macrófagos residentes no tecido e células dendríticas, que se auto-organizam dentro do tecido, espelhando características da mucosa intestinal humana. Um aspecto único desta plataforma é sua capacidade de integrar células imunes primárias humanas circulantes, aumentando a relevância fisiológica. O modelo foi projetado para investigar a resposta do sistema imunológico intestinal à colonização e infecção bacteriana e fúngica. Devido ao seu tamanho de cavidade aumentado, o modelo oferece diversas leituras funcionais, como ensaios de permeação, liberação de citocinas e infiltração de células imunes, e é compatível com a medição de imunofluorescência de estruturas 3D formadas pela camada de células epiteliais. Ele fornece informações abrangentes sobre a diferenciação e função celular. A plataforma intestino em chip demonstrou seu potencial na elucidação de interações complexas entre substitutos de uma microbiota viva e tecido hospedeiro humano dentro de uma plataforma de biochip microfisiológico perfundido.
Introdução
Os sistemas Organ-on-Chip (OoC) representam uma técnica emergente de cultura de células 3D que é capaz de preencher a lacuna entre a cultura de células 2D convencional e os modelos animais. As plataformas OoC geralmente consistem em um ou mais compartimentos contendo células específicas do tecido cultivadas em uma ampla variedade de andaimes, como membranas ou hidrogéis1. Os modelos são capazes de mimetizar uma ou mais funções organotípicas definidas. As bombas permitem a perfusão microfluídica contínua do meio de cultura celular para remoção de resíduos celulares, fornecimento de nutrição e fatores de crescimento para melhor diferenciação celular e recriação de condições essenciais in vivo. Com a integração de células imunes, os sistemas OoC podem mimetizar a resposta imune humana in vitro2. Até o momento, uma ampla gama de órgãos e unidades funcionais foi apresentada1. Esses sistemas incluem modelos da vasculatura3, pulmão4, fígado 2,5 e intestino6 que podem ser facilitados para testes de drogas 5,7 e estudos de infecção 6,8.
Apresentamos aqui um modelo de intestino humano em chip integrando células epiteliais humanas formando uma topografia 3D organotípica de estruturas semelhantes a vilosidades e criptas combinadas com um revestimento endotelial e macrófagos residentes no tecido. O modelo é cultivado em um biochip perfundido microfluidicamente no formato de uma lâmina microscópica. Cada biochip consiste em duas cavidades microfluídicas separadas. Cada cavidade é dividida por uma membrana porosa de tereftalato de polietileno (PET) em uma câmara superior e inferior. A própria membrana também serve como andaime para as células crescerem de cada lado. Os poros da membrana permitem a diafonia celular e a migração celular entre as camadas celulares. Cada câmara pode ser acessada por duas portas fêmeas do tamanho de uma fechadura luer. Opcionalmente, uma porta adicional do tamanho de uma trava mini-luer pode fornecer acesso à câmara superior ou inferior (Figura 1).
A plataforma OoC oferece uma série de leituras que podem ser obtidas a partir de um único experimento. O intestino em chip é adaptado para combinar cultura de células 3D perfundidas, análise de efluentes e microscopia de fluorescência para avaliar a expressão de marcadores celulares, taxas de metabolização, resposta imune, colonização e infecção microbiana e função de barreira 3,6,8. O modelo inclui células imunes residentes no tecido e contato direto de microrganismos vivos com o tecido hospedeiro, o que é um benefício em comparação com outros modelos publicados9. Além disso, as células epiteliais se auto-organizam em estruturas tridimensionais que fornecem uma interface fisiologicamente relevante para a colonização com uma microbiota viva6.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este protocolo requer acesso a ~ 20 mL de sangue fresco por biochip de doadores saudáveis para isolar monócitos humanos primários. Todos os doadores assinaram um termo de consentimento livre e esclarecido para participar deste estudo, que foi aprovado pelo comitê de ética do Hospital Universitário de Jena (número de permissão 2018-1052-BO). Para obter detalhes sobre os materiais, consulte a Tabela de Materiais. Para obter detalhes sobre a composição de todas as soluções e meios, consulte a Tabela 1.
1. Observações gerais sobre o manuseio de biochips
- Separe cuidadosamente uma tira de reservatórios e retire as tampas usando uma faca aquecida para obter reservatórios e tampas individuais. Alargue o orifício da tampa para que o tubo de silicone se encaixe perfeitamente.
- O tubo de silicone tem um diâmetro interno de 0,5 mm, é assimétrico e é separado em lados mais longos (20 cm) e mais curtos (12 cm) por duas rolhas de bomba peristálticas. Monte dois tubos de cada simetria por biochip conectando um tubo a um conector de trava luer macho e a tampa no lado oposto do tubo. Monte também quatro reservatórios por biochip.
NOTA: Prepare a tubulação e os reservatórios com antecedência e esterilize em autoclavagem antes de usar. Como o tubo de silicone tem uma vida útil limitada, troque o tubo após 3-5 experimentos. Para certos interesses de pesquisa, como testes de drogas, é aconselhável preparar novos tubos para cada experimento. Muitas etapas deste protocolo são executadas em paralelo; consulte a figura de visão geral, que destaca as diferentes etapas executadas em um dia, conforme mostrado na Figura 2.
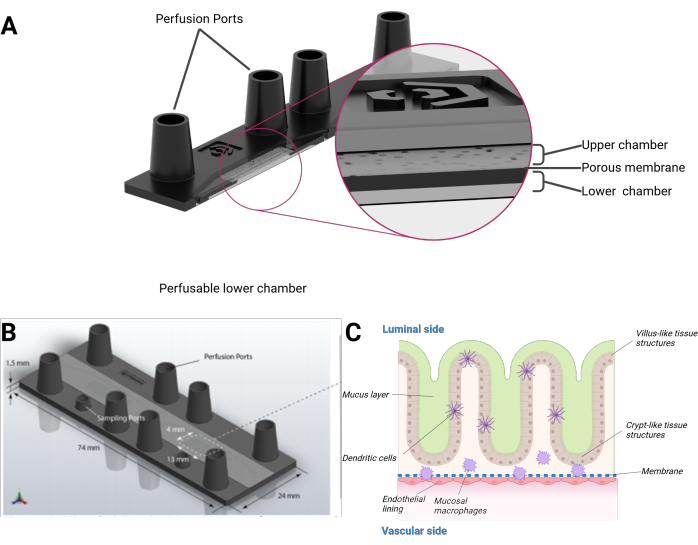
Figura 1: Representação esquemática do modelo intestino em chip. (A) O biochip é apresentado em uma visão transversal. (B) A dimensão de todo o biochip, bem como da membrana PET plana e removível, é visível. O volume total da câmara superior, incluindo as portas fêmeas do tamanho de uma trava luer, é de 290 μL e 270 μL para a câmara inferior, respectivamente. (C) Uma composição esquemática do biochip intestinal, o epitélio de crescimento tridimensional semelhante a estruturas semelhantes a vilosidades e criptas, incluindo células imunes diferenciadas e uma camada de muco pode ser vista. O outro lado da membrana PET é coberto por uma monocamada endotelial. Clique aqui para ver uma versão maior desta figura.
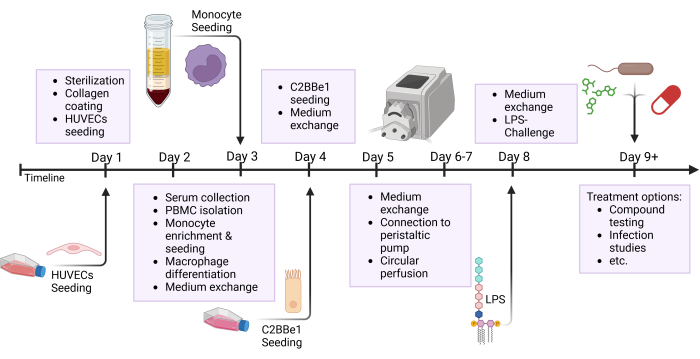
Figura 2: Visão geral esquemática do cronograma de construção do modelo e configuração experimental. Esta figura mostra a visão geral esquemática do protocolo apresentado. Procedimentos importantes, como a semeadura de células e o desafio epitelial com LPS, são indicados por setas. Abreviaturas: HUVECs = células endoteliais venosas umbilicais humanas; LPS = lipopolissacarídeo. Clique aqui para ver uma versão maior desta figura.
2. Esterilização do biochip
- Encher uma placa de Petri de vidro estéril, com um diâmetro de 15 cm, com etanol não desnaturado a 70%. Coloque o biochip dentro de forma que todas as portas do biochip fiquem completamente cobertas pela solução de etanol.
- Duas vezes por porta, puxe 1 mL de etanol a 70% por todas as câmaras do chip. Incube por 45-60 min em temperatura ambiente (RT).
NOTA: Certifique-se de que nenhum ar esteja preso dentro do biochip. Deste ponto em diante, nenhum ar deve entrar no sistema de biochip e as cavidades devem permanecer cheias de líquido. - Remova o etanol da placa de Petri e substitua-o por água bidestilada estéril (ddH2O) até que todas as portas estejam totalmente cobertas. Novamente, duas vezes por porta, aspire 1 mL de ddH2O através da cavidade do biochip. Atualizar o ddH2O na placa de Petri e repetir o procedimento.
- Remova todo o líquido da placa de Petri. Doravante, mantenha os biochips totalmente esterilizados dentro da placa de Petri fechada sempre que estiverem fora de um ambiente estéril. Adicione um pequeno reservatório (por exemplo, a tampa de um tubo de 50 mL) de 2-5 mL ddH2O à placa de Petri para reduzir a evaporação do líquido dentro do biochip.
NOTA: Os biochips podem ser esterilizados com até 3 dias de antecedência se forem mantidos em ambiente estéril até o uso. Isso permite flexibilidade na carga de trabalho em um único dia.
3. Colheita e semeadura de HUVECs
NOTA: As células endoteliais venosas umbilicais humanas (HUVECs) foram isoladas dos cordões umbilicais conforme publicado anteriormente10.
- Antes de semear os HUVECs, cubra a membrana com colágeno humano IV. Para isso, prepare uma diluição de 1:100 de uma solução estoque de colágeno (Tabela 1) em solução salina tamponada com fosfato de Dulbecco contendo magnésio e cálcio (PBS +/+). Adicionar 350 μL da solução-mãe diluída à respectiva câmara. Incube por 5 min em RT.
NOTA: Se manusear o biochip no capô estéril, recomendamos colocar um tecido estéril embaixo dele para coletar o meio excessivo. - Lave todas as câmaras duas vezes com 350 μL de PBS +/+ para lavar o colágeno e o ácido acético restantes. Em seguida, adicione 350 μL de meio de crescimento de células endoteliais (CE) a cada câmara.
NOTA: A partir daqui, os biochips estão prontos para a semeadura celular e podem ser armazenados a 37 °C até o uso. - Use HUVECs nas passagens 1-3 a 80-90% de confluência celular. Cultive HUVECs em meio EC contendo uma mistura de suplementos definida fornecida pelo fabricante. Uma imagem representativa de campo claro de uma cultura de células HUVEC é apresentada na Figura 3A.
NOTA: Dependendo do doador, os HUVECs de passagens superiores podem começar a se desdiferenciar e não podem formar de forma confiável uma monocamada densa e confluente dentro do biochip. O uso de antibióticos, ou seja, penicilina 100 U/mL e estreptomicina 100 μg/mL, é opcional, mas recomendado como suplemento ao meio EC para evitar contaminação microbiana. - Remova o meio de cultura celular de um frasco de cultura de células T25 e lave as células suavemente com 3-5 mL de solução salina tamponada com fosfato de Dulbecco sem magnésio e cálcio (PBS -/-). Remova o PBS -/- e adicione 1 mL de reagente de dissociação de tripsina (Tabela 1). Incubar durante 5 minutos a 37 °C até que as células se desprendam do balão de cultura celular.
- Transfira as células destacadas para um tubo usando 9 mL de soro fetal bovino (FBS) a 5% em PBS -/-. Centrifugue a 350 × g durante 5 min a RT. Remover o sobrenadante, ressuspender em 1 ml de meio EC e determinar o número de células. Ajuste a concentração celular para 0,4 × 106 células por 150 μL (semeadura na câmara inferior) ou por 250 μL (semeadura na câmara superior).
- Adicione o respectivo volume de células à câmara. Se semear na câmara inferior, feche todas as portas e posicione imediatamente o biochip de cabeça para baixo para que as células caiam na membrana PET. Incubar os biochips em uma incubadora umidificada a 37 °C e 5% de CO2.
- Efectuar uma troca de meio da câmara contendo HUVEC com 350 μL de meio EC após 24 h. O meio na câmara oposta não precisa ser substituído.
4. Coleta de soro humano e isolamento de monócitos derivados de células mononucleares do sangue periférico (PBMC)
NOTA: As PBMCs foram isoladas conforme descrito em Mosig et al.11.
- Retirar sangue venoso humano de dadores saudáveis. Por biochip, adquira um mínimo de 10 mL de sangue total em tubos de coleta de sangue contendo silicato para coleta de soro. Após coagulação completa, centrifugue os tubos de colheita de sangue a 2.500 × g durante 10 min em RT. Recolher o soro, alíquota e conservar a -20 °C até nova utilização.
- Adquira um mínimo de 10 mL de sangue total do mesmo doador em tubos de coleta de sangue contendo EDTA para isolamento de PBMC. Misture suavemente o sangue não coagulado 1:1 com iso-tampão (Tabela 1) por inversão e coloque lentamente 35 mL dessa mistura sobre 15 mL de um meio de gradiente de densidade com densidade de 1,077 g/mL em um tubo de 50 mL.
- Centrifugue a 800 × g por 20 min sem freio em RT. Retire cuidadosamente a camada de células imunes resultante, aparecendo no topo do meio de gradiente de densidade, e transfira-a para um novo tubo de 50 mL. Encha até 50 mL com iso-tampão frio e lave as células por inversão suave.
- Centrifugar a 200 × g durante 8 min sem travões a 4 °C. Rejeitar o sobrenadante e ressuspender em 10 ml de tampão iso, por gradiente de densidade. Opcional: Agrupe PBMCs de um doador se vários gradientes forem executados em paralelo.
- Centrifugue a 150 × g durante 8 min a 4 °C. Rejeitar o sobrenadante e ressuspender o sedimento em 10 ml de tampão de iso por gradiente de densidade. Repita a etapa de centrifugação 4.4. Finalmente, descartar o sobrenadante e ressuspender as células em 2 mL de meio de diferenciação de monócitos (Tabela 1).
NOTA: A adição de M-CSF e GM-CSF reforça a diferenciação dos monócitos isolados em macrófagos derivados de monócitos e células dendríticas derivadas de monócitos (em combinação com lipopolissacarídeo [LPS], que é adicionado em um ponto posterior deste protocolo). O uso de antibióticos, ou seja, penicilina 100 U/mL e estreptomicina 100 μg/mL, é opcional, mas recomendado como suplemento do meio para evitar contaminação microbiana. - Determine o número de células e sementes ~ 10 × 106 células por poço de uma placa de 6 poços em 2 mL de meio de diferenciação de monócitos (Tabela 1). Incubar em uma incubadora umidificada a 37 ° C por 1 h para permitir a fixação de monócitos ao plástico da placa de 6 poços.
- Descarte cuidadosamente o sobrenadante e lave 2x com 2 mL pré-aquecidos de meio celular hematopoiético para remover as células não ligadas. Incubar a 37 °C durante mais 24 h em meio de diferenciação de monócitos.
- Para colher os monócitos, descarte cuidadosamente o sobrenadante e lave uma vez com 2 mL de PBS pré-aquecido -/-. Veja a Figura 3B para um exemplo de uma imagem de campo claro da cultura de monócitos neste ponto. Em seguida, incube as células por 7 min em 1 mL de reagente de descolamento de monócitos pré-aquecido (Tabela 1) a 37 ° C para forçar o descolamento dos monócitos do plástico da placa de 6 poços.
- Transfira os monócitos destacados para um tubo de baixa ligação. Opcional: para obter um maior rendimento celular, lave cuidadosamente a placa de 6 poços várias vezes com PBS -/-.
- Centrifugar a 300 × g durante 8 min a RT. Rejeitar o sobrenadante e ressuspender em meio condicionado CE (quadro 1). Determine o número de células e ajuste a concentração de células para 0,1 × 106 células por 150 μL (semeadura na cavidade inferior) ou por 250 μL (semeadura na cavidade superior).
NOTA: Seja gentil em todas as etapas do isolamento das células imunológicas e reduza as forças de cisalhamento para evitar a ativação das células imunológicas. Ao estabelecer esse isolamento, verifique a pureza dos monócitos derivados de PBMC (por exemplo, por citometria de fluxo). Mais de 95% de todas as células devem ser positivas para marcadores típicos de monócitos, como CD14.
5. Semeadura de monócitos
- Efectuar uma troca de meio na câmara contendo HUVEC com 350 μL de meio pré-aquecido condicionado pela CE.
- Adicionar 150 μL (câmara inferior) ou 250 μL (câmara superior) da suspensão de monócitos preparada (ver passo 4.10) à mesma câmara. Se estiver semeando na câmara inferior, feche todas as portas e posicione imediatamente o biochip de cabeça para baixo para que as células caiam na camada HUVEC. Incubar o biochip em uma incubadora umidificada a 37 °C e 5% de CO2.
- Efectuar uma troca de meio na câmara contendo monócitos HUVEC + com 350 μL de meio condicionado CE a cada 24 h.
6. Colheita e semeadura de C2BBe1
NOTA: As células 1 (C2BBe1)12 que expressam a borda em escova Caco-2 são usadas até a passagem 35 e são retiradas de frascos de 80-90% de confluência. Uma imagem representativa de campo claro de uma cultura de C2BBe1 é apresentada na Figura 3C.
- Cultive células C2BBe1 em meio C2 (Tabela 1).
NOTA: O uso de antibióticos, ou seja, 20 μg / mL de gentamicina, é opcional, mas recomendado como suplemento do meio C2 para evitar a contaminação microbiana. - Remover o meio de cultura de células de um balão de cultura de células T25 e lavar as células suavemente com 3-5 ml de PBS -/-. Remova o PBS -/- e adicione 1 mL de reagente de dissociação de tripsina (Tabela 1). Incubar durante 5 minutos a 37 °C até que as células se desprendam do balão de cultura celular.
- Transfira as células destacadas para um tubo usando 9 mL de soro fetal bovino (FBS) a 5% em PBS -/-. Centrifugue a 350 × g por 5 min em RT. Remova o sobrenadante, ressuspenda em 1 mL de meio C2 e determine o número de células. Ajuste a concentração de células para 0,5 × 106 células por 150 μL (semeadura na câmara inferior) ou por 250 μL (semeadura na câmara superior).
- Antes da semeadura do C2BBe1, lave suavemente a respectiva câmara com 350 μL de meio C2.
- Adicionar 150 μL (câmara inferior) ou 250 μL (câmara superior) da suspensão C2BBe1 preparada (ver passo 6.3) à respetiva câmara. Se estiver semeando na câmara inferior, feche todas as portas e posicione imediatamente o biochip de cabeça para baixo para que as células caiam na membrana PET. Incubar os biochips em uma incubadora umidificada a 37 °C e 5% de CO2.

Figura 3: Morfologia celular de HUVECs, monócitos e C2BBe1 antes da semeadura no biochip. Esta figura mostra imagens representativas de campo claro das diferentes fontes de células usadas em todo o protocolo. As imagens foram obtidas com um microscópio de campo claro reverso usando aumento de 10x. Todos os tipos de células, (A) HUVECs, (B) monócitos e (C) C2BBe1 foram cultivados em cultura de células monocamada 2D, conforme descrito em suas seções de protocolo específicas. Barras de escala = 200 μm. Abreviaturas: HUVECs = células endoteliais venosas umbilicais humanas; PBMCs = células mononucleares do sangue periférico. Clique aqui para ver uma versão maior desta figura.
7. Conexão à bomba peristáltica e perfusão circular
- Prepare uma incubadora vazia com a adição de uma bomba peristáltica. Limpe completamente todas as áreas da incubadora e bombeie com desinfetante para proporcionar um ambiente quase estéril.
NOTA: As bombas peristálticas podem produzir muito calor durante o trabalho. Em incubadoras bem isoladas ou laboratórios com ar condicionado deficiente, o número de bombas utilizáveis por incubadora pode ser limitado, pois as incubadoras tendem a superaquecer. Duas bombas peristálticas por incubadora devem ser adequadas. - Antes de conectar os tubos esterilizados ao biochip, lave cada tubo com 700 μL de PBS +/+ seguido por 500 μL de meio C2 ou meio condicionado EC. Prepare um tubo de cada simetria por meio (consulte a etapa 1.2). Use a tubulação com a curta distância da trava luer até a rolha da bomba peristáltica para a cavidade esquerda e a tubulação com a outra simetria para a cavidade direita.
- Retirar o biochip da incubadora e realizar uma troca de meio com 350 μL para cada câmara. Remova todos os plugues e preencha todas as portas até o topo.
- Começando na cavidade esquerda, conecte a primeira tubulação à porta direita da câmara superior inserindo o adaptador luer lock na porta do biochip. Em seguida, conecte o segundo tubo à porta esquerda da câmara inferior. Repita este procedimento para a cavidade microfluídica direita.
- Pegue um reservatório e adicione uma pequena gota de meio de cultura de células no fundo do reservatório. Em seguida, insira o reservatório no lado oposto do primeiro tubo e repita para a outra câmara. Depois que todas as portas estiverem conectadas a uma tubulação ou reservatório, encha os reservatórios com 3,5 mL de meio de cultura celular.
- Coloque o lado solto do tubo, que tem a tampa presa a ele, em cima do reservatório para fechar o sistema microfluídico de cada câmara. Nesse estado, transporte o biochip para a bomba peristáltica.
NOTA: Dependendo da distância até a incubadora e do ambiente do laboratório, uma caixa previamente limpa e autoclavada pode ser usada para transferir os cavacos para a incubadora. - Use as rolhas peristálticas da bomba para conectar a tubulação à bomba. Conecte cada tubulação à bomba peristáltica de forma que o meio flua do reservatório para a cavidade, para a tubulação e através da bomba de volta para o reservatório (Figura 4). O reservatório serve como uma armadilha de bolhas na perfusão circular e evita que o ar fique preso no sistema. Perfundir cada câmara com uma taxa de fluxo de 50 μL / min, resultando em uma tensão de cisalhamento de 0,013 din/cm2 na câmara superior e 0,006 din/cm2 na câmara inferior8.
NOTA: Se o meio das cavidades inferior e superior for movido em direções opostas, um crescimento tridimensional maior do tecido intestinal pode ser alcançado13. Assim, os reservatórios das cavidades superior e inferior são colocados em lados opostos (Figura 4). A perfusão circular reduz a quantidade de meio de cultura celular necessária, mas pode resultar no enriquecimento de citocinas e metabólitos. Se desejado, uma perfusão linear do biochip também é possível. - Perfundir o biochip durante 72 h a 37 °C e 5% de CO2.

Figura 4: Biochip conectado à bomba peristáltica. Um exemplo de biochip conectado a uma bomba peristáltica é apresentado. As células epiteliais C2BBe1 são cultivadas na câmara inferior (o meio C2 vermelho está nos reservatórios na frente), enquanto os HUVECs são cultivados na câmara superior (o meio condicionado CE amarelado está nos reservatórios na parte de trás). Os diferentes meios de cultura de células não estão se misturando devido à função de barreira do tecido cultivado. O biochip é conectado à bomba peristáltica de forma que o meio flua do reservatório para a cavidade. A partir daqui, o meio flui de volta para o reservatório através da tubulação através da bomba. Clique aqui para ver uma versão maior desta figura.
8. LPS-condicionamento da barreira epitelial
- Após 72 h de pré-perfusão, pare a bomba peristáltica e remova a tampa conectada ao tubo de cada reservatório. Coloque-o sobre um lenço estéril próximo à bomba.
- Remova todo o meio e encha os reservatórios com 2 mL de meio recém-preparado. Para o lado epitelial que contém as células C2BBe1, adicione 100 ng/mL de LPS ao meio.
NOTA: O LPS aumenta a função de barreira do tecido, estimula os macrófagos derivados de monócitos a migrar para o tecido epitelial e permite a diferenciação de células dendríticas derivadas de monócitos. - Reconecte a tubulação e as tampas ao reservatório e continue a perfusão circular a uma vazão de 50 μL/min por mais 24 h.
NOTA: Deste ponto em diante, o modelo de chip pode ser usado em experimentos - testes de compostos ou estudos de infecção. Recomendamos uma troca média de 2 mL por reservatório a cada 24 h.
9. Acesso ao tecido para diferentes métodos de leitura
- Coletar sobrenadantes de meio de cultura de células dos reservatórios em todos os momentos da perfusão. Abra o reservatório e colete o volume desejado (consulte as etapas 8.1-8.3). Use esses sobrenadantes para a detecção de metabólitos, citocinas ou outras moléculas.
- Para acessar o tecido, use um bisturi para fazer um corte preciso ao longo da parte externa da câmara superior e remova a folha de ligação para abrir a cavidade microfluídica. O tecido do modelo de biochip intestinal agora está acessível. Corte cuidadosamente ao longo da parte externa da câmara microfluídica para separar a membrana do biochip. Colete a membrana contendo tecido usando uma pinça.
CUIDADO: Esteja ciente da colocação dos dedos durante esta etapa e trabalhe com cuidado para evitar acidentes. Luvas resistentes a cortes são recomendadas. - Alternativamente, colha as células de camadas separadas dentro do biochip usando soluções enzimáticas, ou seja, tripsina ou células lisadas usando tampões contendo Triton X-100.
10. Avaliação da permeabilidade via difusão FITC-dextrana
NOTA: A função de barreira do tecido pode ser analisada por meio de um ensaio de permeabilidade FITC-dextrana após a desconexão da bomba peristáltica. A avaliação da permeabilidade ao dextrano do FITC foi adaptada de Deinhardt-Emmer et al.4.
- Preparar uma solução-mãe de isotiocianato de fluoresceína (FITC)-dextrano (peso molecular de 3-5 kDa, quadro 1).
- Esvazie os reservatórios e desconecte o chip da perfusão.
- Efectuar uma troca de meio na câmara superior e inferior com meio isento de vermelho de fenol.
NOTA: Esta etapa não é necessária se o meio sem vermelho de fenol já tiver sido usado durante o experimento. - Adicionar 350 μL de solução de FITC-dextrano a 1 mg/ml à câmara que contém as células C2BBe1.
- Feche as portas e incube o chip por 60 min a 37 °C com o lado epitelial voltado para cima.
- Após o tempo de incubação, recolher o meio de cultura de ambas as câmaras da pastilha separadamente e conservar a 4 °C, protegido da luz até à medição.
- Para a medição, preparar uma curva padrão em meio C2 e meio condicionado CE sem vermelho de fenol na faixa de 1.000 μg/mL a 0 μg/mL FITC-dextrano com 11 diluições seriadas consecutivas de 1:2.
- Transfira 200 μL de cada amostra para uma placa preta de 96 poços com fundo transparente. Medir a fluorescência com um leitor de microplacas a um comprimento de onda de excitação de 495 nm e a um comprimento de onda de emissão de 517 nm.
- Utilizar a curva padrão para calcular a concentração de FITC-dextrano das amostras e, assim, o coeficiente de permeabilidade.
11. Coloração de imunofluorescência
NOTA: O tecido vivo pode ser investigado microscopicamente. Para facilitar o manuseio, recomendamos o desprendimento do biochip da bomba peristáltica e o uso de objetivas de longa distância em microscópio invertido. Como uma análise de ponto final, o tecido pode ser fixado dentro do biochip para procedimentos como coloração por imunofluorescência.
- Pare a bomba peristáltica e abra os reservatórios de todas as cavidades. Esvazie os reservatórios e desconecte a tubulação, bem como os reservatórios do biochip.
- Duas vezes por câmara, lave as cavidades microfluídicas com 500 μL de PBS frio +/+. Adicione 500 μL de metanol gelado a todas as cavidades e incube por 15 min a -20 °C. Em seguida, duas vezes por cavidade, lave a câmara microfluídica com 500 μL de PBS +/+.
NOTA: Outros métodos de fixação, como fixação com paraformaldeído a 4% ou fixador de Carnoy, também são adequados. Após a fixação, os chips podem ser armazenados a 4 °C ou prosseguir diretamente para a coloração de imunofluorescência. CUIDADO: Produtos químicos fixadores, como metanol ou paraformaldeído, são tóxicos. Execute as respectivas tarefas sob uma hotte e recolha os resíduos em conformidade. - Abra o chip conforme descrito na etapa 9.2 para acessar o tecido. Corte a membrana PET contendo tecido em até três pedaços para corar em paralelo com diferentes painéis imunológicos.
- Transfira cada uma das peças da membrana para uma placa separada de 24 poços contendo uma solução de bloqueio e permeabilização (Tabela 1) usando pinças de precisão. Certifique-se de que a camada celular de interesse sempre esteja voltada para cima durante todo o processo de coloração. Incubar as peças da membrana durante 30 min à RT.
NOTA: Os melhores resultados de coloração são obtidos ao combinar o soro com o anticorpo secundário. Por exemplo, se anticorpos secundários forem obtidos de espécies de cabras, recomendamos o uso de soro de cabra normal. - Transfira as peças da membrana para uma lâmina de vidro limpa dentro de uma câmara úmida. Prepare o painel de anticorpos primário na solução de coloração (Tabela 1) e adicione 50 μL a cada peça de membrana. Incubar durante a noite a 4 °C.
NOTA: A concentração ideal de anticorpos e a eficácia da coloração podem diferir entre fabricantes e clones. Recomendamos testar os painéis de coloração com antecedência em uma cultura de células 2D. - Após a incubação, transfira as amostras para uma placa de 24 poços e lave suavemente as membranas por 3 x 5 min com solução de lavagem (Tabela 1).
- Novamente, transfira as peças da membrana para uma lâmina de vidro limpa dentro de uma câmara úmida. Prepare o painel de anticorpos secundário em solução de coloração (Tabela 1) e adicione 50 μL a cada peça de membrana. Se necessário, adicione uma contracoloração nuclear, como 4',6-diamidino-2-fenilindol (DAPI) ou Hoechst. Incubar por 30 min em RT.
NOTA: Ao trabalhar com fluoróforos, mantenha as amostras protegidas da luz para evitar o fotobranqueamento e aumentar a qualidade da imagem. - Após a incubação, transfira as amostras para uma placa de 24 poços e lave suavemente as membranas 2 x 5 min com solução de lavagem (Tabela 1). Em seguida, lave uma vez com PBS +/+ por 5 min.
- Monte as peças da membrana em uma lâmina de vidro limpa usando um meio de montagem de fluorescência e uma lamínula. Conservar a 4 °C até à obtenção de imagens microscópicas.
Access restricted. Please log in or start a trial to view this content.
Resultados
Esses resultados representativos mostram as distintas camadas de tecido do modelo intestino em chip. Eles são corados por imunofluorescência conforme descrito na seção 11 do protocolo. As imagens foram tiradas com um microscópio de epifluorescência ou fluorescência confocal como z-stacks e processadas para uma projeção ortogonal. Consulte a Tabela de Materiais para obter detalhes sobre a configuração microscópica e o software. A Figura 5 mostra a camada vascular,...
Access restricted. Please log in or start a trial to view this content.
Discussão
O protocolo apresentado detalha as etapas necessárias para gerar um modelo de intestino em chip imunocompetente. Descrevemos técnicas específicas e possíveis métodos de leitura, como microscopia de imunofluorescência, análise de citocinas e metabólitos, citometria de fluxo, análise genética e de proteínas e medição de permeabilidade.
O modelo descrito consiste em HUVECs primários, macrófagos derivados de monócitos e células dendríticas derivadas de monócitos co-cultivadas co...
Access restricted. Please log in or start a trial to view this content.
Divulgações
M.R. é CEO da Dynamic42 GmbH e detém participação acionária na empresa. A.S.M. é consultor científico da Dynamic 42 GmbH e detém participação acionária na empresa.
Agradecimentos
O trabalho foi apoiado financeiramente pelo Centro de Pesquisa Colaborativa PolyTarget 1278 (número do projeto 316213987) para V.D.W. e A.S.M. A.F. e A.S.M. reconhecem ainda o apoio financeiro do Cluster de Excelência "Balance of the Microverse" sob a Estratégia de Excelência da Alemanha - EXC 2051 - Project-ID 690 390713860. Queremos agradecer a Astrid Tannert e ao Laboratório de Imagem e Biofotônica de Jena (JBIL) por nos fornecer acesso ao seu microscópio confocal de varredura a laser ZEISS LSM980. A Figura 1C e a Figura 2 foram criadas com Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
Referências
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados