JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
장 점막 면역 반응을 분석하기 위한 Immunocompetent Intestine-on-Chip 모델
* 이 저자들은 동등하게 기여했습니다
요약
당사의 상세 프로토콜은 3D 구조와 다양한 세포 유형으로 인간의 장 점막을 시뮬레이션하는 고급 intestine-on-chip 모델의 생성 및 사용을 간략하게 설명하여 미생물 집락화에 대한 면역 반응 및 세포 기능에 대한 심층 분석을 가능하게 합니다.
초록
상피 3D 기관형 융모와 같은 및 크립트와 같은 구조를 재현하는 고급 intestine-on-chip 모델이 개발되었습니다. 면역 역량 모델에는 인간 제대 정맥 내피 세포(HUVEC), Caco-2 장 상피 세포, 조직 거주 대식세포 및 수지상 세포가 포함되며, 이들은 인간 장 점막의 특성을 반영하여 조직 내에서 자체 조직화됩니다. 이 플랫폼의 독특한 측면은 순환하는 인간 1차 면역 세포를 통합하여 생리학적 관련성을 향상시키는 능력입니다. 이 모델은 박테리아 및 진균 집락 형성 및 감염에 대한 장 면역 체계의 반응을 조사하도록 설계되었습니다. 확대된 캐비티 크기로 인해 이 모델은 투과 분석, 사이토카인 방출 및 면역 세포 침투와 같은 다양한 기능적 판독을 제공하며 상피 세포층에 의해 형성된 3D 구조의 면역형광 측정과 호환됩니다. 이를 통해 세포 분화 및 기능에 대한 포괄적인 통찰력을 제공합니다. intestine-on-chip 플랫폼은 미세생리학적 관류 바이오칩 플랫폼 내에서 살아있는 미생물군의 대리모와 인간 숙주 조직 간의 복잡한 상호 작용을 규명할 수 있는 잠재력을 입증했습니다.
서문
OoC(Organ-on-Chip) 시스템은 기존의 2D 세포 배양과 동물 모델 간의 격차를 해소할 수 있는 새로운 3D 세포 배양 기술입니다. OoC 플랫폼은 일반적으로 멤브레인 또는 하이드로겔과 같은 다양한 골격체에서 성장한 조직 특이적 세포를 포함하는 하나 이상의 구획으로 구성됩니다1. 이 모델은 하나 이상의 정의된 유기형 기능을 모방할 수 있습니다. 펌프는 세포 배양 배지의 지속적인 미세유체 관류를 가능하게 하여 세포 폐기물을 제거하고, 세포 분화 개선을 위한 영양 및 성장 인자를 공급하고, 필수적인 생체 내 조건을 재현할 수 있습니다. 면역 세포의 통합으로 OoC 시스템은 in vitro2에서 인간의 면역 반응을 모방할 수 있습니다. 현재까지 다양한 장기와 기능 단위가 제시되었습니다1. 이러한 시스템에는 약물 검사(drug testing)5,7 및 감염 연구(infection studies)6,8를 위해 촉진될 수 있는 혈관구조(vasculature)3, 폐4, 간(liver)2,5 및 장(intestine)6의 모델이 포함된다.
여기에서는 인간 상피 세포를 통합하는 인간 장 온 칩 모델을 제시하며, 내피 내벽 및 조직 상주 대식세포와 결합된 융모와 같은 및 크립트와 같은 구조의 유기체형 3D 지형을 형성합니다. 이 모델은 미세한 슬라이드 형태의 미세유체 관류 바이오칩에서 배양됩니다. 각 바이오칩은 두 개의 개별 미세유체 공동으로 구성됩니다. 각 캐비티는 다공성 폴리에틸렌 테레프탈레이트(PET) 멤브레인에 의해 상부 및 하부 챔버로 나뉩니다. 멤브레인 자체는 세포가 양쪽에서 자랄 수 있는 발판 역할도 합니다. 막의 기공은 세포 누화와 세포층 사이의 세포 이동을 가능하게 합니다. 각 챔버는 두 개의 암형 루어 잠금 장치 크기의 포트를 통해 접근할 수 있습니다. 선택적으로, 추가적인 미니 루어 잠금 장치 크기의 포트를 통해 상부 또는 하부 챔버에 접근할 수 있습니다(그림 1).
OoC 플랫폼은 단일 실험에서 얻을 수 있는 여러 판독값을 제공합니다. Intestine-on-Chip은 관류 3D 세포 배양, 유출물 분석 및 형광 현미경을 결합하여 세포 마커 발현, 대사 속도, 면역 반응, 미생물 집락 형성 및 감염, 장벽 기능 3,6,8을 평가하도록 맞춤화되었습니다. 이 모델에는 조직에 상주하는 면역 세포와 살아있는 미생물이 숙주 조직과 직접 접촉하는 것이 포함되는데, 이는 발표된 다른 모델에 비해 이점이 있다9. 또한, 상피세포는 3차원 구조로 자가조직화되어 살아있는 미생물군(living microbiota)과의 집락화에 생리학적으로 유의미한 인터페이스를 제공한다6.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 프로토콜은 1차 인간 단핵구를 분리하기 위해 건강한 기증자로부터 바이오칩당 ~20mL의 신선한 혈액에 접근해야 합니다. 모든 기증자는 이 연구에 참여하기 위해 정보에 입각한 서면 동의서를 제출했으며, 이 동의는 예나 대학병원 윤리 위원회(허가 번호 2018-1052-BO)의 승인을 받았습니다. 재료에 대한 자세한 내용은 재료 표를 참조하십시오. 모든 용액 및 매체의 구성에 대한 자세한 내용은 표 1을 참조하십시오.
1. 바이오칩 취급 일반 주의사항
- 물통 스트립을 조심스럽게 분리하고 가열된 칼을 사용하여 뚜껑을 분리하여 단일 저장통과 뚜껑을 얻습니다. 실리콘 튜브가 꼭 맞도록 뚜껑의 구멍을 넓힙니다.
- 실리콘 튜브는 내경이 0.5mm이고 비대칭이며 두 개의 연동 펌프 스토퍼에 의해 더 긴(20cm) 면과 더 짧은(12cm) 면으로 분리됩니다. 튜브를 남성 루어 잠금 장치에 부착하고 튜브의 반대쪽에 있는 뚜껑에 연결하여 바이오칩당 각 대칭의 두 튜브를 조립합니다. 또한 바이오칩당 4개의 저장소를 조립합니다.
알림: 튜브와 저장소를 미리 준비하고 사용하기 전에 고압멸균으로 멸균하십시오. 실리콘 튜브는 수명이 제한되어 있으므로 3-5번의 실험 후에 튜브를 교체하십시오. 약물 검사와 같은 특정 연구 관심 분야의 경우 각 실험에 대해 새 튜브를 준비하는 것이 좋습니다. 이 프로토콜의 많은 단계가 병렬로 실행됩니다. 그림 2와 같이 하루에 수행된 다양한 단계를 강조 표시하는 개요 그림을 참조하십시오.
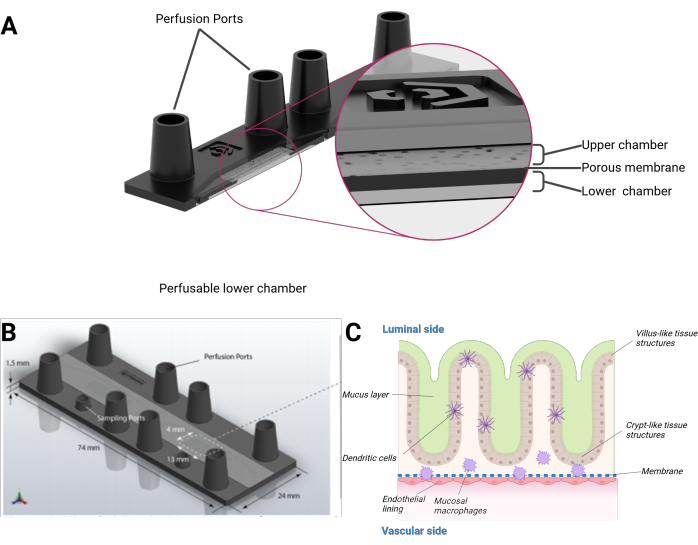
그림 1: intestine-on-chip 모델의 개략도 . (A) 바이오칩은 단면도로 표시됩니다. (B) 전체 바이오칩의 치수와 평평하고 제거 가능한 PET 멤브레인의 치수를 볼 수 있습니다. 암형 루어 잠금 장치 크기의 포트를 포함한 상부 챔버의 총 부피는 하부 챔버에 대해 각각 290 μL 및 270 μL입니다. (C) 장-바이오칩의 개략적인 구성, 분화된 면역 세포와 점액층을 포함하는 융모와 같은 및 크립트와 같은 구조를 닮은 3차원 돌출 상피를 볼 수 있습니다. PET 멤브레인의 다른 쪽은 내피 단층으로 덮여 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
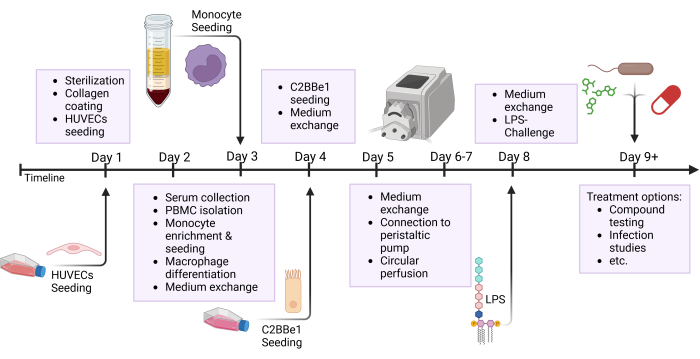
그림 2: 모델 구축 타임라인 및 실험 설정에 대한 개략도. 이 그림은 제시된 프로토콜의 개략도를 보여줍니다. 세포의 파종 및 LPS를 사용한 상피 도전과 같은 중요한 절차는 화살표로 표시됩니다. 약어: HUVECs = human umbilical venous endothelial cells; LPS = 지질다당류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 바이오칩 살균
- 직경이 15cm인 멸균 유리 페트리 접시에 70% 변성되지 않은 에탄올을 채웁니다. 바이오칩의 모든 포트가 에탄올 용액으로 완전히 덮이도록 바이오칩을 내부에 넣습니다.
- 포트당 두 번씩 칩의 모든 챔버를 통해 70% 에탄올 1mL를 당깁니다. 실온(RT)에서 45-60분 동안 배양합니다.
알림: 바이오칩 내부에 공기가 갇혀 있지 않은지 확인하십시오. 이 시점부터 바이오칩 시스템에 공기가 유입되어서는 안 되며 캐비티는 액체로 채워진 상태로 유지되어야 합니다. - 페트리 접시에서 에탄올을 제거하고 모든 포트가 완전히 덮일 때까지 멸균 이중 증류수(ddH2O)로 교체합니다. 다시 말하지만, 포트당 두 번, 바이오칩 캐비티를 통해 1mL의 ddH2O를 끌어들입니다. 페트리 접시에서 ddH2O를 새로 고치고 절차를 반복합니다.
- 페트리 접시에서 모든 액체를 제거하십시오. 이후로는 멸균 환경 외부에 있을 때마다 완전히 멸균된 바이오칩을 밀폐된 페트리 접시 안에 보관하십시오. 2-5mL ddH2O의 작은 저장소(예: 50mL 튜브의 뚜껑)를 페트리 접시에 추가하여 바이오칩 내부의 액체 증발을 줄입니다.
알림: 바이오칩은 사용할 때까지 멸균 환경에 보관하는 경우 최대 3일 전에 멸균할 수 있습니다. 이를 통해 하루 만에 작업 부하를 유연하게 처리할 수 있습니다.
3. HUVEC 수확 및 파종
참고: 인간 제대 정맥 내피 세포(HUVECs)는10 이전에 발표된 바와 같이 탯줄에서 분리되었습니다.
- HUVECs를 파종하기 전에 인간 콜라겐 IV로 멤브레인을 코팅합니다. 이를 위해 마그네슘과 칼슘(PBS +/+)을 함유한 Dulbecco의 인산염 완충 식염수에 콜라겐 원액(표 1)을 1:100으로 희석하여 준비합니다. 희석된 원액 350μL를 해당 챔버에 추가합니다. RT에서 5분 동안 배양합니다.
알림: 멸균 후드에서 바이오칩을 취급하는 경우 과도한 매체를 수집하기 위해 그 아래에 멸균 조직을 놓는 것이 좋습니다. - 350μL의 PBS +/+로 모든 챔버를 두 번 세척하여 남아 있는 콜라겐과 아세트산을 씻어냅니다. 그런 다음 각 챔버에 350μL의 내피 세포 성장(EC)-배지를 추가합니다.
참고: 여기에서 바이오칩은 세포 파종 준비가 되었으며 사용할 때까지 37°C에서 보관할 수 있습니다. - 80-90% 세포 밀도에서 통로 1-3에서 HUVEC을 사용합니다. 제조업체에서 제공한 정의된 보충제 혼합물을 포함하는 EC 배지에서 HUVEC를 배양합니다. HUVEC 세포 배양의 대표적인 명시야 이미지가 그림 3A에 나와 있습니다.
참고: 공여체에 따라 더 높은 통로의 HUVEC는 역분화를 시작할 수 있으며 바이오칩 내부에 조밀하고 합류하는 단층을 안정적으로 형성할 수 없습니다. 항생제, 즉 100U/mL 페니실린 및 100μg/mL 스트렙토마이신의 사용은 선택 사항이지만 미생물 오염을 방지하기 위해 EC 배지의 보충제로 권장됩니다. - T25 세포 배양 플라스크에서 세포 배양 배지를 제거하고 마그네슘과 칼슘이 없는 Dulbecco의 인산염 완충 식염수 3-5mL로 세포를 부드럽게 세척합니다(PBS -/-). PBS -/-를 제거하고 트립신 해리 시약 1mL를 추가합니다(표 1). 세포가 세포 배양 플라스크에서 분리될 때까지 37°C에서 5분 동안 배양합니다.
- PBS -/-에서 9mL의 5% 소 태아 혈청(FBS)을 사용하여 분리된 세포를 튜브로 옮깁니다. RT에서 350× g 에서 5분 동안 원심분리합니다. 상층액을 제거하고 1mL의 EC-배지에 재현탁한 다음 세포 수를 결정합니다. 세포 농도를 0.4 × 150 μL당 106 세포(하부 챔버에 파종) 또는 250 μL(상부 챔버에 파종)로 조정합니다.
- 챔버에 각각의 세포 부피를 추가합니다. 하부 챔버에 파종하는 경우 모든 포트를 닫고 즉시 바이오칩을 거꾸로 놓아 세포가 PET 멤브레인에 떨어지도록 합니다. 37 ° C 및 5 % CO2의 가습 된 인큐베이터에서 바이오 칩을 배양합니다.
- 24시간 후에 HUVEC 함유 챔버를 350μL의 EC-배지와 매체 교환을 수행합니다. 반대쪽 챔버의 매체는 교체할 필요가 없습니다.
4. 인간 혈청 채취 및 말초혈액 단핵세포(PBMC) 유래 단핵구 분리
참고: PBMC는 Mosig et al.11에 설명된 대로 분리되었습니다.
- 건강한 기증자로부터 인간 정맥혈을 채취합니다. 바이오칩당 혈청 수집을 위해 규산염 함유 혈액 수집 튜브에 최소 10mL의 전혈을 조달합니다. 완전한 응고 후 혈액 수집 튜브를 2,500× g 에서 RT에서 10분 동안 원심분리합니다. 혈청, 부분 표본을 수집하고 추가 사용할 때까지 -20°C에서 보관합니다.
- PBMC 분리를 위해 EDTA 함유 혈액 수집 튜브에서 동일한 기증자로부터 최소 10mL의 전혈을 조달합니다. 응고되지 않은 혈액을 iso-buffer(표 1)와 1:1로 반전하여 부드럽게 혼합하고 이 혼합물 35mL를 50mL 튜브에 1.077g/mL의 밀도를 가진 밀도 구배 배지 15mL 위에 천천히 층을 이룹니다.
- RT에서 브레이크 없이 800× g 에서 20분 동안 원심분리합니다. 밀도 구배 매체 위에 나타나는 면역 세포층을 조심스럽게 빼내고 새로운 50mL 튜브로 옮깁니다. 최대 50mL의 차가운 이소 버퍼를 채우고 부드러운 반전으로 세포를 세척합니다.
- 200 × g 에서 4 °C에서 브레이크 없이 8분 동안 원심분리기. 상층액을 버리고 밀도 구배에 따라 10mL의 iso-buffer에 재현탁시킵니다. 선택 사항: 여러 그래디언트가 병렬로 실행되는 경우 한 기증자의 PBMC를 풀링합니다.
- 150 × g 에서 4 °C에서 8분 동안 원심분리합니다. 상층액을 버리고 밀도 구배당 10mL의 iso-buffer에 펠릿을 재현탁시킵니다. 원심분리 단계 4.4를 반복합니다. 마지막으로, 상층액을 버리고 세포를 2mL의 단핵구 분화 배지에 재현탁시킵니다(표 1).
참고: M-CSF 및 GM-CSF의 추가는 고립된 단핵구가 단핵구 유래 대식세포 및 단핵구 유래 수지상 세포로 분화되도록 강제합니다(이 프로토콜의 뒷부분에 추가되는 지질다당류[LPS]와 함께). 항생제, 즉 100U/mL 페니실린 및 100μg/mL 스트렙토마이신의 사용은 선택 사항이지만 미생물 오염을 방지하기 위해 배지의 보충제로 권장됩니다. - 세포 수를 결정하고 2mL의 단핵구 분화 배지에서 6-웰 플레이트의 웰당 ~10 ×10 6 개의 세포를 시드합니다(표 1). 37°C의 가습 인큐베이터에서 1시간 동안 배양하여 단핵구를 6-well plate의 플라스틱에 부착할 수 있도록 합니다.
- 상층액을 조심스럽게 버리고 미리 데워진 2mL의 조혈 세포 배지로 2배 세척하여 결합되지 않은 세포를 제거합니다. 37°C에서 단핵구 분화 배지에서 24시간 더 배양합니다.
- 단핵구를 수확하려면 상층액을 조심스럽게 버리고 미리 데워진 PBS -/-의 2mL로 한 번 세척합니다. 그림 3B 를 참조하면 이 시점에서 단핵구 배양에 대한 명시야 이미지의 예가 표시됩니다. 그런 다음 37°C에서 1mL의 예열된 단핵구 분리 시약(표 1)에서 7분 동안 세포를 배양하여 6-웰 플레이트의 플라스틱에서 단핵구를 강제로 분리합니다.
- 분리된 단핵구를 결합이 낮은 튜브로 옮깁니다. 선택 사항: 더 높은 셀 수율을 얻으려면 PBS -/-로 6웰 플레이트를 여러 번 조심스럽게 세척하십시오.
- 상층액을 300× g 에서 RT에서 8분 동안 원심분리합니다. 상층액을 버리고 EC 조절 매체에 다시 현탁시킵니다(표 1). 세포 수를 측정하고 세포 농도를 150 μL당 0.1 × 106 세포(하부 캐비티에 파종) 또는 250 μL당(상부 캐비티에 파종)으로 조정합니다.
참고: 면역 세포 분리의 모든 단계에서 부드럽게 하고 전단력을 줄여 면역 세포 활성화를 방지하십시오. 이러한 분리를 설정할 때 PBMC 유래 단핵구의 순도를 확인하십시오(예: 유세포 분석을 통해). 모든 세포의 95% 이상이 CD14와 같은 전형적인 단핵구 마커에 대해 양성이어야 합니다.
5. 단핵구 파종
- HUVEC 함유 챔버에서 350μL의 예열된 EC 컨디셔닝 배지와 매체 교환을 수행합니다.
- 준비된 단핵구 현탁액(단계 4.10 참조)의 150μL(하부 챔버) 또는 250μL(상부 챔버)를 동일한 챔버에 추가합니다. 하부 챔버에 파종하는 경우 모든 포트를 닫고 즉시 바이오칩을 거꾸로 놓아 세포가 HUVEC 층으로 떨어지도록 합니다. 37 ° C 및 5 % CO2의 가습 된 인큐베이터에서 바이오 칩을 배양합니다.
- HUVEC + 단핵구 함유 챔버에서 24시간마다 350μL의 EC 조절 배지로 배지 교환을 수행합니다.
6. C2BBe1 수확 및 파종
참고 : Caco-2 브러시 테두리 표현 셀 1 (C2BBe1) 12 는 통로 35까지 사용되며 80-90 % 밀도의 플라스크에서 가져옵니다. C2BBe1 배양권의 대표적인 명시야 이미지가 그림 3C에 나와 있습니다.
- C2-medium에서 C2BBe1 세포를 배양합니다(표 1).
참고: 항생제, 즉 20μg/mL 겐타마이신의 사용은 선택 사항이지만 미생물 오염을 방지하기 위해 C2 배지의 보충제로 권장됩니다. - T25 세포 배양 플라스크의 세포 배양 배지를 제거하고 3-5mL의 PBS -/-로 세포를 부드럽게 세척합니다. PBS -/-를 제거하고 트립신 해리 시약 1mL를 추가합니다(표 1). 세포가 세포 배양 플라스크에서 분리될 때까지 37°C에서 5분 동안 배양합니다.
- PBS -/-에서 9mL의 5% 소 태아 혈청(FBS)을 사용하여 분리된 세포를 튜브로 옮깁니다. 상층액을 제거하고 1mL의 C2- 배지에 재현탁한 다음 세포 수를 측정합니다. 상층액을 제거하고 1mL의 C2-배지에 재현탁한 다음 세포 수를 결정합니다.× 세포 농도를 0.5 × 150 μL당 106 세포(하부 챔버에 파종) 또는 250 μL(상부 챔버에 파종)로 조정합니다.
- C2BBe1을 파종하기 전에 350μL의 C2-medium으로 해당 챔버를 부드럽게 세척합니다.
- 준비된 C2BBe1-현탁액(단계 6.3 참조)의 150μL(하부 챔버) 또는 250μL(상부 챔버)를 해당 챔버에 추가합니다. 하부 챔버에 파종하는 경우 모든 포트를 닫고 즉시 바이오칩을 거꾸로 놓아 세포가 PET 멤브레인에 떨어지도록 합니다. 37 ° C 및 5 % CO2의 가습 된 인큐베이터에서 바이오 칩을 배양합니다.

그림 3: 바이오칩에 파종하기 전의 HUVEC, 단핵구 및 C2BBe1의 세포 형태. 이 그림은 프로토콜 전반에 걸쳐 사용되는 다양한 세포 소스의 대표적인 명시야 이미지를 보여줍니다. 이미지는 10x 배율을 사용하여 역명시야 현미경으로 촬영했습니다. 모든 세포 유형, (A) HUVECs, (B) 단핵구 및 (C) C2BBe1은 특정 프로토콜 섹션에 설명된 대로 2D 단층 세포 배양에서 배양되었습니다. 스케일 바 = 200 μm. 약어: HUVECs = human umbilical venous endothelial cells; PBMCs = 말초 혈액 단핵 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 연동 펌프 및 원형 관류에 연결
- 연동 펌프를 추가하여 빈 인큐베이터를 준비합니다. 인큐베이터와 펌프의 모든 영역을 소독제로 철저히 청소하여 준 멸균 환경을 제공합니다.
알림: 연동 펌프는 작업하는 동안 많은 열을 생성할 수 있습니다. 단열이 잘 된 인큐베이터 또는 냉난방이 제대로 되지 않은 실험실에서는 인큐베이터가 과열되는 경향이 있기 때문에 인큐베이터당 사용 가능한 펌프의 수가 제한될 수 있습니다. 인큐베이터당 두 개의 연동 펌프가 적당해야 합니다. - 멸균된 튜브를 바이오칩에 부착하기 전에 각 튜브를 700μL의 PBS +/+로 세척한 다음 500μL의 C2-매체 또는 EC 컨디셔닝 매체로 세척합니다. 매체당 각 대칭의 튜브 하나를 준비합니다(1.2단계 참조). 왼쪽 캐비티의 경우 루어 잠금 장치에서 연동 펌프 스토퍼까지의 거리가 짧은 튜빙을 사용하고 오른쪽 캐비티의 경우 다른 대칭이 있는 튜빙을 사용합니다.
- 인큐베이터에서 바이오칩을 회수하고 각 챔버에 대해 350μL로 배지 교환을 수행합니다. 모든 플러그를 뽑고 모든 포트를 맨 위까지 채우십시오.
- 왼쪽 캐비티에서 시작하여 루어 잠금 어댑터를 바이오칩의 포트에 삽입하여 첫 번째 튜브를 상부 챔버의 오른쪽 포트에 연결합니다. 그런 다음 두 번째 튜브를 하부 챔버의 왼쪽 포트에 연결합니다. 오른쪽 미세유체 캐비티에 대해 이 절차를 반복합니다.
- 저장소를 가져 와서 저장소 바닥에 세포 배양 배지 소량 방울을 추가합니다. 그런 다음 저장소를 첫 번째 튜브의 반대쪽에 삽입하고 다른 챔버에 대해 반복합니다. 모든 포트가 튜브 또는 reservoir에 연결되면 reservoir에 3.5mL의 세포 배양 배지를 채웁니다.
- 뚜껑이 부착된 튜브의 느슨한 면을 저장소 위에 놓아 각 챔버의 미세유체 시스템을 닫습니다. 이 상태에서 바이오칩을 연동 펌프로 운반합니다.
알림: 인큐베이터까지의 거리와 실험실 주변 환경에 따라 이전에 세척하고 고압멸균한 상자를 사용하여 칩을 인큐베이터로 옮길 수 있습니다. - 연동 펌프 스토퍼를 사용하여 튜브를 펌프에 연결합니다. 매체가 저장소에서 캐비티로, 튜브로, 펌프를 통해 저장소로 다시 흐르도록 각 튜브를 연동 펌프에 연결합니다(그림 4). 저장소는 원형 관류에서 기포 트랩 역할을 하며 공기가 시스템에 갇히는 것을 방지합니다. 각 챔버에 50 μL/min의 유속으로 관류하여 상부 챔버에서 0.013 dyn / cm2, 하부 챔버8에서 0.006 dyn / cm2의 전단 응력을 얻습니다.
주의: 하부 및 상부 공동의 매체가 반대 방향으로 이동하면, 장 조직의 더 높은 3차원 돌출물을 얻을 수 있다13. 따라서 상부 및 하부 캐비티의 저장소는 반대쪽에 배치됩니다(그림 4). 순환 관류는 필요한 세포 배양 배지의 양을 줄이지만 잠재적으로 사이토카인과 대사 산물을 풍부하게 만들 수 있습니다. 원하는 경우, 바이오칩의 선형 관류도 가능하다. - 37 ° C 및 5 % CO2에서 72 시간 동안 바이오 칩을 관류합니다.

그림 4: 연동 펌프에 연결된 바이오칩. 연동 펌프에 연결된 바이오칩의 예가 제시됩니다. 상피 C2BBe1 세포는 하부 챔버(빨간색 C2-배지는 앞쪽의 저장소에 있음)에서 배양되고 HUVEC은 위쪽 챔버(노란색 EC-컨디셔닝-배지는 뒤쪽의 저장소에 있음)에서 배양됩니다. 다른 세포 배양 배지는 성장한 조직의 장벽 기능으로 인해 혼합되지 않습니다. 바이오칩은 매체가 저장소에서 캐비티로 흐르는 방식으로 연동 펌프에 연결됩니다. 여기에서 매체는 펌프를 통해 튜브를 통해 저장소로 다시 흐릅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 상피 장벽의 LPS 조절
- 72시간의 예비 관류 후 연동 펌프를 중지하고 각 저장소의 튜브에 연결된 뚜껑을 제거합니다. 펌프 옆의 멸균 조직에 놓습니다.
- 모든 배지를 제거하고 새로 준비된 배지 2mL로 저장소를 채웁니다. C2BBe1 세포를 포함하는 상피 쪽의 경우 배지에 100ng/mL LPS를 추가합니다.
참고: LPS는 조직의 장벽 기능을 증가시키고, 단핵구 유래 대식세포가 상피 조직으로 이동하도록 자극하며, 단핵구 유래 수지상세포 분화를 가능하게 합니다. - 튜브와 뚜껑을 저장소에 다시 연결하고 추가로 50시간 동안 24μL/min의 유속으로 원형 관류를 계속합니다.
참고: 이 시점부터 칩 모델은 화합물 실험 또는 감염 연구에 사용할 수 있습니다. 24시간마다 저장소당 2mL의 매체 교체를 권장합니다.
9. 다른 해독 방법을 위한 조직에 접근
- 관류가 진행되는 동안 항상 저장소에서 세포 배양 배지 상층액을 수집합니다. 저장소를 열고 원하는 볼륨을 수집합니다(8.1-8.3단계 참조). 이러한 상층액을 대사 산물, 사이토카인 또는 기타 분자의 검출에 사용하십시오.
- 조직에 접근하려면 메스를 사용하여 상부 챔버 외부를 따라 정밀하게 절단하고 접착 호일을 제거하여 미세유체 공동을 엽니다. 이제 장-바이오칩 모델의 조직에 액세스할 수 있습니다. 미세유체 챔버의 외부를 따라 조심스럽게 절단하여 바이오칩에서 멤브레인을 분리합니다. 핀셋을 사용하여 조직 함유 막을 채취합니다.
주의: 이 단계에서 손가락 위치에 주의하고 사고를 방지하기 위해 주의하십시오. 베임 방지 장갑을 착용하는 것이 좋습니다. - 또는 효소 용액, 즉 트립신 또는 Triton X-100 함유 완충액을 사용하여 용해된 세포를 사용하여 바이오칩 내부의 개별 층에서 세포를 수확합니다.
10. FITC-dextran 확산을 통한 투과성 평가
참고: 조직의 장벽 기능은 연동 펌프를 분리한 후 FITC-dextran 투과성 분석을 통해 분석할 수 있습니다. FITC-덱스트란 투과성 평가는 Deinhardt-Emmer et al.4에서 채택되었습니다.
- 플루오레세인 이소티오시아네이트(FITC)-덱스트란(분자량 3-5kDa, 표 1)의 원액을 준비합니다.
- 저장소를 비우고 관류에서 칩을 분리합니다.
- 상부 및 하부 챔버에서 페놀 적색이 없는 배지로 매체 교환을 수행합니다.
참고: 실험 중에 페놀 적색이 없는 매체가 이미 사용된 경우 이 단계가 필요하지 않습니다. - C2BBe1 세포가 들어 있는 챔버에 350μL의 1mg/mL FITC-dextran 용액을 추가합니다.
- 포트를 닫고 상피 면이 위를 향하도록 하여 37°C에서 60분 동안 칩을 배양합니다.
- 배양 시간이 끝나면 칩의 두 챔버에서 배양 배지를 별도로 수집하고 측정할 때까지 빛으로부터 보호되는 4°C에 보관합니다.
- 측정을 위해 1,000 μg/mL - 0 μg/mL FITC-dextran 범위에서 페놀 레드가 없는 C2-배지 및 EC 컨디셔닝 배지에서 11회 연속 1:2 연속 희석으로 표준 곡선을 준비합니다.
- 각 시료 200μL를 바닥이 투명한 검은색 96웰 플레이트에 옮깁니다. 마이크로플레이트 리더를 사용하여 495nm의 여기 파장과 517nm의 방출 파장에서 형광을 측정합니다.
- 표준 곡선을 사용하여 샘플의 FITC-덱스트란 농도를 계산하고 그에 따른 투과성 계수를 계산합니다.
11. 면역형광 염색
참고: 살아있는 조직은 현미경으로 조사할 수 있습니다. 더 쉽게 취급하려면 연동 펌프에서 바이오칩을 분리하고 도립 현미경에서 장거리 대물렌즈를 사용하는 것이 좋습니다. 종말점 분석으로, 조직은 면역형광 염색과 같은 절차를 위해 바이오칩 내부에 고정될 수 있습니다.
- 연동 펌프를 중지하고 모든 캐비티의 저장소를 엽니다. 저장소를 비우고 튜브와 바이오칩에서 저장소를 분리합니다.
- 챔버당 두 번, 500μL의 차가운 PBS +/+로 미세유체 캐비티를 세척합니다. 모든 캐비티에 500μL의 얼음처럼 차가운 메탄올을 추가하고 -20°C에서 15분 동안 배양합니다. 그런 다음 캐비티당 두 번 미세유체 챔버를 500μL의 PBS +/+로 세척합니다.
참고: 4% 파라포름알데히드 또는 Carnoy's 정착제로 고정하는 것과 같은 다른 고정 방법도 적합합니다. 부착 후 칩을 4°C에서 보관하거나 면역 형광 염색으로 바로 진행할 수 있습니다. 주의: 메탄올 또는 파라포름알데히드와 같은 고정 화학 물질은 독성이 있습니다. 흄 후드 아래에서 해당 작업을 수행하고 그에 따라 폐기물을 수거하십시오. - 9.2단계에 설명된 대로 칩을 열어 조직에 접근합니다. 조직을 함유한 PET 멤브레인을 최대 3조각으로 절단하여 다른 면역 패널과 병렬로 염색합니다.
- 정밀 핀셋을 사용하여 차단 및 투과화 용액(표 1)이 포함된 별도의 24웰 플레이트로 각 멤브레인 조각을 옮깁니다. 전체 염색 과정에서 관심 세포층이 항상 위쪽을 향하도록 합니다. RT에서 30분 동안 멤브레인 조각을 배양합니다.
참고: 혈청을 2차 항체와 일치시킬 때 최상의 염색 결과를 얻을 수 있습니다. 예를 들어, 염소 종에서 2차 항체를 얻은 경우 일반 염소 혈청을 사용하는 것이 좋습니다. - 멤브레인 조각을 습한 챔버 내부의 깨끗한 유리 슬라이드로 옮깁니다. 염색 용액(표 1)에서 1차 항체 패널을 준비하고 각 멤브레인 조각에 50μL를 추가합니다. 4 °C에서 하룻밤 동안 배양합니다.
참고: 최적의 항체 농도 및 염색 효능은 제조업체와 클론에 따라 다를 수 있습니다. 2D 세포 배양에서 염색 패널을 미리 테스트하는 것이 좋습니다. - 배양 후 샘플을 24웰 플레이트로 옮기고 세척 용액으로 3 x 5분 동안 멤브레인을 부드럽게 세척합니다(표 1).
- 다시 말하지만, 멤브레인 조각을 습한 챔버 내부의 깨끗한 유리 슬라이드에 옮깁니다. 염색 용액(표 1)에서 2차 항체 패널을 준비하고 각 멤브레인 조각에 50μL를 추가합니다. 필요한 경우 4',6-diamidino-2-phenylindole(DAPI) 또는 Hoechst와 같은 핵 대조염색을 추가합니다. RT에서 30분 동안 배양합니다.
참고: 형광단으로 작업하는 동안 이미지 품질을 높이기 위해 광표백을 방지하기 위해 샘플을 빛으로부터 보호하십시오. - 배양 후 샘플을 24웰 플레이트로 옮기고 세척 용액으로 멤브레인을 2 x 5분 동안 부드럽게 세척합니다(표 1). 그런 다음 PBS +/+로 5분 동안 한 번 씻으십시오.
- 형광 장착 매체와 커버 유리를 사용하여 깨끗한 유리 슬라이드에 멤브레인 조각을 장착합니다. 현미경 이미징이 이루어질 때까지 4 °C에서 보관하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
이러한 대표적인 결과는 intestine-on-chip 모델의 뚜렷한 조직층을 보여줍니다. 이들은 프로토콜 섹션 11에 설명된 대로 면역형광 염색됩니다. 이미지는 epifluorescence 또는 confocal fluorescence microscope를 사용하여 z-stack으로 촬영하고 직교 투영으로 처리했습니다. 현미경 설정 및 소프트웨어에 대한 자세한 내용은 Table of Materials 를 참조하십시오. 그림 5 는 HUVEC과 대식세?...
Access restricted. Please log in or start a trial to view this content.
토론
제시된 프로토콜은 면역 능력이 있는 장-온-칩 모델을 생성하는 데 필요한 단계를 자세히 설명합니다. 면역형광 현미경 검사, 사이토카인 및 대사산물 분석, 유세포 분석, 단백질 및 유전자 분석, 투과성 측정과 같은 특정 기술과 가능한 판독 방법을 설명했습니다.
기술된 모델은 6,14 이전에 기술된 바와 같이 점액 분비, 흡수성, 장?...
Access restricted. Please log in or start a trial to view this content.
공개
M.R.은 Dynamic42 GmbH의 CEO이며 회사의 지분을 보유하고 있습니다. A.S.M.은 Dynamic 42 GmbH의 과학 고문이며 회사의 지분을 보유하고 있습니다.
감사의 말
이 연구는 V.D.W.와 A.S.M. 및 A.S.M. A.F. 및 A.S.M.에 대한 공동 연구 센터 PolyTarget 1278(프로젝트 번호 316213987)의 재정 지원을 받았으며, 독일의 Excellence Strategy - EXC 2051 - Project-ID 690 390713860에 따른 Cluster of Excellence "Balance of the Microverse"의 재정 지원을 인정합니다. 컨포칼 레이저 스캐닝 현미경 ZEISS LSM980을 사용할 수 있도록 지원해 준 Astrid Tannert와 Jena Biophotonic and Imaging Laboratory(JBIL)에 감사드립니다. 그림 1C와 그림 2 는 Biorender.com 로 만들어졌습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
참고문헌
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유