A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تثبيت قطع عظم الفخذ مع تثبيت الصفائح في Ambystoma mexicanum
In This Article
Summary
يتم تقديم بروتوكول لجراحة قطع عظم الفخذ مع استخدام تثبيت اللوحة الداخلية في قنافذ البحر الناضجة. يمكن استخدام الإجراء لإجراء دراسات مقارنة حول تجديد الأطراف والتئام الكسور في البرمائيات المائية.
Abstract
قنفذ البحر (Ambystoma mexicanum) هو كائن نموذجي واعد للطب التجديدي بسبب قدرته الرائعة على تجديد الأعضاء المفقودة أو التالفة ، بما في ذلك الأطراف والدماغ والقلب والذيل وغيرها. تسلط الدراسات التي أجريت على قنفذ البحر الضوء على المسارات الخلوية والجزيئية التي تحكم تنشيط السلف واستعادة الأنسجة بعد الإصابة. يمكن تطبيق هذه المعرفة لتسهيل التئام الإصابات غير الكفؤة للتجديد ، مثل عدم اتحاد العظام. في البروتوكول الحالي ، يتم وصف تثبيت عظم الفخذ باستخدام نظام تثبيت لوحة داخلي. تم تكييف الإجراء للاستخدام في المائية (axolotl ، Ambystoma mexicanum). تم استخدام قنافذ البحر ≥ 20 سم من الخطم إلى الذيل مع عظم الفخذ المتحجر بالكامل بحجم الماوس ، وتم إيلاء اهتمام خاص لوضع اللوحة وتثبيتها ، وكذلك لرعاية ما بعد الجراحة. تسمح هذه التقنية الجراحية بتثبيت العظام بشكل موحد ومستقر ويمكن أن تكون مفيدة للمقارنة المباشرة مع تجديد أطراف axolotl والدراسات المماثلة لشفاء العظام عبر البرمائيات والثدييات.
Introduction
يعد قنفذ البحر (Ambystoma mexicanum) نموذجا مهما لتجديد الأعضاء ، بما في ذلك الذيل والحبل الشوكي والدماغ والقلب والخياشيم والأطراف1،2،3،4،5. كشفت الدراسات التفصيلية لتجديد أطراف قنفذ البحر عن آليات عدم تمايز الخلايا وتشكيل تجمع الخلايا الجذعية ، blastema، في موقع البتر. نظرا لقدرة الخلايا الأرومية على إعادة بناء جميع أجزاء الأطراف المفقودة ، بما في ذلك الهيكل العظميالمنقوش 6,7 ، يبدو أن قنفذ البحر كائن نموذجي جذاب لدراسات شفاء العظام. في الآونة الأخيرة ، ركزت العديد من الدراسات بشكل أكبر على بيولوجيا العظام في axolotls ، واصفة مورفولوجيا الهيكل العظمي ، والتكوين الخلوي ، وديناميكيات التعظم.
وجد في الثدييات أن عملية التئام العظام في العظام الطويلة تحدث عن طريق التعظم داخل الغضروف وتتكون من عدة مراحل: ورم دموي ، وأنسجة حبيبية ، وتشكيل الكالس الناعم ، وتعظم الكالس إلى الكالس الصلب والعظام المنسوجة ، وإعادة تشكيل العظام8. أظهرت دراسة حديثة أنه يمكن ملاحظة مراحل مماثلة في شفاء عظم إبسولوتل9.
حتى الآن ، تمت دراسة كسور axolotl في نظام غير مستقر ، حيث يتم قطع العظام ببساطة بمقص استئصال القزحية. تم إنشاء الكسور الكبيرة في zeugopod ، حيث يتم إجراء قطع العظم على إحدى العظام ، في حين أن الآخر بمثابة دعم10,11. في المقابل ، تتم دراسة الكسور بشكل روتيني في الثدييات ، بما في ذلك الجرذان والفئران ، باستخدام أنظمة تثبيت موثوقة ، مثل دبوس داخل النخاع وألواح محاذاة العظام ، للتحكم في حجم الكسر وضمان محاذاة العظام.
وبالتالي ، تهدف الطريقة إلى ضمان تثبيت مستقر وموحد لعظم الفخذ قبل قطع العظم. من أجل جعل دراسات axolotl أكثر قابلية للمقارنة مع الثدييات ، بما في ذلك الفئران والبشر ، تم النظر في تثبيت دبوس داخل النخاع12 ، ومثبت الصفيحة الخارجية13،14 ، وتثبيت لوحة محاذاة العظام الداخلية15،16،17. وقد تبين أن هذا الأخير يضمن التثبيت المناسب للعظام ويسمح بإنشاء فجوة بحجم معين باستخدام قطع أو قطعتين بمنشار Gigly بقطر معين. نظرا لأن قنافذ البحر تمثل اليرقات المائية ل Ambystoma mexicanum ، فقد يكون المثبت الخارجي قد تسبب في مضاعفات ما بعد الجراحة بسبب الجرح المفتوح والتلامس مع الماء. نظرا لأن قنافذ البحر لا تطور مراكز تعظم ثانوية حتى وقت متأخر جدا من تطورها (20 عاما18) ، وبالتالي قد لا يتم منع الظفر القياسي داخل النخاع المستخدم في الفئران من ثقب المشاش ، فقد تم اتخاذ قرار بتطبيق طريقة تثبيت الصفائح الداخلية على قنافذ البحر الكبيرة. في قنافذ البحر الكبيرة ، يشبه حجم عظم الفخذ ودرجة التعظم حجم الفأر البالغ ، مما يسمح بقطع العظم في منتصف الحجاب مع تثبيت صفيحة التيتانيوم1.
يحدد حجم فجوة الكسر إلى حد كبير ديناميكيات الشفاء والنتيجة. على سبيل المثال ، في الفأر ، تلتئم الكسور المستقرة 0.25 مم في الغالب من خلال التعظم داخل الغشاء بسبب صغر حجمها واستقرارها الصلب. يشفى كسر 0.7 مم عن طريق التعظم داخل الغضروف ، مع تشكيل الكالس الغضروفي حول الكسر ؛ العيوب الكبيرة ، مثل العيوب الحرجة 3.5 مم لا تلتئم تماما ، وبالتالي يتم استخدامها لنمذجة كسر العظام غير الاتحاد16. في هذه الدراسة ، تم إنشاء بروتوكول تثبيت الصفيحة لعظم الفخذ قبل قطع العظم باستخدام مثال فجوة كسر 0.7 مم مع الهدف النهائي المتمثل في مقارنة شفاء عظم إبسولوتل بشفاء الفأر9.
بعد قطع العظم ، خضعت الكسور لعملية التعظم داخل الغضروف ، وإن كانت أبطأ من الفئران ، ربما بسبب نمط الحياة المائية ل axolotls ومعدلات انقسام الخلايا الأبطأ. في الطريقة المعروضة هنا ، يتم عرض قطع العظم بفجوة 0.7 مم مع تثبيت لوحة صلبة ؛ ومع ذلك ، من المحتمل أن تكون أحجام الفجوات الأخرى والمثبتات شبه المرنة ، وكذلك الألواح من مواد مختلفة ممكنة. بشكل عام ، يمكن استخدام الطريقة المعروضة هنا لتثبيت العظام القياسي وستكون مفيدة للدراسات التي تقارن تجديد أطراف قنفذ البحر بشفاء العظام أو دراسة التئام العظام في قنافذ البحر في ظل ظروف مختلفة لضمان تثبيت الكسر الموحد.
Protocol
تم تنفيذ الإجراء التالي بموافقة قاضي فيينا (GZ: MA 58-65248-2021-26). 5-8 سنوات ، ≥ 20 سم من طرف الخطم إلى الذيل (الخطم إلى طرف الذيل) تم استخدام قنافذ البحر الطويلة (Ambystoma mexicanum) لجراحة الكسور وبتر الأطراف. تم استخدام كل من الذكور والإناث في العمليات الجراحية. تم تربية Axolotls في معهد أبحاث مرفق علم الأمراض الجزيئي. تمت إدارة الألم وخطر العدوى باستخدام المسكنات والمضادات الحيوية المناسبة لضمان نتيجة ناجحة. يتم سرد الكواشف والمعدات المستخدمة للدراسة في جدول المواد.
1. إعداد
- استحم في محلول بنزوكائين 0.03٪ لمدة 15-20 دقيقة حتى يتم الوصول إلى التخدير الكامل ولا توجد حركة انعكاسية عند ملامسة الأطراف للملاقط.
- ضع مع الجانب البطني لأسفل على مناشف ورقية مبللة مبللة بمحلول البنزوكائين بنسبة 0.03٪ وقم بتغطيته بمناشف ورقية مبللة بالبنزوكائين. جلد المائية ، مثل قنافذ البحر ، حساس للجفاف ، وبالتالي ، من الضروري تغطية سطح الجسم لمنع الجفاف وضمان التنفس الجلدي (الجلد).
- قم بتمديد الطرف الخلفي ليتم تشغيله باستخدام ملقط حلقي. لا تستخدم كواشف التطهير ، مثل الإيثانول ، لأن جلد قنفذ البحر حساس للمواد الكيميائية ويسهل تهيجه. بدلا من ذلك ، استخدم 0.7x PBS (A-PBS) مع 50 وحدة / مل من البنسلين و 20 ميكروغرام / مل من الستربتومايسين لتنظيف الطرف وبعد ذلك لري العظام عند النشر.
ملاحظة: العدوى بشكل عام ليست مصدر قلق للعمليات الجراحية التي يتم إجراؤها على قنافذ البحر. ومع ذلك ، نظرا للطبيعة المائية لهذه والخيوط الموضوعة على سطح الجلد ، نوصي باستخدام المضادات الحيوية لمنع أي تلوث في موقع الجراحة.
2. الجراحة
ملاحظة: تعقيم جميع الأدوات الجراحية. طرق التعقيم الشائعة مثل التعقيم الحراري والتعقيم والغسيل بنسبة 70٪ من الإيثانول ، تليها إزالة شاملة لبقايا الكحول ، مناسبة لهذا الغرض. إذا كنت تعمل على متعددة ، فقم بتعقيم الأدوات بينهما باستخدام معقم حبة ساخنة أو 70٪ إيثانول.
- قم بعمل شق طولي جانبي (1.5-2 سم) بمشرط فوق عظم الفخذ يمتد على الفخذ بالكامل في الطرف الخلفي العلوي. من أجل القيام بذلك ، جس العظم قبل قطع الجلد.
- قم بإزاحة العضلات والأعصاب بعناية من موقع الجراحة دون قطع. استخدم ملقط منحني للقيام بذلك بكفاءة.
- ضع ملقط منحني برفق تحت عظم الفخذ لفضحه للجراحة.
- ضع لوحة تثبيت صلبة مقاس 7.75 مم ذات 4 ثقوب جنبا إلى جنب مع عظم الفخذ ، وتجنب لمس المفاصل ، وقم بتثبيتها في وضع محاذاة بالملقط.
- استخدم أربعة مسامير من التيتانيوم مقاس 2 مم لربط العظم باللوحة.
ملاحظة: تتميز البراغي المستخدمة في هذا البروتوكول بتصميم معقد وتتكون من 4 أجزاء: الجزء الرئيسي (سيتم تثبيته في العظم) ، ورأس المسمار (يسمح بإزالة البراغي واللوحة باستخدام مفتاح الربط المربع) ، والرقبة الأضيق (تستخدم كنقطة كسر بمجرد شد المسمار في العظم) ومقبض لولبي (يستخدم للربط بمفك البراغي وجهاز توجيه المنشار). - ترتيب مرفق المسمار مهم. ابدأ بالبراغي الداخلية أولا ، ثم المسمارين الخارجيين لضمان محاذاة اللوحة مع محور العظام. استخدم مثقابا يدويا لإنشاء الثقب الأول في العظم لسهولة إدخال المسمار ، متبوعا بوضع المسمار 1. حفر في منتصف محيط العظام لتجنب أرق العظام على جانب واحد ، مما قد يؤدي إلى كسر العظام التلقائي. استخدم الري مع 0.7x PBS + 1٪ قلم / بكتيريا أثناء الحفر. لا تقطع مقبض المسمار (المسمار)الأول (اختياري: 1 و 2).
- ضع جهاز توجيه المنشار على المسمار (المسمار)الأول (اختياري : 1و 2الثاني ) وقم بمحاذاته مع العظم والصفيحة.
ملاحظة: في هذا البروتوكول ، يتم توفير لوحة ومسامير وجهاز توجيه منشار ومنشار من قبل نفس الشركة المصنعة وتحسينها لتناسب بعضها البعض. يمكن أن يأتي جهاز توجيه المنشار بأحجام مختلفة ليكون متوافقا مع الألواح وأحجام المنشار المختلفة. - استخدم جهاز توجيه المنشار لحفر وإدخال بقية البراغي. تأكد من محاذاة اللوحة مع العظم. قطع مقابض البراغي.
- ضع قطعة من الفيلم البلاستيكي (6-7 مم × 4-5 سم) ، معقمة بالمسح بنسبة 70٪ من الإيثانول ثم تعقيمها أو تعقيمها بالحرارة (140 درجة مئوية لمدة 4 ساعات) ، تحت عظم الفخذ لمنع تلف الأنسجة الرخوة أثناء عملية قطع العظم.
ملاحظة: لهذا الغرض ، يمكن استخدام قطعة من الفيلم البلاستيكي ، وقطع كيس للتعقيم الحراري. - ضع منشار سلك Gigly بين العظام وفيلم الحماية.
- قطع العظام باستخدام منشار سلك Gigly مقاس 0.66 مم ، مما أدى إلى قطع واحد 0.7 مم في عظم الفخذ. استخدم الري المستمر مع 0.7x PBS + 1٪ قلم / بكتيريا أثناء النشر لتقليل تلف الأنسجة والاحتكاك.
- قم بإزالة المنشار ودليل المنشار واستخدم مفك البراغي لكسر المقابض اللولبية من البراغي.
- قم بإزالة طبقة الحماية ، وقم بري موقع الجراحة باستخدام 0.7x PBS + 1٪ قلم / بكتيريا العقدية.
- قم بتغطية الجزء العلوي من اللوحة والبراغي بشمع نحل العظام المعقم لحماية الجلد والعضلات من تهيج حواف البراغي.
- ضع العضلات والجلد فوق شمع نحل العظام.
- أغلق موقع الشق بخيط صناعي 7.0 (بولي بروبيلين / بولي إيثيلين) باستخدام غرز بسيطة متقطعة. يستخدم الخيط الصناعي لتقليل التلوث بالبكتيريا والفطريات المنقولة بالماء.
3. إدارة ما بعد الجراحة
- لإيقاظ ، ضعه في خزان به ماء بركة اصطناعي عذب ، مكمل ب 50 وحدة / مل من البنسلين ، و 20 ميكروغرام / مل من الستربتومايسين ، وبوتورفانول (0.5 مجم / لتر ماء).
- مراقبة لبدء تحريك الخياشيم ، واتخاذ الخطوات ، والسباحة - عادة في غضون 1 ساعة بعد الجراحة.
- احتفظ بالحيوان لمدة 3 أيام في ماء البركة الاصطناعي مع 50 وحدة / مل من البنسلين و 20 ميكروغرام / مل من الستربتومايسين قبل إعادته إلى الخزان القابض. لضمان التسكين، يضاف بوتورفانول (0.5 ملغ/لتر ماء).
- تأكد من بقاء الغرز في مكانها وحدوث التئام الجروح بشكل صحيح.
النتائج
تستغرق العملية الجراحية الموصوفة هنا (الشكل 1) ما بين 20 دقيقة و 30 دقيقة وتتطلب جراحا ومساعدا. اختياريا ، استخدم مجهر تشريح مجهر أو نظام عدسة مكبرة.
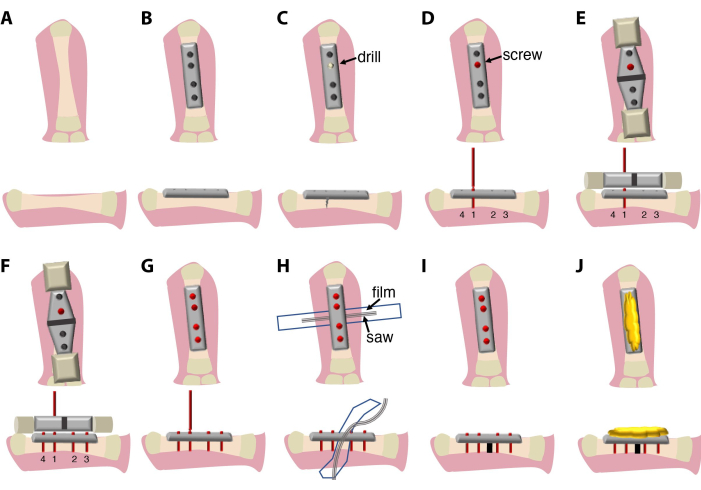
الشكل 1...
Discussion
تسمح الطريقة الموصوفة حاليا لتثبيت صفيحة عظم الفخذ وقطع العظم بتطبيقه في المائية ، مثل Ambystoma mexicanum (axolotl). تم استخدام هذه الطريقة الجراحية مؤخرا لمقارنة التئام الكسور وتجديد الأطراف في قنافذ البحر بشفاء الكسور في الفئران9. كما هو الحال في الفئران ، يمكن ت...
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
يود المؤلفون أن يشكروا سابين ستامب على الدعم الفني الممتاز وليديا غروسر على المساعدة في العمليات الجراحية. تم تمويل هذا البحث من قبل صندوق العلوم النمساوي [زمالة Hertha Firnberg رقم T-1219] ، ERC [منحة متقدمة ، 742046 RegGeneMems] ، DFG [CRC 1444].
Materials
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
References
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved