このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Ambystoma mexicanumのプレート固定による大腿骨骨切り術の安定化
要約
成熟したウーパールーパーの内部プレート固定を使用した大腿骨骨切り術手術のプロトコルが提示されます。この手順は、水生両生類の四肢の再生と骨折治癒に関する比較研究を行うために使用できます。
要約
ウーパールーパー(Ambystoma mexicanum)は、手足、脳、心臓、尾などの失われた臓器や損傷した臓器を再生する優れた能力を備えているため、再生医療の有望なモデル生物です。ウーパールーパーに関する研究は、前駆細胞の活性化と損傷後の組織回復を支配する細胞および分子経路に光を当てます。この知識は、骨の非結合などの再生不能な損傷の治癒を促進するために適用できます。現在のプロトコルでは、内部プレート固定システムを使用した大腿骨骨切り術の安定化が説明されています。この手順は、水生動物(ウーパールーパー、 Ambystoma mexicanum)での使用に適応されました。≥20 cm の鼻から尾までの軸生ルーパーを使用し、完全に骨化したマウスサイズの同等の大腿骨を使用し、プレートの位置決めと固定、および術後のケアに特別な注意が払われました。この外科的技術は、標準化され安定した骨固定を可能にし、ウーパールーパーの四肢再生との直接比較や、両生類と哺乳類の骨治癒の類似の研究に役立つ可能性があります。
概要
ウーパールーパー(Ambystoma mexicanum)は、尾、脊髄、脳、心臓、鰓、および四肢を含む臓器再生の重要なモデルです1,2,3,4,5。ウーパールーパー四肢の再生に関する詳細な研究により、細胞の脱分化のメカニズムと、切断部位での幹細胞プールである芽球の形成が明らかになりました。胞子細胞が、パターン化された骨格6,7を含むすべての欠損肢部分を再構築する能力があるため、ウーパールーパーは骨治癒研究のための魅力的なモデル生物であるように思われる。最近、いくつかの研究がウーパールーパーの骨生物学に焦点を当て、骨格の形態、細胞組成、および骨化ダイナミクスについて説明しています。
哺乳類では、長骨の骨治癒過程は軟骨内骨化 を介して 発生し、血腫、肉芽組織、軟骨形成、硬骨と織骨へのカルス骨化、骨リモデリングのいくつかの段階で構成されることがわかっています8。最近の研究では、ウーパールーパーの骨治癒9でも同様の段階が観察できることが示されています。
これまで、ウーパールーパーの骨折は、虹彩切除ハサミで骨を単純に切断する非安定化システムで研究されていました。大きな骨折はzeugopodで作成され、骨切り術は骨の1つで行われ、もう1つはサポートとして機能します10,11。対照的に、ラットやマウスなどの哺乳類では、骨折のサイズを制御し、骨のアライメントを確保するために、髄内ピンや骨整列プレートなどの信頼性の高い固定システムを使用して、骨折が日常的に研究されています。
したがって、この方法は、骨切り術の前にウーパールーパー大腿骨の安定した均一な固定を確保することを目的としています。ウーパールーパー研究をマウスやヒトを含む哺乳動物とより同等にするために、髄内ピン12、外部プレート固定器13,14、および内部骨整列プレート15,16,17固定が検討された。後者は、適切な骨の固定を確保し、特定の直径のジグリーソーで1つまたは2つのカットを使用することにより、特定のサイズのギャップを作成できることが示されました。ウーパールーパーはAmbystoma mexicanumの水生幼虫を表しているため、創傷が開いており、水と接触しているため、外部固定具が術後の合併症を引き起こした可能性があります。ウーパールーパーは、その発達の非常に遅い時期(20歳18歳)まで二次骨化中心を発達させず、したがってマウスに使用される標準的な髄内釘が骨端に穴を開けるのを防ぐことができない可能性があるため、大きなウーパールーパーに内部プレート固定法を適用することが決定されました。大型のウーパールーパーでは、大腿骨のサイズと骨化の程度が成体マウスに似ているため、チタンプレート固定による中骨端骨切り術が可能になります1。
骨折のギャップ サイズは、治癒のダイナミクスと結果を大きく左右します。例えば、マウスでは、0.25mmの安定化骨折は、その小さなサイズと剛性のある安定化により、主に膜内骨化によって治癒します。0.7 mmの骨折は、軟骨内骨化によって治癒し、骨折の周囲に軟骨カルスが形成されます。3.5 mm の臨界サイズの欠陥などの大きな欠陥は完全には治癒しないため、骨折の非癒合16 をモデル化するために使用されます。この研究では、骨切り術前のウーパールーパー大腿骨のプレート固定プロトコルを確立しました 0.7 mm 骨折ギャップの例を使用して、ウーパールーパーの骨の治癒をマウスの治癒と比較することを最終目標としています9.
骨切り術後、骨折は、マウスよりも遅いものの、おそらくウーパールーパーの水生生活様式と細胞分裂速度の遅さのために、軟骨内骨化の過程を経ました。ここで紹介する方法では、硬質プレート固定による0.7mmギャップ骨切り術が示されています。ただし、他のギャップサイズや半柔軟な固定具、および異なる材料のプレートが可能になる可能性があります。全体として、ここで紹介する方法は標準化された骨固定に使用でき、ウーパールーパーの四肢再生と骨の治癒を比較する研究や、標準化された骨折固定を確保するためにさまざまな条件下でのウーパールーパーの骨治癒の研究に役立ちます。
プロトコル
次の手順は、ウィーンの治安判事(GZ:MA 58-65248-2021-26)の承認を得て行われました。5〜8歳≥、鼻から尾の先端まで20cmの長いウーパールーパー(Ambystoma mexicanum)を骨折手術と切断に使用しました。手術には男性と女性の両方が使用されました。ウーパールーパーは分子病理学研究所の施設で飼育されました。疼痛と感染症のリスクは、適切な鎮痛薬と抗生物質で管理し、良好な結果を確保した。本試験に使用した試薬および機器は、 資料表に記載されています。
1.動物の調理
- 動物を0.03%ベンゾカイン溶液に約15〜20分間浸漬し、完全な鎮静に達し、ピンセットで手足に触れても反射的な動きがなくなるまで待ちます。
- 0.03%ベンゾカイン溶液に浸した濡れたペーパータオルの上に腹側を下にして動物を置き、ベンゾカインを染み込ませたペーパータオルで覆います。.ウーパールーパーなどの水生動物の皮膚は乾燥に弱いため、脱水症状を防ぎ、皮膚(皮膚)呼吸を確保するためには体表を覆うことが不可欠です。
- リング鉗子を使用して操作する後肢を伸ばします。エタノールなどの消毒試薬は、ウーパールーパーの皮膚が化学物質に敏感で刺激を受けやすいため、塗布しないでください。代わりに、0.7x PBS(A-PBS)と50 U / mLペニシリンおよび20μg / mLストレプトマイシンを使用して、四肢の洗浄とその後の鋸引き時の骨洗浄に使用します。.
注:感染は一般的に、ウーパールーパーで行われる手術では問題になりません。ただし、これらの動物の水生性および皮膚表面に縫合糸が配置されるため、手術部位の汚染を防ぐために抗生物質の使用をお勧めします。
2. 手術
注:すべての手術器具を滅菌します。この目的には、熱滅菌、オートクレーブ、70%エタノールでの洗浄、その後のアルコール残骸の徹底的な除去などの一般的な滅菌方法が適しています。複数の動物を操作する場合は、ホットビーズ滅菌器または70%エタノールを使用して、その間にツールを滅菌します。
- 大腿骨の上のメスで、後肢上部の大腿部全体に広がる横方向の縦切開(1.5〜2cm)を行います。これを行うには、皮膚を切る前に骨を触診します。
- 筋肉と神経を手術部位から慎重に変位させ、切断せずに行います。それを効率的に行うために、曲がった鉗子を使用してください。
- 大腿骨の下に曲がった鉗子をそっと置き、手術のために大腿骨を露出させます。
- 剛性のある7.75mmの4穴固定プレートを大腿骨骨幹と一緒に置き、関節に触れないようにし、鉗子で整列した位置に固定します。
- 2mmのチタン製ネジを4本使用して、骨をプレートに取り付けます。
注:このプロトコルで使用されるネジは複雑な設計で、主要部分(骨にねじ込まれる)、ネジヘッド(四角いボックスレンチを使用してネジとプレートを取り外すことができる)、狭いネック(ネジが骨で締められると破断点として使用される)、およびネジハンドル(ドライバーとのこぎりガイド装置に取り付けるために使用)。 - ネジの取り付け順序は重要です。最初に内側のネジから始めて、次に外側の2本のネジから始めて、プレートが骨の軸と位置合わせされていることを確認します。手動ドリルを使用して、ネジを簡単に挿入できるように骨に最初の穴を開け、次に1本目の ネジを配置します。骨の周囲中央にドリルを開けて、片側の細い骨を避けます。これは自然に骨折する可能性があります。掘削中は、0.7x PBS + 1%ペン/連鎖球菌による灌漑を使用します。1st (オプション:1st および2nd)ネジのハンドルを折らないでください。
- のこぎりガイド装置を1番目 (オプション:1番目 と2番目 )のネジに取り付け、骨とプレートに合わせます。
注:このプロトコルでは、プレート、ネジ、のこぎりガイド装置、およびのこぎりが同じメーカーから提供され、互いに適合するように最適化されています。のこぎりガイド装置は、さまざまなプレートやのこぎりサイズと互換性を持つために、さまざまなサイズで提供できます。 - のこぎりガイド装置を使用して、残りのネジをドリルで穴を開けて挿入します。プレートと骨の位置合わせを確認します。ネジのハンドルを折ってください。
- プラスチックフィルム(6〜7 mm x 4〜5 cm)を70%エタノールで拭いて滅菌し、大腿骨の下にオートクレーブ滅菌または加熱滅菌(140°Cで4時間)して、骨切りプロセス中の軟部組織の損傷を防ぎます。
注:この目的のために、熱滅菌用の袋を切り取ったプラスチックフィルムを使用することができます。 - 骨と保護フィルムの間にGiglyワイヤーソーを置きます。
- 0.66mmのGiglyワイヤーソーを使用して骨を切断し、大腿骨に0.7mmの単一の切断を作成します。鋸引き中は、0.7x PBS + 1%ペン/溶連菌による一定の灌漑を使用して、組織の損傷と摩擦を最小限に抑えます。
- のこぎりとのこぎりガイドを取り外し、ドライバーを使用してネジのハンドルをネジから切り離します。
- 保護フィルムをはがし、0.7x PBS + 1%ペン/連鎖球菌で手術部位を洗浄します。
- プレートの上部とネジを滅菌骨ミツバチワックスで覆い、ネジの端による刺激から皮膚と筋肉を保護します。
- 骨のミツバチワックスの上に筋肉と皮膚を置きます。
- 7.0合成(ポリプロピレン/ポリエチレン)縫合糸で切開部位を閉じます。合成縫合糸は、水に由来する細菌や真菌による汚染を最小限に抑えるために使用されます。
3. 術後管理
- 動物を再び目覚めさせるには、50 U / mLペニシリン、20 μg / mLストレプトマイシン、および鎮痛剤ブトルファノール(0.5 mg / L水)を補充した新鮮な人工池の水を入れたタンクに入れます。.
- 動物を観察して、えらを動かし、歩みを始め、泳ぎ始めます-通常は手術後1時間以内に。
- 動物を50 U / mLペニシリンと20μg / mLストレプトマイシンを入れた人工池の水に3日間保管してから、保持タンクに戻します。.鎮痛を確実にするために、ブトルファノール(0.5 mg / L水)を追加します。.
- 縫合糸が所定の位置に留まり、適切な創傷治癒が行われることを確認します。
結果
ここで説明する外科手術(図1)は20分から30分続き、外科医と助手が必要です。オプションで、双眼解剖顕微鏡または虫眼鏡システムを使用します。
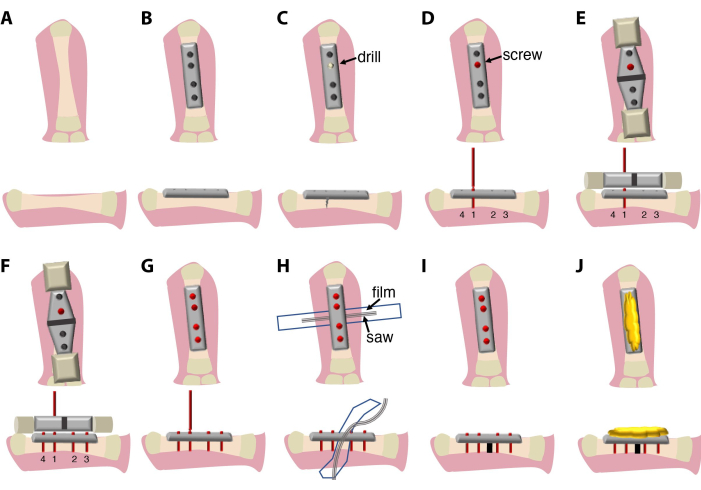
図1:外科的処置と実験セットアップの概略図(
ディスカッション
現在記載されている大腿骨プレート固定術と骨切り術の方法は、 Ambystoma mexicanum (ウーパールーパー)などの水生動物への適用を可能にします。この外科的方法は、最近、ウーパールーパーの骨折治癒と四肢再生をマウス9の骨折治癒と比較するために使用されました。マウスと同様に、4穴の固定プレートを自己破壊ネジで骨に取り付けること?...
開示事項
著者は、競合する利益を宣言しません。
謝辞
著者は、優れた技術サポートを提供してくれたSabine Stumppと、手術の支援を提供してくれたLidiaGrösserに感謝します。この研究は、Austrian Science Fund [Hertha Firnberg Fellowship number T-1219]、ERC [Advanced Grant, 742046 RegGeneMems]、DFG [CRC 1444]の助成を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
参考文献
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved