需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在墨西哥 Ambystoma 中使用钢板固定稳定股骨截骨术
摘要
提出了一种在成熟蝾螈中使用内板固定的股骨截骨手术方案。该程序可用于对水生两栖动物的肢体再生和骨折愈合进行比较研究。
摘要
蝾螈 (Ambystoma mexicanum) 是一种很有前途的再生医学模式生物,因为它具有再生丢失或受损器官(包括四肢、大脑、心脏、尾巴等)的非凡能力。对蝾螈的研究揭示了支配损伤后祖细胞活化和组织恢复的细胞和分子途径。这些知识可用于促进再生功能不全的损伤的愈合,例如骨不连。在当前的方案中,描述了使用内板固定系统的股骨截骨稳定。该程序适用于水生动物 (axolotl, Ambystoma mexicanum)。使用 ≥20 cm 吻尖到尾尖的蝾螈,股骨完全骨化,小鼠大小相当,特别注意板的定位和固定,以及术后护理。这种手术技术允许标准化和稳定的骨固定,可用于与蝾螈肢体再生的直接比较以及两栖动物和哺乳动物骨愈合的类似研究。
引言
蝾螈 (Ambystoma mexicanum) 是器官再生的重要模型,包括尾巴、脊髓、大脑、心脏、鳃和四肢 1,2,3,4,5。蝾螈肢体再生的详细研究揭示了细胞去分化的机制和在截肢部位形成干细胞库 blastema。由于 blastema 细胞能够重建所有缺失的肢体部分,包括有图案的骨骼 6,7,蝾螈似乎是骨愈合研究的有吸引力的模式生物。最近,几项研究更多地关注蝾螈的骨骼生物学,描述了骨骼形态、细胞组成和骨化动力学。
在哺乳动物中发现,长骨的骨愈合过程 是通过 软骨内骨化发生的,包括几个阶段:血肿、肉芽组织和软愈伤组织形成,愈伤组织骨化成硬愈伤组织和编织骨,以及骨重塑8。最近的一项研究表明,在蝾螈骨愈合中可以观察到类似的阶段9。
到目前为止,蝾螈骨折是在非稳定系统中研究的,其中骨骼只是用虹膜切除术剪刀切割。大的骨折是在 zeugopod 中形成的,其中一块骨头进行截骨术,而另一块骨头作为支撑10,11。相比之下,在哺乳动物(包括大鼠和小鼠)中,使用可靠的固定系统(如髓内销和骨对齐板)常规研究骨折,以控制骨折大小并确保骨对齐。
因此,该方法旨在确保在截骨术前稳定和均匀地固定蝾螈股骨。为了使蝾螈研究更具与哺乳动物(包括小鼠和人类)的相似性,考虑了髓内针12、外板固定器13,14 和内骨对齐板 15,16,17 固定。后者被证明可以确保正确的骨固定,并允许通过使用特定直径的 Gigly 锯进行一两次切割来产生一定大小的间隙。由于蝾螈代表墨西哥 Ambystoma mexicanum 的水生幼虫,外固定器可能因开放性伤口和与水接触而引起术后并发症。由于蝾螈直到发育的晚期(20 岁18 岁)才发育出次级骨化中心,因此可能无法阻止小鼠使用的标准髓内钉刺穿骨骺,因此决定将内板固定方法应用于大型蝾螈。在大型蝾螈中,股骨的大小和骨化程度类似于成年小鼠,因此允许使用钛板固定进行中骨干截骨术 1。
骨折间隙的大小在很大程度上决定了愈合动态和结果。例如,在小鼠中,由于体积小且稳定性强,0.25 mm 的稳定骨折主要通过膜内骨化愈合;0.7 mm 骨折通过软骨内骨化愈合,在骨折周围形成软骨愈伤组织;大缺损,例如 3.5 mm 临界大小的缺损不会完全愈合,因此用于模拟骨折不愈合16。在这项研究中,使用 0.7 毫米骨折间隙的例子建立了截骨术前蝾螈股骨的板固定方案,最终目标是将蝾螈骨愈合与小鼠的骨愈合进行比较9。
截骨术后,骨折经历了软骨内骨化的过程,尽管比小鼠慢,这可能是由于蝾螈的水生生活方式和较慢的细胞分裂速率。在此处介绍的方法中,显示了具有刚性板固定的 0.7 mm 间隙截骨术;然而,其他间隙尺寸和半柔性固定器,以及不同材料的板,可能是可能的。总体而言,此处介绍的方法可用于标准化骨固定,将有助于比较蝾螈肢体再生与骨愈合的研究或研究不同条件下蝾螈的骨愈合以确保标准化骨折固定。
研究方案
以下程序经维也纳地方法官 (GZ: MA 58-65248-2021-26) 批准执行。5-8 岁,≥ 20 cm 的吻尖到尾尖 (鼻子到尾尖) 长螈 (Ambystoma mexicanum) 用于骨折手术和截肢。男性和女性均用于手术。蝾螈是在分子病理学研究所的设施中培育的。使用适当的镇痛药和抗生素控制疼痛和感染风险,以确保成功的结果。用于研究的试剂和设备列在 材料表中。
1. 动物准备
- 将动物浸泡在 0.03% 苯佐卡因溶液中约 15-20 分钟,直到达到完全镇静,并且用镊子接触肢体时没有反射性运动。
- 将动物腹侧朝下放在浸泡在 0.03% 苯佐卡因溶液中的湿纸巾上,并用浸泡过苯佐卡因的纸巾盖住。水生动物(如蝾螈)的皮肤对干燥很敏感,因此必须覆盖体表以防止脱水并确保皮肤(皮肤)呼吸。
- 使用环形镊子伸展要操作的后肢。不要使用消毒试剂,如乙醇,因为蝾螈皮肤对化学物质敏感,容易刺激。相反,使用 0.7x PBS (A-PBS) 与 50 U/mL 青霉素和 20 μg/mL 链霉素清洁肢体,然后在锯切时进行骨冲洗。
注意:对于对蝾螈进行的手术,感染通常不是问题。然而,由于这些动物的水生性质和皮肤表面的缝合线,我们建议使用抗生素以防止手术部位受到任何污染。
2. 手术
注意:对所有手术工具进行消毒。常见的灭菌方法,如热灭菌、高压灭菌和在 70% 乙醇中洗涤,然后彻底去除酒精残留物,都适用于此目的。如果对多只动物进行手术,请使用热珠灭菌器或 70% 乙醇对工具进行消毒。
- 用股骨上方的手术刀做一个横向纵向切口(1.5-2 厘米),横跨后上肢的整个大腿。为此,请在切割皮肤之前触诊骨头。
- 小心地从手术部位移位肌肉和神经,不要切割。使用弓形镊子可以有效地完成。
- 轻轻地将弓形镊子放在股骨下方,使其露出以进行手术。
- 将刚性 7.75 毫米 4 孔固定板与股骨骨干一起放置,避免接触关节,并用镊子将其固定在对齐位置。
- 使用四个 2 毫米钛螺钉将骨头连接到板上。
注意:本协议中使用的螺钉设计复杂,由 4 部分组成:主要部分(将拧入骨头)、螺钉头(允许使用方盒扳手卸下螺钉和板)、较窄的颈部(一旦螺钉拧紧在骨头中,用作断裂点)和螺钉手柄(用于连接到螺丝刀和锯导向装置)。 - 螺钉连接的顺序很重要。首先从内螺钉开始,然后是两个外螺钉,以确保板与骨轴对齐。使用手动钻头在骨头上打第一个孔,以便于插入螺钉,然后放置第 1 个 螺钉。在骨圆周的中间钻孔,以避免一侧的骨头较薄,这可能会导致自发性骨折。钻孔时使用 0.7x PBS + 1% Pen/Strep 冲洗。不要折断第 1 个 (可选:第 1 个 和第 2个)螺钉的手柄。
- 将锯导向装置应用到第 1 个 (可选:第 1 个 和第 2个 )螺钉上,并将其与骨骼和板对齐。
注意:在本协议中,板、螺钉、锯导向装置和锯由同一制造商提供,并经过优化以相互配合。锯导向装置可以有不同的尺寸,以兼容不同的板材和锯尺寸。 - 使用锯导向装置钻孔并插入其余的螺钉。确保板与骨骼对齐。折断螺钉的手柄。
- 将一块塑料薄膜(6-7 毫米 x 4-5 厘米),用 70% 乙醇擦拭消毒,然后高压灭菌或加热消毒(140 °C 4 小时),在股骨下方,以防止截骨过程中软组织损伤。
注意:为此,可以使用一块塑料薄膜,剪下袋子进行热消毒。 - 将 Gigly 线锯放在骨头和保护膜之间。
- 使用 0.66 毫米 Gigly 线锯切割骨头,在股骨上切开一个 0.7 毫米的切口。在锯切过程中使用 0.7x PBS + 1% Pen/Strep 持续冲洗,以尽量减少组织损伤和摩擦。
- 拆下锯子和锯导轨,用螺丝刀从螺丝上折断螺丝手柄。
- 撕掉保护膜,用 0.7x PBS + 1% Pen/Strep 冲洗手术部位。
- 用无菌骨蜂蜡覆盖板和螺钉的顶部,以保护皮肤和肌肉免受螺钉边缘的刺激。
- 将肌肉和皮肤放在骨蜂蜡上。
- 用 7.0 合成(聚丙烯/聚乙烯)缝合线,使用简单的间断缝合线闭合切口部位。合成缝合线用于最大限度地减少水生细菌和真菌的污染。
3. 术后管理
- 为了重新唤醒动物,将其放入装有新鲜人工池塘水的水箱中,补充有 50 U/mL 青霉素、20 μg/mL 链霉素和镇痛布托啡诺(0.5 mg/L 水)。
- 观察动物开始移动鳃、走台阶和游泳 - 通常在手术后 1 小时内。
- 将动物在含有 50 U/mL 青霉素和 20 μg/mL 链霉素的人工池水中保存 3 天,然后再将其放回储水箱中。为确保镇痛,添加布托啡诺(0.5 mg/L 水)。
- 确保缝合线保持在原位并发生适当的伤口愈合。
结果
此处描述的外科手术(图 1)持续 20 分钟到 30 分钟,需要外科医生和助手。或者,使用双目解剖显微镜或放大镜系统。
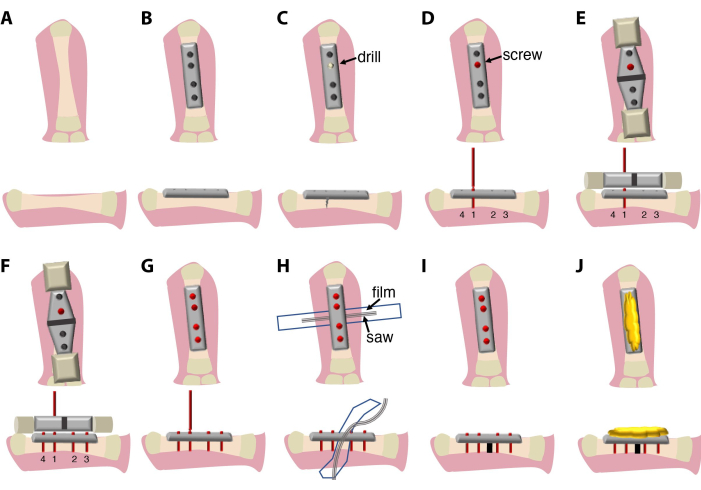
图 1:外科手术和实验设置的示意图。(A) 通过皮肤解剖和将?...
讨论
目前描述的股骨板固定和截骨方法允许其应用于水生动物,例如 墨西哥 Ambystoma mexicanum (axolotl)。这种手术方法最近被用于比较蝾螈的骨折愈合和肢体再生与小鼠的骨折愈合9。与小鼠一样,可以使用自断螺钉将 4 孔固定板连接到骨骼上,并且可以使用 Gigly 锯来制造均匀大小为15 的骨折。钢板固定有助于保持间隙尺寸并确保骨?...
披露声明
作者声明没有利益冲突。
致谢
作者要感谢 Sabine Stumpp 的出色技术支持和 Lidia Grösser 在手术中的帮助。这项研究由奥地利科学基金 [Hertha Firnberg 奖学金编号 T-1219]、ERC [高级资助,742046 RegGeneMems]、DFG [CRC 1444] 资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
参考文献
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。