JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Ambystoma mexicanum에서 플레이트 고정을 통한 대퇴골 절골술 안정화
요약
성숙한 아홀로틀에서 내부 플레이트 고정을 사용하는 대퇴골 절골술 수술을 위한 프로토콜이 제시됩니다. 이 절차는 수생 양서류의 사지 재생 및 골절 치유에 대한 비교 연구를 수행하는 데 사용할 수 있습니다.
초록
아홀로틀(Ambystoma mexicanum)은 팔다리, 뇌, 심장, 꼬리 등을 포함하여 손실되거나 손상된 장기를 재생하는 놀라운 능력으로 인해 재생 의학을 위한 유망한 모델 유기체입니다. 아홀로틀에 대한 연구는 손상 후 전구 세포 활성화와 조직 복원을 지배하는 세포 및 분자 경로에 대한 실마리를 제공합니다. 이 지식은 뼈 불유합과 같은 재생 불능 부상의 치유를 촉진하는 데 적용될 수 있습니다. 현재 프로토콜에서는 내부 플레이트 고정 시스템을 사용한 대퇴골 절골술 안정화에 대해 설명합니다. 이 절차는 수생 동물(axolotl, Ambystoma mexicanum)에서 사용하도록 조정되었습니다. ≥20cm의 주둥이에서 꼬리 끝까지의 아홀로틀과 완전히 골화된 쥐 크기의 대퇴골이 사용되었으며, 플레이트 위치 지정 및 고정, 수술 후 관리에 특별한 주의를 기울였습니다. 이 수술 기법은 표준화되고 안정적인 뼈 고정을 가능하게 하며, 아홀로틀 사지 재생과 직접 비교하고 양서류 및 포유류에 걸친 뼈 치유에 대한 유사한 연구에 유용할 수 있습니다.
서문
아홀로틀(Ambystoma mexicanum)은 꼬리, 척수, 뇌, 심장, 아가미 및 팔다리를 포함한 장기 재생의 중요한 모델입니다 1,2,3,4,5. 아홀로틀 사지 재생에 대한 상세한 연구를 통해 세포 역분화 메커니즘과 절단 부위에서 줄기세포 풀인 모세포(blastema)가 형성되는 것을 밝혀냈습니다. 패턴화된 골격 6,7을 포함하여 모든 누락된 사지 부분을 재구성할 수 있는 아세포세포 세포의 능력으로 인해, 아홀로틀은 뼈 치유 연구를 위한 매력적인 모델 유기체인 것으로 보인다. 최근에는 여러 연구에서 아홀로틀의 뼈 생물학에 더 중점을 두어 골격 형태, 세포 구성 및 골화 역학을 설명했습니다.
포유류에서 긴 뼈의 뼈 치유 과정은 내연골 골화(endochondral ossification)를 통해 이루어지며, 혈종, 육아 조직, 부드러운 굳은살 형성, 단단한 굳은살과 직조된 뼈로의 굳은살 골화, 뼈 재형성 등 여러 단계로 구성되는 것으로 밝혀졌다8. 최근 연구에 따르면 아홀로틀 뼈 치유(axolotl bone healing)에서도 유사한 단계를 관찰할 수 있다9.
지금까지 아홀로틀 골절은 홍채 절제술 가위로 뼈를 간단히 절단하는 비안정화 시스템에서 연구되었습니다. 큰 골절은 뼈 중 하나에 절골술을 수행하는 반면 다른 뼈는 지지 역할을 하는 zeugopod에서 생성되었습니다(10,11). 이와는 대조적으로, 쥐와 생쥐를 포함한 포유류에서는 골절 크기를 제어하고 뼈 정렬을 보장하기 위해 골수내 핀 및 뼈 정렬판과 같은 신뢰할 수 있는 고정 시스템을 사용하여 골절을 일상적으로 연구합니다.
따라서 이 방법은 절골술 전에 아홀로틀 대퇴골의 안정적이고 균일한 고정을 보장하는 것을 목표로 합니다. 아홀로틀 연구를 생쥐 및 인간을 포함한 포유류와 보다 비교하기 위해 골수내 핀12, 외부 플레이트 고정자(13,14) 및 내부 뼈 정렬 플레이트(15,16,17) 고정을 고려했습니다. 후자는 적절한 뼈 고정을 보장하고 특정 직경의 Gigly 톱으로 하나 또는 두 개의 절단을 사용하여 특정 크기의 틈을 만들 수 있는 것으로 나타났습니다. 아홀로틀은 Ambystoma mexicanum의 수생 유충을 대표하기 때문에 외부 고정기는 열린 상처와 물과의 접촉으로 인해 수술 후 합병증을 일으켰을 수 있습니다. 아홀로틀은 발달 시기가 매우 늦어질 때까지(20세18세) 2차 골화 중추를 발달시키지 않기 때문에 생쥐에 사용되는 표준 골수 내 발톱은 골단에 구멍을 뚫는 것을 막지 못할 수 있기 때문에 큰 아홀로틀에 내부 플레이트 고정 방법을 적용하기로 결정했습니다. 큰 아홀로틀에서 대퇴골 크기와 골화 정도는 성인 마우스와 유사하므로 티타늄 플레이트 고정을 이용한 중간 골절개술이 가능하다1.
골절 간격의 크기는 치유의 역동성과 결과를 크게 결정합니다. 예를 들어, 마우스에서 0.25mm 안정화 골절은 작은 크기와 단단한 안정화로 인해 대부분 막내 골화를 통해 치유됩니다. 0.7mm 골절은 골절 주변에 연골 굳은살이 형성되는 내연골 골화에 의해 치유됩니다. 3.5mm의 임계 크기의 결손과 같은 큰 결손은 완전히 치유되지 않으므로 골절 불유합을 모델링하는 데 사용된다16. 이 연구에서는 0.7mm의 골절 간격을 예로 들어 절골술 전 아홀로틀 대퇴골의 판 고정 프로토콜을 설정했으며, 궁극적인 목표는 아홀로틀 뼈 치유를 마우스의 치유와 비교하는 것을 목표로 했습니다9.
절골술 후, 골절은 내연골 골화 과정을 거쳤는데, 비록 생쥐보다 느리긴 했지만, 아마도 아홀로틀의 수생 생활 방식과 느린 세포 분열 속도 때문일 수 있습니다. 여기에 제시된 방법에서는 강판 고정을 사용한 0.7mm 간격의 절골술이 표시됩니다. 그러나 다른 갭 크기와 반유연한 고정 장치뿐만 아니라 다른 재료의 플레이트도 잠재적으로 가능합니다. 전반적으로, 여기에 제시된 방법은 표준화된 뼈 고정에 사용할 수 있으며, 아홀로틀 사지 재생과 뼈 치유를 비교하는 연구 또는 표준화된 골절 고정을 보장하기 위해 다양한 조건에서 아홀로틀의 뼈 치유를 연구하는 데 도움이 될 것입니다.
프로토콜
다음 절차는 비엔나 치안 판사(GZ: MA 58-65248-2021-26)의 승인을 받아 수행되었습니다. 5-8세, 주둥이에서 꼬리 끝까지(주둥이에서 꼬리 끝까지) 길이의 아홀로틀(Ambystoma mexicanum)을 ≥ 골절 수술 및 절단에 사용되었습니다. 수술에는 남성과 여성이 모두 사용되었다. 아홀로틀은 분자 병리학 연구소(Research Institute of Molecular Pathology) 시설에서 사육되었습니다. 통증과 감염 위험은 성공적인 결과를 보장하기 위해 적절한 진통제와 항생제로 관리되었습니다. 연구에 사용된 시약 및 장비는 재료 표에 나열되어 있습니다.
1. 동물 준비
- 완전한 진정에 도달하고 핀셋으로 팔다리를 만질 때 반사적인 움직임이 없을 때까지 약 15-20분 동안 0.03% 벤조카인 용액으로 동물을 목욕시킵니다.
- 0.03% 벤조카인 용액에 적신 젖은 종이 타월에 복부 쪽이 아래로 향하게 동물을 놓고 벤조카인에 적신 종이 타월로 덮습니다. 아홀로틀과 같은 수생 동물의 피부는 건조에 민감하기 때문에 탈수를 방지하고 피부(피부) 호흡을 보장하기 위해 신체 표면을 덮는 것이 필수적입니다.
- 링 집게를 사용하여 작동할 뒷다리를 뻗습니다. 에탄올과 같은 소독 시약을 바르지 마십시오., 아홀로틀 피부는 화학 물질에 민감하고 쉽게 자극을 받기 때문입니다. 대신 50U/mL 페니실린 및 20μg/mL 스트렙토마이신과 함께 0.7x PBS(A-PBS)를 사용하여 팔다리를 청소하고 나중에 톱질 시 뼈 세척에 사용하십시오.
참고: 감염은 일반적으로 아홀로틀에 적용되는 수술에서 문제가 되지 않습니다. 그러나 이러한 동물의 수생 특성과 피부 표면에 배치되는 봉합사로 인해 수술 부위의 오염을 방지하기 위해 항생제 사용을 권장합니다.
2. 수술
알림: 모든 수술 도구를 소독하십시오. 열 살균, 오토클레이빙 및 70% 에탄올로 세척한 후 알코올 잔류물을 철저히 제거하는 것과 같은 일반적인 살균 방법이 이 목적에 적합합니다. 여러 동물에게 수술하는 경우 핫 비드 멸균기 또는 70% 에탄올을 사용하여 중간에 도구를 멸균하십시오.
- 위쪽 뒷다리의 허벅지 전체에 걸쳐 있는 대퇴골 뼈 위에 메스로 측면 세로 절개(1.5-2cm)를 합니다. 이렇게 하려면 피부를 자르기 전에 뼈를 촉진하십시오.
- 수술 부위의 근육과 신경을 자르지 않고 조심스럽게 옮겨 놓습니다. 효율적으로 하려면 구부러진 집게를 사용하십시오.
- 구부러진 집게를 대퇴골 아래에 부드럽게 넣어 수술을 위해 노출시킵니다.
- 대퇴골 이완부와 함께 단단한 7.75mm 4구 고정판을 놓고 관절을 건드리지 않도록 하고 집게로 정렬된 위치에 고정합니다.
- 4개의 2mm 티타늄 나사를 사용하여 뼈를 플레이트에 부착합니다.
알림: 이 프로토콜에 사용된 나사는 복잡한 디자인을 가지고 있으며 주요 부분(뼈에 나사로 고정됨), 나사 머리(사각형 상자 렌치를 사용하여 나사와 플레이트를 제거할 수 있음), 좁은 목(나사가 뼈에서 조여지면 파손점으로 사용됨) 및 나사 핸들(드라이버 및 톱 안내 장치에 부착하는 데 사용됨)의 4개 부분으로 구성됩니다. - 나사 부착 순서가 중요합니다. 먼저 내부 나사로 시작한 다음 두 개의 외부 나사로 시작하여 플레이트가 뼈 축과 정렬되도록 합니다. 수동 드릴을 사용하여 나사를 쉽게 삽입할 수 있도록 뼈에 첫 번째 구멍을 만든 다음 1개의첫 번째 나사를 배치합니다. 한쪽 뼈가 얇아져 자발적인 뼈 골절이 발생하지 않도록 뼈 둘레의 중앙을 뚫습니다. 드릴링 중에 0.7x PBS + 1% 펜/스트렙으로 관개를 사용하십시오. 1st (옵션: 1st및 2nd) 나사의 손잡이를 끊지 마십시오.
- 톱 안내 장치를1st (옵션: 1st및 2nd ) 나사에 적용하고 뼈와 플레이트에 맞춥니다.
알림: 이 프로토콜에서 플레이트, 나사, 톱 안내 장치 및 톱은 동일한 제조업체에서 제공하며 서로 맞도록 최적화되어 있습니다. 톱 가이딩 장치는 다양한 플레이트 및 톱 크기와 호환되도록 다양한 크기로 제공될 수 있습니다. - 톱 가이드 장치를 사용하여 나머지 나사를 뚫고 삽입합니다. 플레이트가 뼈와 정렬되었는지 확인합니다. 나사의 손잡이를 부러뜨립니다.
- 70% 에탄올로 닦아 멸균한 플라스틱 필름(6-7mm x 4-5cm)을 대퇴골 아래에 놓고 절골술 과정 중 연조직 손상을 방지하기 위해 고압멸균 또는 열 멸균(140°C에서 4시간 동안)합니다.
알림: 이를 위해 플라스틱 필름 조각을 사용하고 열 살균을 위해 봉지를 잘라낼 수 있습니다. - 뼈와 보호 필름 사이에 Gigly 와이어 톱을 놓습니다.
- 0.66mm Gigly 와이어 톱을 사용하여 뼈를 절단하여 대퇴골에 단일 0.7mm 절단을 만듭니다. 조직 손상과 마찰을 최소화하기 위해 톱질 중에 0.7x PBS + 1% 펜/스트렙으로 지속적인 관개를 사용하십시오.
- 톱과 톱 가이드를 제거하고 드라이버를 사용하여 나사에서 나사 핸들을 분리합니다.
- 보호 필름을 제거하고 수술 부위에 0.7x PBS + 1% 펜/연쇄상구균을 주입합니다.
- 플레이트와 나사의 상단을 멸균 뼈 꿀벌 왁스로 덮어 나사 가장자리에 의한 자극으로부터 피부와 근육을 보호합니다.
- 뼈 꿀벌 왁스 위에 근육과 피부를 놓습니다.
- 간단한 단속 바늘을 사용하여 7.0 합성(폴리프로필렌/폴리에틸렌) 봉합사로 절개 부위를 닫습니다. 인공 봉합사는 수성 박테리아 및 곰팡이에 의한 오염을 최소화하는 데 사용됩니다.
3. 수술 후 관리
- 동물을 다시 깨우려면 50U/mL 페니실린, 20μg/mL 스트렙토마이신, 항문용 부토르판올(0.5mg/L 물)이 보충된 신선한 인공 연못 물이 담긴 탱크에 넣으십시오.
- 아가미를 움직이고, 걸음을 내딛고, 수영을 시작하는 동물을 관찰하십시오 - 보통 수술 후 1시간 이내에 말입니다.
- 50U/mL 페니실린과 20μg/mL 스트렙토마이신이 함유된 인공 연못 물에 동물을 3일 동안 보관한 후 저장 탱크로 되돌려 보냅니다. 진통을 위해 Butorphanol(물 0.5mg/L)을 첨가하십시오.
- 봉합사가 제자리에 있고 적절한 상처 치유가 이루어지는지 확인하십시오.
결과
여기에 설명된 수술 절차(그림 1)는 20분에서 30분 사이로 진행되며 외과의와 보조의가 필요합니다. 선택적으로 양안 해부 현미경 또는 돋보기 시스템을 사용하십시오.
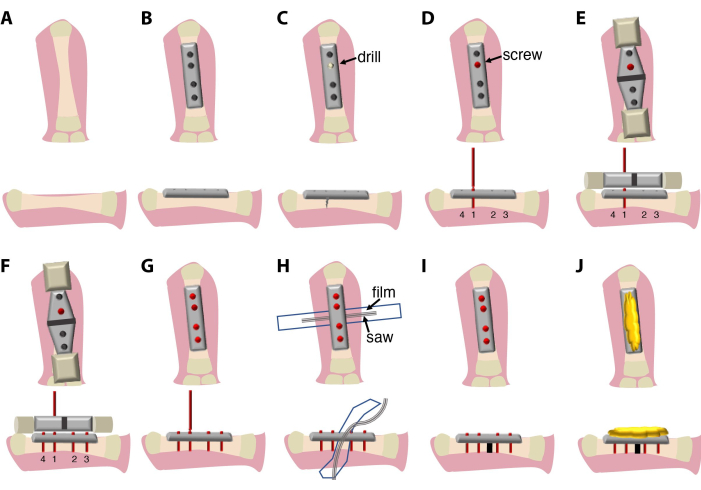
그림 1: 수술 절차 및 실험 설정의 ?...
토론
현재 기술된 대퇴골 판 고정 및 절골술의 방법은 Ambystoma mexicanum (axolotl)과 같은 수생 동물에 적용할 수 있습니다. 이 수술법은 최근 아홀로틀(axolotls)의 골절 치유와 사지 재생을 마우스의 골절 치유와 비교하는 데 사용되었다9. 생쥐와 마찬가지로 자체 파괴 나사로 4홀 고정 플레이트를 뼈에 부착할 수 있으며 Gigly 톱을 사용하여 균일한 크기
공개
저자는 상충되는 이해관계가 없음을 선언합니다.
감사의 말
저자는 탁월한 기술 지원을 제공한 Sabine Stumpp와 수술에 도움을 준 Lidia Grösser에게 감사를 표하고 싶습니다. 이 연구는 Austrian Science Fund [Hertha Firnberg Fellowship 번호 T-1219], ERC [Advanced Grant, 742046 RegGeneMems], DFG [CRC 1444]의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
참고문헌
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유