È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Stabilizzazione di un'osteotomia del femore con una fissazione della placca nell'Ambystoma mexicanum
In questo articolo
Riepilogo
Viene presentato un protocollo per la chirurgia dell'osteotomia femorale con l'uso della fissazione interna della placca in axolotl maturi. La procedura può essere utilizzata per eseguire studi comparativi sulla rigenerazione degli arti e sulla guarigione delle fratture negli anfibi acquatici.
Abstract
L'axolotl (Ambystoma mexicanum) è un promettente organismo modello per la medicina rigenerativa grazie alla sua notevole capacità di rigenerare organi persi o danneggiati, inclusi arti, cervello, cuore, coda e altri. Gli studi sull'axolotl hanno fatto luce sulle vie cellulari e molecolari che regolano l'attivazione dei progenitori e il ripristino dei tessuti dopo una lesione. Questa conoscenza può essere applicata per facilitare la guarigione di lesioni incompetenti alla rigenerazione, come la mancata unione ossea. Nell'attuale protocollo, viene descritta la stabilizzazione dell'osteotomia del femore utilizzando un sistema di fissazione interna della placca. La procedura è stata adattata per l'uso negli animali acquatici (axolotl, Ambystoma mexicanum). Sono stati utilizzati axolotl da muso a coda di ≥20 cm con femori completamente ossificati, di dimensioni simili a quelle di un topo, e particolare attenzione è stata prestata al posizionamento e alla fissazione della placca, nonché alla cura postoperatoria. Questa tecnica chirurgica consente una fissazione ossea standardizzata e stabilizzata e potrebbe essere utile per il confronto diretto con la rigenerazione degli arti axolotl e studi analoghi sulla guarigione ossea tra anfibi e mammiferi.
Introduzione
L'axolotl (Ambystoma mexicanum) è un modello importante per la rigenerazione degli organi, tra cui la coda, il midollo spinale, il cervello, il cuore, le branchie e gli arti 1,2,3,4,5. Studi dettagliati sulla rigenerazione degli arti axolotl hanno scoperto meccanismi di dedifferenziazione cellulare e la formazione di un pool di cellule staminali, blastema, nel sito di amputazione. A causa della capacità delle cellule del blastema di ricostruire tutte le parti mancanti degli arti, incluso uno scheletro modellato 6,7, l'axolotl sembra essere un organismo modello attraente per gli studi di guarigione ossea. Recentemente, diversi studi si sono concentrati maggiormente sulla biologia ossea negli axolotl, descrivendo la morfologia scheletrica, la composizione cellulare e le dinamiche di ossificazione.
Nei mammiferi è stato riscontrato che il processo di guarigione ossea nelle ossa lunghe avviene attraverso l'ossificazione endocondrale e consiste in diverse fasi: ematoma, tessuto di granulazione e formazione di callo molle, ossificazione del callo in callo duro e osso intrecciato e rimodellamento osseo8. Uno studio recente ha dimostrato che stadi simili possono essere osservati nella guarigione ossea dell'axolotl9.
Fino ad ora, le fratture dell'axolotl sono state studiate in un sistema non stabilizzato, in cui l'osso viene semplicemente tagliato con le forbici per iridectomia. Le grandi fratture sono state create nello zeugopodi, dove l'osteotomia viene eseguita su una delle ossa, mentre l'altra funge da supporto10,11. Al contrario, le fratture sono studiate di routine nei mammiferi, compresi ratti e topi, utilizzando sistemi di fissazione affidabili, come il perno intramidollare e le placche di allineamento osseo, per controllare le dimensioni della frattura e garantire l'allineamento osseo.
Pertanto, il metodo mira a garantire una fissazione stabilizzata e uniforme del femore axolotl prima dell'osteotomia. Al fine di rendere gli studi sull'axolotl più comparabili ai mammiferi, inclusi topi e esseri umani, sono stati presi in considerazione il pin12 per via endomidollare, il fissatore esterno della piastra13,14 e la fissazione interna della piastra di allineamento osseo 15,16,17. Quest'ultimo ha dimostrato di garantire una corretta fissazione dell'osso e di creare uno spazio di una certa dimensione utilizzando uno o due tagli con una sega Gigly di un diametro specifico. Poiché gli axolotl rappresentano le larve acquatiche di Ambystoma mexicanum, il fissatore esterno potrebbe aver causato complicanze post-chirurgiche a causa della ferita aperta e del contatto con l'acqua. Poiché gli axolotl non sviluppano centri di ossificazione secondari anche fino a molto tardi nel loro sviluppo (20 anni,18 anni), e quindi il chiodo endomidollare standard utilizzato nei topi potrebbe non essere impedito di perforare le epifisi, è stata presa la decisione di applicare un metodo di fissazione della placca interna agli axolotl di grandi dimensioni. Negli axolotl di grandi dimensioni, le dimensioni del femore e il grado di ossificazione assomigliano a quelli di un topo adulto, consentendo così l'osteotomia diafisaria media con fissazione della placca in titanio1.
La dimensione della fessura di frattura determina in gran parte la dinamica di guarigione e l'esito. Ad esempio, in un topo, le fratture stabilizzate di 0,25 mm guariscono principalmente attraverso l'ossificazione intramembranosa a causa delle loro piccole dimensioni e della rigida stabilizzazione; una frattura di 0,7 mm guarisce per ossificazione endocondrale, con formazione di un callo cartilagineo attorno alla frattura; I difetti di grandi dimensioni, come i difetti di dimensioni critiche di 3,5 mm, non guariscono completamente e quindi vengono utilizzati per modellare la mancata unione delle fratture ossee16. In questo studio, è stato stabilito il protocollo di fissazione della placca del femore axolotl prima dell'osteotomia utilizzando l'esempio di una fessura di frattura di 0,7 mm con l'obiettivo finale di confrontare la guarigione dell'osso axolotl con quella del topo9.
Dopo l'osteotomia, le fratture hanno subito il processo di ossificazione endocondrale, anche se più lento rispetto ai topi, probabilmente a causa dello stile di vita acquatico degli axolotl e dei tassi di divisione cellulare più lenti. Nel metodo qui presentato, viene mostrata l'osteotomia con gap di 0,7 mm con fissazione a placca rigida; Tuttavia, sono potenzialmente possibili altre dimensioni di fessure e fissatori semiflessibili, nonché piastre di materiali diversi. Nel complesso, il metodo qui presentato può essere utilizzato per la fissazione ossea standardizzata e sarà utile per gli studi che confrontano la rigenerazione degli arti axolotl con la guarigione ossea o per studiare la guarigione ossea negli axolotl in diverse condizioni per garantire una fissazione standardizzata della frattura.
Protocollo
La seguente procedura è stata eseguita con l'approvazione del Magistrato di Vienna (GZ: MA 58-65248-2021-26). Axolotl lunghi 5-8 anni di età ≥ 20 cm dal muso alla coda (muso fino alla punta della coda) sono stati utilizzati per la chirurgia delle fratture e le amputazioni. Sia i maschi che le femmine sono stati utilizzati per gli interventi chirurgici. Gli axolotl sono stati allevati nella struttura dell'Istituto di Ricerca di Patologia Molecolare. Il dolore e il rischio di infezioni sono stati gestiti con analgesici e antibiotici adeguati per garantire un esito positivo. I reagenti e le attrezzature utilizzate per lo studio sono elencati nella tabella dei materiali.
1. Preparazione degli animali
- Immergere l'animale in una soluzione di benzocaina allo 0,03% per circa 15-20 minuti fino a raggiungere la sedazione completa e non vi è alcun movimento riflessivo quando l'arto si tocca con una pinzetta.
- Posiziona l'animale con il lato ventrale rivolto verso il basso su tovaglioli di carta bagnati imbevuti di soluzione di benzocaina allo 0,03% e coprilo con salviette di carta imbevute di benzocaina. La pelle degli animali acquatici, come gli axolotl, è sensibile all'essiccazione e, quindi, è essenziale coprire la superficie corporea per prevenire la disidratazione e garantire la respirazione cutanea (della pelle).
- Allungare l'arto posteriore da azionare utilizzando una pinza ad anello. Non applicare reagenti disinfettanti, come l'etanolo, poiché la pelle dell'axolotl è sensibile alle sostanze chimiche e si irrita facilmente. Utilizzare invece 0,7x PBS (A-PBS) con 50 U/mL di penicillina e 20 μg/mL di streptomicina per la pulizia dell'arto e successivamente per l'irrigazione ossea dopo il taglio.
NOTA: L'infezione non è generalmente un problema per gli interventi chirurgici eseguiti sugli axolotl. Tuttavia, a causa della natura acquatica di questi animali e delle suture poste sulla superficie della pelle, si consiglia l'uso di antibiotici per prevenire qualsiasi contaminazione del sito chirurgico.
2. Chirurgia
NOTA: Sterilizzare tutti gli strumenti chirurgici. A questo scopo sono adatti metodi di sterilizzazione comuni come la sterilizzazione a caldo, la sterilizzazione in autoclave e il lavaggio in etanolo al 70%, seguiti da un'accurata rimozione dei residui di alcol. Se si opera su più animali, sterilizzare gli strumenti tra un dispositivo di sterilizzazione a perline calde o etanolo al 70%.
- Praticare un'incisione longitudinale laterale (1,5-2 cm) con un bisturi sopra l'osso del femore che copre tutta la coscia nell'arto posteriore superiore. Per fare questo, palpare l'osso prima di tagliare la pelle.
- Spostare con cautela i muscoli e i nervi dal sito dell'intervento chirurgico senza tagliare. Usa una pinza ad arco per farlo in modo efficiente.
- Metti delicatamente una pinza ad arco sotto il femore per esporlo per l'intervento chirurgico.
- Posizionare una piastra di fissaggio rigida da 7,75 mm a 4 fori insieme alla diafisi del femore, evitando di toccare le articolazioni, e fissarla in posizione allineata con una pinza.
- Utilizzare quattro viti in titanio da 2 mm per fissare l'osso alla placca.
NOTA: Le viti utilizzate in questo protocollo hanno un design complesso e sono costituite da 4 parti: la parte principale (verrà avvitata nell'osso), la testa della vite (consente la rimozione delle viti e della piastra utilizzando la chiave a tubo quadrata), il collo più stretto (utilizzato come punto di rottura una volta che la vite è stata serrata nell'osso) e una maniglia a vite (utilizzata per il fissaggio al cacciavite e al dispositivo di guida della sega). - L'ordine di fissaggio delle viti è importante. Inizia prima con le viti interne, quindi con le due viti esterne per assicurarti che la placca sia allineata con l'asse osseo. Utilizzare un trapano manuale per creare il primo foro nell'osso per un facile inserimento della vite, seguito dal 1° posizionamento della vite. Forare al centro della circonferenza ossea per evitare l'assottigliamento dell'osso su un lato, che può provocare una frattura ossea spontanea. Utilizzare l'irrigazione con 0,7x PBS + 1% Pen/Strep durante la perforazione. Non rompere l'impugnatura della vite da 1punto (opzionale: 1punto e 2punto).
- Applicare il dispositivo di guida della sega sulla/e vite/e 1° (opzionale: 1e 2° ) e allinearlo con l'osso e la piastra.
NOTA: In questo protocollo, una piastra, viti, un dispositivo di guida della sega e una sega sono forniti dallo stesso produttore e ottimizzati per adattarsi l'uno all'altro. Il dispositivo di guida della sega può essere disponibile in diverse dimensioni per essere compatibile con diverse piastre e dimensioni della sega. - Utilizzare il dispositivo di guida della sega per forare e inserire il resto delle viti. Assicurarsi che la placca sia allineata con l'osso. Rompere le maniglie delle viti.
- Posizionare un pezzo di pellicola di plastica (6-7 mm per 4-5 cm), sterilizzato strofinando con etanolo al 70% e poi sterilizzato in autoclave o a caldo (140 °C per 4 ore), sotto il femore per evitare danni ai tessuti molli durante il processo di osteotomia.
NOTA: A tale scopo, è possibile utilizzare un pezzo di pellicola di plastica, tagliare un sacchetto per la sterilizzazione a caldo. - Posizionare la sega a filo Gigly tra l'osso e la pellicola di protezione.
- Tagliare l'osso con la sega a filo Gigly da 0,66 mm, creando un unico taglio da 0,7 mm nel femore. Utilizzare un'irrigazione costante con 0,7x PBS + 1% Pen/Strep durante il taglio per ridurre al minimo i danni ai tessuti e l'attrito.
- Rimuovere la sega e la guida della sega e utilizzare un cacciavite per rompere le maniglie delle viti dalle viti.
- Rimuovere la pellicola protettiva e irrigare il sito chirurgico con 0,7x PBS + 1% Pen/Strep.
- Coprire la parte superiore della piastra e le viti con cera d'api sterile per proteggere la pelle e i muscoli dall'irritazione dei bordi delle viti.
- Posiziona i muscoli e la pelle sopra la cera d'api ossea.
- Chiudere il sito di incisione con una sutura sintetica 7.0 (polipropilene/polietilene) utilizzando semplici punti interrotti. La sutura sintetica viene utilizzata per ridurre al minimo la contaminazione con batteri e funghi presenti nell'acqua.
3. Gestione postoperatoria
- Per risvegliare l'animale, metterlo in una vasca con acqua fresca di laghetto artificiale, integrata con 50 U/mL di penicillina, 20 μg/mL di streptomicina e analgesico Butorphanol (0,5 mg/L di acqua).
- Osserva l'animale mentre inizia a muovere le branchie, fare passi e nuotare, di solito entro 1 ora dall'intervento.
- Tenere l'animale per 3 giorni in acqua di laghetto artificiale con 50 U/mL di penicillina e 20 μg/mL di streptomicina prima di rimetterlo nel serbatoio di contenimento. Per garantire l'analgesia, aggiungere butorfanolo (0,5 mg/L di acqua).
- Assicurarsi che le suture rimangano in posizione e che si verifichi una corretta guarigione della ferita.
Risultati
La procedura chirurgica qui descritta (Figura 1) dura tra i 20 e i 30 minuti e richiede un chirurgo e un assistente. Opzionalmente, utilizzare un microscopio binoculare per dissezione o un sistema di lenti d'ingrandimento.
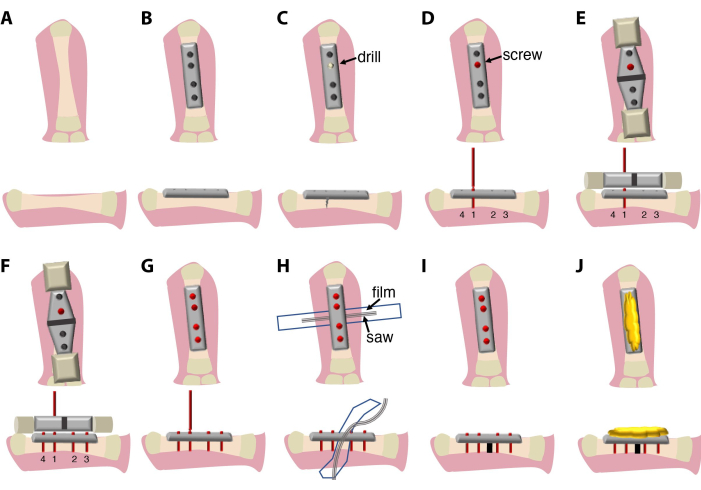
Figura 1: Schemi della procedura chirurgica e...
Discussione
Il metodo attualmente descritto di fissazione della placca femorale e osteotomia ne consente l'applicazione in animali acquatici, come l'Ambystoma mexicanum (axolotl). Questo metodo chirurgico è stato recentemente utilizzato per confrontare la guarigione delle fratture e la rigenerazione degli arti negli axolotl con la guarigione delle fratture nei topi9. Come nei topi, una piastra di fissaggio a 4 fori può essere fissata all'osso con viti autodistrutti...
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Gli autori ringraziano Sabine Stumpp per l'eccellente supporto tecnico e Lidia Grösser per l'assistenza negli interventi chirurgici. Questa ricerca è stata finanziata dall'Austrian Science Fund [Hertha Firnberg Fellowship number T-1219], ERC [Advanced Grant, 742046 RegGeneMems], DFG [CRC 1444].
Materiali
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
Riferimenti
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon