Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ambystoma mexicanum'da Plak Fiksasyonu ile Femur Osteotomisinin Stabilize Edilmesi
Bu Makalede
Özet
Olgun aksolotllarda iç plak fiksasyonu ile femoral osteotomi cerrahisi için bir protokol sunulmuştur. Prosedür, suda yaşayan amfibilerde uzuv rejenerasyonu ve kırık iyileşmesi üzerine karşılaştırmalı çalışmalar yapmak için kullanılabilir.
Özet
Aksolotl (Ambystoma mexicanum), uzuvlar, beyin, kalp, kuyruk ve diğerleri dahil olmak üzere kaybedilen veya hasar gören organları yeniden oluşturma konusundaki olağanüstü yeteneği nedeniyle rejeneratif tıp için umut verici bir model organizmadır. Aksolotl üzerine yapılan çalışmalar, yaralanma sonrası progenitör aktivasyonu ve doku restorasyonunu yöneten hücresel ve moleküler yollara ışık tutmuştur. Bu bilgi, kemik kaynamaması gibi rejenerasyon yetersizliği olan yaralanmaların iyileşmesini kolaylaştırmak için uygulanabilir. Mevcut protokolde, internal plak fiksasyon sistemi kullanılarak femur osteotomi stabilizasyonu anlatılmaktadır. Prosedür, suda yaşayan hayvanlarda (axolotl, Ambystoma mexicanum) kullanılmak üzere uyarlanmıştır. ≥20 cm'lik burundan kuyruğa kadar uçlu, tamamen kemikleşmiş, fare boyutunda karşılaştırılabilir femurlara sahip aksolotllar kullanıldı ve plak konumlandırma ve fiksasyonun yanı sıra ameliyat sonrası bakıma özel dikkat gösterildi. Bu cerrahi teknik, standartlaştırılmış ve stabilize edilmiş kemik fiksasyonuna izin verir ve aksolotl uzuv rejenerasyonu ve amfibiler ve memeliler arasında benzer kemik iyileşmesi çalışmaları ile doğrudan karşılaştırma için yararlı olabilir.
Giriş
Aksolotl (Ambystoma mexicanum) kuyruk, omurilik, beyin, kalp, solungaçlar ve uzuvlar 1,2,3,4,5 dahil olmak üzere organ yenilenmesi için önemli bir modeldir. Aksolotl uzuv rejenerasyonu ile ilgili ayrıntılı çalışmalar, hücre farklılaşma mekanizmalarını ve amputasyon bölgesinde bir kök hücre havuzu, blastema oluşumunu ortaya çıkardı. Blastema hücrelerinin, desenli bir iskelet 6,7 de dahil olmak üzere tüm eksik uzuv parçalarını yeniden yapılandırma yeteneği nedeniyle, aksolotl, kemik iyileştirme çalışmaları için çekici bir model organizma gibi görünmektedir. Son zamanlarda, iskelet morfolojisini, hücresel bileşimi ve kemikleşme dinamiklerini tanımlayan birkaç çalışma aksolotllarda kemik biyolojisine daha fazla odaklandı.
Memelilerde, uzun kemiklerde kemik iyileşme sürecinin endokondral ossifikasyon yoluyla gerçekleştiği ve birkaç aşamadan oluştuğu bulunmuştur: hematom, granülasyon dokusu ve yumuşak kallus oluşumu, sert kallus ve dokuma kemiğe kallus kemikleşmesi ve kemiğin yeniden şekillenmesi8. Yakın zamanda yapılan bir çalışma, aksolotl kemik iyileşmesinde benzer aşamaların gözlenebileceğini göstermiştir9.
Şimdiye kadar, aksolotl kırıkları stabilize olmayan bir sistemde incelendi, bu sayede kemik basitçe iridektomi makası ile kesildi. Büyük kırıklar, kemiklerden birinde osteotomi yapılırken, diğerinin destek görevi gördüğü zeugopodda oluşturulmuştur10,11. Buna karşılık, kırıklar, kırık boyutunu kontrol etmek ve kemik hizalamasını sağlamak için intramedüller pim ve kemik hizalama plakaları gibi güvenilir fiksasyon sistemleri kullanılarak, sıçanlar ve fareler de dahil olmak üzere memelilerde rutin olarak incelenir.
Bu nedenle yöntem, osteotomi öncesi aksolotl uyluk kemiğinin stabilize ve düzgün bir şekilde sabitlenmesini sağlamayı amaçlar. Aksolotl çalışmalarını fareler ve insanlar da dahil olmak üzere memelilerle daha karşılaştırılabilir hale getirmek için intramedüller pin12, dış plak fiksatörü13,14 ve iç kemik hizalama plakası 15,16,17 fiksasyonu düşünüldü. Sonuncusunun uygun kemik fiksasyonunu sağladığı ve belirli bir çaptaki bir Gigly testere ile bir veya iki kesim kullanarak belirli bir boyutta bir boşluk oluşturulmasına izin verdiği gösterilmiştir. Aksolotllar Ambystoma mexicanum'un suda yaşayan larvalarını temsil ettiğinden, eksternal fiksatör açık yara ve su ile temas nedeniyle ameliyat sonrası komplikasyonlara neden olmuş olabilir. Aksolotllar, gelişimlerinin çok geç dönemlerine kadar (20 yaşında18) bile ikincil ossifikasyon merkezleri geliştirmediğinden ve bu nedenle farelerde kullanılan standart intramedüller çivinin epifizleri delmesini engelleyemeyebileceğinden, büyük aksolotlara bir iç plaka fiksasyon yöntemi uygulanmaya karar verildi. Büyük aksolotllarda, femur boyutu ve kemikleşme derecesi yetişkin bir fareninkine benzer, böylece titanyum plaka fiksasyonu1 ile orta diyafiz osteotomiye izin verir.
Kırık boşluğu boyutu, iyileşme dinamiklerini ve sonucunu büyük ölçüde belirler. Örneğin, bir farede, 0.25 mm'lik stabilize kırıklar, küçük boyutları ve rijit stabilizasyonları nedeniyle çoğunlukla intramembranöz ossifikasyon yoluyla iyileşir; 0.7 mm'lik bir kırık, kırık çevresinde kıkırdaklı bir kallus oluşumu ile endokondral ossifikasyon ile iyileşir; 3,5 mm'lik kritik boyutlu defektler gibi büyük defektler tamamen iyileşmez ve bu nedenle kaynamayan kemik kırığımodellemek için kullanılır 16. Bu çalışmada, 0.7 mm'lik bir kırık boşluğu örneği kullanılarak osteotomiden önce aksolotl uyluk kemiğinin plaka fiksasyon protokolü, aksolotl kemik iyileşmesini fareninkiyle karşılaştırmak nihai hedefiyle oluşturulmuştur9.
Osteotomiden sonra, kırıklar, muhtemelen aksolotlların sucul yaşam tarzı ve daha yavaş hücre bölünme oranları nedeniyle, farelerden daha yavaş da olsa endokondral ossifikasyon sürecine tabi tutuldu. Burada sunulan yöntemde, rijit plak fiksasyonu ile 0.7 mm boşluk osteotomisi gösterilmiştir; Bununla birlikte, diğer boşluk boyutları ve yarı esnek fiksatörlerin yanı sıra farklı malzemelerden yapılmış plakalar da potansiyel olarak mümkündür. Genel olarak, burada sunulan yöntem standartlaştırılmış kemik fiksasyonu için kullanılabilir ve aksolotl uzuv rejenerasyonunu kemik iyileşmesi ile karşılaştıran çalışmalar veya standartlaştırılmış kırık fiksasyonunu sağlamak için farklı koşullar altında aksolotllarda kemik iyileşmesini inceleyen çalışmalar için yardımcı olacaktır.
Protokol
Aşağıdaki prosedür Viyana Sulh Ceza Hakimi'nin onayı ile gerçekleştirilmiştir (GZ: MA 58-65248-2021-26). 5-8 yaşlarında, ≥ 20 cm burundan kuyruğa (burundan kuyruğun ucuna kadar) uzun aksolotllar (Ambystoma mexicanum) kırık cerrahisi ve amputasyonlar için kullanıldı. Ameliyatlar için hem erkekler hem de kadınlar kullanıldı. Aksolotllar, Moleküler Patoloji Araştırma Enstitüsü tesisinde yetiştirildi. Ağrı ve enfeksiyon riski, başarılı bir sonuç elde etmek için uygun analjezikler ve antibiyotiklerle yönetildi. Çalışma için kullanılan reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir.
1. Hayvan hazırlama
- Hayvanı% 0.03 benzokain solüsyonunda, tam sedasyona ulaşılana kadar yaklaşık 15-20 dakika yıkayın ve cımbızla uzuvlara dokunulduğunda refleksif bir hareket olmaz.
- Hayvanı ventral tarafı aşağı bakacak şekilde% 0.03 benzokain çözeltisine batırılmış ıslak kağıt havluların üzerine yerleştirin ve benzokaine batırılmış kağıt havlularla örtün. Aksolotllar gibi suda yaşayan hayvanların derisi kurumaya karşı hassastır ve bu nedenle dehidrasyonu önlemek ve kutanöz (cilt) solunumu sağlamak için vücut yüzeyini kaplamak önemlidir.
- Halka forseps kullanarak çalıştırılacak arka ayağı gerin. Aksolotl cilt kimyasallara karşı hassas olduğundan ve kolayca tahriş olduğundan etanol gibi dezenfeksiyon reaktifleri uygulamayın. Bunun yerine, uzuvları temizlemek için 50 U / mL penisilin ve 20 μg / mL streptomisin ile 0.7x PBS (A-PBS) kullanın ve daha sonra testere üzerine kemik irrigasyonu için kullanın.
NOT: Enfeksiyon genellikle aksolotllar üzerinde yapılan ameliyatlar için bir endişe kaynağı değildir. Bununla birlikte, bu hayvanların suda yaşayan doğası ve deri yüzeyine yerleştirilen dikişler nedeniyle, ameliyat bölgesinin herhangi bir kontaminasyonunu önlemek için antibiyotik kullanılmasını önermekteyiz.
2. Ameliyat
NOT: Tüm cerrahi aletleri sterilize edin. Isı sterilizasyonu, otoklavlama ve %70 etanolde yıkama gibi yaygın sterilizasyon yöntemleri ve ardından alkol kalıntılarının tamamen çıkarılması bu amaç için uygundur. Birden fazla hayvan üzerinde çalışıyorsanız, aletleri arada sıcak boncuk sterilizatörü veya% 70 etanol kullanarak sterilize edin.
- Üst arka bacakta tüm uyluğu kapsayan femur kemiğinin üzerinde bir neşter ile lateral uzunlamasına bir kesi (1.5-2 cm) yapın. Bunu yapmak için, cildi kesmeden önce kemiği palpe edin.
- Kasları ve sinirleri kesmeden ameliyat bölgesinden dikkatlice çıkarın. Verimli bir şekilde yapmak için eğik forseps kullanın.
- Ameliyat için ortaya çıkarmak için uyluk kemiğinin altına nazikçe eğilmiş forseps koyun.
- Eklemlere dokunmaktan kaçınarak femur diyafizi ile birlikte 7,75 mm'lik 4 delikli sert bir fiksatör plakası yerleştirin ve forseps ile aynı hizada sabitleyin.
- Kemiği plakaya takmak için dört adet 2 mm titanyum vida kullanın.
NOT: Bu protokolde kullanılan vidalar karmaşık bir tasarıma sahiptir ve 4 parçadan oluşur: ana parça (kemiğe vidalanacak), vida başı (kare kutu anahtarı kullanılarak vidaların ve plakanın çıkarılmasına izin verir), daha dar boyun (vida kemikte sıkıldıktan sonra kırılma noktası olarak kullanılır) ve bir vida kolu (tornavidaya ve testere yönlendirme cihazına takmak için kullanılır). - Vida bağlantı sırası önemlidir. Plakanın kemik ekseni ile hizalandığından emin olmak için önce iç vidalarla ve ardından iki dış vidayla başlayın. Vidanın kolay takılması için kemikte ilk deliği oluşturmak için manuel bir matkap kullanın, ardından 1. vida yerleştirme işlemi yapın. Bir tarafta daha ince kemikten kaçınmak için kemik çevresinin ortasını delin, bu da spontan kemik kırılmasına neden olabilir. Delme sırasında 0,7x PBS + %1 Pen/Strep ile sulama kullanın. 1. (isteğe bağlı: 1. ve 2.) vidanın/vidaların sapını kırmayın.
- Testere yönlendirme cihazını 1. (isteğe bağlı: 1. ve 2. ) vida(lar)a uygulayın ve kemik ve plaka ile hizalayın.
NOT: Bu protokolde, bir plaka, vidalar, bir testere yönlendirme cihazı ve bir testere aynı üretici tarafından sağlanır ve birbirine uyacak şekilde optimize edilir. Testere yönlendirme cihazı, farklı plakalar ve testere boyutları ile uyumlu olması için farklı boyutlarda olabilir. - Vidaların geri kalanını delmek ve takmak için testere kılavuz cihazını kullanın. Plakanın kemikle hizalandığından emin olun. Vidaların kollarını kırın.
- Osteotomi işlemi sırasında yumuşak doku hasarını önlemek için uyluk kemiğinin altına% 70 etanol ile silinerek sterilize edilmiş ve daha sonra otoklavlanmış veya ısıyla sterilize edilmiş (4 saat boyunca 140 ° C) bir parça plastik film (6-7 mm x 4-5 cm) yerleştirin.
NOT: Bu amaçla, bir parça plastik film, ısı sterilizasyonu için kesilmiş bir torba kullanılabilir. - Gigly tel testereyi kemik ile koruma filmi arasına yerleştirin.
- 0,66 mm Gigly tel testereyi kullanarak kemiği kesin ve uyluk kemiğinde 0,7 mm'lik tek bir kesi oluşturun. Doku hasarını ve sürtünmeyi en aza indirmek için testere sırasında 0,7x PBS + %1 Pen/Strep ile sürekli sulama kullanın.
- Testereyi ve testere kılavuzunu çıkarın ve vida saplarını vidalardan koparmak için bir tornavida kullanın.
- Koruma filmini çıkarın ve ameliyat bölgesini 0.7x PBS +% 1 Pen / Strep ile sulayın.
- Cildi ve kasları vidaların kenarlarından tahrişe karşı korumak için plakanın ve vidaların üst kısmını steril kemik arı mumu ile örtün.
- Kasları ve cildi kemik arısı mumunun üzerine yerleştirin.
- Kesi bölgesini 7.0 sentetik (polipropilen/polietilen) sütür ile basit kesikli dikişler kullanarak kapatın. Sentetik sütür, su kaynaklı bakteri ve mantarlarla kontaminasyonu en aza indirmek için kullanılır.
3. Ameliyat sonrası yönetim
- Hayvanı yeniden uyandırmak için, 50 U/mL penisilin, 20 μg/mL streptomisin ve analjetik Butorphanol (0,5 mg/L su) ile desteklenmiş taze yapay havuz suyu içeren bir tanka koyun.
- Hayvanın solungaçlarını hareket ettirmeye, adım atmaya ve yüzmeye başlamasını gözlemleyin - genellikle ameliyattan sonraki 1 saat içinde.
- Hayvanı, tutma tankına geri göndermeden önce 50 U / mL penisilin ve 20 μg / mL streptomisin içeren yapay havuz suyunda 3 gün boyunca tutun. Analjeziyi sağlamak için Butorphanol (0.5 mg / L su) ekleyin.
- Dikişlerin yerinde kaldığından ve uygun yara iyileşmesinin gerçekleştiğinden emin olun.
Sonuçlar
Burada anlatılan cerrahi prosedür (Şekil 1) 20 dakika ile 30 dakika arasında sürer ve bir cerrah ve bir asistan gerektirir. İsteğe bağlı olarak binoküler diseksiyon mikroskobu veya büyüteç sistemi kullanın.
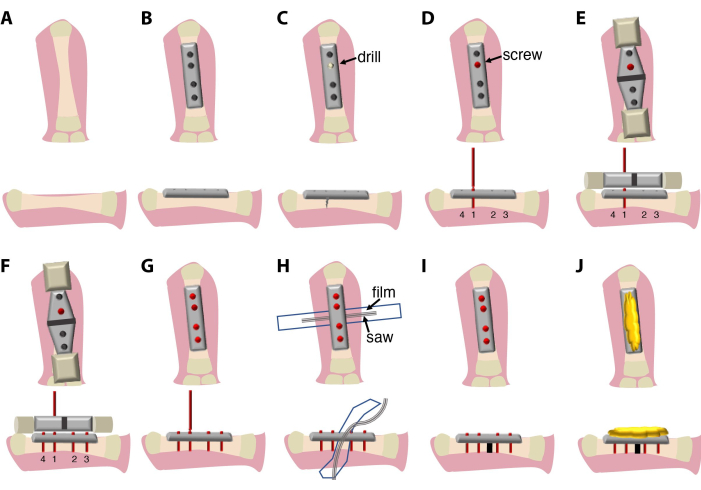
Şekil 1: Cerrahi prosedürün şemaları ve de...
Tartışmalar
Şu anda tarif edilen femur plağı fiksasyonu ve osteotomi yöntemi, Ambystoma mexicanum (aksolotl) gibi suda yaşayan hayvanlarda uygulanmasına izin verir. Bu cerrahi yöntem son zamanlarda aksolotllarda kırık iyileşmesi ve uzuv rejenerasyonunu farelerde kırık iyileşmesi ile karşılaştırmak için kullanılmıştır9. Farelerde olduğu gibi, kendiliğinden kırılan vidalarla kemiğe 4 delikli bir fiksatör plakası takılabilir ve
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
Yazarlar, mükemmel teknik destek için Sabine Stumpp'a ve ameliyatlardaki yardımları için Lidia Grösser'e teşekkür eder. Bu araştırma Avusturya Bilim Fonu [Hertha Firnberg Burs numarası T-1219], ERC [Advanced Grant, 742046 RegGeneMems], DFG [CRC 1444] tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
Referanslar
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır