É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estabilização de uma osteotomia de fêmur com fixação de placa em Ambystoma mexicanum
Neste Artigo
Resumo
Apresenta-se um protocolo para cirurgia de osteotomia femoral com o uso de fixação interna em axolotes maduros. O procedimento pode ser utilizado para realizar estudos comparativos sobre regeneração de membros e consolidação de fraturas em anfíbios aquáticos.
Resumo
O axolote (Ambystoma mexicanum) é um organismo modelo promissor para a medicina regenerativa devido à sua notável capacidade de regenerar órgãos perdidos ou danificados, incluindo membros, cérebro, coração, cauda e outros. Estudos sobre axolotes lançam luz sobre as vias celulares e moleculares que regem a ativação do progenitor e a restauração tecidual após a lesão. Esse conhecimento pode ser aplicado para facilitar a cicatrização de lesões incompetentes de regeneração, como a não consolidação óssea. No protocolo atual, a estabilização da osteotomia do fêmur usando um sistema de fixação de placa interna é descrita. O procedimento foi adaptado para uso em animais aquáticos (axolote , Ambystoma mexicanum). Foram utilizados axolotes de ≥20 cm focinho-cauda com fêmures comparáveis totalmente ossificados do tamanho de camundongos, e atenção especial foi dada ao posicionamento e fixação da placa, bem como aos cuidados pós-operatórios. Esta técnica cirúrgica permite a fixação óssea padronizada e estabilizada e pode ser útil para comparação direta com a regeneração de membros de axolotes e estudos análogos de cicatrização óssea em anfíbios e mamíferos.
Introdução
O axolote (Ambystoma mexicanum) é um modelo importante para a regeneração de órgãos, incluindo cauda, medula espinhal, cérebro, coração, brânquias e membros 1,2,3,4,5. Estudos detalhados da regeneração de membros de axolotes descobriram mecanismos de desdiferenciação celular e a formação de um pool de células-tronco, blastema, no local da amputação. Devido à capacidade das células do blastema de reconstruir todas as partes dos membros ausentes, incluindo um esqueleto padronizado 6,7, o axolote parece ser um organismo modelo atraente para estudos de cicatrização óssea. Recentemente, vários estudos se concentraram mais na biologia óssea em axolotes, descrevendo a morfologia esquelética, a composição celular e a dinâmica de ossificação.
Verificou-se em mamíferos que o processo de cicatrização óssea em ossos longos ocorre via ossificação endocondral e consiste em vários estágios: hematoma, tecido de granulação e formação de calo mole, ossificação de calo em calo duro e osso tecido e remodelação óssea8. Um estudo recente mostrou que estágios semelhantes podem ser observados na cicatrização óssea do axolote9.
Até agora, as fraturas de axolote eram estudadas em um sistema não estabilizado, em que o osso é simplesmente cortado com tesoura de iridectomia. As grandes fraturas foram criadas no zeugópode, onde a osteotomia é realizada em um dos ossos, enquanto o outro serve de suporte 10,11. Em contraste, as fraturas são rotineiramente estudadas em mamíferos, incluindo ratos e camundongos, usando sistemas de fixação confiáveis, como pinos intramedulares e placas de alinhamento ósseo, para controlar o tamanho da fratura e garantir o alinhamento ósseo.
Assim, o método visa garantir uma fixação estabilizada e uniforme do fêmur axolote antes da osteotomia. Para tornar os estudos de axolotes mais comparáveis aos de mamíferos, incluindo camundongos e humanos, foram considerados o pino intramedular12, o fixador de placa externa13,14 e a fixação da placa de alinhamento ósseo interno 15,16,17. Este último demonstrou garantir a fixação óssea adequada e permitir a criação de uma lacuna de um determinado tamanho usando um ou dois cortes com uma serra Gigly de um diâmetro específico. Como os axolotes representam as larvas aquáticas de Ambystoma mexicanum, o fixador externo pode ter causado complicações pós-cirúrgicas devido à ferida aberta e ao contato com a água. Como os axolotes não desenvolvem centros de ossificação secundários nem mesmo muito tarde em seu desenvolvimento (20 anos18) e, portanto, a haste intramedular padrão usada em camundongos pode não ser impedida de perfurar as epífises, foi tomada a decisão de aplicar um método de fixação de placa interna a grandes axolotes. Em axolotes grandes, o tamanho do fêmur e o grau de ossificação se assemelham aos de um camundongo adulto, permitindo assim a osteotomia diafisária média com fixação da placa de titânio1.
O tamanho da lacuna da fratura determina em grande parte a dinâmica e o resultado da cicatrização. Por exemplo, em um camundongo, as fraturas estabilizadas de 0,25 mm cicatrizam principalmente por ossificação intramembranosa devido ao seu pequeno tamanho e estabilização rígida; uma fratura de 0,7 mm cicatriza por ossificação endocondral, com a formação de um calo cartilaginoso ao redor da fratura; Grandes defeitos, como defeitos de tamanho crítico de 3,5 mm, não cicatrizam completamente e, portanto, são usados para modelar a não consolidação da fratura óssea16. Neste estudo, o protocolo de fixação da placa do fêmur do axolote antes da osteotomia usando o exemplo de uma lacuna de fratura de 0,7 mm foi estabelecido com o objetivo final de comparar a cicatrização óssea do axolote com a do camundongo9.
Após a osteotomia, as fraturas foram submetidas ao processo de ossificação endocondral, embora mais lenta do que em camundongos, possivelmente devido ao estilo de vida aquático dos axolotes e taxas de divisão celular mais lentas. No método aqui apresentado, mostra-se a osteotomia com gap de 0,7 mm com fixação de placa rígida; no entanto, outros tamanhos de folga e fixadores semiflexíveis, bem como placas de diferentes materiais, são potencialmente possíveis. No geral, o método apresentado aqui pode ser usado para fixação óssea padronizada e será útil para estudos comparando a regeneração de membros de axolotes com a cicatrização óssea ou estudando a cicatrização óssea em axolotes sob diferentes condições para garantir a fixação padronizada de fraturas.
Protocolo
O seguinte procedimento foi realizado com a aprovação do Magistrado de Viena (GZ: MA 58-65248-2021-26). Axolotes longos (Ambystoma mexicanum) de 5 a 8 anos de idade, ≥ 20 cm focinho à ponta da cauda (focinho à ponta da cauda) foram usados para cirurgia de fratura e amputações. Tanto homens quanto mulheres foram usados para as cirurgias. Os axolotes foram criados nas instalações do Instituto de Pesquisa de Patologia Molecular. A dor e o risco de infecções foram controlados com analgésicos e antibióticos adequados para garantir um resultado bem-sucedido. Os reagentes e equipamentos utilizados para o estudo estão listados na Tabela de Materiais.
1. Preparação animal
- Banhar o animal em solução de benzocaína a 0,03% por cerca de 15-20 min até que a sedação total seja alcançada e não haja movimento reflexivo ao tocar o membro com uma pinça.
- Coloque o animal com o lado ventral voltado para baixo em toalhas de papel molhadas embebidas em solução de benzocaína a 0,03% e cubra-o com papel toalha embebido em benzocaína. A pele de animais aquáticos, como os axolotes, é sensível ao ressecamento e, portanto, é essencial cobrir a superfície corporal para evitar a desidratação e garantir a respiração cutânea (pele).
- Estique o membro posterior a ser operado usando uma pinça de anel. Não aplique reagentes de desinfecção, como etanol, pois a pele do axolote é sensível a produtos químicos e facilmente irritada. Em vez disso, use 0,7x PBS (A-PBS) com 50 U/mL de penicilina e 20 μg/mL de estreptomicina para limpar o membro e, posteriormente, para irrigação óssea ao serrar.
NOTA: A infecção geralmente não é uma preocupação para as cirurgias realizadas em axolotes. No entanto, devido à natureza aquática desses animais e às suturas colocadas na superfície da pele, recomendamos o uso de antibióticos para evitar qualquer contaminação do sítio cirúrgico.
2. Cirurgia
NOTA: Esterilize todas as ferramentas cirúrgicas. Métodos comuns de esterilização, como esterilização por calor, autoclavagem e lavagem em etanol a 70%, seguidos de remoção completa dos restos de álcool, são adequados para esse fim. Se estiver operando em vários animais, esterilize as ferramentas usando um esterilizador de esferas quentes ou etanol a 70%.
- Faça uma incisão longitudinal lateral (1,5-2 cm) com um bisturi acima do osso do fêmur, abrangendo toda a coxa no membro posterior superior. Para fazer isso, palpe o osso antes de cortar a pele.
- Desloque cuidadosamente os músculos e nervos do local da cirurgia sem cortar. Use uma pinça curvada para fazê-lo com eficiência.
- Coloque suavemente uma pinça curvada sob o fêmur para expô-lo para a cirurgia.
- Coloque uma placa fixadora rígida de 7,75 mm com 4 orifícios junto com a diáfise do fêmur, evitando tocar nas articulações, e prenda-a na posição alinhada com uma pinça.
- Use quatro parafusos de titânio de 2 mm para prender o osso à placa.
NOTA: Os parafusos usados neste protocolo têm um design complexo e consistem em 4 partes: a parte principal (será aparafusada no osso), cabeça do parafuso (permite a remoção dos parafusos e da placa usando a chave de caixa quadrada), pescoço mais estreito (usado como ponto de ruptura uma vez que o parafuso é apertado no osso) e uma alça de parafuso (usada para prender à chave de fenda e ao dispositivo de guia da serra). - A ordem de fixação do parafuso é importante. Comece com os parafusos internos primeiro e depois com os dois parafusos externos para garantir que a placa esteja alinhada com o eixo ósseo. Use uma broca manual para criar o primeiro orifício no osso para facilitar a inserção do parafuso, seguido pela colocação do1º parafuso. Perfure no meio da circunferência óssea para evitar osso mais fino de um lado, o que pode resultar em fratura óssea espontânea. Use irrigação com 0,7x PBS + 1% Pen/Strep durante a perfuração. Nãoquebre a alça do(s) 1º(s) parafuso(s)(opcional: 1º e2º).
- Aplique o dispositivo de guia da serra no(s) parafuso(s)1º (opcional: 1ºe 2º ) e alinhe-o com o osso e a placa.
NOTA: Neste protocolo, uma placa, parafusos, um dispositivo de guia de serra e uma serra são fornecidos pelo mesmo fabricante e otimizados para se encaixarem. O dispositivo de guia de serra pode vir em diferentes tamanhos para ser compatível com diferentes placas e tamanhos de serra. - Use o dispositivo de guia de serra para perfurar e inserir o restante dos parafusos. Garanta o alinhamento da placa com o osso. Quebre as alças dos parafusos.
- Coloque um pedaço de filme plástico (6-7 mm por 4-5 cm), esterilizado com etanol a 70% e depois autoclavado ou esterilizado por calor (140 °C por 4 horas), sob o fêmur para evitar danos aos tecidos moles durante o processo de osteotomia.
NOTA: Para isso, pode-se usar um pedaço de filme plástico, cortado de um saco para esterilização por calor. - Coloque a serra de fio Gigly entre o osso e o filme de proteção.
- Corte o osso usando a serra de fio Gigly de 0,66 mm, criando um único corte de 0,7 mm no fêmur. Use irrigação constante com 0,7x PBS + 1% Pen/Strep durante a serragem para minimizar os danos e o atrito nos tecidos.
- Remova a serra e a guia da serra e use uma chave de fenda para quebrar as alças dos parafusos.
- Remova o filme de proteção e irrigue o local da cirurgia com 0,7x PBS + 1% Pen/Strep.
- Cubra a parte superior da placa e os parafusos com cera de abelha de osso estéril para proteger a pele e os músculos da irritação pelas bordas dos parafusos.
- Coloque os músculos e a pele em cima da cera de abelha óssea.
- Feche o local da incisão com uma sutura sintética 7.0 (polipropileno/polietileno) usando pontos simples interrompidos. A sutura sintética é usada para minimizar a contaminação com bactérias e fungos transmitidos pela água.
3. Manejo pós-operatório
- Para despertar o animal, coloque-o em um tanque com água fresca artificial da lagoa, suplementada com 50 U/mL de penicilina, 20 μg/mL de estreptomicina e analgésico Butorfanol (0,5 mg/L de água).
- Observe o animal começar a mover as brânquias, dar passos e nadar - geralmente dentro de 1 h após a cirurgia.
- Mantenha o animal por 3 dias em água de lagoa artificial com 50 U/mL de penicilina e 20 μg/mL de estreptomicina antes de devolvê-lo ao tanque de retenção. Para garantir a analgesia, adicione Butorfanol (0,5 mg/L de água).
- Certifique-se de que as suturas permaneçam no lugar e que ocorra a cicatrização adequada da ferida.
Resultados
O procedimento cirúrgico aqui descrito (Figura 1) dura entre 20 min e 30 min e requer um cirurgião e um assistente. Opcionalmente, use um microscópio de dissecção binocular ou sistema de lupa.
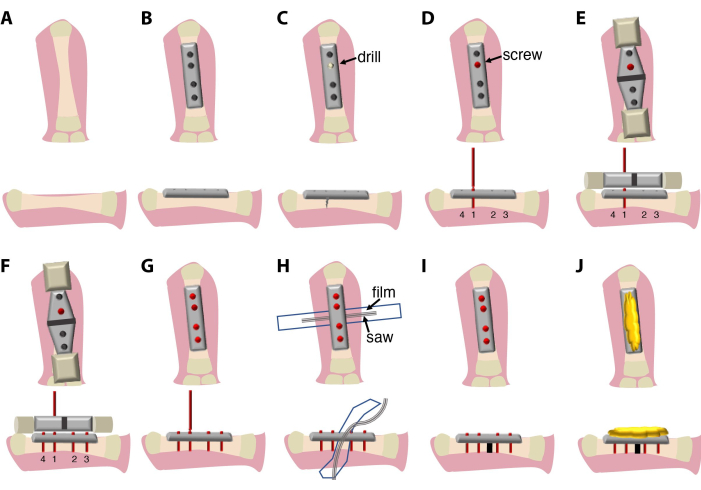
Figura 1: Esquemas do procedimento cirúrgico e da configuração expe...
Discussão
O método atualmente descrito de fixação e osteotomia da placa do fêmur permite sua aplicação em animais aquáticos, como o Ambystoma mexicanum (axolote). Este método cirúrgico foi recentemente utilizado para comparar a consolidação de fraturas e regeneração de membros em axolotes com a consolidação de fraturas em camundongos9. Como nos camundongos, uma placa fixadora de 4 orifícios pode ser fixada ao osso com parafusos auto-quebráveis, e u...
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Os autores gostariam de agradecer a Sabine Stumpp pelo excelente suporte técnico e a Lidia Grösser pela assistência nas cirurgias. Esta pesquisa foi financiada pelo Fundo Austríaco de Ciência [Hertha Firnberg Fellowship número T-1219], ERC [Advanced Grant, 742046 RegGeneMems], DFG [CRC 1444].
Materiais
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
Referências
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados