A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف السريع عن مسببات الأمراض البكتيرية التي تسبب التهابات الجهاز التنفسي السفلي عن طريق التضخيم متساوي الحرارة بوساطة الحلقة القائمة على رقائق الموائع الدقيقة
* These authors contributed equally
In This Article
Summary
يمكن أن تسبب مسببات الأمراض البكتيرية المختلفة التهابات الجهاز التنفسي وتؤدي إلى مشاكل صحية خطيرة إذا لم يتم اكتشافها بدقة وعلاجها على الفور. يوفر الكشف السريع والدقيق عن هذه العوامل الممرضة عن طريق التضخيم متساوي الحرارة بوساطة الحلقة إدارة فعالة ومكافحة التهابات الجهاز التنفسي في البيئات السريرية.
Abstract
تعد التهابات الجهاز التنفسي (RTIs) من بين أكثر المشكلات شيوعا في البيئات السريرية. سيوفر التحديد السريع والدقيق لمسببات الأمراض البكتيرية إرشادات عملية لإدارة وعلاج RTIs. تصف هذه الدراسة طريقة للكشف السريع عن مسببات الأمراض البكتيرية التي تسبب التهابات الجهاز التنفسي عن طريق التضخيم متساوي الحرارة بوساطة حلقة متعددة القنوات (LAMP). LAMP هي أداة تشخيصية حساسة ومحددة تكتشف بسرعة الأحماض النووية البكتيرية بدقة وموثوقية عالية. توفر الطريقة المقترحة ميزة كبيرة على طرق زراعة البكتيريا التقليدية ، والتي تستغرق وقتا طويلا وغالبا ما تتطلب حساسية أكبر للكشف عن المستويات المنخفضة من الأحماض النووية البكتيرية. تقدم هذه المقالة نتائج تمثيلية لعدوى K. pneumoniae والعدوى المشتركة المتعددة باستخدام LAMP للكشف عن العينات (البلغم ، سائل غسل الشعب الهوائية ، وسائل غسل السنخية) من الجهاز التنفسي السفلي. باختصار ، توفر طريقة LAMP متعددة القنوات وسيلة سريعة وفعالة لتحديد مسببات الأمراض البكتيرية المفردة والمتعددة في العينات السريرية ، والتي يمكن أن تساعد في منع انتشار مسببات الأمراض البكتيرية والمساعدة في العلاج المناسب ل RTIs.
Introduction
تساهم التهابات الجهاز التنفسي (RTIs) التي تسببها مسببات الأمراض البكتيرية في المقام الأول في المراضة والوفيات في جميع أنحاء العالم1. يتم تعريفه على أنه أي أعراض تنفسية علوية أو سفلية مصحوبة بحمى تستمر 2-3 أيام. في حين أن عدوى الجهاز التنفسي العلوي أكثر شيوعا من عدوى الجهاز التنفسي السفلي ، فإن التهابات الجهاز التنفسي المزمنة والمتكررة هي أيضا حالات سريرية شائعة ، مما يشكل مخاطر كبيرة على الأفراد ويضع عبئا كبيرا على أنظمة الرعاية الصحية2. تشمل مسببات الأمراض البكتيرية الشائعة ل RTIs العقدية الرئوية3 ، المستدمية النزلية4 ، المكورات العنقودية الذهبية ، الإشريكية القولونية ، الكلبسيلة الرئوية ، Stenotrophomonas maltophilia ، من بين أمور أخرى. عادة ما تستعمر هذه البكتيريا المسببة للأمراض الأسطح المخاطية للبلعوم الأنفي للمضيف والجهاز التنفسي العلوي ، مما يسبب أعراضا نموذجية ل RTIs مثل التهاب الحلق والتهاب الشعب الهوائية. تسبب الالتهاب الرئوي عندما تنتشر من الجهاز التنفسي العلوي إلى مناطق معقمة في الجهاز التنفسي السفلي وقد تنتشر من شخص لآخر عبر الجهاز التنفسي5. في الحالات الشديدة ، يمكن أن تؤدي أيضا إلى أمراض بكتيرية غازية ، وخاصة الالتهاب الرئوي الجرثومي والتهاب السحايا والإنتان ، والتي تعد الأسباب الرئيسية للمراضة والوفيات لدى الأشخاص من جميع الفئات العمرية في جميع أنحاء العالم.
تتضمن الاختبارات التقليدية ل RTIs الثقافة الميكروبيولوجية باستخدام مسحات الحلق وعينات الجهاز التنفسي للبلغم6. بالإضافة إلى ذلك ، تكتشف الاختبارات المصلية مثل مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) الأجسام المضادة أو المستضدات في المصل ، بينما تراقب اختبارات التراص تفاعل التراص للأجسام المضادة والمستضدات للكشف عن العدوى7. تعتبر الثقافة الميكروبية المعيار الذهبي لتشخيص RTIs ، لكن معدل إيجابية الثقافة المنخفض ، والموثوقية الضعيفة ، ودورة الكشف الطويلة تحد من كفاءة التشخيص8. في الواقع ، يعد التشخيص السريع والدقيق ل RTIs أمرا بالغ الأهمية للقضاء الدقيق على مسببات الأمراض البكتيرية. يمكن أن تساعد طرق الكشف السريعة والفعالة في تقليل معدل انتقال مسببات الأمراض ، وتقصير مدة العدوى ، وتقليل الاستخدام غير الضروري للمضادات الحيوية 9,10. تعمل الطرق القائمة على البيولوجيا الجزيئية على تسريع عملية الكشف بشكل كبير ، مثل تفاعل البوليميراز المتسلسل (PCR) ، الذي يضخم تسلسل الحمض النووي للجين المستهدف للكشف عن مسببات الأمراض. ومع ذلك ، فإن تفاعل البوليميراز المتسلسل التقليدي يتطلب معدات معقدة لتدوير درجات الحرارة ، وهو أمر مرهق ويستغرق وقتا طويلا. علاوة على ذلك ، فإن كل تضخيم للحمض النووي باستخدام تفاعل البوليميراز المتسلسل (باستثناء تفاعل البوليميراز المتسلسل في الوقت الفعلي) يختتم بفصل كهربائي للمنتج ، الأمر الذي يستغرق وقتا أيضا. يتطلب تصور المنتج أصباغ ، كثير منها مطفرة أو مسرطنة. لذلك ، من الضروري التطوير المستمر لطرق وتقنيات جديدة لتشخيص مسببات الأمراض البكتيرية RTI.
التضخيم متساوي الحرارة بوساطة الحلقة (LAMP) هي تقنية جزيئية جديدة وناشئة تم تطويرها في البداية بواسطة Notomi et al. في عام 200011. يمكن ل LAMP تضخيم الحمض النووي في ظل ظروف متساوية الحرارة مستقرة بدون معدات دورة درجة حرارة معقدة ، مما يجعله مناسبا للكشف السريع ويقلل من تعقيد المعدات وتكلفتها12. يمكن ل LAMP اكتشاف تركيزات منخفضة من الحمض النووي المستهدف بحساسية عالية13. يستخدم العديد من البادئات المحددة لتحسين الانتقائية للتسلسلات المستهدفة وتقليل احتمالية الإيجابيات الخاطئة14. يتم استخدام LAMP تدريجيا على نطاق واسع في المختبرات السريرية نظرا لسهولة وسرعة تشغيله البديهي ، حتى للكشف عن RTIs. في هذه الدراسة ، قمنا بالتحقيق في فعالية LAMP في الكشف عن انخفاض RTIs في العينات السريرية (البلغم ، سائل غسل الشعب الهوائية ، وسائل غسل السنخية) ، كما هو موضح في الشكل 1. من الواضح أن LAMP يوفر مزايا مثل السرعة والحساسية وسهولة الاستخدام مقارنة بالاختبارات التقليدية في اكتشاف RTI المنخفض ، مما يجعله تطبيقا واعدا.
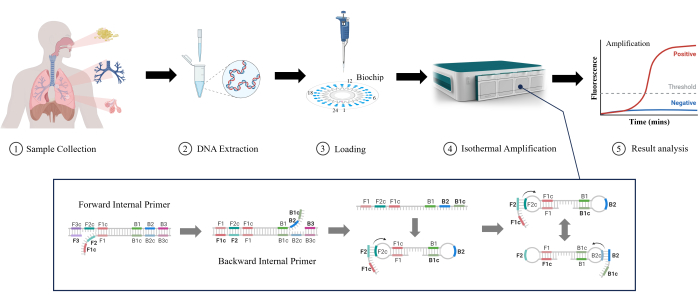
الشكل 1: رسم تخطيطي لطريقة الكشف عن LAMP. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم تقييم جميع عينات هذه الدراسة والموافقة عليها من قبل لجنة مراجعة الأخلاقيات في مستشفى مقاطعة قوانغدونغ الشعبي (رقم الموافقة: KY2023-1114-01). وقع جميع المشاركين على موافقة خطية مستنيرة قبل التجارب. يتم سرد الكواشف والمعدات المستخدمة للدراسة في جدول المواد. الاختصارات المستخدمة في البروتوكول مدرجة في الجدول التكميلي 1.
1. جمع العينات السريرية من الجهاز التنفسي السفلي
- جمع البلغم
- نظف تجويف الفم والأسنان بالماء النظيف ، مع ضمان إزالة طقم الأسنان إن أمكن. السعال بقوة لطرد البلغم التنفسي العميق في وعاء البلغم (الحد الأدنى 0.6 مل).
- تجنب التلوث باللعاب أو إفرازات الأنف. في حال صعوبة السعال، يتم تطبيق استنشاق محلول كلوريد الصوديوم 100 غ/لتر عند 45 درجة مئوية لتسهيل البلغم. انقل العينة إلى حاوية معقمة قابلة للإغلاق.
ملاحظة: تأكد من جمع عينات البلغم في الصباح وقبل أي استخدام للأدوية المضادة للبكتيريا.
- سائل غسل الشعب الهوائية (BLF)
- أدخل رأس المجمع في القصبة الهوائية من فتحة الأنف أو موقع القصبة الهوائية (بعمق 30 سم تقريبا). حقن 5 مل من المياه المالحة ، وإنشاء ضغط سلبي ، وتدوير رأس المجمع ، والانسحاب ببطء.
- جمع المخاط المستخرج وشطف المجمع مرة واحدة بمحلول أخذ العينات (المياه المالحة الفسيولوجية أو الماء المعقم للحقن). بدلا من ذلك ، قم بتوصيل قسطرة بولية للأطفال بحقنة سعة 50 مل كبديل للجمع.
- سائل غسل السنخية (ALF)
- تحديد موقع الآفة من خلال فحوصات تصوير الصدر. حدد المنطقة الأكثر أهمية أو التي تتقدم بسرعة للغسل.
- حقن 1-2 مل من 2٪ يدوكائين في الجزء القصبي من خلال قناة الخزعة أثناء الغسيل ، مما يوفر تخديرا موضعيا لجزء الرئةالمغسول 15. بالنسبة للمرضى الذين يخضعون للتخدير العام عن طريق الوريد والذين لا يزالون يظهرون تفاعلات قوية في مجرى الهواء ، قم بحقن 1-2 مل من 2٪ يدوكائين.
- بعد التخدير الموضعي ، أدخل منظار القصبات الليفي من خلال الفم أو الأنف ، مرورا بالبلعوم إلى القصبات الهوائية في الفص الأوسط الأيمن أو الجزء اللغوي من الرئة اليسرى. ضع طرفه عند فتحة فرع الشعب الهوائية وأدخل ببطء محلول ملحي فسيولوجي معقم.
- تطبيق محلول ملحي 30-50 مل في كل جلسة، بحجم 100-250 مل (بحد أقصى 300 مل). جمع المخاط المستخرج في حاوية معقمة مختومة.
2. استخراج الحمض النووي
- بناء على لزوجة عينات الجهاز التنفسي السفلي ، أضف كمية مناسبة من 10٪ هيدروكسيد الصوديوم. بالنسبة للعينات ذات اللزوجة المنخفضة ، أضف 2-3 أضعاف حجم عينة محلول التسييل. بالنسبة للعينات ذات اللزوجة المعتدلة ، أضف 5-6 أضعاف حجم عينة محلول التسييل. بالنسبة للعينات ذات اللزوجة العالية ، أضف 8-10 أضعاف حجم عينة محلول التسييل.
- اضبط حجم 10٪ هيدروكسيد الصوديوم وفقا لزوجة العينة. قم بتفريق العينات بشكل موحد قدر الإمكان باستخدام خلاط دوامة لمدة 15 ثانية واحتضانها عند 37 درجة مئوية لمدة 30 دقيقة للتسييل.
ملاحظة: بالنسبة للعينات الأكثر سمكا ، قم بزيادة حجم NaOH أو قم بتمديد وقت التسييل. تؤثر جودة تسييل العينات بشكل مباشر على كفاءة الاستخراج اللاحقة. من الناحية المثالية ، يجب أن تظهر العينات المسالة اتساقا ثابتا وغير لزج.
- اضبط حجم 10٪ هيدروكسيد الصوديوم وفقا لزوجة العينة. قم بتفريق العينات بشكل موحد قدر الإمكان باستخدام خلاط دوامة لمدة 15 ثانية واحتضانها عند 37 درجة مئوية لمدة 30 دقيقة للتسييل.
- ماصة 1 مل من العينة المسالة في أنبوب طرد مركزي سعة 1.5 مل. جهاز طرد مركزي بسرعة 15777 × جم لمدة 5 دقائق عند 2-6 درجة مئوية ، ثم استخدم ماصة لإزالة المادة الطافية والتخلص منها.
ملاحظة: عند استنشاق العينة ، تجنب سحب الشوائب من قاع الأنبوب ؛ إذا كان هناك العديد من الشوائب ، يمكن طرد العينة بالطرد المركزي عند 1,753-2,739 × جم لمدة 1 دقيقة قبل الطموح. - أضف 1 مل من محلول الغسيل إلى أنبوب الطرد المركزي والدوامة لرفع الراسب من قاع الأنبوب. ليست هناك حاجة لتفريقها تماما.
- قم بطرد المحلول عند 15777 × جم لمدة 5 دقائق ، وتخلص من المادة الطافية ، وحاول ألا تلمس الراسب.
ملاحظة: تأكد من الإزالة الشاملة لمحلول الغسيل لتجنب التأثير على التضخيم اللاحق.
- قم بطرد المحلول عند 15777 × جم لمدة 5 دقائق ، وتخلص من المادة الطافية ، وحاول ألا تلمس الراسب.
- أضف 100 ميكرولتر من محلول استخراج الحمض النووي إلى أنبوب الطرد المركزي. استخدم ماصة لشفط وخلط الراسب جيدا. انقل السائل وترسب معا في أنبوب استخلاص الحمض النووي. يتم عرض تكوين محلول استخراج الحمض النووي في الجدول 1.
- ضع أنابيب استخراج الحمض النووي في خلاط دوامة ودوامة بسرعة متوسطة لمدة 5 دقائق على الأقل. بعد الدوامة ، انقل أنابيب استخراج الحمض النووي إلى حمام معدني بدرجة حرارة ثابتة وحرارة عند 100 درجة مئوية لمدة 5 دقائق.
- أجهزة الطرد المركزي عند 15777 جم × عند 2-6 درجة مئوية لمدة 5 دقائق وتوضع جانبا.
ملاحظة: إذا تم إجراء تفاعل تضخيم PCR في غضون 24 ساعة ، فيمكن تخزين الحمض النووي عند 4 درجات مئوية. بعد التضخيم ، قم بتخزين الحمض النووي عند -20 درجة مئوية. للتخزين طويل الأجل (بعد 24 ساعة) ، قم بتخزين الحمض النووي في -20 درجة مئوية. عندما تكون جاهزا للاستخدام مرة أخرى ، قم بإذابة العينة بشكل طبيعي ، دوامة للخلط ، سخنها في حمام مائي 95 درجة مئوية لمدة 5 دقائق ، أجهزة الطرد المركزي عند 10956 × جم لمدة 1 دقيقة ، واستخدم المادة الطافية لتضخيم تفاعل البوليميراز المتسلسل.
| حل | مكونات | رقم | مواصفات |
| حل الغسيل | 10 مللي متر EDTA | 1 زجاجة | 24 مل / زجاجة |
| كاشف استخراج الحمض النووي | 10mM Tris-HCl ، 1 مللي متر EDTA ، مواد حافظة للحمض النووي | 2 أنابيب | 1.2 مل / زجاجة |
| أنبوب استخراج الحمض النووي | الخرز الزجاجي | 1 كيس | 24 زجاجة / كيس |
الجدول 1: تكوين كاشف استخراج الحمض النووي.
3. التضخيم متساوي الحرارة بوساطة الحلقة ورقاقة الموائع الدقيقة
- الكاشف ورقاقة الموائع الدقيقة
- إجراء تفاعلات تضخيم متساوي الحرارة على شريحة على شكل قرص الموائع الدقيقة (انظر جدول المواد). نفذ تضخيم درجة الحرارة الثابتة عند 65 درجة مئوية.
- قم بإجراء تحليل مضان في الوقت الفعلي باستخدام طريقة دمج صبغة الفلورسنت14 على محلل الحمض النووي لرقاقة الموائع الدقيقة لتضخيم درجة الحرارة الثابتة. لاحظ منحنى تضخيم على شكل حرف S للعينات الموجبة باستخدام إنزيم بوليميراز مع وظيفة إزاحة الخيط.
- تضخيم متساوي الحرارة بوساطة الحلقة
- استهدف ست مناطق تسلسل بأربعة بادئات محددة ، بما في ذلك اثنين من البادئات الداخلية واثنين من البادئات الخارجية (المرفقة مع مجموعة LAMP).
ملاحظة: يتم تكرار الحمض النووي وتضخيمه باستمرار عند درجة حرارة ثابتة باستخدام بوليميراز الحمض النووي مع وظيفة إزاحة الشريط. تتضمن عملية التفاعل مرحلة تخليق القالب على شكل الدمبل ، ومرحلة تضخيم الدورة ، والاستطالة ، ومرحلة إعادة التدوير ، مما يؤدي في النهاية إلى تكوين خليط من شظايا الحمض النووي مع حلقة جذعية وهياكل تشبه القرنبيط. راجع تعليمات المجموعة للحصول على معلومات مفصلة (الملف التكميلي 1). - أضف بادئات ثنائية الحلقة إلى نظام التفاعل لتعزيز كفاءة التفاعل ، والتي ترتبط بهياكل الحلقة الجذعية ، مما يؤدي إلى تخليق إزاحة الشريط والتكرار الدوري. يتم عرض تركيبة مجموعة الكشف عن الحمض النووي لمسببات الأمراض في الجهاز التنفسي في الجدول 2.
ملاحظة: تستخدم مجموعة الكاشف طريقة LAMP. يعتمد المبدأ على التوازن الديناميكي للحمض النووي عند حوالي 65 درجة مئوية ، حيث يتسبب أي تمهيدي يمتد عبر تزاوج القاعدة في الموقع التكميلي للحمض النووي المزدوج الشريط في تفكك الشريط الآخر ، مكونا شريطا واحدا.
- استهدف ست مناطق تسلسل بأربعة بادئات محددة ، بما في ذلك اثنين من البادئات الداخلية واثنين من البادئات الخارجية (المرفقة مع مجموعة LAMP).
- رقاقة ميكروفلويديك
ملاحظة: كل رقاقة ميكروفلويديك (انظر جدول المواد) مجهزة ب 24 بئر تفاعل مرقمة عكس اتجاه عقارب الساعة ، مع مدخل ومخرج البئر 1 المقابل لبئر التفاعل 1 (الشكل 2). يتم تضمين مجموعة محددة من البادئات لتضخيم واكتشاف تسلسل هدف حمض نووي معين وتثبيتها في كل بئر تفاعل.- امزج عينة الحمض النووي مع كاشف التضخيم. حقن الخليط في رقاقة وتوزيعه على كل تفاعل جيد الطرد المركزي في 1000 × غرام لمدة 30 ثانية في درجة حرارة الغرفة.
ملاحظة: تحدث تفاعلات تضخيم متساوية الحرارة مستقلة واكتشاف مضان في الوقت الفعلي في كل تفاعل جيد على الرقاقة. إذا تم الكشف عن منحنى تضخيم على شكل حرف S في بئر تفاعل معين ، فإن مؤشر الكشف المقابل لهذا البئر يكون موجبا.
- امزج عينة الحمض النووي مع كاشف التضخيم. حقن الخليط في رقاقة وتوزيعه على كل تفاعل جيد الطرد المركزي في 1000 × غرام لمدة 30 ثانية في درجة حرارة الغرفة.
| مكونات | تكوين | رقم |
| رقاقه | الاشعال | 12 أماكن |
| فيلم الختم | / | 1 ورقة |
| كاشف تضخيم متساوي الحرارة | صبغة الفلورسنت ، إنزيم | 270 ميكرولتر / أنبوب |
| السيطرة الإيجابية | الإشريكية القولونية الحمض النووي الجينومي | 160 ميكرولتر / أنبوب |
الجدول 2: تكوين مجموعة الكشف عن الحمض النووي لمسببات الأمراض في الجهاز التنفسي.
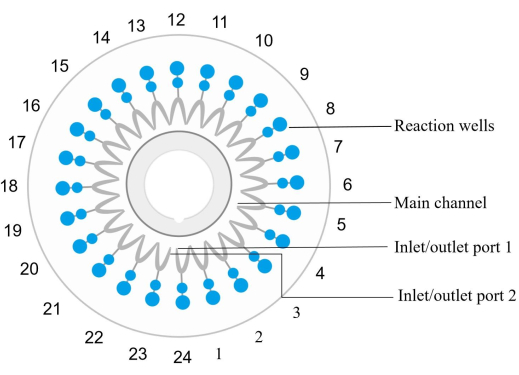
الشكل 2: مخطط هيكل رقاقة القرص. يتم ترقيم آبار التفاعل بالتتابع عكس اتجاه عقارب الساعة ، حيث يتوافق منفذ المدخل / المخرج 1 مع بئر التفاعل رقم 1. آبار التفاعل 1 و 4 و 7 و 10 و 13 و 16 و 19 و 22 و 24 هي عناصر تحكم سلبية. رد الفعل جيدا 6 هو عنصر تحكم إيجابي (الإشريكية القولونية). بئر التفاعل 12 هو تحكم إيجابي داخلي ، وبئر رد الفعل 23 هو تحكم إيجابي خارجي. رد فعل جيد 2 يكتشف spn. رد فعل جيد 3 يكتشف sau. بئر التفاعل 5 يكتشف MRSA. بئر التفاعل 8 يكتشف kpn. بئر التفاعل 9 يكتشف pae. بئر التفاعل 11 يكتشف أبا. بئر التفاعل 14 يكتشف SMA. بئر التفاعل 15 يكتشف هين. يرجى الاطلاع على الجدول 5 للحصول على تفاصيل العينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تحضير العينة والكشف عن البكتيريا
- تحضير نظام تفاعل التضخيم متساوي الحرارة
- خذ كاشف التضخيم متساوي الحرارة من المجموعة واتركه يذوب في درجة حرارة الغرفة تماما. رج العبوة برفق لتختلط جيدا وأجهزة الطرد المركزي لفترة وجيزة لتجميعها في قاع الأنبوب.
- في منطقة تخزين وإعداد الكاشف ، ماصة 20 ميكرولتر من كاشف التضخيم متساوي الحرارة في أنبوب طرد مركزي معد 200 ميكرولتر. قم بتغطية الأنبوب ونقله إلى منطقة تحضير العينة باستخدام أنبوب طرد مركزي واحد لكل عينة.
- في منطقة تحضير العينة ، أضف 34.5 ميكرولتر من عينة الحمض النووي المستهدفة. رج العبوة برفق لخلطها جيدا وجهاز الطرد المركزي لفترة وجيزة لتجميعها في الجزء السفلي من الأنبوب. الحجم الكلي لكل نظام تفاعل تضخيم الحمض النووي هو 54.5 ميكرولتر (الجدول 3).
- إجراء تحميل رقاقة
- على عبوة الرقاقة ، قم بتسمية رقم العينة. افتح شريحة الموائع الدقيقة مع توجيه ملصق العبوة لأعلى.
- ضع الشريحة بحيث تكون منافذ المدخل والمخرج متجهة لأعلى. باستخدام ماصة ، ارسم 50 ميكرولتر من نظام تفاعل التضخيم المحضر وأضفه إلى القناة الرئيسية للرقاقة من خلال منفذ المدخل. توقف عن الإضافة عند ملء القناة الرئيسية ، وامسح بسرعة أي سائل زائد حول منافذ المدخل والمخرج بمنديل خال من النسالة.
- استخدم الملقط لالتقاط فيلم مانع للتسرب وتغطيته فوق منافذ المدخل والمخرج. اضغط على طرف ماصة نظيف على فيلم الختم في اتجاه واحد. تأكد من إحكام الغلق.
- رد فعل qPCR
- بعد اكتمال مصدر الضوء لمحلل الحمض النووي التسخين المسبق ، انقر فوق الزر "فتح الدرج ". ضع الشريحة مع الجانب الأمامي لأعلى على الدرج ، مع التأكد من ظهور الأسطوانة الصغيرة المحددة من الفجوة المركزية للشريحة لتثبيتها. قم بمحاذاة جهاز تحديد الموضع المركزي في الدرج مع الفتحة المركزية الكبيرة في الشريحة.
- انقر فوق الزر إغلاق الدرج لإدخال الشريحة في محلل الحمض النووي.
- في منطقة معلومات العينة على واجهة الكشف، أدخل المعلومات الخاصة باختبار العينة. رقم العينة ورقم الشريحة ونوع العينة إلزامية ؛ البعض الآخر اختياري.
- انقر فوق الزر "بدء الكشف " في منطقة العملية لبدء اكتشاف العينة. ستقوم الأداة بإجراء اختبار العينة وفقا للبرنامج المحدد مسبقا.
ملاحظة: بعد الانتهاء من الكشف ، سيقوم البرنامج المصاحب للجهاز تلقائيا بإجراء تحليل البيانات. في الوقت نفسه ، سيبدأ محلل الحمض النووي عملية تبريد تلقائية. بمجرد انخفاض درجة الحرارة إلى 37 درجة مئوية ، يفتح الجهاز الدرج تلقائيا ويخرج الشريحة لاسترجاعها. سيتم تفسير النتائج تلقائيا بواسطة النظام (الجدول 4).
- معايير مراقبة الجودة
- يتم تضمين مراقبة جودة إيجابية واحدة وتسعة ضوابط جودة سلبية في كل شريحة في مجموعة الكاشف هذه. تأكد من أن نتائج الكشف عن مراقبة الجودة الإيجابية إيجابية ، وفي الوقت نفسه ، تكون نتائج جميع ضوابط الجودة السلبية التسعة سلبية.
ملاحظة: يتم عرض النتائج على الجانب الأيمن من الصورة التي تنص على "نتائج مراقبة الجودة: تجربة طبيعية (طبيعية إيجابية ، طبيعية سلبية)" ، مما يشير إلى أن نتائج الاختبار صالحة. يلزم إعادة الاختبار إذا كانت أي نتيجة غير صحيحة وتم اعتبار نتيجة اختبار العينة غير صالحة. يتم وضع عنصر تحكم داخلي إيجابي واحد باستخدام مواد أولية خاصة بالإنسان في الشريحة ، تكون نتيجتها إيجابية لاختبار العينات السريرية بينما تكون سلبية إذا كانت العينة تحتوي على محتوى جيني جيني بشري منخفض ، مما يشير إلى انخفاض عدد الخلايا. جمع العينات وإعادة اختبارها في مثل هذه الحالات.
- يتم تضمين مراقبة جودة إيجابية واحدة وتسعة ضوابط جودة سلبية في كل شريحة في مجموعة الكاشف هذه. تأكد من أن نتائج الكشف عن مراقبة الجودة الإيجابية إيجابية ، وفي الوقت نفسه ، تكون نتائج جميع ضوابط الجودة السلبية التسعة سلبية.
- تحليل النتائج
- بعد الانتهاء من الكشف ، استخدم طريقة الحد الأقصى للمشتق الثاني جنبا إلى جنب مع الخوارزميات المحمية تجاريا في البرنامج لحساب نقطة الانعطاف الأولى لمنحنى التضخيم على شكل حرف S أثناء مرحلة التضخيم السريع. التفاصيل موصوفة في جزء "مبادئ الاختبار" من تعليمات مجموعة أدوات الكشف عن الحمض النووي لمسببات الأمراض التنفسية (الملف التكميلي 1).
ملاحظة: قيمة TP هي الفارق الزمني بين نقطة الانعطاف والأصل. يتم تفسير النتيجة بناء على TP وقيم الحكم الإيجابي. إذا كانت قيمة TP لمؤشر الكشف أقل من أو تساوي قيمة الحكم الإيجابي لهذا المؤشر، يتم تفسيرها على أنها موجبة. إذا تجاوزت قيمة TP قيمة الحكم الإيجابي ، يتم تفسيرها على أنها سلبية ، وفقا لمعايير "قيمة القرار الإيجابي" في التعليمات. تعرض "منطقة منحنى التألق" المنحنى الطبيعي ، وتعرض منطقة "نتيجة الكشف" نتائج مراقبة الجودة والكشف لكل معلمة (الجدول 5).
- بعد الانتهاء من الكشف ، استخدم طريقة الحد الأقصى للمشتق الثاني جنبا إلى جنب مع الخوارزميات المحمية تجاريا في البرنامج لحساب نقطة الانعطاف الأولى لمنحنى التضخيم على شكل حرف S أثناء مرحلة التضخيم السريع. التفاصيل موصوفة في جزء "مبادئ الاختبار" من تعليمات مجموعة أدوات الكشف عن الحمض النووي لمسببات الأمراض التنفسية (الملف التكميلي 1).
| المتفاعل | الحجم (ميكرولتر) |
| كاشف تضخيم متساوي الحرارة | 20 |
| قالب الحمض النووي | 34.5 |
الجدول 3: نظام تفاعل التضخيم متساوي الحرارة.
| درج | واحد | اثنان |
| درجة الحرارة (°C) | 37 | 65 |
| الوقت (دقيقة) | 3 | 47 |
الجدول 4: برنامج تفاعل تضخيم الحمض النووي.
| اسم المؤشر | قيمة التحكم الإيجابية |
| العقدية الرئوية (sp) | 30 |
| المكورات العنقودية الذهبية (sau) | 34 |
| المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) | 22 |
| الكلبسيلة الرئوية (kpn) | 29 |
| الزائفة الزنجارية (pae) | 36 |
| الراكدة بوماني (أبا) | 36 |
| ستينوتروفوموناس مالتوفيليا (SMA) | 27 |
| المستدمية النزلية (HIN) | 36 |
الجدول 5: قيمة التحكم الإيجابية لمؤشر العدوى.
Access restricted. Please log in or start a trial to view this content.
النتائج
تستخدم هذه التجربة تقنية التضخيم متساوي الحرارة ، وإجراء تفاعلات على شريحة قرص الموائع الدقيقة. يحدث التفاعل على محلل الحمض النووي لرقاقة الموائع الدقيقة ، باستخدام طريقة إدخال صبغة مضانة. يتم إجراء التفاعل متساوي الحرارة عند درجة حرارة ثابتة تبلغ 65 درجة مئوية ، ويتم إجراء تحليل مضان في ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تنتشر التهابات الجهاز التنفسي في المستشفيات ، مما يفرض عواقب وخيمة على المرضى ويتصاعد معدلات الوفيات16. إن تحديد مسببات الأمراض المحتملة في الوقت المناسب وبدقة تليها المضادات الحيوية الفعالة هو مفتاح العلاج الناجح وتحسين التشخيص ، لا سيما بالنظر إلى القيود المتأصلة في طرق ا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نحن نقدر تقديرا كبيرا الدعم المالي المقدم من مؤسسة قوانغدونغ للبحوث الأساسية والتطبيقية (المنحة رقم 2022A1515220023) ومؤسسة أبحاث المواهب المتقدمة في مستشفى مقاطعة غواندونغ الشعبي (المنحة رقم. KY012023293).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Bath Incubator(MK2000-2) | ALLSHENG | Provide a constant temperature environment | |
| Bronchial lavage fluid collector head | TIANPINGHUACHANG | SEDA 20172081375 | Collecting bronchoalveolar lavage fluid |
| Fiberoptic bronchoscope | OLYMPUS | SEDA 20153062703 | A flexible bronchoscope equipped with a fiberoptic light source and camera, to visually examine the airways and structures within the lungs. Assist in collecting bronchoalveolar lavage |
HR1500- B2 B2 | Haier | SEDA 20183541642 | Biosafety cabinet |
| NAOH | MACKLIN | S817977 | Liquefy viscous lower respiratory tract sample |
| Nucleic acid detection kit for respiratory tract pathogens | Capitalbio Technology | SEDA 20173401346 | Testing for bacteria infection |
| Nucleic acid extraction reagent | Capitalbio Technology | SEDA 20160034 | For DNA extraction |
| RTisochip-W | Capitalbio Technology | SEDA 20193220539 | Loop-mediated Isothermal Amplification |
| THERMO ST16R | Thermo Fisher Scientific | SEDA 20180585 | Centrifuge the residual liquid off the wall of the tube. |
| Vortex mixer VM-5005 | JOANLAB | For mixing reagent |
References
- GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: A systematic analysis for the global burden of disease study 2016. Lancet Infect Dis. 18 (11), 1191-1210 (2018).
- Niederman, M. S., Torres, A. Respiratory infections. Eur Respir Rev. 31 (166), 220150(2022).
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: Transmission, colonization and invasion. Nat Rev Microbiol. 16 (6), 355-367 (2018).
- Watt, J. P., et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years_ global estimates. Lancet. 374 (9693), 903-911 (2009).
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat Rev Microbiol. 6 (4), 288-301 (2008).
- Popova, G., Boskovska, K., Arnaudova-Danevska, I., Smilevska-Spasova, O., Jakovska, T. Sputum quality assessment regarding sputum culture for diagnosing lower respiratory tract infections in children. Open Access Maced J Med Sci. 7 (12), 1926-1930 (2019).
- Nuyttens, H., Cyncynatus, C., Renaudin, H., Pereyre, S., Identification Bébéar, C. expression and serological evaluation of the recombinant ATP synthase beta subunit of mycoplasma pneumoniae. BMC Microbiol. 10 (1), 216(2010).
- Noviello, S., Huang, D. B. The basics and the advancements in diagnosis of bacterial lower respiratory tract infections. Diagnostics (Basel). 9 (2), 37(2019).
- Hanson, K. E., et al. Molecular testing for acute respiratory tract infections: Clinical and diagnostic recommendations from the IDSA's diagnostics committee. Clin Infect Dis. 71 (10), 2744-2751 (2020).
- Daniel Reynolds, J. P. B., et al. The threat of multidrug-resistant/extensively drug-resistant gram-negative respiratory infections: Another pandemic. Eur Respir Rev. 31 (166), 220068(2022).
- T Notomi, H. O., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 28 (12), 63(2000).
- Soroka, M., Wasowicz, B., Rymaszewska, A. Loop-mediated isothermal amplification (LAMP): The better sibling of PCR. Cells. 10 (8), 1931(2021).
- Mori, Y., Kitao, M., Tomita, N., Notomi, T. Real-time turbidimetry of lamp reaction for quantifying template DNA. Biophys J. 59 (2), 145-157 (2004).
- Parida, M., Sannarangaiah, S., Dash, P. K., Rao, P. V., Morita, K. Loop mediated isothermal amplification (LAMP): A new generation of innovative gene amplification technique: Perspectives in clinical diagnosis of infectious diseases. Rev Med Virol. 18 (6), 407-421 (2008).
- Chinese Medical Association Respiratory Branch Critical Care Medicine Group, Working Committee on Critical Care Medicine of the Chinese Physicians Association Respiratory Physicians Branch. Standardization of collection, submission, testing, and interpretation of bronchoalveolar lavage fluid in ICU patients. Chin J Tubere Respir Dis. 43 (9), 744-756 (2020).
- Koch, A. M., Nilsen, R. M., Eriksen, H. M., Cox, R. J., Harthug, S. Mortality related to hospital-associated infections in a tertiary hospital: Repeated cross-sectional studies between 2004-2011. Antimicrob Resist Infect Control. 4 (1), 57(2015).
- Seymour, C. W. F. G., et al. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 376 (23), 2235-2244 (2017).
- Choi, C. W., Hyun, J. W., Hwang, R. Y., Powell, C. A. Loop-mediated isothermal amplification assay for detection of candidatus Liberibacter asiaticus: A causal agent of citrus huanglongbing. Plant Pathol. 34 (6), 499-505 (2018).
- Büscher, P., Njiru, Z. K. Loop-mediated isothermal amplification technology: Towards point of care diagnostics. PLoS Negl Trop Dis. 6 (6), e1572(2012).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): Principle, features, and future prospects. J Microbiol. 53 (1), 1-5 (2015).
- Ajibola, O., Gulumbe, B., Eze, A., Obishakin, E. Tools for detection of schistosomiasis in resource limited settings. Medical Sciences. 6 (2), 39(2018).
- Kumar, Y. S. B., et al. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Compr Rev Food Sci Food SAF. 16 (6), 1359-1378 (2017).
- Hongling Ou, Y. W., et al. Rapid detection of multiple pathogens by the combined loop-mediated isothermal amplification technology and microfluidic chip technology. Ann Palliat Med. 10 (10), 11053-11066 (2021).
- Liang Wang, J. -X. L., et al. Quantitative polymerase chain reaction (qPCR)-based rapid diagnosis of helicobacter pylori infection and antibiotic resistance. J Vis Exp. (197), e65689(2023).
- Jing-Wen Lyu, B. X., et al. Rapid prediction of multidrug-resistant klebsiella pneumoniae through deep learning analysis of SERS spectra. Microbiol Spectr. 11 (2), e0412622(2023).
- Wei Liu, J. -W. T., et al. Discrimination between carbapenem-resistant and carbapenem-sensitive klebsiella pneumoniae strains through computational analysis of surface-enhanced Raman spectra a pilot study. Microbiol Spectr. 10 (1), e0240921(2022).
- Zhang, L. Y., et al. Classification and prediction of klebsiella pneumoniae strains with different MLST allelic profiles via SERS spectral analysis. Peer J. 11, e16161(2023).
- Zhi Liu, Q. Z., et al. Rapid and sensitive detection of salmonella in chickens using loop-mediated isothermal amplification combined with a lateral flow dipstick. J Microbiol Biotechnol. 29 (3), 454-464 (2019).
- Chen, F., et al. Fully Integrated microfluidic platform for multiplexed detection of hunov by a dynamic confined-space-implemented one-pot RPA-LAMP system. Adv Sci (Weinh). 21, e2306612(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved