A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי מהיר של פתוגנים חיידקיים הגורמים לזיהומים בדרכי הנשימה התחתונות באמצעות הגברה איזותרמית בתיווך לולאה בתיווך שבב מיקרופלואידי
* These authors contributed equally
In This Article
Summary
פתוגנים חיידקיים שונים עלולים לגרום לזיהומים בדרכי הנשימה ולהוביל לבעיות בריאותיות חמורות אם לא מזהים אותם במדויק ומטפלים בהם מיד. זיהוי מהיר ומדויק של פתוגנים אלה באמצעות הגברה איזותרמית בתיווך לולאה מספק ניהול ובקרה יעילים של זיהומים בדרכי הנשימה בסביבות קליניות.
Abstract
זיהומים בדרכי הנשימה (RTIs) הם בין הבעיות הנפוצות ביותר במסגרות קליניות. זיהוי מהיר ומדויק של פתוגנים חיידקיים יספק הנחיות מעשיות לניהול וטיפול ב- RTIs. מחקר זה מתאר שיטה לגילוי מהיר של פתוגנים חיידקיים הגורמים לזיהומים בדרכי הנשימה באמצעות הגברה איזותרמית רב-ערוצית בתיווך לולאה (LAMP). LAMP הוא כלי אבחון רגיש וספציפי המזהה במהירות חומצות גרעין חיידקיות בדיוק ובאמינות גבוהים. השיטה המוצעת מציעה יתרון משמעותי על פני שיטות גידול חיידקים מסורתיות, אשר גוזלות זמן רב ולעתים קרובות דורשות רגישות רבה יותר לאיתור רמות נמוכות של חומצות גרעין חיידקיות. מאמר זה מציג תוצאות מייצגות של זיהום K. pneumoniae וזיהומים משותפים מרובים שלו באמצעות LAMP כדי לזהות דגימות (כיח, נוזל שטיפת הסימפונות ונוזל שטיפה alveolar) מדרכי הנשימה התחתונות. לסיכום, שיטת LAMP רב ערוצית מספקת אמצעי מהיר ויעיל לזיהוי פתוגנים חיידקיים בודדים ומרובים בדגימות קליניות, אשר יכול לסייע במניעת התפשטות פתוגנים חיידקיים ולסייע בטיפול המתאים ב- RTIs.
Introduction
זיהומים בדרכי הנשימה (RTIs) הנגרמים על ידי פתוגנים חיידקיים תורמים בעיקר לתחלואה ולתמותה ברחבי העולם1. זה מוגדר כמו כל סימפטומים בדרכי הנשימה העליונות או התחתונות מלווה חום שנמשך 2-3 ימים. בעוד שזיהומים בדרכי הנשימה העליונות שכיחים יותר מזיהומים בדרכי הנשימה התחתונות, זיהומים כרוניים וחוזרים בדרכי הנשימה הם גם מצבים קליניים נפוצים, המהווים סיכונים גדולים לאנשים ומטילים עומס משמעותי על מערכות הבריאות2. פתוגנים חיידקיים נפוצים של RTI כוללים Streptococcus pneumoniae3, Haemophilus influenzae4, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Stenotrophomonas maltophilia, בין היתר. חיידקים פתוגניים אלה בדרך כלל מאכלסים את המשטחים הריריים של הלוע של הפונדקאי ודרכי הנשימה העליונות, וגורמים לתסמינים אופייניים של RTIs כגון כאב גרון וברונכיטיס. הם גורמים לדלקת ריאות כאשר הם מתפשטים מדרכי הנשימה העליונות לאזורים סטריליים של דרכי הנשימה התחתונות ועלולים להתפשט מאדם לאדם דרך דרכי הנשימה5. במקרים חמורים הם עלולים להוביל גם למחלות חיידקיות פולשניות, בעיקר דלקת ריאות חיידקית, דלקת קרום המוח ואלח דם, שהן סיבות מובילות לתחלואה ולתמותה בקרב אנשים בכל קבוצות הגיל בעולם.
בדיקות מסורתיות עבור RTIs כוללות תרבית מיקרוביולוגית באמצעות מקלוני גרון ודגימות נשימה כיח6. בנוסף, בדיקות סרולוגיות כגון בדיקת אימונוסורבנט מקושרת אנזים (ELISA) מזהות נוגדנים או אנטיגנים בסרום, בעוד בדיקות agglutination לבחון את תגובת agglutination של נוגדנים ואנטיגנים כדי לזהות זיהום7. תרבית מיקרוביאלית נחשבת לתקן הזהב לאבחון RTIs, אך שיעור החיוביות הנמוך שלה בתרביות, אמינות ירודה ומחזור זיהוי ארוך מגבילים את יעילות האבחון8. במציאות, אבחון מהיר ומדויק של RTIs הוא חיוני לחיסול מדויק של הפתוגן החיידקי. שיטות זיהוי מהירות ויעילות יכולות לסייע בהפחתת קצב ההעברה של פתוגנים, לקצר את משך ההדבקה ולהפחית שימוש מיותר באנטיביוטיקה 9,10. שיטות מבוססות ביולוגיה מולקולרית מזרזות באופן משמעותי את האיתור, כגון תגובת שרשרת פולימראז (PCR), המגבירה את רצף הדנ"א של גן המטרה כדי לזהות פתוגנים. עם זאת, PCR מסורתי דורש ציוד רכיבה בטמפרטורה מורכבת, וזה מסורבל וגוזל זמן. יתר על כן, כל הגברה של DNA באמצעות PCR (למעט PCR בזמן אמת) מסתיימת בהפרדה אלקטרופורטית של המוצר, שגם היא לוקחת זמן. הדמיה של המוצר דורשת צבעים, שרבים מהם מוטגניים או מסרטנים. לכן, הכרחי לפתח ללא הרף שיטות וטכנולוגיות חדשות לאבחון פתוגנים חיידקיים RTI.
הגברה איזותרמית בתיווך לולאה (LAMP) היא טכנולוגיה מולקולרית חדשנית ומתפתחת שפותחה לראשונה על ידי Notomi et al. בשנת 200011. LAMP יכול להגביר DNA בתנאים איזותרמיים יציבים ללא ציוד רכיבה מורכב בטמפרטורה, מה שהופך אותו מתאים לגילוי מהיר ומפחית את מורכבות הציוד ועלותו12. LAMP יכול לזהות ריכוזים נמוכים של DNA מטרה עם רגישות גבוהה13. הוא משתמש במספר פריימרים ספציפיים כדי לשפר את הסלקטיביות עבור רצפי מטרה ולהפחית את האפשרות של תוצאות חיוביות שגויות14. LAMP נמצא בהדרגה בשימוש נרחב במעבדות קליניות בשל הקלות, המהירות והפעולה האינטואיטיבית שלו, אפילו לגילוי RTIs. במחקר הזה חקרנו את היעילות של LAMP בזיהוי RTI נמוך יותר בדגימות קליניות (כיח, נוזל שטיפת סימפונות ונוזל שטיפה בנאדיות), כפי שמוצג באיור 1. ניכר כי LAMP מציע יתרונות כגון מהירות, רגישות וקלות שימוש על פני בדיקות מסורתיות בזיהוי RTI נמוך יותר, מה שהופך אותו ליישום מבטיח.
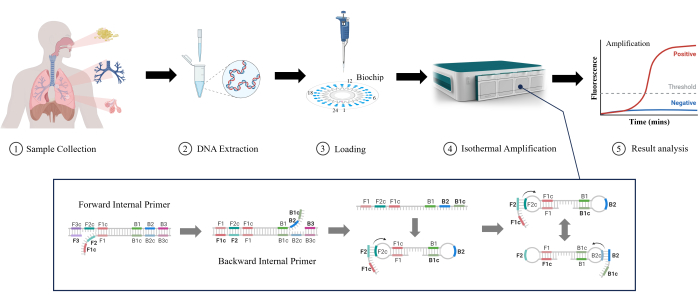
איור 1: המחשה סכמטית של שיטת זיהוי LAMP. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הדגימות למחקר זה הוערכו ואושרו על ידי ועדת האתיקה של בית החולים העממי המחוזי גואנגדונג (מספר אישור: KY2023-1114-01). כל המשתתפים חתמו על הסכמה מדעת בכתב לפני הניסויים. הריאגנטים והציוד ששימשו למחקר מפורטים בטבלת החומרים. הקיצורים המשמשים בפרוטוקול מפורטים בטבלה משלימה 1.
1. איסוף דגימות קליניות מדרכי הנשימה התחתונות
- אוסף כיח
- נקו את חלל הפה והשיניים במים נקיים, והקפידו על הסרת שיניים תותבות במידת הצורך. שיעול בכוח כדי לגרש כיח נשימתי עמוק לתוך מיכל כיח (מינימום 0.6 מ"ל).
- הימנע זיהום עם רוק או הפרשות האף. אם השיעול קשה, יש לשאוף תמיסת NaCl במינון 100 גרם/ליטר ב-45°C כדי להקל על הכיוח. העבירו את הדגימה למיכל סטרילי הניתן לאטימה.
הערה: ודא שדגימות הכיח נאספות בבוקר ולפני כל שימוש בסמים אנטיבקטריאליים.
- נוזל שטיפת הסימפונות (BLF)
- הכנס את ראש האספן לקנה הנשימה מאתר הנחיר או קנה הנשימה (בעומק של כ-30 ס"מ). להזריק 5 מ"ל של מלוחים, ליצור לחץ שלילי, לסובב את ראש האספן, ולאט לאט לסגת.
- אספו את הריר המופק ושטפו את הקולט פעם אחת בתמיסת דגימה (מי מלח פיזיולוגיים או מים סטריליים להזרקה). לחילופין, יש לחבר קטטר שתן לילדים למזרק במינון 50 מ"ל כתחליף לאיסוף.
- נוזל שטיפה בנאדיות (ALF)
- זהה את מיקום הנגע באמצעות בדיקות הדמיה בחזה. בחרו את האזור המשמעותי ביותר או המתקדם במהירות לשטיפה.
- יש להזריק 1-2 מ"ל של 2% לידוקאין למקטע הסימפונות דרך תעלת הביופסיה במהלך השטיפה, ולספק הרדמה מקומית למקטע הריאה15. עבור חולים תחת הרדמה כללית תוך ורידית שעדיין מפגינים תגובות חזקות בדרכי הנשימה, יש להזריק 1-2 מ"ל של 2% לידוקאין.
- לאחר הרדמה מקומית, להכניס ברונכוסקופ סיבים אופטיים דרך הפה או האף, עובר דרך הלוע לתוך הסימפונות של האונה האמצעית הימנית או קטע השפה של הריאה השמאלית. מניחים את קצהו בפתח ענף הסימפונות ולאט לאט מכניסים מי מלח פיזיולוגיים סטריליים.
- יש לתת 30-50 מ"ל מי מלח בכל מפגש, בנפח 100-250 מ"ל (מקסימום 300 מ"ל). יש לאסוף את הריר המופק במיכל סטרילי אטום.
2. מיצוי DNA
- בהתבסס על צמיגות דגימות דרכי הנשימה התחתונות, יש להוסיף כמות מתאימה של 10% NaOH. עבור דגימות עם צמיגות נמוכה, להוסיף 2-3 פעמים את נפח המדגם של פתרון הנזלה. עבור דגימות עם צמיגות בינונית, להוסיף 5-6 פעמים את נפח המדגם של פתרון נוזלי. עבור דגימות עם צמיגות גבוהה, להוסיף 8-10 פעמים את נפח המדגם של פתרון נוזלי.
- כוונן את עוצמת הקול של 10% NaOH בהתאם לצמיגות הדגימה. מפזרים את הדגימות בצורה אחידה ככל האפשר באמצעות מערבל מערבולת למשך 15 שניות ודגרים בטמפרטורה של 37°C למשך 30 דקות להנזלה.
הערה: עבור דגימות עבות יותר, הגדל את נפח NaOH או הארך את זמן ההנזלה. איכות ההנזלה של הדגימות משפיעה ישירות על יעילות המיצוי שלאחר מכן. באופן אידיאלי, דגימות נוזליות צריכות להציג עקביות עקבית ולא דביקה.
- כוונן את עוצמת הקול של 10% NaOH בהתאם לצמיגות הדגימה. מפזרים את הדגימות בצורה אחידה ככל האפשר באמצעות מערבל מערבולת למשך 15 שניות ודגרים בטמפרטורה של 37°C למשך 30 דקות להנזלה.
- פיפטה 1 מ"ל של הדגימה הנוזלית לתוך צינור צנטריפוגה 1.5 מ"ל. צנטריפוגה במהירות של 15,777 × גרם למשך 5 דקות ב 2-6 ° C, ולאחר מכן להשתמש פיפטה כדי להסיר ולהשליך את supernatant.
הערה: בעת שאיפת הדגימה, הימנע משיכת זיהומים מתחתית הצינור; אם יש זיהומים רבים, הדגימה יכולה להיות צנטריפוגה ב 1,753-2,739 × גרם במשך 1 דקות לפני השאיפה. - הוסף 1 מ"ל של תמיסת שטיפה לצינור הצנטריפוגה ולמערבולת כדי להרים את המשקע מתחתית הצינור. אין צורך לפזר אותו לחלוטין.
- צנטריפוגה את התמיסה ב 15,777 × גרם במשך 5 דקות, להשליך את supernatant, ולנסות לא לגעת במשקע.
הערה: הקפידו על הסרה יסודית של תמיסת הכביסה כדי למנוע השפעה על ההגברה הבאה.
- צנטריפוגה את התמיסה ב 15,777 × גרם במשך 5 דקות, להשליך את supernatant, ולנסות לא לגעת במשקע.
- הוסף 100 μL של תמיסת מיצוי חומצת גרעין לצינור הצנטריפוגה. השתמש פיפטה כדי לשאוף ולערבב את המשקע ביסודיות. מעבירים את הנוזל ומזרזים יחד לתוך צינור מיצוי חומצת גרעין. הרכב תמיסת מיצוי חומצות הגרעין מוצג בטבלה 1.
- מניחים את צינורות מיצוי חומצות הגרעין במערבולת מערבולת במהירות בינונית למשך 5 דקות לפחות. לאחר המערבולת, מעבירים את צינורות מיצוי חומצות הגרעין לאמבט מתכת עם טמפרטורה קבועה וחום ב 100 מעלות צלזיוס למשך 5 דקות.
- צנטריפוגה ב-15,777 × גרם ב-2-6 מעלות צלזיוס למשך 5 דקות ומניחים בצד.
הערה: אם תגובת הגברת ה-PCR מבוצעת תוך 24 שעות, ניתן לאחסן את חומצת הגרעין ב-4°C. לאחר ההגברה, לאחסן את חומצת הגרעין ב -20 ° C. לאחסון לטווח ארוך (מעבר ל-24 שעות), אחסנו את חומצת הגרעין בטמפרטורה של -20°C. כאשר המוצר מוכן לשימוש חוזר, הפשירו את הדגימה באופן טבעי, ערבבו מערבולת, חממו באמבט מים בטמפרטורה של 95 מעלות צלזיוס למשך 5 דקות, צנטריפוגה בטמפרטורה של 10,956 × גרם למשך דקה אחת, והשתמשו בסופרנאטנט להגברת PCR.
| תמיסה | רכיבים | מספר | מפרט |
| תמיסת כביסה | 10 מ"מ EDTA | 1 בקבוק | 24 מ"ל/בקבוק |
| מגיב מיצוי חומצות גרעין | 10mM Tris-HCl, 1mM EDTA, חומרים משמרים של חומצות גרעין | 2 צינורות | 1.2 מ"ל/בקבוק |
| צינור מיצוי חומצת גרעין | חרוזי זכוכית | 1 שקית | 24 בקבוקים/שקית |
טבלה 1: הרכב מגיב מיצוי חומצות גרעין.
3. הגברה איזותרמית בתיווך לולאה ושבב מיקרו-נוזל
- מגיב ושבב מיקרופלואידי
- בצע תגובות הגברה איזותרמיות על שבב בצורת דיסק מיקרופלואידי (ראה טבלת חומרים). בצע את הגברת הטמפרטורה הקבועה ב 65 °C.
- בצע ניתוח פלואורסצנטי בזמן אמת באמצעות שיטת שילוב צבע פלואורסצנטי14 על מנתח חומצות גרעין שבב מיקרופלואידי בטמפרטורה קבועה. שימו לב לעקומת הגברה בצורת S עבור דגימות חיוביות באמצעות פולימראז עם פונקציונליות תזוזה של גדיל.
- הגברה איזותרמית בתיווך לולאה
- התמקדו בשישה אזורי רצף עם ארבעה פריימרים ספציפיים, כולל שני פריימרים פנימיים ושני פריימרים חיצוניים (מסופק עם ערכת LAMP).
הערה: DNA משוכפל ומוגבר ברציפות בטמפרטורה קבועה באמצעות DNA פולימראז עם פונקציונליות תזוזת גדילים. תהליך התגובה כולל את שלב סינתזת התבנית בצורת משקולת, שלב הגברה מחזורית, שלב התארכות ומיחזור, ובסופו של דבר יוצרים תערובת של מקטעי DNA עם מבנים דמויי לולאת גזע וכרובית. עיין בהוראות הערכה לקבלת מידע מפורט (קובץ משלים 1). - הוסף פריימרים בעלי שתי לולאאות למערכת התגובה כדי לשפר את יעילות התגובה, אשר נקשר למבני לולאת הגזע, ומתחיל סינתזת תזוזה של גדילים ושכפול מחזורי. הרכב הערכה לזיהוי חומצות גרעין לפתוגנים בדרכי הנשימה מוצג בטבלה 2.
הערה: ערכת המגיב משתמשת בשיטת LAMP. העיקרון מבוסס על שיווי המשקל הדינמי של הדנ"א בסביבות 65 מעלות צלזיוס, כאשר כל פריימר הנמשך דרך זיווג בסיסים באתר המשלים של דנ"א דו-גדילי גורם לגדיל השני להתנתק, ויוצר גדיל יחיד.
- התמקדו בשישה אזורי רצף עם ארבעה פריימרים ספציפיים, כולל שני פריימרים פנימיים ושני פריימרים חיצוניים (מסופק עם ערכת LAMP).
- שבב מיקרופלואידי
הערה: כל שבב מיקרופלואידי (ראו טבלת חומרים) מצויד ב-24 בארות תגובה ממוספרות נגד כיוון השעון, כאשר הכניסה והמוצא של באר 1 מתאימים לבאר התגובה 1 (איור 2). קבוצה ספציפית של פריימרים להגברה וזיהוי של רצף מטרה מסוים של חומצת גרעין מוטמעת ומקובעת היטב בכל תגובה.- ערבבו את הדנ"א הדגימה עם מגיב ההגברה. הזריקו את התערובת לתוך השבב והפיצו אותה לכל צנטריפוגת תגובה ב-1,000 × גרם למשך 30 שניות בטמפרטורת החדר.
הערה: תגובות הגברה איזותרמיות עצמאיות וזיהוי פלואורסצנטי בזמן אמת מתרחשים יחד בכל תגובה על השבב. אם עקומת הגברה בצורת S מזוהה היטב בתגובה מסוימת, מדד הזיהוי המתאים לאותה באר הוא חיובי.
- ערבבו את הדנ"א הדגימה עם מגיב ההגברה. הזריקו את התערובת לתוך השבב והפיצו אותה לכל צנטריפוגת תגובה ב-1,000 × גרם למשך 30 שניות בטמפרטורת החדר.
| רכיבים | הרכב | מספר |
| צ'יפ | פריימרים | 12 מקומות |
| סרט איטום | / | 1 גיליון |
| מגיב הגברה איזותרמי | צבע פלואורסצנטי, אנזים | 270 מיקרוליטר/צינור |
| שליטה חיובית | Escherichia coli DNA גנומי | 160 מיקרוליטר/צינור |
טבלה 2: הרכב הערכה לזיהוי חומצות גרעין לפתוגנים בדרכי הנשימה.
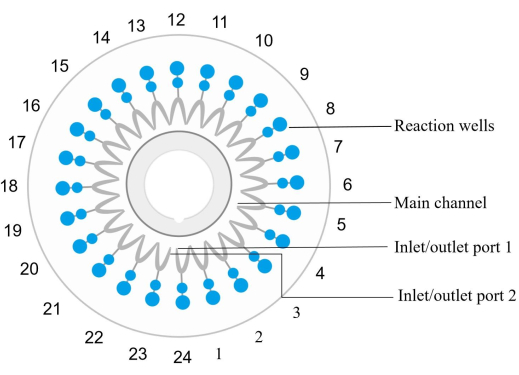
איור 2: דיאגרמת מבנה שבב דיסק. בארות התגובה ממוספרות ברצף נגד כיוון השעון, כאשר יציאת הכניסה / יציאה 1 מתאימה לבאר התגובה מספר 1. בארות תגובה 1, 4, 7, 10, 13, 16, 19, 22 ו-24 הן בקרות שליליות. תגובה טובה 6 היא שליטה חיובית (E. coli). באר התגובה 12 היא בקרה חיובית פנימית, ובאר התגובה 23 היא בקרה חיובית חיצונית. תגובה באר 2 מזהה spn. תגובה היטב 3 מזהה sau. התגובה 5 מזהה MRSA. התגובה גם 8 מזהה kpn. התגובה ובכן 9 מזהה pae. התגובה 11 מזהה אבא. התגובה היטב 14 מזהה sma. התגובה היטב 15 מזהה hin. ראה טבלה 5 לפרטים לדוגמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הכנת דגימות וזיהוי חיידקים
- הכינו את מערכת תגובת ההגברה האיזותרמית
- קחו את מגיב ההגברה האיזותרמי מהערכה ואפשרו לו להפשיר בטמפרטורת החדר באופן מלא. נערו בעדינות כדי לערבב היטב וצנטריפוגה קצרה כדי לאסוף בתחתית הצינור.
- באזור האחסון וההכנה של המגיב, פיפטה 20 μL של מגיב הגברה איזותרמית לתוך צינור צנטריפוגה מוכן 200 μL. כסו את הצינור והעבירו אותו לאזור הכנת הדגימה עם צינור צנטריפוגה אחד לכל דגימה.
- באזור הכנת הדגימה, הוסף 34.5 μL של דגימת חומצת הגרעין היעד. נערו בעדינות כדי לערבב היטב וצנטריפוגה קצרה כדי לאסוף בתחתית הצינור. הנפח הכולל של כל מערכת תגובה להגברת חומצות גרעין הוא 54.5 μL (טבלה 3).
- הליך טעינת שבבים
- על אריזת השבב, תייגו את מספר המדגם. פתח את השבב המיקרופלואידי כשתווית האריזה פונה כלפי מעלה.
- מקם את השבב כאשר יציאות הכניסה והיציאה פונות כלפי מעלה. באמצעות פיפטה, לצייר 50 μL של מערכת תגובת הגברה מוכן ולהוסיף אותו לערוץ הראשי של השבב דרך יציאת הכניסה. הפסק להוסיף כאשר התעלה הראשית מלאה, ונגב במהירות את עודפי הנוזלים סביב יציאות הכניסה והיציאה עם רקמות ללא מוך.
- השתמש בפינצטה כדי להרים סרט איטום אחד ולכסות אותו מעל יציאות הכניסה והיציאה. לחץ קצה פיפטה נקי על סרט האיטום בכיוון אחד. יש לוודא אטימה הדוקה.
- תגובת qPCR
- לאחר שמקור האור של מנתח חומצות הגרעין סיים את החימום המוקדם, לחץ על כפתור פתח מגש . הניחו את השבב עם הצד הקדמי למעלה על המגש, וודאו שהגליל הקטן המאתר יוצא מהרווח המרכזי של השבב כדי לאבטח אותו. יישר את התקן המיקום המרכזי במגש עם החור המרכזי הגדול בשבב.
- לחץ על סגור מגש כפתור כדי להכניס את השבב לתוך מנתח חומצות גרעין.
- באזור מידע לדוגמה בממשק האיתור, הזן את המידע לבדיקת הדגימה. מספר מדגם, מספר שבב וסוג מדגם הם חובה; אחרים הם אופציונליים.
- לחץ על כפתור התחל זיהוי באזור הפעולה כדי להתחיל את זיהוי הדגימה. המכשיר יבצע בדיקות מדגמיות בהתאם לתוכנית שנקבעה מראש.
הערה: לאחר השלמת הזיהוי, התוכנה הנלווית של המכשיר תבצע ניתוח נתונים באופן אוטומטי. במקביל, מנתח חומצות הגרעין יתחיל תהליך קירור אוטומטי. ברגע שהטמפרטורה יורדת ל -37 מעלות צלזיוס, המכשיר פותח אוטומטית את המגש ומוציא את השבב לאפיגה. התוצאות יפורשו אוטומטית על ידי המערכת (טבלה 4).
- תקני בקרת איכות
- בקרת איכות חיובית אחת ותשע בקרות איכות שליליות מוקפות בכל שבב בערכת מגיב זו. ודא שתוצאות הזיהוי של בקרת האיכות החיובית הן חיוביות, ובמקביל, התוצאות עבור כל תשע בקרות האיכות השליליות הן שליליות.
הערה: התוצאות מוצגות בצד ימין של התמונה עם הכיתוב "תוצאות בקרת איכות: ניסוי נורמלי (חיובי נורמלי, שלילי נורמלי)", המציין שתוצאות הבדיקה תקפות. בדיקה חוזרת נדרשת אם תוצאה כלשהי שגויה ותוצאת הבדיקה לדוגמה נחשבת לא חוקית. בקרה פנימית חיובית אחת באמצעות פריימרים ספציפיים לבני אדם סגורה בשבב, שתוצאתה חיובית לבדיקת דגימה קלינית בעוד שהיא שלילית אם לדגימה יש תוכן DNA גנומי אנושי נמוך, מה שמצביע על ספירת תאים נמוכה יותר. איסוף ובדיקה חוזרת של דגימות במקרים כאלה.
- בקרת איכות חיובית אחת ותשע בקרות איכות שליליות מוקפות בכל שבב בערכת מגיב זו. ודא שתוצאות הזיהוי של בקרת האיכות החיובית הן חיוביות, ובמקביל, התוצאות עבור כל תשע בקרות האיכות השליליות הן שליליות.
- ניתוח תוצאות
- לאחר השלמת הזיהוי, השתמש בשיטת המקסימום הנגזרת השנייה בשילוב עם אלגוריתמים מוגנים מסחרית בתוכנה כדי לחשב את נקודת הנטייה הראשונה של עקומת ההגברה בצורת S בשלב ההגברה המהירה. הפרטים מתוארים בחלק "עקרונות הבדיקה" בהוראות הערכה לזיהוי חומצות גרעין של פתוגנים נשימתיים (קובץ משלים 1).
הערה: ערך TP הוא הפרש הזמן בין נקודת הנטייה למקור. התוצאה מתפרשת על בסיס TP וערכי שיפוט חיובי. אם ערך TP עבור אינדקס זיהוי קטן או שווה לערך השיפוט החיובי עבור מדד זה, הוא יפורש כחיובי. אם ערך TP עולה על ערך השיפוט החיובי, הוא מתפרש כשלילי, על פי הקריטריונים ל"ערך החלטה חיובית" בהוראות. האזור "אזור עקומת פלואורסצנטיות" מציג את העקומה המנורמלת, ואזור "תוצאת זיהוי" מציג את תוצאות בקרת האיכות והזיהוי עבור כל פרמטר (טבלה 5).
- לאחר השלמת הזיהוי, השתמש בשיטת המקסימום הנגזרת השנייה בשילוב עם אלגוריתמים מוגנים מסחרית בתוכנה כדי לחשב את נקודת הנטייה הראשונה של עקומת ההגברה בצורת S בשלב ההגברה המהירה. הפרטים מתוארים בחלק "עקרונות הבדיקה" בהוראות הערכה לזיהוי חומצות גרעין של פתוגנים נשימתיים (קובץ משלים 1).
| מגיב | נפח (μl) |
| מגיב הגברה איזותרמי | 20 |
| DNA של תבנית | 34.5 |
טבלה 3: מערכת תגובת הגברה איזותרמית.
| צעד | אחד | שניים |
| טמפרטורה (°C) | 37 | 65 |
| זמן (דקות) | 3 | 47 |
טבלה 4: תוכנית תגובה להגברת חומצות גרעין.
| שם מחוון | ערך שליטה חיובי |
| סטרפטוקוקוס דלקת ריאות (sp) | 30 |
| סטפילוקוקוס זהוב (SAU) | 34 |
| סטפילוקוקוס אאורוס עמיד למתיצילין (MRSA) | 22 |
| קלבסיאלה דלקת ריאות (kpn) | 29 |
| Pseudomonas aeruginosa (pae) | 36 |
| Acinetobacter baumannii (אבא) | 36 |
| מלטופיליה Stenotrophomonas (SMA) | 27 |
| המופילוס אינפלואנזה (הין) | 36 |
טבלה 5: ערך בקרה חיובי עבור מחוון זיהום.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ניסוי זה עושה שימוש בטכנולוגיית הגברה איזותרמית, ביצוע תגובות על שבב דיסק מיקרופלואידי. התגובה מתרחשת על מנתח חומצת גרעין שבב מיקרופלואידית, תוך שימוש בשיטת החדרת צבע פלואורסצנטי. התגובה האיזותרמית מבוצעת בטמפרטורה קבועה של 65 מעלות צלזיוס, וניתוח פלואורסצנטי בזמן אמת מתבצע בו זמנית. דגי?...
Access restricted. Please log in or start a trial to view this content.
Discussion
זיהומים בדרכי הנשימה הם זיהומים נפוצים הקשורים לבתי חולים, המטילים השלכות חמורות על חולים ומאמירים בשיעורי התמותה16. זיהוי מהיר ומדויק של פתוגנים פוטנציאליים ואחריו אנטיביוטיקה יעילה הוא המפתח לטיפול מוצלח ולשיפור הפרוגנוזה, במיוחד בהתחשב במגבלות הטבועות בשיטות תרבית מסור?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
הערכנו מאוד את התמיכה הכספית הניתנת על ידי קרן המחקר הבסיסית והיישומית של גואנגדונג (מענק מס '2022A1515220023) וקרן המחקר לכישרונות מתקדמים של בית החולים העממי המחוזי של גואנדונג (מענק מס '. KY012023293).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Bath Incubator(MK2000-2) | ALLSHENG | Provide a constant temperature environment | |
| Bronchial lavage fluid collector head | TIANPINGHUACHANG | SEDA 20172081375 | Collecting bronchoalveolar lavage fluid |
| Fiberoptic bronchoscope | OLYMPUS | SEDA 20153062703 | A flexible bronchoscope equipped with a fiberoptic light source and camera, to visually examine the airways and structures within the lungs. Assist in collecting bronchoalveolar lavage |
HR1500- B2 B2 | Haier | SEDA 20183541642 | Biosafety cabinet |
| NAOH | MACKLIN | S817977 | Liquefy viscous lower respiratory tract sample |
| Nucleic acid detection kit for respiratory tract pathogens | Capitalbio Technology | SEDA 20173401346 | Testing for bacteria infection |
| Nucleic acid extraction reagent | Capitalbio Technology | SEDA 20160034 | For DNA extraction |
| RTisochip-W | Capitalbio Technology | SEDA 20193220539 | Loop-mediated Isothermal Amplification |
| THERMO ST16R | Thermo Fisher Scientific | SEDA 20180585 | Centrifuge the residual liquid off the wall of the tube. |
| Vortex mixer VM-5005 | JOANLAB | For mixing reagent |
References
- GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: A systematic analysis for the global burden of disease study 2016. Lancet Infect Dis. 18 (11), 1191-1210 (2018).
- Niederman, M. S., Torres, A. Respiratory infections. Eur Respir Rev. 31 (166), 220150(2022).
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: Transmission, colonization and invasion. Nat Rev Microbiol. 16 (6), 355-367 (2018).
- Watt, J. P., et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years_ global estimates. Lancet. 374 (9693), 903-911 (2009).
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat Rev Microbiol. 6 (4), 288-301 (2008).
- Popova, G., Boskovska, K., Arnaudova-Danevska, I., Smilevska-Spasova, O., Jakovska, T. Sputum quality assessment regarding sputum culture for diagnosing lower respiratory tract infections in children. Open Access Maced J Med Sci. 7 (12), 1926-1930 (2019).
- Nuyttens, H., Cyncynatus, C., Renaudin, H., Pereyre, S., Identification Bébéar, C. expression and serological evaluation of the recombinant ATP synthase beta subunit of mycoplasma pneumoniae. BMC Microbiol. 10 (1), 216(2010).
- Noviello, S., Huang, D. B. The basics and the advancements in diagnosis of bacterial lower respiratory tract infections. Diagnostics (Basel). 9 (2), 37(2019).
- Hanson, K. E., et al. Molecular testing for acute respiratory tract infections: Clinical and diagnostic recommendations from the IDSA's diagnostics committee. Clin Infect Dis. 71 (10), 2744-2751 (2020).
- Daniel Reynolds, J. P. B., et al. The threat of multidrug-resistant/extensively drug-resistant gram-negative respiratory infections: Another pandemic. Eur Respir Rev. 31 (166), 220068(2022).
- T Notomi, H. O., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 28 (12), 63(2000).
- Soroka, M., Wasowicz, B., Rymaszewska, A. Loop-mediated isothermal amplification (LAMP): The better sibling of PCR. Cells. 10 (8), 1931(2021).
- Mori, Y., Kitao, M., Tomita, N., Notomi, T. Real-time turbidimetry of lamp reaction for quantifying template DNA. Biophys J. 59 (2), 145-157 (2004).
- Parida, M., Sannarangaiah, S., Dash, P. K., Rao, P. V., Morita, K. Loop mediated isothermal amplification (LAMP): A new generation of innovative gene amplification technique: Perspectives in clinical diagnosis of infectious diseases. Rev Med Virol. 18 (6), 407-421 (2008).
- Chinese Medical Association Respiratory Branch Critical Care Medicine Group, Working Committee on Critical Care Medicine of the Chinese Physicians Association Respiratory Physicians Branch. Standardization of collection, submission, testing, and interpretation of bronchoalveolar lavage fluid in ICU patients. Chin J Tubere Respir Dis. 43 (9), 744-756 (2020).
- Koch, A. M., Nilsen, R. M., Eriksen, H. M., Cox, R. J., Harthug, S. Mortality related to hospital-associated infections in a tertiary hospital: Repeated cross-sectional studies between 2004-2011. Antimicrob Resist Infect Control. 4 (1), 57(2015).
- Seymour, C. W. F. G., et al. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 376 (23), 2235-2244 (2017).
- Choi, C. W., Hyun, J. W., Hwang, R. Y., Powell, C. A. Loop-mediated isothermal amplification assay for detection of candidatus Liberibacter asiaticus: A causal agent of citrus huanglongbing. Plant Pathol. 34 (6), 499-505 (2018).
- Büscher, P., Njiru, Z. K. Loop-mediated isothermal amplification technology: Towards point of care diagnostics. PLoS Negl Trop Dis. 6 (6), e1572(2012).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): Principle, features, and future prospects. J Microbiol. 53 (1), 1-5 (2015).
- Ajibola, O., Gulumbe, B., Eze, A., Obishakin, E. Tools for detection of schistosomiasis in resource limited settings. Medical Sciences. 6 (2), 39(2018).
- Kumar, Y. S. B., et al. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Compr Rev Food Sci Food SAF. 16 (6), 1359-1378 (2017).
- Hongling Ou, Y. W., et al. Rapid detection of multiple pathogens by the combined loop-mediated isothermal amplification technology and microfluidic chip technology. Ann Palliat Med. 10 (10), 11053-11066 (2021).
- Liang Wang, J. -X. L., et al. Quantitative polymerase chain reaction (qPCR)-based rapid diagnosis of helicobacter pylori infection and antibiotic resistance. J Vis Exp. (197), e65689(2023).
- Jing-Wen Lyu, B. X., et al. Rapid prediction of multidrug-resistant klebsiella pneumoniae through deep learning analysis of SERS spectra. Microbiol Spectr. 11 (2), e0412622(2023).
- Wei Liu, J. -W. T., et al. Discrimination between carbapenem-resistant and carbapenem-sensitive klebsiella pneumoniae strains through computational analysis of surface-enhanced Raman spectra a pilot study. Microbiol Spectr. 10 (1), e0240921(2022).
- Zhang, L. Y., et al. Classification and prediction of klebsiella pneumoniae strains with different MLST allelic profiles via SERS spectral analysis. Peer J. 11, e16161(2023).
- Zhi Liu, Q. Z., et al. Rapid and sensitive detection of salmonella in chickens using loop-mediated isothermal amplification combined with a lateral flow dipstick. J Microbiol Biotechnol. 29 (3), 454-464 (2019).
- Chen, F., et al. Fully Integrated microfluidic platform for multiplexed detection of hunov by a dynamic confined-space-implemented one-pot RPA-LAMP system. Adv Sci (Weinh). 21, e2306612(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved