Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрое обнаружение бактериальных патогенов, вызывающих инфекции нижних дыхательных путей, с помощью изотермической амплификации, опосредованной петлей на основе микрофлюидных чипов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Различные бактериальные патогены могут вызывать инфекции дыхательных путей и приводить к серьезным проблемам со здоровьем, если их не выявить точно и не лечить своевременно. Быстрое и точное обнаружение этих патогенов с помощью петлевой изотермической амплификации обеспечивает эффективное лечение и контроль инфекций дыхательных путей в клинических условиях.
Аннотация
Инфекции дыхательных путей (ИРТ) являются одними из наиболее распространенных проблем в клинических условиях. Быстрая и точная идентификация бактериальных патогенов обеспечит практические рекомендации по ведению и лечению ИРТ. В этом исследовании описывается метод быстрого обнаружения бактериальных патогенов, вызывающих инфекции дыхательных путей, с помощью многоканальной петлевой изотермической амплификации (LAMP). LAMP является чувствительным и специфичным диагностическим инструментом, который быстро обнаруживает бактериальные нуклеиновые кислоты с высокой точностью и надежностью. Предложенный метод имеет значительное преимущество по сравнению с традиционными методами культивирования бактерий, которые являются трудоемкими и часто требуют большей чувствительности для обнаружения низких уровней бактериальных нуклеиновых кислот. В данной статье представлены репрезентативные результаты инфекции K. pneumoniae и ее множественных сопутствующих инфекций с использованием LAMP для обнаружения образцов (мокроты, жидкости бронхиального лаважа и жидкости альвеолярного лаважа) из нижних дыхательных путей. Таким образом, многоканальный метод LAMP обеспечивает быстрые и эффективные средства идентификации одиночных и множественных бактериальных патогенов в клинических образцах, что может помочь предотвратить распространение бактериальных патогенов и помочь в надлежащем лечении ИРТ.
Введение
Инфекции дыхательных путей (ИТР), вызываемые бактериальными патогенами, в первую очередь способствуют заболеваемости и смертности во всем мире1. Он определяется как любые симптомы верхних или нижних дыхательных путей, сопровождающиеся лихорадкой продолжительностью 2-3 дня. В то время как инфекции верхних дыхательных путей встречаются чаще, чем инфекции нижних дыхательных путей, хронические и рецидивирующие инфекции дыхательных путей также являются распространенными клиническими состояниями, представляющими большой риск для людей и создающими значительную нагрузку на системы здравоохранения2. К распространенным бактериальным патогенам РТИ относятся Streptococcus pneumoniae3, Haemophilus influenzae4, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Stenotrophomonas maltophilia и другие. Эти патогенные бактерии обычно колонизируют слизистые поверхности носоглотки и верхних дыхательных путей хозяина, вызывая типичные симптомы ИРТ, такие как боль в горле и бронхит. Они вызывают пневмонию, когда распространяются из верхних дыхательных путей в стерильные участки нижних дыхательных путей и могут передаваться от человека к человеку через дыхательные пути5. В тяжелых случаях они также могут приводить к инвазивным бактериальным заболеваниям, особенно к бактериемической пневмонии, менингиту и сепсису, которые являются основными причинами заболеваемости и смертности среди людей всех возрастных групп во всем мире.
Традиционные тесты на RTI включают микробиологическое культивирование с использованием мазков из горла и образцов мокроты из дыхательных путей6. Кроме того, серологические тесты, такие как иммуноферментный анализ (ИФА), обнаруживают антитела или антигены в сыворотке крови, в то время как тесты на агглютинацию наблюдают за реакцией агглютинации антител и антигенов для выявления инфекции7. Микробное бактериологическое исследование считается золотым стандартом для диагностики ИОТ, но его низкий уровень положительности культуры, низкая надежность и длительный цикл обнаружения ограничивают эффективность диагностики. На самом деле, быстрая и точная диагностика ДП имеет решающее значение для точной эрадикации бактериального патогена. Быстрые и эффективные методы обнаружения могут помочь снизить скорость передачи патогенов, сократить продолжительность инфекции и уменьшить ненужное использование антибиотиков 9,10. Методы, основанные на молекулярной биологии, значительно ускоряют обнаружение, такие как полимеразная цепная реакция (ПЦР), которая усиливает последовательность ДНК целевого гена для обнаружения патогенов. Однако традиционная ПЦР требует сложного оборудования для температурного цикла, которое является громоздким и трудоемким. Кроме того, каждая амплификация ДНК с помощью ПЦР (за исключением ПЦР в реальном времени) заканчивается электрофоретическим разделением продукта, что также требует времени. Для визуализации продукта требуются красители, многие из которых являются мутагенными или канцерогенными. Поэтому крайне важно постоянно разрабатывать новые методы и технологии диагностики бактериальных патогенов РТИ.
Петлевая изотермическая амплификация (LAMP) является новой и развивающейся молекулярной технологией, первоначально разработанной Notomi et al. в 2000году. LAMP может амплифицировать ДНК в стабильных изотермических условиях без сложного оборудования для температурного цикла, что делает его пригодным для быстрого обнаружения и снижает сложность и стоимость оборудования12. LAMP может обнаруживать низкие концентрации целевой ДНК с высокойчувствительностью13. Он использует несколько специфических праймеров для улучшения селективности по целевым последовательностям и снижения вероятности ложных срабатываний14. LAMP постепенно получает широкое распространение в клинических лабораториях благодаря своей простоте, скорости и интуитивно понятному управлению даже для обнаружения RTI. В этом исследовании мы изучили эффективность LAMP в выявлении более низких RTI в клинических образцах (мокрота, жидкость бронхиального лаважа и жидкость альвеолярного лаважа), как показано на рисунке 1. Очевидно, что LAMP обладает такими преимуществами, как скорость, чувствительность и простота использования по сравнению с традиционными тестами при обнаружении более низкого RTI, что делает его многообещающим приложением.
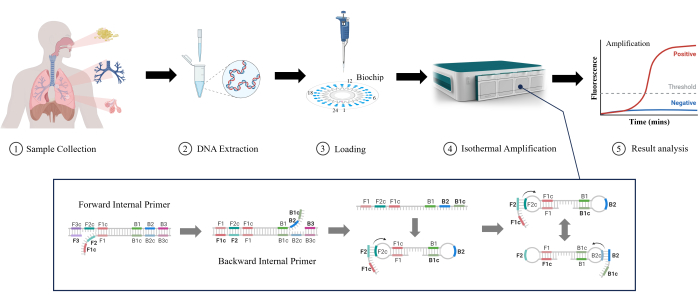
Рисунок 1: Схематическое изображение метода обнаружения LAMP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все образцы для этого исследования были оценены и одобрены Комитетом по этике Народной больницы провинции Гуандун (номер одобрения: KY2023-1114-01). Перед началом экспериментов все участники подписали письменное информированное согласие. Реагенты и оборудование, использованные для исследования, перечислены в Таблице материалов. Сокращения, используемые в протоколе, перечислены в дополнительной таблице 1.
1. Забор клинических образцов из нижних дыхательных путей
- Сбор мокроты
- Очистите полость рта и зубы чистой водой, при необходимости обеспечив снятие зубного протеза. Сильно кашляйте для выведения мокроты из глубоких дыхательных путей в контейнер с мокротой (минимум 0,6 мл).
- Избегайте загрязнения слюной или выделениями из носа. Если кашель затруднен, введите ингаляцию раствора NaCl 100 г/л при температуре 45 °C для облегчения отхаркивания. Переложите образец в стерильный, закрывающийся контейнер.
ПРИМЕЧАНИЕ: Убедитесь, что образцы мокроты собраны утром и перед применением антибактериальных препаратов.
- Бронхиальная жидкость для лаважа (BLF)
- Вводите коллекторную головку в трахею из ноздри или места трахеостомы (примерно на 30 см вглубь). Введите 5 мл физиологического раствора, установите отрицательное давление, поверните коллекторную головку и медленно вытащите.
- Соберите извлеченную слизь и один раз промойте коллектор раствором для отбора проб (физиологическим раствором или стерильной водой для инъекций). В качестве альтернативы подсоедините детский мочевой катетер к шприцу объемом 50 мл в качестве замены сбора.
- Альвеолярная жидкость для лаважа (ОПН)
- Определите место поражения с помощью визуализации грудной клетки. Выберите наиболее значимую или быстро прогрессирующую область для промывания.
- Введите 1-2 мл 2% лидокаина в бронхиальный сегмент через биопсийный канал во время лаважа, обеспечивая местную анестезию для промытого сегмента легкого15. Пациентам под внутривенной общей анестезией, у которых все еще проявляются сильные реакции дыхательных путей, вводят 1-2 мл 2% лидокаина.
- После местной анестезии через рот или нос вводят фиброоптический бронхоскоп, проходя через глотку в бронх правой средней доли или язычный сегмент левого легкого. Поместите его кончик в отверстие бронхиальной ветви и медленно введите стерильный физиологический раствор.
- Вводите 30-50 мл физиологического раствора за сеанс объемом 100-250 мл (макс. 300 мл). Соберите извлеченную слизь в герметичный стерильный контейнер.
2. Экстракция ДНК
- Исходя из вязкости образцов нижних дыхательных путей, добавьте соответствующее количество 10% NaOH. Для образцов с низкой вязкостью добавьте в 2-3 раза больше объема образца разжижающего раствора. Для образцов с умеренной вязкостью добавьте в 5-6 раз больше объема образца разжижающего раствора. Для образцов с высокой вязкостью добавьте в 8-10 раз больше объема образца разжижающего раствора.
- Отрегулируйте объем 10% NaOH в соответствии с вязкостью образца. Как можно более равномерно диспергируйте образцы с помощью вихревого смесителя в течение 15 с и инкубируйте при 37 °C в течение 30 минут для сжижения.
ПРИМЕЧАНИЕ: Для более густых образцов увеличьте объем NaOH или увеличьте время сжижения. Качество сжижения образцов напрямую влияет на последующую эффективность экстракции. В идеале сжиженные образцы должны иметь однородную, нелипкую консистенцию.
- Отрегулируйте объем 10% NaOH в соответствии с вязкостью образца. Как можно более равномерно диспергируйте образцы с помощью вихревого смесителя в течение 15 с и инкубируйте при 37 °C в течение 30 минут для сжижения.
- Пипетируйте 1 мл сжиженного образца в центрифужную пробирку объемом 1,5 мл. Центрифугируйте со скоростью 15 777 × г в течение 5 минут при температуре 2-6 °C, затем с помощью пипетки удалите и выбросьте надосадочную жидкость.
ПРИМЕЧАНИЕ: При отсасывании образца избегайте забора примесей со дна пробирки; Если примесей много, образец можно центрифугировать при 1,753-2,739 × г в течение 1 мин перед аспирацией. - Добавьте 1 мл моющего раствора в пробирку центрифуги и с помощью вихрева поднимите осадок со дна пробирки. Нет необходимости разгонять его полностью.
- Центрифугируйте раствор при 15 777 × г в течение 5 мин, выбросьте надосадочную жидкость и старайтесь не трогать осадок.
ПРИМЕЧАНИЕ: Обеспечьте тщательное удаление моющего раствора, чтобы не повлиять на последующее усиление.
- Центрифугируйте раствор при 15 777 × г в течение 5 мин, выбросьте надосадочную жидкость и старайтесь не трогать осадок.
- Добавьте в центрифужную пробирку 100 μл раствора для экстракции нуклеиновых кислот. Используйте пипетку для аспирации и тщательно перемешайте осадок. Перелейте жидкость и осадок вместе в пробирку для экстракции нуклеиновых кислот. Состав раствора для экстракции нуклеиновых кислот представлен в таблице 1.
- Поместите пробирки для экстракции нуклеиновых кислот в вихревой смеситель и установите вихревую скорость на среднюю скорость не менее чем на 5 минут. После вортекса перенесите пробирки для экстракции нуклеиновых кислот в металлическую ванну с постоянной температурой и нагрейте до 100 °C в течение 5 минут.
- Центрифугируйте при 15 777 × г при 2-6 °C в течение 5 минут и отложите в сторону.
Примечание: Если реакцию амплификации ПЦР проводят в течение 24 часов, нуклеиновую кислоту можно хранить при температуре 4 °C. После амплификации нуклеиновую кислоту хранить при температуре -20 °C. Для длительного хранения (более 24 часов) нуклеиновую кислоту хранят при температуре -20 °C. Когда образец снова будет готов к использованию, разморозьте его естественным образом, перемешайте с помощью воркса, нагрейте на водяной бане при температуре 95 °C в течение 5 минут, центрифугируйте при 10 956 × г в течение 1 минуты и используйте надосадочную жидкость для амплификации ПЦР.
| Решение | Компоненты | Число | Спецификация |
| Моющий раствор | 10 мМ ЭДТА | 1 флакон | 24 мл/флакон |
| Реагент для экстракции нуклеиновых кислот | 10mM Tris-HCl, 1mM EDTA, консерванты нуклеиновых кислот | 2 пробирки | 1,2 мл/флакон |
| Пробирка для экстракции нуклеиновых кислот | Стеклянные бусины | 1 мешок | 24 бутылки/мешок |
Таблица 1: Состав реагента для экстракции нуклеиновых кислот.
3. Петлевая изотермическая амплификация и микрофлюидный чип
- Реагент и микрофлюидный чип
- Проведение реакций изотермической амплификации на микрофлюидном чипе в форме диска (см. Таблицу материалов). Проводите амплификацию постоянной температуры при 65 °C.
- Выполнение флуоресцентного анализа в реальном времени с использованием метода14 включения флуоресцентного красителя на микрофлюидном чип-анализаторе нуклеиновых кислот с амплификацией при постоянной температуре. Наблюдайте за S-образной кривой амплификации для положительных образцов с использованием полимеразы с функцией смещения цепи.
- Петлевая изотермическая амплификация
- Нацельтесь на шесть областей последовательности с помощью четырех специфических праймеров, включая два внутренних праймера и два внешних праймера (входят в комплект LAMP).
ПРИМЕЧАНИЕ: ДНК непрерывно реплицируется и амплифицируется при постоянной температуре с использованием ДНК-полимеразы с функцией смещения цепи. Процесс реакции включает в себя стадию синтеза матрицы в форме гантели, стадию циклической амплификации, стадию удлинения и рециркуляции, в конечном итоге образуя смесь фрагментов ДНК со стеблевой петлей и структурами, подобными цветной капусте. Подробную информацию см. в инструкции к набору (Дополнительный файл 1). - Добавьте двухконтурные праймеры в реакционную систему для повышения эффективности реакции, которая связывается со структурами ствол-петля, инициируя синтез смещения цепи и циклическую репликацию. Состав набора для обнаружения возбудителей дыхательных путей в области нуклеиновых кислот представлен в таблице 2.
ПРИМЕЧАНИЕ: В наборе реагентов используется метод LAMP. Принцип основан на динамическом равновесии ДНК при температуре около 65 °C, где любой праймер, распространяющийся через спаривание оснований в комплементарном участке двухцепочечной ДНК, вызывает диссоциацию другой цепи, образуя одну цепь.
- Нацельтесь на шесть областей последовательности с помощью четырех специфических праймеров, включая два внутренних праймера и два внешних праймера (входят в комплект LAMP).
- Микрофлюидный чип
ПРИМЕЧАНИЕ: Каждый микрофлюидный чип (см. Таблицу материалов) оснащен 24 реакционными лунками, пронумерованными против часовой стрелки, при этом вход и выход для лунки 1 соответствуют реакционной яме 1 (рис. 2). В каждую реакционную лунку встраивается и фиксируется определенный набор праймеров для амплификации и детектирования определенной последовательности-мишени нуклеиновой кислоты.- Смешайте образец ДНК с реагентом для амплификации. Введите смесь в чип и распределите ее по каждой реакционной лунке центрифуги при 1000 × г в течение 30 с при комнатной температуре.
ПРИМЕЧАНИЕ: Независимые реакции изотермической амплификации и обнаружение флуоресценции в реальном времени происходят в каждой реакционной яме на чипе. Если в определенной реакционной лунке обнаруживается S-образная кривая амплификации, соответствующий индекс обнаружения для этой лунки является положительным.
- Смешайте образец ДНК с реагентом для амплификации. Введите смесь в чип и распределите ее по каждой реакционной лунке центрифуги при 1000 × г в течение 30 с при комнатной температуре.
| Компоненты | Состав | Число |
| Чип | Грунтовки | 12 мест |
| Герметизирующая пленка | / | 1 лист |
| Реагент для изотермической амплификации | Флуоресцентный краситель, фермент | 270 μл/туба |
| Позитивный контроль | Геномная ДНК Escherichia coli | 160 μл/туба |
Таблица 2: Состав набора для обнаружения нуклеиновых кислот для патогенов дыхательных путей.
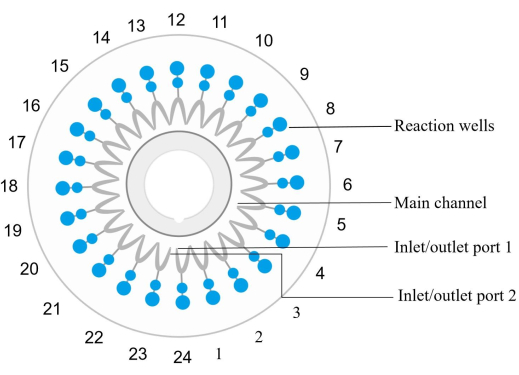
Рисунок 2: Схема структуры дисковой стружки. Реакционные лунки последовательно нумеруются против часовой стрелки, где входной/выходной порт 1 соответствует реакционной скважине No 1. Реакционные лунки 1, 4, 7, 10, 13, 16, 19, 22 и 24 являются отрицательными контрольными. Реакция лунки 6 является положительным контролем (E. coli). Реакционная яма 12 представляет собой внутренний положительный контроль, а реакционная скважина 23 представляет собой внешний положительный контроль. Реакционная скважина 2 обнаруживает спн. Реакционная скважина 3 обнаруживает сау. Реакционная лунка 5 обнаруживает MRSA. Реакционная лунка 8 обнаруживает kpn. Реакционная скважина 9 обнаруживает pae. Реакционная лунка 11 обнаруживает aba. Реакционная лунка 14 обнаруживает сма. Реакционная скважина 15 обнаруживает hin. Пожалуйста, ознакомьтесь с Таблицей 5 для получения подробной информации о примере. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Пробоподготовка и обнаружение бактерий
- Подготовка реакционной системы изотермической амплификации
- Возьмите реагент для изотермической амплификации из набора и дайте ему полностью оттаять при комнатной температуре. Осторожно встряхните, чтобы тщательно перемешать, и кратковременно центрифугировать, чтобы собрать на дно пробирки.
- В зоне хранения и подготовки реагента пипетку нанесите 20 мкл реагента изотермической амплификации в подготовленную центрифужную пробирку объемом 200 мкл. Накройте пробирку крышкой и переместите ее в зону подготовки образцов с помощью одной центрифужной пробирки на образец.
- В зону подготовки образца добавьте 34,5 мкл образца нуклеиновой кислоты-мишени. Осторожно встряхните, чтобы тщательно перемешать, и кратковременно центрифугируйте, чтобы собрать на дне пробирки. Общий объем каждой реакционной системы амплификации нуклеиновых кислот составляет 54,5 мкл (табл. 3).
- Процедура загрузки стружки
- На упаковке чипа должна быть указана этикетка с номером образца. Откройте микрофлюидный чип упаковочной этикеткой вверх.
- Поместите микросхему впускным и выпускным отверстиями вверх. С помощью пипетки набрать 50 мкл подготовленной реакционной системы амплификации и добавить ее в основной канал чипа через входное отверстие. Прекратите добавление, когда основной канал будет заполнен, и быстро сотрите лишнюю жидкость вокруг входного и выпускного отверстий безворсовой салфеткой.
- С помощью пинцета возьмите одну герметизирующую пленку и накройте ею входное и выходное отверстия. Прижмите чистый наконечник пипетки к уплотнительной пленке в одном направлении. Обеспечьте плотное прилегание.
- реакция количественной ПЦР
- После того как источник света анализатора нуклеиновых кислот завершит предварительный нагрев, нажмите на кнопку «Открыть лоток ». Поместите чип лицевой стороной вверх на лоток, убедившись, что маленький цилиндр выходит из центрального зазора чипа для фиксации его. Совместите центральное позиционирующее устройство в лотке с большим центральным отверстием в чипе.
- Нажмите кнопку «Закрыть лоток», чтобы вставить чип в анализатор нуклеиновых кислот.
- В области Sample Information (Информация об образце ) интерфейса обнаружения введите информацию для тестирования образца. Номер образца, номер микросхемы и тип образца являются обязательными; другие являются необязательными.
- Нажмите кнопку « Начать обнаружение » в рабочей области, чтобы начать обнаружение образца. Прибор проведет тестирование образца по заданной программе.
ПРИМЕЧАНИЕ: После завершения обнаружения сопутствующее программное обеспечение устройства автоматически проведет анализ данных. Одновременно с этим анализатор нуклеиновых кислот запустит автоматический процесс охлаждения. Как только температура падает до 37 °C, прибор автоматически открывает лоток и извлекает чип для извлечения. Результаты будут автоматически интерпретированы системой (Таблица 4).
- Стандарты контроля качества
- Один положительный контроль качества и девять отрицательных контрольных элементов содержатся в каждом чипе в этом наборе реагентов. Убедитесь, что результаты обнаружения для положительного контроля качества положительные, и одновременно результаты для всех девяти отрицательных элементов контроля качества являются отрицательными.
ПРИМЕЧАНИЕ: Результаты отображаются в правой части изображения с надписью «Результаты контроля качества: Эксперимент в норме (положительный нормальный, отрицательный нормальный)», что указывает на то, что результаты теста действительны. Повторный тест требуется, если какой-либо результат неверен и результат теста образца признан недействительным. Один положительный внутренний контроль с использованием специфичных для человека праймеров заключен в чип, результат которого положительен для клинического тестирования образца и отрицателен, если образец имеет низкое содержание геномной ДНК человека, что указывает на более низкое количество клеток. В таких случаях повторите сбор и повторное тестирование образцов.
- Один положительный контроль качества и девять отрицательных контрольных элементов содержатся в каждом чипе в этом наборе реагентов. Убедитесь, что результаты обнаружения для положительного контроля качества положительные, и одновременно результаты для всех девяти отрицательных элементов контроля качества являются отрицательными.
- Анализ результатов
- После завершения детектирования используйте метод максимума второй производной в сочетании с коммерчески защищенными алгоритмами в программном обеспечении для расчета первой точки перегиба S-образной кривой усиления во время фазы быстрой амплификации. Подробности описаны в разделе «Принципы теста» Инструкции к набору для обнаружения нуклеиновых кислот респираторных патогенов (Дополнительный файл 1).
ПРИМЕЧАНИЕ: Значение TP - это разница во времени между точкой перегиба и началом координат. Результат интерпретируется на основе значений TP и положительного суждения. Если значение TP для индекса обнаружения меньше или равно положительному значению суждения для этого индекса, оно интерпретируется как положительное. Если значение ТЦО превышает значение положительного суждения, оно интерпретируется как отрицательное, в соответствии с критериями «значения положительного решения» в инструкции. В поле "Fluorescence Curve Area" отображается нормализованная кривая, а в поле "Detection Result" - результаты контроля качества и обнаружения для каждого параметра (Таблица 5).
- После завершения детектирования используйте метод максимума второй производной в сочетании с коммерчески защищенными алгоритмами в программном обеспечении для расчета первой точки перегиба S-образной кривой усиления во время фазы быстрой амплификации. Подробности описаны в разделе «Принципы теста» Инструкции к набору для обнаружения нуклеиновых кислот респираторных патогенов (Дополнительный файл 1).
| Реагент | Объем (мкл) |
| Реагент для изотермической амплификации | 20 |
| Шаблонная ДНК | 34.5 |
Таблица 3: Реакционная система изотермической амплификации.
| Шаг | Один | Два |
| Температура (°C) | 37 | 65 |
| Время (мин) | 3 | 47 |
Таблица 4: Программа реакции амплификации нуклеиновых кислот.
| Название индикатора | Положительное контрольное значение |
| Streptococcus pneumoniae (sp) | 30 |
| Золотистый стафилококк (sau) | 34 |
| Метициллин-резистентный золотистый стафилококк (mrsa) | 22 |
| Klebsiella pneumoniae (kpn) | 29 |
| Pseudomonas aeruginosa (pae) | 36 |
| Acinetobacter baumannii (aba) | 36 |
| Stenotrophomonas maltophilia (sma) | 27 |
| Haemophilus influenzae (hin) | 36 |
Таблица 5: Положительное контрольное значение для индикатора инфекции.
Access restricted. Please log in or start a trial to view this content.
Результаты
В этом эксперименте используется технология изотермической амплификации, проводящая реакции на микрофлюидном чипе диска. Реакция происходит на микрофлюидном чип-анализаторе нуклеиновых кислот с использованием метода введения флуоресцентного красителя. Изотермическая реакция пров...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Инфекции дыхательных путей являются распространенными внутрибольничными инфекциями, которые влекут за собой тяжелые последствия для пациентов и приводят к росту смертности16. Своевременная и точная идентификация потенциальных патогенов с последующим назначением эффек?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы высоко ценим финансовую поддержку, оказанную Фондом фундаментальных и прикладных фундаментальных исследований провинции Гуандун (грант No 2022A1515220023) и Научно-исследовательским фондом передовых талантов Народной больницы провинции Гуандун (грант No 2022A. KY012023293).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Bath Incubator(MK2000-2) | ALLSHENG | Provide a constant temperature environment | |
| Bronchial lavage fluid collector head | TIANPINGHUACHANG | SEDA 20172081375 | Collecting bronchoalveolar lavage fluid |
| Fiberoptic bronchoscope | OLYMPUS | SEDA 20153062703 | A flexible bronchoscope equipped with a fiberoptic light source and camera, to visually examine the airways and structures within the lungs. Assist in collecting bronchoalveolar lavage |
HR1500- B2 B2 | Haier | SEDA 20183541642 | Biosafety cabinet |
| NAOH | MACKLIN | S817977 | Liquefy viscous lower respiratory tract sample |
| Nucleic acid detection kit for respiratory tract pathogens | Capitalbio Technology | SEDA 20173401346 | Testing for bacteria infection |
| Nucleic acid extraction reagent | Capitalbio Technology | SEDA 20160034 | For DNA extraction |
| RTisochip-W | Capitalbio Technology | SEDA 20193220539 | Loop-mediated Isothermal Amplification |
| THERMO ST16R | Thermo Fisher Scientific | SEDA 20180585 | Centrifuge the residual liquid off the wall of the tube. |
| Vortex mixer VM-5005 | JOANLAB | For mixing reagent |
Ссылки
- GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: A systematic analysis for the global burden of disease study 2016. Lancet Infect Dis. 18 (11), 1191-1210 (2018).
- Niederman, M. S., Torres, A. Respiratory infections. Eur Respir Rev. 31 (166), 220150(2022).
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: Transmission, colonization and invasion. Nat Rev Microbiol. 16 (6), 355-367 (2018).
- Watt, J. P., et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years_ global estimates. Lancet. 374 (9693), 903-911 (2009).
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat Rev Microbiol. 6 (4), 288-301 (2008).
- Popova, G., Boskovska, K., Arnaudova-Danevska, I., Smilevska-Spasova, O., Jakovska, T. Sputum quality assessment regarding sputum culture for diagnosing lower respiratory tract infections in children. Open Access Maced J Med Sci. 7 (12), 1926-1930 (2019).
- Nuyttens, H., Cyncynatus, C., Renaudin, H., Pereyre, S., Identification Bébéar, C. expression and serological evaluation of the recombinant ATP synthase beta subunit of mycoplasma pneumoniae. BMC Microbiol. 10 (1), 216(2010).
- Noviello, S., Huang, D. B. The basics and the advancements in diagnosis of bacterial lower respiratory tract infections. Diagnostics (Basel). 9 (2), 37(2019).
- Hanson, K. E., et al. Molecular testing for acute respiratory tract infections: Clinical and diagnostic recommendations from the IDSA's diagnostics committee. Clin Infect Dis. 71 (10), 2744-2751 (2020).
- Daniel Reynolds, J. P. B., et al. The threat of multidrug-resistant/extensively drug-resistant gram-negative respiratory infections: Another pandemic. Eur Respir Rev. 31 (166), 220068(2022).
- T Notomi, H. O., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 28 (12), 63(2000).
- Soroka, M., Wasowicz, B., Rymaszewska, A. Loop-mediated isothermal amplification (LAMP): The better sibling of PCR. Cells. 10 (8), 1931(2021).
- Mori, Y., Kitao, M., Tomita, N., Notomi, T. Real-time turbidimetry of lamp reaction for quantifying template DNA. Biophys J. 59 (2), 145-157 (2004).
- Parida, M., Sannarangaiah, S., Dash, P. K., Rao, P. V., Morita, K. Loop mediated isothermal amplification (LAMP): A new generation of innovative gene amplification technique: Perspectives in clinical diagnosis of infectious diseases. Rev Med Virol. 18 (6), 407-421 (2008).
- Chinese Medical Association Respiratory Branch Critical Care Medicine Group, Working Committee on Critical Care Medicine of the Chinese Physicians Association Respiratory Physicians Branch. Standardization of collection, submission, testing, and interpretation of bronchoalveolar lavage fluid in ICU patients. Chin J Tubere Respir Dis. 43 (9), 744-756 (2020).
- Koch, A. M., Nilsen, R. M., Eriksen, H. M., Cox, R. J., Harthug, S. Mortality related to hospital-associated infections in a tertiary hospital: Repeated cross-sectional studies between 2004-2011. Antimicrob Resist Infect Control. 4 (1), 57(2015).
- Seymour, C. W. F. G., et al. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 376 (23), 2235-2244 (2017).
- Choi, C. W., Hyun, J. W., Hwang, R. Y., Powell, C. A. Loop-mediated isothermal amplification assay for detection of candidatus Liberibacter asiaticus: A causal agent of citrus huanglongbing. Plant Pathol. 34 (6), 499-505 (2018).
- Büscher, P., Njiru, Z. K. Loop-mediated isothermal amplification technology: Towards point of care diagnostics. PLoS Negl Trop Dis. 6 (6), e1572(2012).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): Principle, features, and future prospects. J Microbiol. 53 (1), 1-5 (2015).
- Ajibola, O., Gulumbe, B., Eze, A., Obishakin, E. Tools for detection of schistosomiasis in resource limited settings. Medical Sciences. 6 (2), 39(2018).
- Kumar, Y. S. B., et al. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Compr Rev Food Sci Food SAF. 16 (6), 1359-1378 (2017).
- Hongling Ou, Y. W., et al. Rapid detection of multiple pathogens by the combined loop-mediated isothermal amplification technology and microfluidic chip technology. Ann Palliat Med. 10 (10), 11053-11066 (2021).
- Liang Wang, J. -X. L., et al. Quantitative polymerase chain reaction (qPCR)-based rapid diagnosis of helicobacter pylori infection and antibiotic resistance. J Vis Exp. (197), e65689(2023).
- Jing-Wen Lyu, B. X., et al. Rapid prediction of multidrug-resistant klebsiella pneumoniae through deep learning analysis of SERS spectra. Microbiol Spectr. 11 (2), e0412622(2023).
- Wei Liu, J. -W. T., et al. Discrimination between carbapenem-resistant and carbapenem-sensitive klebsiella pneumoniae strains through computational analysis of surface-enhanced Raman spectra a pilot study. Microbiol Spectr. 10 (1), e0240921(2022).
- Zhang, L. Y., et al. Classification and prediction of klebsiella pneumoniae strains with different MLST allelic profiles via SERS spectral analysis. Peer J. 11, e16161(2023).
- Zhi Liu, Q. Z., et al. Rapid and sensitive detection of salmonella in chickens using loop-mediated isothermal amplification combined with a lateral flow dipstick. J Microbiol Biotechnol. 29 (3), 454-464 (2019).
- Chen, F., et al. Fully Integrated microfluidic platform for multiplexed detection of hunov by a dynamic confined-space-implemented one-pot RPA-LAMP system. Adv Sci (Weinh). 21, e2306612(2023).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены