A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحضير جسيمات أكسيد الزنك النانوية وتقييم آثارها المضادة للبكتيريا
* These authors contributed equally
In This Article
Summary
في هذه الدراسة ، تم تصنيع جسيمات أكسيد الزنك النانوية باستخدام طريقة الترسيب. تم اختبار التأثير المضاد للبكتيريا للجسيمات المركبة ضد سلالات المكورات العنقودية الذهبية المقاومة للميثيسيلين المقاوم للأدوية المتعددة (MRSA) والسلالات البكتيرية Pseudomonas aeruginosa .
Abstract
أصبحت الالتهابات البكتيرية في المستشفيات صعبة بشكل متزايد بسبب مقاومتها المتأصلة للمضادات الحيوية. ويعزى ظهور سلالات بكتيرية مقاومة للأدوية المتعددة في المستشفيات إلى الاستخدام المكثف والمتنوع للمضادات الحيوية، مما يزيد من تفاقم مشكلة مقاومة المضادات الحيوية. تمت دراسة المواد النانوية المعدنية على نطاق واسع كحل بديل للقضاء على الخلايا البكتيرية المقاومة للمضادات الحيوية. تهاجم الجسيمات النانوية المعدنية الخلايا البكتيرية من خلال آليات مختلفة ، مثل إطلاق الأيونات المضادة للبكتيريا ، أو توليد أنواع الأكسجين التفاعلية ، أو الاضطراب المادي ، والتي لا تستطيع البكتيريا تطوير مقاومتها. من بين الجسيمات النانوية المعدنية المضادة للميكروبات التي تم بحثها بنشاط ، تشتهر جسيمات أكسيد الزنك النانوية ، المعتمدة من إدارة الغذاء والدواء ، بتوافقها الحيوي وخصائصها المضادة للبكتيريا. في هذه الدراسة ، ركزنا على تطوير طريقة ترسيب ناجحة لتوليف جسيمات أكسيد الزنك النانوية ، وتحليل خصائص هذه الجسيمات النانوية ، وإجراء اختبارات مضادة للميكروبات. تم توصيف جسيمات أكسيد الزنك النانوية باستخدام المجهر الإلكتروني النافذ (TEM) ، وتشتت الضوء الديناميكي (DLS) ، والتحليل الطيفي فوق البنفسجي / المرئي ، وحيود الأشعة السينية (XRD). أجريت اختبارات مضادة للبكتيريا باستخدام اختبار التخفيف الدقيق للمرق مع السلالات المقاومة للأدوية المتعددة للمكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) والزائفة الزنجارية. أظهرت هذه الدراسة إمكانات جسيمات أكسيد الزنك النانوية في تثبيط تكاثر البكتيريا المقاومة للمضادات الحيوية.
Introduction
تشكل العدوى البكتيرية المقاومة للأدوية المتعددة تهديدا عالميا كبيرا لصحة الإنسان1. نظرا لأن هذه العدوى يمكن أن تكون قاتلة في المرضى الذين يعانون من حالات كامنة ، فإن البحث النشط يحاول معالجة هذه المشكلة2. تطورت البكتيريا للتهرب من عمل الأدوية المختلفة. البنسلين ، المعروف على نطاق واسع وينسب إليه الفضل في إنقاذ ملايين الأرواح في جميع أنحاء العالم ، هو مضاد حيوي β-lactam يمنع تخليق جدار الخليةالبكتيرية 3. ومع ذلك ، فقد تطورت البكتيريا لتحييد فعالية الأدوية من خلال آليات مختلفة مثل مضخات التدفق ، أو تغيرات transpeptidase ، أو انخفاض النفاذية4. بالإضافة إلى ذلك ، يمكن للخلايا البكتيرية نقل جينات المقاومة هذه إلى الجيل التالي ، مما يزيد من معدلات البقاء على قيد الحياة للجيل اللاحق ويعزز مشكلة السلالات المقاومة5.
أدت الزيادة في البكتيريا المقاومة للمضادات الحيوية إلى ظهور بكتيريا MDR ، والتي تظهر عادة مقاومة للمضادات الحيوية المتعددة. غالبا ما تصادف سلالات MDR في المستشفيات ، حيث تتعرض سلالات بكتيرية متعددة وبالتالي تطور مقاومة للمضادات الحيويةالمختلفة 6. المكورات العنقودية الذهبية ، وخاصة المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) ، هي بكتيريا متعايشة إيجابية الجرام تشكل مجموعات على جلد ما يقرب من 30٪ من البشر 7,8. MRSA ، التي تم تحديدها لأول مرة في ستينيات القرن العشرين ، ويعرض انخفاض الحساسية للمضادات الحيوية β-lactam ، مما أدى إلى زيادة حادة في معدلات الإصابة منذ تسعينياتالقرن العشرين 9. من بين البكتيريا سالبة الجرام ، تعد Pseudomonas aeruginosa (P. aeruginosa) واحدة من أكثر السلالات انتشارا المكتسبة في المستشفيات. هذا النوع ، وهو بكتيريا اختيارية على شكل قضيب ، يسبب التهابات انتهازية في البشر10. وعلى وجه الخصوص، فإن سلالات الأدوية المتعددة التي تؤثر بشكل مباشر على صحة الإنسان مسؤولة عن أكثر من 50٪ من حالات العدوى المرتبطة بالرعايةالصحية11. في هذه الدراسة ، استخدمنا السلالات المقاومة للأدوية المتعددة الأكثر شيوعا داخل المستشفيات ، MRSA و P. aeruginosa.
تم التحقيق على نطاق واسع في استخدام الجسيمات النانوية (NPs) لأغراض مضادات الميكروبات لمعالجة مسألة مقاومة المضادات الحيوية. تحفز NPs المعدنية ، على وجه الخصوص ، موت الخلايا البكتيرية من خلال آليات مختلفة ، مما يوفر حلا محتملا لمشكلة مقاومة الأدوية. تمارس NPs المعدنية نشاطا مضادا للميكروبات من خلال آليات متعددة ، بما في ذلك إطلاق أيونات مضادات الميكروبات ، وتوليد أنواع الأكسجين التفاعلية (ROS) ، والتعطيل المادي للخلايا ، من بين وسائل أخرى12. تمتلك NPs المكونة من الفضة والنحاس وأكسيد الزنك (ZnO) وأكسيد التيتانيوم فعالية عالية مضادة للميكروبات وبالتالي يتم بحثها بنشاط13.
تمت الموافقة على ZnO NPs من قبل إدارة الغذاء والدواء الأمريكية (FDA) للاستخدام في البشر. على العكس من ذلك ، على الرغم من فعاليتها العالية في مضادات الميكروبات ، فإن استخدام NPs الفضية والنحاسية في البشر محدود بسبب سميتها الخلوية العالية. ومع ذلك ، توجد ZnO NPs بشكل شائع في الحياة اليومية وهي موجودة حتى في تركيبات واقية من الشمس المستخدمة على نطاق واسع14. تجدر الإشارة إلى أن أيونات Zn2+ المنبعثة من ZnO NPs فعالة للغاية في العلاج البكتيري ، مما يؤدي إلى موت الخلايا البكتيرية من خلال توليد أنواع الأكسجين التفاعلية وآليات الضرر المادي الأخرى15.
تحدد هذه الدراسة بروتوكول توليف جسيمات ZnO النانوية (NPs) باستخدام طريقة الترسيب وتقدم نهج اختبار مضاد للميكروبات باستخدام طريقة تخفيف المرق الدقيق مع عينات سريرية من MRSA و P. aeruginosa. تتضمن طريقة الترسيب ل ZnO NPs توليف ZnO NPs الصلبة غير القابلة للذوبان عن طريق ضبط الأس الهيدروجيني ودرجة الحرارة باستخدام السلائف القابلة للذوبان مثل أسيتات الزنك أو نترات الزنك16. إلى جانب الإنتاج السهل والسريع نسبيا ، تضمن هذه الطريقة التكرار في التوليف وتسهل التحكم في حجم الجسيمات والتشكل17. في بروتوكول التوليف هذا ، تم استخدام هيدروكسيد الصوديوم (NaOH) ، وهو أحد أكثر عوامل الترسيب شيوعا ، لترسيب أسيتات الزنك ، وتم استخدام كمية صغيرة من بروميد سداسي ديسيل ثلاثي ميثيل الأمونيوم (CTAB) لمنع التوليف غير المنضبط للجسيمات النانوية18. من بين الاختبارات المضادة للميكروبات المختلفة ، تم تقييم النشاط المضاد للبكتيريا لجسيمات ZnO النانوية باستخدام طريقة تخفيف المرق الدقيق ، والتي تتجنب التداخل البصري من جسيمات أكسيد المعادن النانوية وتمكن من قياس المستعمرة المباشر لتحديد MIC19.
Access restricted. Please log in or start a trial to view this content.
Protocol
يتم سرد الكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. تحضير جسيمات أكسيد الزنك النانوية
- قم بقياس 200 مل من الكحول الإيثيلي المطلق واسكبه في دورق زجاجي دائري القاع.
- ضع القارورة ذات القاع المستدير على عباءة تسخين وحافظ على التقليب عند 25-40 درجة مئوية.
- قياس 500 ملغ من CTAB في قارورة 50 مل وإضافته إلى الكحول الإيثيلي في القارورة. يقلب حتى يذوب CTAB تماما.
- أضف 1.4 غرام من أسيتات الزنك في المحلول وحركه حتى يذوب تماما.
- ارفع درجة حرارة المحلول عن طريق ضبط درجة حرارة عباءة التسخين على 70 درجة مئوية.
- أضف 25 مل من محلول 0.5 M NaOH إلى الخليط واتركه يتفاعل لمدة 1 ساعة حتى يصبح المحلول الصافي أبيض اللون.
- قسمة الحل إلى أنابيب مخروطية 50 مل ، وأجهزة الطرد المركزي في 15000 × غرام لمدة 15 دقيقة في درجة حرارة الغرفة ، ثم تجاهل طاف.
- أضف 10 مل من الماء المقطر إلى أحد الأنابيب المخروطية وأعد تعليق الجسيمات النانوية عن طريق صوتنة المحلول. انقل المحلول المعلق إلى أنبوب مخروطي مختلف يحتوي على حبيبات ZnO وكرر حتى يتم جمع جميع محاليل ZnO في أنبوب مخروطي واحد.
- اغسل الجسيمات النانوية من خلال الطرد المركزي عند 15000 × جم لمدة 15 دقيقة (درجة حرارة الغرفة) ، وأزل المادة الطافية ، وأعد تعليقها في الماء المقطر. تحقق من الرقم الهيدروجيني للمحلول الطافي باستخدام ورقة اختبار الأس الهيدروجيني وكرر حتى يصبح الرقم الهيدروجيني للمحلول متعادلا.
ملاحظة: عندما يصبح الرقم الهيدروجيني لمحلول المادة الطافية محايدا (الرقم الهيدروجيني = 7) ، تخلص من المحلول الطافي ولا تعيد تعليقه بالماء المقطر. - جفف لوح العينة بالمكنسة الكهربائية عند 60 درجة مئوية لمدة 24 ساعة واحصل على مسحوق ZnO NP.
2. اختبارات مضادة للبكتيريا باستخدام MRSA و P. aeruginosa
- الثقافة البكتيرية
ملاحظة: تم الحصول على السلالات البكتيرية السريرية MDR من مستشفى جامعة تشونغ آنغ ، سيول ، كوريا الجنوبية.- أخرج سلالات بكتيريا MRSA و P. aeruginosa المخزنة في مرق الصويا التربتيك (TSB) من الفريزر العميق.
- بعد إذابة المحاليل البكتيرية ، قم بخط المحلول على لوحة Tryptic Soy Agar (TSA) باستخدام حلقة تلقيح يمكن التخلص منها. ضع ألواح أجار مخططة في الحاضنة واحتضانها لمدة 24 ساعة.
ملاحظة: أضيفت مستعمرة واحدة منتقاة من صفيحة TSA إلى 10 مل من وسائط TSB في أنبوب مخروطي سعة 50 مل باستخدام حلقة تلقيح بكتيري. تم استزراع البكتيريا لمدة 24 ساعة. تم استزراع البكتيريا تحت ظروف الاستزراع الهوائي عند 37 درجة مئوية. - لقياس تركيز محلول البكتيريا ، قم بتخفيف المحلول المستزرع باستخدام تخفيف تسلسلي 10 أضعاف إلى 10-6 باستخدام الماء المقطر. بعد ذلك ، ضع 50 ميكرولتر من المحلول المخفف على ألواح TSA وانشر المحلول باستخدام مفرشة على شكل حرف L.
- احتضان لوحات في الحاضنة لمدة 24 ساعة.
ملاحظة: تم حساب المستعمرات بصريا ، وتم حساب تركيز المحلول المستزرع بضرب عوامل التخفيف في عدد المستعمرات التي تم حسابها.
- أخذ العينات البكتيرية
- لاختبار مجموعة واسعة من تركيزات ZnO ، قم بإعداد محلول ZnO NPs 2 مجم / مل باستخدام محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco وقم بإجراء تخفيف تسلسلي بمقدار ضعفين لعمل تركيزات مختلفة.
ملاحظة: تم اختبار 1000 ميكروغرام / مل ، 500 ميكروغرام / مل ، 250 ميكروغرام / مل ، 125 ميكروغرام / مل ، و 62.5 ميكروغرام / مل. - أضف 100 ميكرولتر لكل من التركيزات المختبرة ل ZnO NPs في لوحة 96 بئرا.
ملاحظة: استخدم ضعف (2x) من التركيز النهائي المطلوب من ZnO NPs ، حيث سيتم تخفيف كل عينة في البئر بإضافة 100 ميكرولتر من زراعة البكتيريا. استخدم محلول مضاد حيوي مضاد حيوي (A / A) بنسبة 2٪ كعنصر تحكم إيجابي و DPBS كعنصر تحكم سلبي. A / A هو مركب مضاد حيوي للبنسلين والستربتومايسين ، وهو فعال ضد البكتيريا إيجابية الجرام وسالبة الجرام ، على التوالي. - خفف المستنبتة البكتيرية إلى 1 × 106 CFU/mL باستخدام وسائط TSB وأضف 100 ميكرولتر إلى كل بئر يحتوي على تركيزات مختلفة من ZnO NPs.
ملاحظة: كانت تركيزات محلول الاستزراع الأولي ل MRSA و P. aeruginosa 3 × 109 CFU / mL. تم إجراء تركيز زراعة البكتيريا 1 × 106 CFU / mL بواسطة 1/20 و 1/150 تخفيف محلول الاستزراع. بعد الخلط مع 100 ميكرولتر من ZnO NPs ، سيكون التركيز النهائي للبكتيريا 5 × 105 CFU / mL. - ضع الصفيحة المكونة من 96 بئرا في حاضنة 37 درجة مئوية واحتضانها لمدة 24 ساعة.
- لاختبار مجموعة واسعة من تركيزات ZnO ، قم بإعداد محلول ZnO NPs 2 مجم / مل باستخدام محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco وقم بإجراء تخفيف تسلسلي بمقدار ضعفين لعمل تركيزات مختلفة.
- الانتشار البكتيري
- ماصة 100 ميكرولتر من كل بئر وإعداد مختلف التخفيفات التسلسلية 10 أضعاف حتى 10-6.
ملاحظة: أضف 100 ميكرولتر من ZnO NPs التي تحتوي على محلول بكتيري إلى 900 ميكرولتر من الماء المقطر المعقم وكرر 6 مرات. - ماصة 50 ميكرولتر من أربعة محاليل مخففة وتضاف إلى لوحات الوسائط TSA. استخدم مفرشة خلوية على شكل حرف L لنشر المعلق البكتيري على صفيحة أجار.
ملاحظة: استخدم التخفيفات 100 و 10-2 و 10-4 و 10-6 . إجراء جميع التجارب في ثلاث نسخ. انتشر حتى يتم امتصاص كل المحلول البكتيري على صفيحة أجار. - ضع ألواح الآجار في حاضنة 37 درجة مئوية واحتضانها لمدة 24 ساعة.
- ماصة 100 ميكرولتر من كل بئر وإعداد مختلف التخفيفات التسلسلية 10 أضعاف حتى 10-6.
- عد CFU البكتيرية
- حدد عامل تخفيف قابل للعد لكل مجموعة. ضع علامة على جميع المستعمرات في لوحة التخفيف القابلة للعد وأعد الحساب بحيث يصبح التركيز # من CFU / mL.
ملاحظة: يشير عامل التخفيف القابل للعد إلى اللوحات التي تحتوي على 20-100 CFU على لوحة فردية. نتائج التركيز المحسوبة في البداية # من CFU / 50 ميكرولتر. باستخدام لوحة الانتشار مع المحلول البكتيري غير المخفف ، حدد الحد الأدنى المحتمل لتركيز مبيد الجراثيم. - استخدم البيانات التي تم الحصول عليها لتمثيل النسبة المئوية للبكتيريا الحية بالنسبة لتلك الموجودة في السيطرة السلبية.
ملاحظة: النسبة المئوية للبكتيريا الحية (٪) =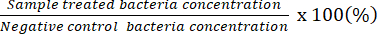
- حدد عامل تخفيف قابل للعد لكل مجموعة. ضع علامة على جميع المستعمرات في لوحة التخفيف القابلة للعد وأعد الحساب بحيث يصبح التركيز # من CFU / mL.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تأكيد التوليف الناجح ل ZnO NPs باستخدام المجهر الإلكتروني النافذ (TEM) ، كما هو موضح في الشكل 1A. لوحظ أن ZnO NPs التي تم الحصول عليها مستديرة الشكل ، بمتوسط حجم جسيم يبلغ 35.35 نانومتر وانحراف معياري يبلغ 6.81 نانومتر. لوحظ ترسيب هذه الجسيمات النانوية من خلال تفاعل ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تخليق ZnO NPs عن طريق هطول الأمطار بسيط نسبيا ومباشر. لتجميع ZnO NPs بنجاح باستخدام هذه الطريقة ، يعد التقليب أمرا بالغ الأهمية لضمان إذابة السلائف (أسيتات الزنك) بالكامل في المذيب. علاوة على ذلك ، تساعد زيادة درجة الحرارة على تحفيز تفاعل الإزاحة المزدوجة الناجح. في تخليق Z...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الدكتور جونغون تشوي هو الرئيس التنفيذي / المؤسس ، والدكتور يونغهيون تشوي هو الرئيس التنفيذي للتكنولوجيا في معهد فاينمان للتكنولوجيا في مؤسسة الطب النانوي.
Acknowledgements
تم دعم هذا البحث من خلال منحة أبحاث الدراسات العليا بجامعة Chung-Ang في عام 2022 (السيدة Gahyun Lee). تم دعم هذا العمل أيضا من خلال منحة المؤسسة الوطنية للبحوث الكورية (NRF) الممولة من الحكومة الكورية (MSIT) (رقم 2020R1A5A1018052) وبرنامج تطوير التكنولوجيا (RS202300261938) الممول من وزارة الشركات الصغيرة والمتوسطة والشركات الناشئة (MSS ، كوريا).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
References
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616(2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907(2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582(2022).
- Jiang, J. -H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300(2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441(2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. McNeil, S. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63(2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148(2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292(2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771(2023).
- Choi, K. -C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055(2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -L., Zhu, Y. -J., Wang, S. -W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452(2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500(2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved