A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת ננו-חלקיקים של תחמוצת אבץ והערכת ההשפעות האנטיבקטריאליות שלהם
* These authors contributed equally
In This Article
Summary
במחקר זה, ננו-חלקיקים של תחמוצת אבץ סונתזו בשיטת משקעים. ההשפעה האנטי-בקטריאלית של החלקיקים המסונתזים נבדקה כנגד זני חיידקים עמידים למתיצילין (MRSA) ו-Pseudomonas aeruginosa .
Abstract
זיהומים חיידקיים Nosocomial הפכו מאתגרים יותר ויותר בשל עמידותם הטבועה לאנטיביוטיקה. הופעתם של זני חיידקים עמידים לתרופות מרובות בבתי חולים מיוחסת לשימוש נרחב ומגוון באנטיביוטיקה, מה שמחמיר עוד יותר את בעיית העמידות לאנטיביוטיקה. ננו-חומרים מתכתיים נחקרו רבות כפתרון חלופי לחיסול תאי חיידקים עמידים לאנטיביוטיקה. ננו-חלקיקים מתכתיים תוקפים תאי חיידקים באמצעות מנגנונים שונים, כגון שחרור יונים אנטיבקטריאליים, יצירת מיני חמצן תגובתי או שיבוש פיזי, שכנגדו חיידקים אינם יכולים לפתח עמידות. בין חלקיקי המתכות האנטי-מיקרוביאליים שנחקרו באופן פעיל, ננו-חלקיקי תחמוצת אבץ, שאושרו על ידי ה-FDA, ידועים בתאימות הביולוגית שלהם ובתכונות האנטי-בקטריאליות שלהם. במחקר זה התמקדנו בפיתוח מוצלח של שיטת משקעים לסינתזה של ננו-חלקיקים של תחמוצת אבץ, ניתוח התכונות של ננו-חלקיקים אלה וביצוע בדיקות אנטי-מיקרוביאליות. ננו-חלקיקים של תחמוצת אבץ אופיינו באמצעות מיקרוסקופ אלקטרונים תמסורת (TEM), פיזור אור דינמי (DLS), ספקטרוסקופיה אולטרה סגולה/נראית לעין ועקיפה של קרני רנטגן (XRD). בדיקות אנטיבקטריאליות נערכו באמצעות בדיקת מיקרודילוציה של מרק עם זנים עמידים לתרופות מרובות של Staphylococcus aureus עמיד למתיצילין (MRSA) ו - Pseudomonas aeruginosa. מחקר זה הדגים את הפוטנציאל של ננו-חלקיקי תחמוצת אבץ בעיכוב התרבות חיידקים עמידים לאנטיביוטיקה.
Introduction
זיהומים חיידקיים עמידים לתרופות מרובות (MDR) מהווים איום עולמי משמעותי על בריאות האדם1. מכיוון שזיהומים אלה יכולים להיות קטלניים בחולים עם מחלות רקע, מחקר פעיל מנסה לטפל בבעיה זו2. חיידקים התפתחו כדי להתחמק מפעולה של תרופות שונות. פניצילין, הידוע ברבים ונזקף לזכותו כמי שהציל מיליוני חיים ברחבי העולם, הוא אנטיביוטיקה β-לקטם המעכבת את הסינתזה של דופן תא החיידק3. עם זאת, חיידקים התפתחו כדי לנטרל את היעילות של תרופות באמצעות מנגנונים שונים כגון משאבות efflux, שינויים transpeptidase, או חדירות מופחתת4. בנוסף, תאי חיידקים יכולים להעביר את גני העמידות הללו לדור הבא, להגדיל את שיעורי ההישרדות של הדור הבא ולחזק את בעיית הזנים העמידים5.
העלייה במספר החיידקים העמידים לאנטיביוטיקה הובילה להופעתם של חיידקי MDR, אשר בדרך כלל מפגינים עמידות לאנטיביוטיקה מרובה. זני MDR נתקלים בתדירות הגבוהה ביותר בבתי חולים, שם נחשפים זנים חיידקיים מרובים וכתוצאה מכך מפתחים עמידות לאנטיביוטיקה שונה6. סטפילוקוקוס זהוב, במיוחד S. aureus עמיד למתיצילין (MRSA), הוא חיידק קומנסלי גראם-חיובי היוצר אשכולות על העור של כ-30% מבני האדם 7,8. MRSA, שזוהה לראשונה בשנות השישים, מציג רגישות מופחתת לאנטיביוטיקה β-לקטם, וכתוצאה מכך עלייה חדה בשיעורי הזיהום מאז שנות התשעים9. בקרב חיידקים גראם-שליליים, Pseudomonas aeruginosa (P. aeruginosa) הוא אחד הזנים הנפוצים ביותר הנרכשים בבתי חולים. מין זה, חיידק פקולטטיבי בצורת מוט, גורם לזיהומים אופורטוניסטיים בבני אדם10. בפרט, זני MDR המשפיעים ישירות על בריאות האדם אחראים ליותר מ-50% מהזיהומים הקשורים לשירותי בריאות11. במחקר זה השתמשנו בזנים העמידים ביותר לתרופות בבתי חולים, MRSA ו-P. aeruginosa.
השימוש בננו-חלקיקים (NPs) למטרות אנטי-מיקרוביאליות נחקר בהרחבה כדי להתמודד עם נושא העמידות לאנטיביוטיקה. NPs מתכתיים, בפרט, גורמים למוות תאי חיידקים באמצעות מנגנונים שונים, ומציעים פתרון פוטנציאלי לבעיית העמידות לתרופות. NPs מתכתיים מפעילים פעילות אנטי-מיקרוביאלית באמצעות מנגנונים רבים, כולל שחרור יונים אנטי-מיקרוביאליים, יצירת מיני חמצן תגובתי (ROS) ושיבוש פיזי של תאים, בין אמצעים אחרים12. NPs המורכבים מכסף, נחושת, תחמוצת אבץ (ZnO) ותחמוצת טיטניום הם בעלי יעילות אנטי-מיקרוביאלית גבוהה ולכן נחקרים באופן פעיל13.
ZnO NPs אושרו על ידי מנהל המזון והתרופות האמריקני (FDA) לשימוש בבני אדם. לעומת זאת, למרות יעילותם האנטי-מיקרוביאלית הגבוהה, השימוש בכסף ובנחושת NPs בבני אדם מוגבל על ידי ציטוטוקסיות גבוהה שלהם. עם זאת, ZnO NPs נמצאים בדרך כלל בחיי היומיום והם אפילו נוכחים בפורמולות מסנני קרינה בשימוש נרחב14. יש לציין כי יוני Zn2+ המשתחררים מ-ZnO NPs יעילים מאוד בטיפול בחיידקים, וגורמים למוות תאי חיידקי באמצעות יצירת ROS ומנגנוני נזק פיזיים אחרים15.
מחקר זה מתאר את הפרוטוקול לסינתזה של ננו-חלקיקי ZnO (NPs) באמצעות שיטת משקעים ומציג גישת בדיקה אנטי-מיקרוביאלית באמצעות שיטת דילול מיקרו-מרק עם דגימות קליניות של MRSA ו-P. aeruginosa. שיטת המשקעים עבור NPs ZnO כוללת סינתזה של NPs מוצקים בלתי מסיסים של ZnO על ידי התאמת pH וטמפרטורה באמצעות קודמנים מסיסים כגון אבץ אצטט או אבץ חנקתי16. יחד עם ייצור קל ומהיר יחסית, שיטה זו מבטיחה חזרתיות בסינתזה ומקלה על שליטה בגודל החלקיקים ובמורפולוגיה17. בפרוטוקול סינתזה זה, נתרן הידרוקסידי (NaOH), אחד מסוכני המשקעים הנפוצים ביותר, נוצל כדי לזרז אבץ אצטט, וכמות קטנה של הקסדצילטרימתילאמוניום ברומיד (CTAB) שימשה כדי לעכב את הסינתזה הבלתי מבוקרת של ננו-חלקיקים18. בין הבדיקות האנטי-מיקרוביאליות השונות, הפעילות האנטי-בקטריאלית של ננו-חלקיקי ZnO הוערכה בשיטת דילול מיקרו-מרק, המונעת הפרעות אופטיות מננו-חלקיקי תחמוצת מתכת ומאפשרת מדידת מושבה ישירה לקביעת מיקרופון19.
Protocol
הריאגנטים והציוד ששימשו במחקר זה מפורטים בטבלת החומרים.
1. הכנת ננו-חלקיקי תחמוצת אבץ
- למדוד 200 מ"ל של אלכוהול אתילי מוחלט ולשפוך אותו לתוך בקבוק תחתון עגול זכוכית.
- מניחים את הבקבוק התחתון העגול על מעטפת חימום וממשיכים לערבב בטמפרטורה של 25-40 מעלות צלזיוס.
- למדוד 500 מ"ג של CTAB בבקבוקון 50 מ"ל ולהוסיף אותו אלכוהול אתילי בצלוחית. יש לערבב עד להמסה מוחלטת של CTAB.
- מוסיפים 1.4 גרם אבץ אצטט לתמיסה ומערבבים עד שהיא מומסת לחלוטין.
- העלה את טמפרטורת התמיסה על ידי הגדרת טמפרטורת מעטפת החימום ל -70 מעלות צלזיוס.
- הוסף 25 מ"ל של תמיסת 0.5 M NaOH לתערובת ותן לה להגיב במשך שעה אחת עד שתמיסה ברורה הופכת בצבע לבן.
- Aliquot את הפתרון 50 מ"ל צינורות חרוטיים, צנטריפוגה ב 15000 × גרם במשך 15 דקות בטמפרטורת החדר, ולאחר מכן להשליך את supernatant.
- הוסף 10 מ"ל מים מזוקקים לאחד הצינורות החרוטיים והשהה מחדש את הננו-חלקיקים על ידי סוניקציה של התמיסה. מעבירים את התמיסה המרחפת לצינור חרוטי אחר המכיל את גלולת ZnO וחוזרים על הפעולה עד שכל תמיסות ZnO נאספות בצינור חרוטי אחד.
- שטפו את הננו-חלקיקים באמצעות צנטריפוגה ב-15000 × גרם למשך 15 דקות (טמפרטורת החדר), הסירו את הסופר-נטנט והרחיפו מחדש במים מזוקקים. בדוק את ה- pH של תמיסת supernatant באמצעות נייר בדיקת pH וחזור על הפעולה עד שה- pH של התמיסה הופך ניטרלי.
הערה: כאשר ה- pH של תמיסת הסופרנאטנט הופך לנייטרלי (pH = 7), השליכו את תמיסת הסופרנאטנט ואל תשעו מחדש עם מים מזוקקים. - יש לייבש בוואקום את משטח הדגימה בטמפרטורה של 60°C למשך 24 שעות ולקבל את אבקת ZnO NP.
2. בדיקות אנטיבקטריאליות באמצעות MRSA ו- P. aeruginosa
- תרבית חיידקים
הערה: זני חיידקי MDR קליניים התקבלו מבית החולים האוניברסיטאי צ'ונג-אנג, סיאול, דרום קוריאה.- הוציאו מהמקפיא העמוק את זני החיידקים MRSA ו-P. aeruginosa המלאים בציר סויה טריפטי (TSB).
- לאחר הפשרת התמיסות החיידקיות, פזרו את התמיסה על צלחת אגר סויה טריפטית (TSA) באמצעות לולאת חיסון חד פעמית. מניחים את צלחות האגר המפוספסות באינקובטור ודגרים במשך 24 שעות.
הערה: מושבה אחת שנבחרה מצלחת TSA נוספה למדיה של 10 מ"ל TSB בצינור חרוטי של 50 מ"ל באמצעות לולאת חיסון חיידקית. חיידקים גודלו בתרבית במשך 24 שעות. חיידקים גודלו בתרבית בתנאי תרבית אירובית בטמפרטורה של 37 מעלות צלזיוס. - כדי למדוד את ריכוז תמיסת החיידקים, מדללים את התמיסה המתורבת באמצעות דילול סדרתי פי 10 עד פי 10-6 באמצעות מים מזוקקים. לאחר מכן, מניחים 50 μL של התמיסה המדוללת על לוחות TSA ומפזרים את התמיסה באמצעות מפזר בצורת L.
- לדגור על הצלחות באינקובטור במשך 24 שעות.
הערה: מושבות נספרו אופטית, וריכוז התמיסה המתורבת חושב על ידי הכפלת גורמי הדילול במספר המושבות שנספרו.
- דגימת חיידקים
- כדי לבדוק טווח רחב של ריכוזי ZnO, הכינו תמיסת ZnO NPs של 2 מ"ג/מ"ל באמצעות תמיסת מלח חוצצת פוספט (DPBS) של Dulbecco ובצעו דילול טורי פי 2 כדי לבצע ריכוזים שונים.
הערה: נבדקו 1000 מיקרוגרם/מ"ל, 500 מיקרוגרם/מ"ל, 250 מיקרוגרם/מ"ל, 125 מיקרוגרם/מ"ל ו-62.5 מיקרוגרם/מ"ל. - הוסף 100 μL עבור כל אחד מהריכוזים שנבדקו של NPs ZnO לצלחת של 96 בארות.
הערה: השתמש כפול (2x) מהריכוז הרצוי הסופי של ZnO NPs, מכיוון שכל דגימה בבאר תדולל בתוספת של 100 μL של תרבית חיידקים. השתמש בתמיסה אנטיביוטית-אנטי-מיקוטית (A/A) 2% כבקרה חיובית וב- DPBS כבקרה שלילית. A/A הוא קומפלקס אנטיביוטי של פניצילין וסטרפטומיצין, היעיל נגד חיידקים גראם-חיוביים וגראם-שליליים, בהתאמה. - לדלל את תרבית החיידקים ל 1 × 106 CFU/mL באמצעות מדיה TSB ולהוסיף 100 μL לכל באר המכילה ריכוזים שונים של NPs ZnO.
הערה: ריכוזי תמיסת התרבית הראשונית MRSA ו-P. aeruginosa היו 3 x 109 CFU/mL. ריכוז תרבית חיידקים 1 x 106 CFU/מ"ל נעשה על ידי דילול 1/20 ו 1/150 של תמיסת התרבית. לאחר ערבוב עם 100 μL של ZnO NPs, הריכוז הסופי של חיידקים יהיה 5 × 105 CFU/mL. - מניחים את הצלחת 96 בארות באינקובטור של 37 מעלות צלזיוס ודגרים במשך 24 שעות.
- כדי לבדוק טווח רחב של ריכוזי ZnO, הכינו תמיסת ZnO NPs של 2 מ"ג/מ"ל באמצעות תמיסת מלח חוצצת פוספט (DPBS) של Dulbecco ובצעו דילול טורי פי 2 כדי לבצע ריכוזים שונים.
- התפשטות חיידקים
- פיפטה 100 μL מכל באר ולהכין דילולים טוריים שונים פי 10 עד 10-6.
הערה: הוסף 100 μL של NPs ZnO המכילים תמיסה חיידקית לתוך 900 μL של מים מזוקקים מעוקרים וחזור על הפעולה 6 פעמים. - פיפטה 50 μL מארבע פתרונות מדוללים ולהוסיף לוחות מדיה TSA. השתמשו במפזר תאים בצורת L כדי לפזר את התרחיף החיידקי על צלחת האגר.
הערה: השתמש בדילולים 100, 10-2, 10-4 ו- 10-6 . לערוך את כל הניסויים משולש. מורחים עד שכל התמיסה החיידקית נספגת על צלחת האגר. - הכניסו את צלחות האגר לאינקובטור בטמפרטורה של 37 מעלות צלזיוס ודגרו במשך 24 שעות.
- פיפטה 100 μL מכל באר ולהכין דילולים טוריים שונים פי 10 עד 10-6.
- ספירת CFU חיידקית
- בחר גורם דילול שניתן לספור עבור כל קבוצה. סמן את כל המושבות בלוח הדילול הניתן לספירה, וחשב מחדש כך שהריכוז יהפוך ל- # של CFU/mL.
הערה: גורם הדילול הניתן לספירה מציין לוחות שיש להם 20-100 CFU על צלחת בודדת. תוצאות הריכוז שנספרו בתחילה # של Counted CFU/50 μL. באמצעות צלחת ההתפשטות עם תמיסת החיידקים הלא מדוללת, קבעו את ריכוז החיידקים המינימלי הפוטנציאלי. - השתמש בנתונים שהתקבלו כדי לייצג את אחוז החיידקים החיים ביחס לאלה שבבקרה השלילית.
הערה: אחוז החיידקים החיים (%) =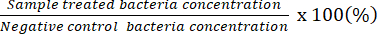
- בחר גורם דילול שניתן לספור עבור כל קבוצה. סמן את כל המושבות בלוח הדילול הניתן לספירה, וחשב מחדש כך שהריכוז יהפוך ל- # של CFU/mL.
תוצאות
הסינתזה המוצלחת של NPs ZnO אושרה באמצעות מיקרוסקופ אלקטרונים תמסורת (TEM), כפי שמוצג באיור 1A. NPs ZnO שהתקבלו נצפו עגולים בצורתם, עם גודל חלקיקים ממוצע של 35.35 ננומטר וסטיית תקן של 6.81 ננומטר. המשקעים של ננו-חלקיקים אלה נצפו באמצעות תגובת תזוזה כפולה על ידי הוספת תמי...
Discussion
הסינתזה של NPs ZnO באמצעות משקעים היא פשוטה יחסית ופשוטה. כדי לסנתז בהצלחה NPs ZnO בשיטה זו, ערבוב חיוני כדי להבטיח כי קודמן (אבץ אצטט) מומס במלואו בממס. יתר על כן, הגדלת הטמפרטורה מסייעת לגרום לתגובת עקירה כפולה מוצלחת. בסינתזה של NPs ZnO, ישנם גורמים רבים הקובעים את הגודל והצו...
Disclosures
ד"ר ג'ונגהון צ'וי הוא המנכ"ל/מייסד, וד"ר יונג-היון צ'וי הוא ה-CTO של מכון פיינמן לטכנולוגיה בתאגיד הננו-רפואה.
Acknowledgements
מחקר זה נתמך על ידי מלגת המחקר לתארים מתקדמים של אוניברסיטת צ'ונג-אנג בשנת 2022 (גב 'גאהיון לי). עבודה זו נתמכה גם על ידי מענק קרן המחקר הלאומית של קוריאה (NRF) שמומן על ידי ממשלת קוריאה (MSIT) (מס '2020R1A5A1018052) ועל ידי התוכנית לפיתוח טכנולוגיה (RS202300261938) במימון משרד העסקים הקטנים והבינוניים (MSS, קוריאה).
Materials
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
References
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved