È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione di nanoparticelle di ossido di zinco e valutazione dei loro effetti antibatterici
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo studio, le nanoparticelle di ossido di zinco sono state sintetizzate utilizzando un metodo di precipitazione. L'effetto antibatterico delle particelle sintetizzate è stato testato contro ceppi batterici multiresistenti di Staphylococcus aureus (MRSA) e Pseudomonas aeruginosa .
Abstract
Le infezioni batteriche nosocomiali sono diventate sempre più impegnative a causa della loro intrinseca resistenza agli antibiotici. La comparsa di ceppi batterici multiresistenti negli ospedali è stata attribuita all'uso esteso e variegato di antibiotici, aggravando ulteriormente il problema della resistenza agli antibiotici. I nanomateriali metallici sono stati ampiamente studiati come soluzione alternativa per l'eradicazione delle cellule batteriche resistenti agli antibiotici. Le nanoparticelle metalliche attaccano le cellule batteriche attraverso vari meccanismi, come il rilascio di ioni antibatterici, la generazione di specie reattive dell'ossigeno o la distruzione fisica, contro la quale i batteri non possono sviluppare resistenza. Tra le nanoparticelle metalliche antimicrobiche attivamente studiate, le nanoparticelle di ossido di zinco, approvate dalla FDA, sono note per la loro biocompatibilità e proprietà antibatteriche. In questo studio, ci siamo concentrati sullo sviluppo di un metodo di precipitazione per sintetizzare nanoparticelle di ossido di zinco, analizzare le proprietà di queste nanoparticelle e condurre test antimicrobici. Le nanoparticelle di ossido di zinco sono state caratterizzate utilizzando la microscopia elettronica a trasmissione (TEM), la diffusione dinamica della luce (DLS), la spettroscopia ultravioletta/visibile e la diffrazione dei raggi X (XRD). I test antibatterici sono stati condotti utilizzando il test di microdiluizione in brodo con i ceppi multiresistenti di Staphylococcus aureus resistente alla meticillina (MRSA) e Pseudomonas aeruginosa. Questo studio ha dimostrato il potenziale delle nanoparticelle di ossido di zinco nell'inibire la proliferazione di batteri resistenti agli antibiotici.
Introduzione
Le infezioni batteriche multiresistenti (MDR) rappresentano una minaccia globale significativa per la salute umana1. Poiché queste infezioni possono essere fatali nei pazienti con condizioni di base, la ricerca attiva sta tentando di affrontare questo problema2. I batteri si sono evoluti per eludere l'azione di vari farmaci. La penicillina, ampiamente conosciuta e accreditata per aver salvato milioni di vite in tutto il mondo, è un antibiotico β-lattamico che inibisce la sintesi della parete cellulare batterica3. Tuttavia, i batteri si sono evoluti per neutralizzare l'efficacia dei farmaci attraverso vari meccanismi come le pompe di efflusso, le alterazioni della transpeptidasi o la diminuzione della permeabilità4. Inoltre, le cellule batteriche possono trasmettere questi geni di resistenza alla generazione successiva, aumentando i tassi di sopravvivenza della generazione successiva e rafforzando il problema dei ceppi resistenti5.
L'aumento dei batteri resistenti agli antibiotici ha portato alla comparsa di batteri MDR, che comunemente mostrano resistenza a più antibiotici. I ceppi MDR si incontrano più frequentemente in ambito ospedaliero, dove più ceppi batterici sono esposti e di conseguenza sviluppano resistenza a diversi antibiotici6. Lo Staphylococcus aureus, in particolare lo S. aureus resistente alla meticillina (MRSA), è un batterio commensale gram-positivo che forma grappoli sulla pelle di circa il 30% degli esseri umani 7,8. L'MRSA, che è stato identificato per la prima volta negli anni '60, mostra una ridotta sensibilità agli antibiotici β-lattamici, con conseguente forte aumento dei tassi di infezionedagli anni '90. Tra i batteri gram-negativi, Pseudomonas aeruginosa (P. aeruginosa) è uno dei ceppi più diffusi acquisiti negli ospedali. Questa specie, un batterio facoltativo a forma di bastoncello, causa infezioni opportunistiche nell'uomo10. In particolare, i ceppi MDR che incidono direttamente sulla salute umana sono responsabili di oltre il 50 % delle infezioni associate all'assistenza sanitaria11. In questo studio, abbiamo utilizzato i ceppi multiresistenti più comunemente riscontrati negli ospedali, MRSA e P. aeruginosa.
L'uso di nanoparticelle (NP) per scopi antimicrobici è stato ampiamente studiato per affrontare il problema della resistenza agli antibiotici. Le NP metalliche, in particolare, inducono la morte cellulare batterica attraverso vari meccanismi, offrendo una potenziale soluzione al problema della resistenza ai farmaci. Le NP metalliche esercitano attività antimicrobica attraverso molteplici meccanismi, tra cui il rilascio di ioni antimicrobici, la generazione di specie reattive dell'ossigeno (ROS) e la distruzione fisica delle cellule, tra gli altri mezzi12. Le NP composte da argento, rame, ossido di zinco (ZnO) e ossido di titanio possiedono un'elevata efficacia antimicrobica e sono quindi oggetto di ricerca attiva13.
Le NP di ZnO sono state approvate dalla Food and Drug Administration (FDA) degli Stati Uniti per l'uso nell'uomo. Al contrario, nonostante la loro elevata efficacia antimicrobica, l'uso di NP di argento e rame nell'uomo è limitato dalla loro elevata citotossicità. Tuttavia, le NP di ZnO si trovano comunemente nella vita di tutti i giorni e sono persino presenti in formulazioni di creme solari ampiamente utilizzate14. Da notare che gli ioni Zn2+ rilasciati dalle NP di ZnO sono altamente efficaci nel trattamento batterico, inducendo la morte cellulare batterica attraverso la generazione di ROS e altri meccanismi di danno fisico15.
Questo studio delinea il protocollo per la sintesi di nanoparticelle di ZnO (NP) utilizzando un metodo di precipitazione e introduce un approccio di test antimicrobico utilizzando un metodo di diluizione con microbrodo con campioni clinici di MRSA e P. aeruginosa. Il metodo di precipitazione per le NP di ZnO prevede la sintesi di NP di ZnO solide insolubili regolando il pH e la temperatura utilizzando precursori solubili come l'acetato di zinco o il nitrato di zinco16. Oltre a una produzione relativamente facile e rapida, questo metodo garantisce la ripetibilità nella sintesi e facilita il controllo delle dimensioni e della morfologia delle particelle17. In questo protocollo di sintesi, l'idrossido di sodio (NaOH), uno degli agenti di precipitazione più comunemente usati, è stato utilizzato per precipitare l'acetato di zinco e una piccola quantità di bromuro di esadeciltrimetilammonio (CTAB) è stata impiegata per inibire la sintesi incontrollata delle nanoparticelle18. Tra i vari test antimicrobici, l'attività antibatterica delle nanoparticelle di ZnO è stata valutata utilizzando il metodo di diluizione del microbrodo, che evita l'interferenza ottica delle nanoparticelle di ossido di metallo e consente la misurazione diretta delle colonie per determinare il MIC19.
Protocollo
I reagenti e le attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Preparazione di nanoparticelle di ossido di zinco
- Misurare 200 ml di alcol etilico assoluto e versarlo in un pallone di vetro a fondo rotondo.
- Posizionare il pallone a fondo tondo su un mantello riscaldante e continuare ad agitare a 25-40 °C.
- Misurare 500 mg di CTAB in un flaconcino da 50 ml e aggiungerlo all'alcol etilico nel pallone. Mescolare fino a quando il CTAB non si sarà completamente sciolto.
- Aggiungere 1,4 g di acetato di zinco nella soluzione e mescolare fino a quando non è completamente sciolto.
- Aumentare la temperatura della soluzione impostando la temperatura del mantello riscaldante a 70 °C.
- Aggiungere 25 mL di soluzione di NaOH 0,5 M alla miscela e lasciarla agire per 1 ora fino a quando la soluzione limpida diventa di colore bianco.
- Aliquotare la soluzione in provette coniche da 50 mL, centrifugare a 15000 × g per 15 minuti a temperatura ambiente, quindi eliminare il surnatante.
- Aggiungere 10 ml di acqua distillata in una delle provette coniche e risospendere le nanoparticelle sonicando la soluzione. Trasferire la soluzione sospesa in un altro tubo conico contenente il pellet di ZnO e ripetere l'operazione fino a quando tutte le soluzioni di ZnO sono raccolte in un unico tubo conico.
- Lavare le nanoparticelle attraverso la centrifugazione a 15000 × g per 15 minuti (temperatura ambiente), rimuovere il surnatante e risospendere in acqua distillata. Controllare il pH della soluzione surnatante utilizzando carta per il test del pH e ripetere fino a quando il pH della soluzione diventa neutro.
NOTA: Quando il pH della soluzione surnatante diventa neutro (pH = 7), scartare la soluzione surnatante e non risospendere con acqua distillata. - Asciugare sottovuoto il pallet del campione a 60 °C per 24 ore e ottenere la polvere di ZnO NP.
2. Test antibatterici con MRSA e P. aeruginosa
- Coltura batterica
NOTA: I ceppi batterici clinici MDR sono stati ottenuti dal Chung-Ang University Hospital, Seoul, Corea del Sud.- Estrarre dal congelatore i ceppi batterici MRSA e P. aeruginosa contenuti nel brodo di soia triptico (TSB).
- Dopo aver scongelato le soluzioni batteriche, strisciare la soluzione su una piastra di Agar di Soia Triptica (TSA) utilizzando un anello di inoculazione monouso. Posizionare le piastre di agar striate nell'incubatrice e incubare per 24 ore.
NOTA: Una singola colonia prelevata dalla piastra TSA è stata aggiunta a 10 mL di terreno TSB in una provetta conica da 50 mL utilizzando un circuito di inoculazione batterica. I batteri sono stati coltivati per 24 ore. I batteri sono stati coltivati in condizioni di coltura aerobica a 37 °C. - Per misurare la concentrazione della soluzione batterica, diluire la soluzione coltivata utilizzando una diluizione seriale di 10 volte a 10-6 utilizzando acqua distillata. Successivamente, posizionare 50 μl della soluzione diluita sulle piastre TSA e stendere la soluzione utilizzando uno spandiconcime a forma di L.
- Incubare le piastre nell'incubatore per 24 ore.
NOTA: Le colonie sono state contate otticamente e la concentrazione della soluzione coltivata è stata calcolata moltiplicando i fattori di diluizione per il numero di colonie contate.
- Campionamento batterico
- Per testare un'ampia gamma di concentrazioni di ZnO, preparare una soluzione di NP di ZnO da 2 mg/mL utilizzando la soluzione salina tamponata con fosfato (DPBS) di Dulbecco ed eseguire una diluizione seriale di 2 volte per ottenere concentrazioni diverse.
NOTA: Sono stati testati 1000 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL e 62,5 μg/mL. - Aggiungere 100 μl per ciascuna delle concentrazioni testate di NP di ZnO in una piastra a 96 pozzetti.
NOTA: Utilizzare il doppio (2x) della concentrazione finale desiderata di NP di ZnO, poiché ogni campione nel pozzetto verrà diluito con l'aggiunta di 100 μL di coltura batterica. Utilizzare una soluzione antibiotico-antimicotica (A/A) al 2% come controllo positivo e DPBS come controllo negativo. A/A è un complesso antibiotico di penicillina e streptomicina, efficace rispettivamente contro i batteri gram-positivi e gram-negativi. - Diluire la coltura batterica a 1 × 106 CFU/mL utilizzando terreni TSB e aggiungere 100 μL a ciascun pozzetto contenente diverse concentrazioni di NNP di ZnO.
NOTA: Le concentrazioni iniziali della soluzione di coltura di MRSA e P. aeruginosa erano 3 x 109 CFU/mL. La concentrazione di coltura batterica 1 x 106 CFU/mL è stata ottenuta mediante diluizione 1/20 e 1/150 della soluzione di coltura. Dopo la miscelazione con 100 μL di NP di ZnO, la concentrazione finale di batteri sarà di 5 × 105 CFU/mL. - Collocare la piastra a 96 pozzetti in un incubatore a 37 °C e incubare per 24 ore.
- Per testare un'ampia gamma di concentrazioni di ZnO, preparare una soluzione di NP di ZnO da 2 mg/mL utilizzando la soluzione salina tamponata con fosfato (DPBS) di Dulbecco ed eseguire una diluizione seriale di 2 volte per ottenere concentrazioni diverse.
- Diffusione batterica
- Pipettare 100 μl da ciascun pozzetto e preparare varie diluizioni seriali da 10 volte fino a 10-6.
NOTA: Aggiungere 100 μL di NP di ZnO contenenti soluzione batterica in 900 μL di acqua distillata sterilizzata e ripetere 6 volte. - Pipettare 50 μl da quattro soluzioni diluite e aggiungerlo alle piastre dei terreni TSA. Utilizzare un divaricatore cellulare a forma di L per stendere la sospensione batterica sulla piastra di agar.
NOTA: Utilizzare le diluizioni 100, 10-2, 10-4 e 10-6 . Condurre tutti gli esperimenti in triplice copia. Distribuire fino a quando tutta la soluzione batterica non è assorbita sulla piastra di agar. - Posizionare le piastre di agar in un'incubatrice a 37 °C e incubare per 24 ore.
- Pipettare 100 μl da ciascun pozzetto e preparare varie diluizioni seriali da 10 volte fino a 10-6.
- Conteggio delle CFU batteriche
- Selezionare un fattore di diluizione che sia conteggiabile per ogni gruppo. Segnare tutte le colonie nella piastra di diluizione numerabile e ricalcolare in modo che la concentrazione diventi # di CFU/mL.
NOTA: Il fattore di diluizione numerabile indica piastre che hanno 20-100 CFU su una singola piastra. Risultati della concentrazione inizialmente contati # di CFU/50 μL. Utilizzando la piastra di diffusione con la soluzione batterica non diluita, determinare la potenziale concentrazione battericida minima. - Utilizzare i dati ottenuti per rappresentare la percentuale di batteri vivi rispetto a quelli nel controllo negativo.
NOTA: Percentuale di batteri vivi (%) =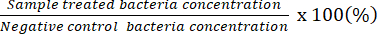
- Selezionare un fattore di diluizione che sia conteggiabile per ogni gruppo. Segnare tutte le colonie nella piastra di diluizione numerabile e ricalcolare in modo che la concentrazione diventi # di CFU/mL.
Risultati
Il successo della sintesi delle NP di ZnO è stato confermato utilizzando la microscopia elettronica a trasmissione (TEM), come mostrato nella Figura 1A. È stato osservato che le NP di ZnO ottenute sono di forma rotonda, con una dimensione media delle particelle di 35,35 nm e una deviazione standard di 6,81 nm. La precipitazione di queste nanoparticelle è stata osservata attraverso una reazione a doppio spostamento aggiungendo una soluzione di NaOH all'ace...
Discussione
La sintesi di NP di ZnO per precipitazione è relativamente semplice e diretta. Per sintetizzare con successo le NP di ZnO utilizzando questo metodo, l'agitazione è fondamentale per garantire che il precursore (acetato di zinco) sia completamente disciolto nel solvente. Inoltre, l'aumento della temperatura aiuta a indurre una reazione di doppio spostamento di successo. Nella sintesi delle NP di ZnO, ci sono molti fattori che determinano le dimensioni e la forma, tra cui l'agent...
Divulgazioni
Il Dr. Jonghoon Choi è l'Amministratore Delegato/Fondatore e il Dr. Yonghyun Choi è il CTO del Feynman Institute of Technology presso la Nanomedicine Corporation.
Riconoscimenti
Questa ricerca è stata supportata dalla borsa di studio per la ricerca universitaria della Chung-Ang University nel 2022 (Ms. Gahyun Lee). Questo lavoro è stato supportato anche dalla sovvenzione della National Research Foundation of Korea (NRF) finanziata dal governo coreano (MSIT) (n. 2020R1A5A1018052) e dal Programma di sviluppo tecnologico (RS202300261938) finanziato dal Ministero delle PMI e delle Startup (MSS, Corea).
Materiali
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
Riferimenti
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon