Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation de nanoparticules d’oxyde de zinc et évaluation de leurs effets antibactériens
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans cette étude, des nanoparticules d’oxyde de zinc ont été synthétisées à l’aide d’une méthode de précipitation. L’effet antibactérien des particules synthétisées a été testé contre des souches bactériennes de Staphylococcus aureus résistant à la méthicilline multirésistante (SARM) et de souches bactériennes Pseudomonas aeruginosa .
Résumé
Les infections bactériennes nosocomiales sont devenues de plus en plus difficiles en raison de leur résistance inhérente aux antibiotiques. L’émergence de souches bactériennes multirésistantes dans les hôpitaux a été attribuée à l’utilisation extensive et variée des antibiotiques, ce qui a encore exacerbé le problème de la résistance aux antibiotiques. Les nanomatériaux métalliques ont été largement étudiés comme solution alternative pour éradiquer les cellules bactériennes résistantes aux antibiotiques. Les nanoparticules métalliques attaquent les cellules bactériennes par divers mécanismes, tels que la libération d’ions antibactériens, la génération d’espèces réactives de l’oxygène ou la perturbation physique, contre laquelle les bactéries ne peuvent pas développer de résistance. Parmi les nanoparticules métalliques antimicrobiennes faisant l’objet d’une recherche active, les nanoparticules d’oxyde de zinc, qui sont approuvées par la FDA, sont connues pour leur biocompatibilité et leurs propriétés antibactériennes. Dans cette étude, nous nous sommes concentrés sur le développement d’une méthode de précipitation pour synthétiser des nanoparticules d’oxyde de zinc, analyser les propriétés de ces nanoparticules et effectuer des tests antimicrobiens. Les nanoparticules d’oxyde de zinc ont été caractérisées à l’aide de la microscopie électronique à transmission (MET), de la diffusion dynamique de la lumière (DLS), de la spectroscopie ultraviolette/visible et de la diffraction des rayons X (DRX). Des tests antibactériens ont été effectués à l’aide du test de microdilution en bouillon avec des souches multirésistantes de Staphylococcus aureus résistant à la méthicilline (SARM) et de Pseudomonas aeruginosa. Cette étude a démontré le potentiel des nanoparticules d’oxyde de zinc dans l’inhibition de la prolifération des bactéries résistantes aux antibiotiques.
Introduction
Les infections bactériennes multirésistantes (MR) constituent une menace mondiale importante pour la santé humaine1. Comme ces infections peuvent être mortelles chez les patients atteints de maladies sous-jacentes, des recherches actives tentent de résoudre ce problème2. Les bactéries ont évolué pour échapper à l’action de divers médicaments. La pénicilline, largement connue et créditée d’avoir sauvé des millions de vies dans le monde, est un antibiotique à β-lactamines qui inhibe la synthèse de la paroi cellulaire bactérienne3. Cependant, les bactéries ont évolué pour neutraliser l’efficacité des médicaments par divers mécanismes tels que les pompes à efflux, les altérations de la transpeptidase ou la diminution de la perméabilité4. De plus, les cellules bactériennes peuvent transmettre ces gènes de résistance à la génération suivante, augmentant ainsi les taux de survie de la génération suivante et renforçant le problème des souches résistantes5.
L’augmentation des bactéries résistantes aux antibiotiques a conduit à l’émergence de bactéries multirésistantes, qui présentent généralement une résistance à plusieurs antibiotiques. Les souches multirésistantes sont le plus souvent rencontrées en milieu hospitalier, où plusieurs souches bactériennes sont exposées à différents antibiotiques et développent par conséquent une résistance à ceux-ci6. Staphylococcus aureus, en particulier S. aureus résistant à la méthicilline (SARM), est une bactérie commensale à Gram positif qui forme des grappes sur la peau d’environ 30 % des humains 7,8. Le SARM, qui a été identifié pour la première fois dans les années 1960, présente une sensibilité réduite aux antibiotiques à β-lactamines, ce qui a entraîné une forte augmentation des taux d’infection depuisles années 19909. Parmi les bactéries à Gram négatif, Pseudomonas aeruginosa (P. aeruginosa) est l’une des souches les plus répandues acquises dans les hôpitaux. Cette espèce, une bactérie facultative en forme de bâtonnet, provoque des infections opportunistes chez l’homme10. En particulier, les souches multirésistantes qui affectent directement la santé humaine sont responsables de plus de 50 % des infections associées aux soins de santé11. Dans cette étude, nous avons utilisé les souches multirésistantes les plus couramment rencontrées dans les hôpitaux, le SARM et P. aeruginosa.
L’utilisation de nanoparticules (NP) à des fins antimicrobiennes a fait l’objet d’études approfondies pour s’attaquer au problème de la résistance aux antibiotiques. Les NP métalliques, en particulier, induisent la mort cellulaire bactérienne par divers mécanismes, offrant une solution potentielle au problème de la résistance aux médicaments. Les NP métalliques exercent une activité antimicrobienne par le biais de multiples mécanismes, notamment la libération d’ions antimicrobiens, la génération d’espèces réactives de l’oxygène (ROS) et la perturbation physique des cellules, entre autres moyens12. Les NP composés d’argent, de cuivre, d’oxyde de zinc (ZnO) et d’oxyde de titane possèdent une efficacité antimicrobienne élevée et font donc l’objet de recherches actives13.
Les NP ZnO ont été approuvés par la Food and Drug Administration (FDA) des États-Unis pour une utilisation chez l’homme. À l’inverse, malgré leur grande efficacité antimicrobienne, l’utilisation des nanoparticules d’argent et de cuivre chez l’homme est limitée par leur cytotoxicité élevée. Cependant, les NP ZnO sont couramment trouvés dans la vie quotidienne et sont même présents dans les formulations de protection solaire largement utilisées14. Il convient de noter que les ions Zn2+ libérés par les NP ZnO sont très efficaces dans le traitement bactérien, induisant la mort cellulaire bactérienne par la génération de ROS et d’autres mécanismes de dommages physiques15.
Cette étude décrit le protocole de synthèse des nanoparticules de ZnO (NP) à l’aide d’une méthode de précipitation et présente une approche d’essai antimicrobienne utilisant une méthode de dilution de microbouillon avec des échantillons cliniques de SARM et de P. aeruginosa. La méthode de précipitation des NP de ZnO consiste à synthétiser des NP de ZnO solides insolubles en ajustant le pH et la température à l’aide de précurseurs solubles tels que l’acétate de zinc ou le nitratede zinc 16. Associée à une production relativement facile et rapide, cette méthode assure la répétabilité de la synthèse et facilite le contrôle de la taille et de la morphologie des particules17. Dans ce protocole de synthèse, l’hydroxyde de sodium (NaOH), l’un des agents de précipitation les plus couramment utilisés, a été utilisé pour précipiter l’acétate de zinc, et une petite quantité de bromure d’hexadécyltriméthylammonium (CTAB) a été utilisée pour inhiber la synthèse incontrôlée des nanoparticules18. Parmi divers tests antimicrobiens, l’activité antibactérienne des nanoparticules de ZnO a été évaluée à l’aide de la méthode de dilution par microbouillon, qui évite les interférences optiques des nanoparticules d’oxyde métallique et permet de mesurer directement les colonies pour déterminer la CMI19.
Protocole
Les réactifs et l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation de nanoparticules d’oxyde de zinc
- Mesurer 200 ml d’alcool éthylique absolu et le verser dans une fiole en verre à fond rond.
- Placer la fiole à fond rond sur un ballon chauffant et maintenir l’agitation à 25-40 °C.
- Mesurer 500 mg de CTAB dans un flacon de 50 mL et l’ajouter à l’alcool éthylique dans la fiole. Remuer jusqu’à ce que le CTAB soit complètement dissous.
- Ajoutez 1,4 g d’acétate de zinc dans la solution et remuez jusqu’à ce qu’elle soit complètement dissoute.
- Augmentez la température de la solution en réglant la température du ballon chauffant à 70 °C.
- Ajouter 25 mL de solution de NaOH 0,5 M au mélange et laisser agir pendant 1 h jusqu’à ce que la solution claire devienne blanche.
- Prélever la solution dans des tubes coniques de 50 mL, centrifuger à 15000 × g pendant 15 min à température ambiante, puis jeter le surnageant.
- Ajoutez 10 ml d’eau distillée dans l’un des tubes coniques et remettez les nanoparticules en suspension en sonifiant la solution. Transférez la solution en suspension dans un autre tube conique contenant la pastille de ZnO et répétez l’opération jusqu’à ce que toutes les solutions de ZnO soient rassemblées dans un seul tube conique.
- Laver les nanoparticules par centrifugation à 15000 × g pendant 15 min (température ambiante), retirer le surnageant et remettre en suspension dans de l’eau distillée. Vérifiez le pH de la solution surnageante à l’aide d’un papier réactif et répétez l’opération jusqu’à ce que le pH de la solution devienne neutre.
REMARQUE : Lorsque le pH de la solution surnageante devient neutre (pH = 7), jetez la solution surnageante et ne la remettez pas en suspension avec de l’eau distillée. - Faites sécher la palette d’échantillons sous vide à 60 °C pendant 24 h et obtenez la poudre de ZnO NP.
2. Tests antibactériens à l’aide de SARM et de P. aeruginosa
- Culture bactérienne
REMARQUE : Des souches bactériennes cliniques MDR ont été obtenues à l’hôpital universitaire Chung-Ang, à Séoul, en Corée du Sud.- Sortez du congélateur les souches bactériennes de SARM et de P. aeruginosa stockées dans du bouillon de soja tryptique (BST).
- Après avoir décongelé les solutions bactériennes, étalez la solution sur une plaque de gélose tryptique de soja (TSA) à l’aide d’une boucle d’inoculation jetable. Placez les plaques de gélose striées dans l’incubateur et incubez pendant 24 h.
REMARQUE : Une seule colonie prélevée sur la plaque TSA a été ajoutée à 10 mL de milieu TSB dans un tube conique de 50 mL à l’aide d’une boucle d’inoculation bactérienne. Les bactéries ont été cultivées pendant 24 h. Les bactéries ont été cultivées dans des conditions de culture aérobie à 37 °C. - Pour mesurer la concentration de la solution bactérienne, diluez la solution de culture en utilisant une dilution en série de 10 fois à 10-6 avec de l’eau distillée. Ensuite, placez 50 μL de la solution diluée sur des plaques TSA et étalez la solution à l’aide d’un épandeur en forme de L.
- Incuber les plaques dans l’incubateur pendant 24 h.
REMARQUE : Les colonies ont été comptées optiquement, et la concentration de la solution cultivée a été calculée en multipliant les facteurs de dilution par le nombre de colonies comptées.
- Prélèvement bactérien
- Pour tester une large gamme de concentrations de ZnO, préparez une solution de 2 mg/mL de NPs de ZnO à l’aide de la solution saline tamponnée au phosphate de Dulbecco (DPBS) et effectuez une dilution en série de 2 fois pour obtenir différentes concentrations.
REMARQUE : 1000 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL et 62,5 μg/mL ont été testés. - Ajouter 100 μL pour chacune des concentrations testées de NP de ZnO dans une plaque à 96 puits.
REMARQUE : Utilisez le double (2x) de la concentration finale souhaitée de NP de ZnO, car chaque échantillon dans le puits sera dilué avec l’ajout de 100 μL de culture bactérienne. Utilisez une solution d’antibiotique-antimycosique (A/A) à 2 % comme témoin positif et DPBS comme témoin négatif. A/A est un complexe antibiotique de pénicilline et de streptomycine, qui est efficace contre les bactéries à Gram positif et à Gram négatif, respectivement. - Diluer la culture bactérienne à 1 × 10 à6 UFC/mL à l’aide d’un milieu TSB et ajouter 100 μL dans chaque puits contenant différentes concentrations de NP de ZnO.
REMARQUE : Les concentrations initiales de SARM et de solution de culture de P. aeruginosa étaient de 3 x 109 UFC/mL. La concentration de la culture bactérienne de 1 x 106 UFC/mL a été obtenue par dilution de 1/20 et 1/150 de la solution de culture. Après mélange avec 100 μL de NP de ZnO, la concentration finale de bactéries sera de 5 × 105 UFC/mL. - Placez la plaque à 96 puits dans un incubateur à 37 °C et incubez pendant 24 h.
- Pour tester une large gamme de concentrations de ZnO, préparez une solution de 2 mg/mL de NPs de ZnO à l’aide de la solution saline tamponnée au phosphate de Dulbecco (DPBS) et effectuez une dilution en série de 2 fois pour obtenir différentes concentrations.
- Propagation bactérienne
- Pipeter 100 μL de chaque puits et préparer diverses dilutions en série 10 fois jusqu’à 10-6.
REMARQUE : Ajouter 100 μL de NPs de ZnO contenant une solution bactérienne dans 900 μL d’eau distillée stérilisée et répéter l’opération 6 fois. - Pipeter 50 μL à partir de quatre solutions diluées et les ajouter aux plaques de support TSA. À l’aide d’un épandeur de cellules en forme de L, la suspension bactérienne est étalée sur la plaque de gélose.
REMARQUE : Utilisez les dilutions 100, 10-2, 10-4 et 10-6 . Mener toutes les expériences en trois exemplaires. Étalez jusqu’à ce que toute la solution bactérienne soit absorbée sur la plaque de gélose. - Placez les plaques de gélose dans un incubateur à 37 °C et incubez pendant 24 h.
- Pipeter 100 μL de chaque puits et préparer diverses dilutions en série 10 fois jusqu’à 10-6.
- Comptage des UFC bactériennes
- Sélectionnez un facteur de dilution dénombrable pour chaque groupe. Marquez toutes les colonies dans la plaque de dilution dénombrable et recalculez de manière à ce que la concentration devienne # d’UFC/mL.
REMARQUE : Le facteur de dilution dénombrable indique les plaques qui ont 20-100 UFC sur une plaque individuelle. La concentration initialement comptée donne # d’UFC/50 μL comptée. À l’aide de la plaque d’épandage avec la solution bactérienne non diluée, déterminer la concentration bactéricide minimale potentielle. - Utilisez les données obtenues pour représenter le pourcentage de bactéries vivantes par rapport à celles du témoin négatif.
REMARQUE : Pourcentage de bactéries vivantes (%) =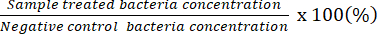
- Sélectionnez un facteur de dilution dénombrable pour chaque groupe. Marquez toutes les colonies dans la plaque de dilution dénombrable et recalculez de manière à ce que la concentration devienne # d’UFC/mL.
Résultats
La synthèse réussie des NPs de ZnO a été confirmée par microscopie électronique à transmission (MET), comme le montre la figure 1A. On a observé que les NP de ZnO obtenus étaient de forme ronde, avec une taille moyenne de particules de 35,35 nm et un écart-type de 6,81 nm. La précipitation de ces nanoparticules a été observée par une réaction de double déplacement par ajout d’une solution de NaOH à de l’acétate de zinc, où les ions Zn<...
Discussion
La synthèse des NP de ZnO par précipitation est relativement simple et directe. Pour réussir à synthétiser les NP de ZnO à l’aide de cette méthode, il est essentiel de remuer pour s’assurer que le précurseur (acétate de zinc) est complètement dissous dans le solvant. De plus, l’augmentation de la température aide à induire une réaction réussie de double déplacement. Dans la synthèse des NP de ZnO, de nombreux facteurs déterminent la taille et la forme, not...
Déclarations de divulgation
Le Dr Jonghoon Choi est le PDG/fondateur, et le Dr Yonghyun Choi est le directeur technique de l’Institut de technologie Feynman de la Nanomedicine Corporation.
Remerciements
Cette recherche a été soutenue par la bourse de recherche supérieure de l’Université Chung-Ang en 2022 (Mme Gahyun Lee). Ces travaux ont également été soutenus par la subvention de la Fondation nationale de recherche de Corée (NRF) financée par le gouvernement coréen (MSIT) (n° 2020R1A5A1018052) et par le Programme de développement technologique (RS202300261938) financé par le ministère des PME et des startups (MSS, Corée).
matériels
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
Références
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon