需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
氧化锌纳米颗粒的制备及其抗菌效果评价
* 这些作者具有相同的贡献
摘要
在本研究中,采用沉淀法合成了氧化锌纳米颗粒。对合成颗粒的抗菌效果进行了耐多重耐甲氧西林金 黄色葡萄球菌 (MRSA) 和 铜绿假单胞 菌菌株的抗菌效果测试。
摘要
由于医院内细菌感染对抗生素的固有耐药性,因此变得越来越具有挑战性。医院中出现多重耐药菌株归因于抗生素的广泛和多样化使用,进一步加剧了抗生素耐药性问题。金属纳米材料作为根除抗生素耐药细菌细胞的替代解决方案已被广泛研究。金属纳米颗粒通过各种机制攻击细菌细胞,例如释放抗菌离子、产生活性氧或物理破坏,细菌无法对这些机制产生耐药性。在积极研究的抗菌金属纳米颗粒中,获得 FDA 批准的氧化锌纳米颗粒以其生物相容性和抗菌特性而闻名。在这项研究中,我们专注于成功开发一种合成氧化锌纳米颗粒的沉淀方法,分析这些纳米颗粒的性质,并进行抗菌测试。使用透射电子显微镜 (TEM) 、动态光散射 (DLS) 、紫外/可见光谱和 X 射线衍射 (XRD) 对氧化锌纳米颗粒进行表征。使用肉汤微量稀释试验对耐甲氧西林金 黄色葡萄球菌 (MRSA) 和 铜绿假单胞菌的多重耐药菌株进行抗菌试验。这项研究证明了氧化锌纳米颗粒在抑制抗生素耐药细菌增殖方面的潜力。
引言
耐多药 (MDR) 细菌感染对人类健康构成重大的全球威胁1。由于这些感染对患有潜在疾病的患者可能是致命的,因此积极的研究正在尝试解决这个问题2。细菌已经进化到可以逃避各种药物的作用。青霉素是一种β-内酰胺类抗生素,广为人知,并被认为可以挽救全球数百万人的生命3。然而,细菌已经进化到通过各种机制(如外排泵、转肽酶改变或渗透性降低)来中和药物的疗效4。此外,细菌细胞可以将这些耐药基因传递给下一代,从而提高下一代的存活率并加强耐药菌株的问题5。
抗生素耐药细菌的增加导致了 MDR 细菌的出现,这些细菌通常对多种抗生素表现出耐药性。MDR 菌株最常见于医院环境中,在那里,多种细菌菌株暴露于医院环境中,因此对不同的抗生素产生耐药性6。金黄色葡萄球菌,尤其是耐甲氧西林金黄色葡萄球菌 (MRSA),是一种革兰氏阳性共生细菌,在大约 30% 的人类皮肤上形成簇状 7,8。MRSA 于 1960 年代首次被发现,对 β-内酰胺类抗生素的敏感性降低,导致自 1990 年代以来感染率急剧增加9。在革兰氏阴性菌中,铜绿假单胞菌 (P. aeruginosa) 是在医院获得的最普遍的菌株之一。该物种是一种兼性杆状细菌,可在人类中引起机会性感染10。特别是,直接影响人类健康的 MDR 菌株占医疗保健相关感染的 50%以上 11。在这项研究中,我们利用了医院中最常见的多重耐药菌株 MRSA 和铜绿假单胞菌。
为了解决抗生素耐药性问题,已对纳米颗粒 (NPs) 用于抗菌目的进行了广泛研究。特别是金属 NPs,通过各种机制诱导细菌细胞死亡,为耐药性问题提供了潜在的解决方案。金属 NP 通过多种机制发挥抗菌活性,包括抗菌离子的释放、活性氧 (ROS) 的产生和细胞的物理破坏等12。由银、铜、氧化锌 (ZnO) 和氧化钛组成的 NP 具有很高的抗菌功效,因此正在积极研究中13。
ZnO NP 已被美国食品和药物管理局 (FDA) 批准用于人类。相反,尽管银和铜 NP 具有很高的抗菌功效,但它们在人类中的使用受到其高细胞毒性的限制。然而,ZnO NP 常见于日常生活中,甚至存在于广泛使用的防晒霜配方中14。值得注意的是,ZnO NP 释放的 Zn2+ 离子在细菌处理中非常有效,通过产生 ROS 和其他物理损伤机制诱导细菌细胞死亡15。
本研究概述了使用沉淀法合成 ZnO 纳米颗粒 (NPs) 的方案,并介绍了一种使用微肉汤稀释法对 MRSA 和 铜绿假单胞菌临床样品的抗菌检测方法。ZnO NP 的沉淀法涉及通过使用可溶性前驱体(如乙酸锌或硝酸锌)调节 pH 值和温度来合成不溶性固体 ZnO NP16。除了相对简单和快速的生产外,该方法还确保了合成的可重复性,并有助于控制粒度和形态17。在该合成方案中,氢氧化钠 (NaOH) 是最常用的沉淀剂之一,用于沉淀乙酸锌,并使用少量十六烷基三甲基溴化铵 (CTAB) 来抑制纳米颗粒的不受控制的合成18。在各种抗菌试验中,使用微肉汤稀释法评估 ZnO 纳米颗粒的抗菌活性,该方法避免了金属氧化物纳米颗粒的光学干扰,并能够直接测量菌落以确定 MIC19。
研究方案
本研究中使用的试剂和设备列在 材料表中。
1. 氧化锌纳米颗粒的制备
- 量取 200 mL 无水乙醇,倒入玻璃圆底烧瓶中。
- 将圆底烧瓶放在加热套上,并保持在 25-40 °C 的搅拌。
- 在 50 mL 样品瓶中量取 500 mg CTAB,并将其添加到烧瓶中的乙醇中。搅拌至 CTAB 完全溶解。
- 在溶液中加入 1.4 g 乙酸锌并搅拌直至完全溶解。
- 通过将加热套温度设置为 70 °C 来提高溶液的温度。
- 向混合物中加入 25 mL 的 0.5 M NaOH 溶液,并让它反应 1 小时,直到透明溶液变成白色。
- 将溶液分装到 50 mL 锥形管中,在室温下以 15000 × g 离心 15 分钟,然后弃去上清液。
- 向其中一个锥形管中加入 10 mL 蒸馏水,并通过对溶液进行超声处理来重悬纳米颗粒。将悬浮溶液转移到含有 ZnO 沉淀的不同锥形管中,然后重复,直到所有 ZnO 溶液都收集在一个锥形管中。
- 通过在 15000 × g 离心 15 分钟(室温)洗涤纳米颗粒,去除上清液,并重悬于蒸馏水中。使用 pH 试纸检查上清液的 pH 值,然后重复直到溶液的 pH 值变为中性。
注:当上清液溶液的 pH 值变为中性 (pH = 7) 时,丢弃上清液,不要用蒸馏水重悬。 - 将样品托盘在 60 °C 下真空干燥 24 小时,得到 ZnO NP 粉末。
2. 使用 MRSA 和铜绿假单胞菌的抗菌测试
- 细菌培养
注:临床 MDR 细菌菌株购自韩国首尔中央大学医院。- 从深冰箱中取出胰蛋白酶大豆肉汤 (TSB) 中储存的 MRSA 和 铜绿假单 胞菌细菌菌株。
- 解冻细菌溶液后,使用一次性接种环将溶液划线到胰蛋白酶大豆琼脂 (TSA) 板上。将划线的琼脂平板放入培养箱中并孵育 24 小时。
注:使用细菌接种环将从 TSA 板中挑选的单个菌落添加到 50 mL 锥形管中的 10 mL TSB 培养基中。细菌培养 24 小时。细菌在 37 °C 的好氧培养条件下培养。 - 为了测量细菌溶液的浓度,使用蒸馏水将培养的溶液稀释 10 倍连续稀释至 10-6 。然后,将 50 μL 稀释溶液放在 TSA 板上,并使用 L 形铺展器铺展溶液。
- 将板在培养箱中孵育 24 小时。
注:对菌落进行光学计数,通过将稀释因子乘以计数的菌落数来计算培养液的浓度。
- 细菌采样
- 要测试各种 ZnO 浓度,请使用 Dulbecco 磷酸盐缓冲盐水 (DPBS) 制备 2 mg/mL ZnO NPs 溶液,并进行 2 倍连续稀释以获得不同的浓度。
注:检测了 1000 μg/mL、500 μg/mL、250 μg/mL、125 μg/mL 和 62.5 μg/mL。 - 将每种测试浓度的 ZnO NP 添加 100 μL 到 96 孔板中。
注:使用两倍 (2x) 最终所需浓度的 ZnO NP,因为孔中的每个样品都将通过添加 100 μL 细菌培养物进行稀释。使用 2% 抗生素 - 抗真菌 (A/A) 溶液作为阳性对照,使用 DPBS 作为阴性对照。A/A 是一种青霉素和链霉素抗生素复合物,分别对革兰氏阳性菌和革兰氏阴性菌有效。 - 使用 TSB 培养基将细菌培养物稀释至 1 × 106 CFU/mL,并向含有不同浓度 ZnO NP 的每个孔中加入 100 μL。
注:初始 MRSA 和 铜绿假单 胞菌培养液浓度为 3 x 109 CFU/mL。细菌培养浓度 1 x 106 CFU/mL 由 1/20 和 1/150 稀释培养液制成。与 100 μL ZnO NPs 混合后,细菌的最终浓度为 5 × 105 CFU/mL。 - 将 96 孔板置于 37 °C 培养箱中并孵育 24 小时。
- 要测试各种 ZnO 浓度,请使用 Dulbecco 磷酸盐缓冲盐水 (DPBS) 制备 2 mg/mL ZnO NPs 溶液,并进行 2 倍连续稀释以获得不同的浓度。
- 细菌传播
- 从每个孔中吸取 100 μL,并准备各种 10 倍连续稀释液,直至 10-6。
注:将 100 μL 含有细菌溶液的 ZnO NPs 加入 900 μL 无菌蒸馏水中,重复 6 次。 - 从四种稀释溶液中吸取 50 μL,并添加到 TSA 培养基板中。使用 L 形细胞扩散器将细菌悬浮液涂抹到琼脂平板上。
注:使用 100、10-2、10-4 和 10-6 稀释液。一式三份进行所有实验。铺展直到所有细菌溶液都被吸收到琼脂平板上。 - 将琼脂板放入 37 °C 培养箱中并孵育 24 小时。
- 从每个孔中吸取 100 μL,并准备各种 10 倍连续稀释液,直至 10-6。
- 细菌 CFU 计数
- 选择每个组可计数的稀释因子。在可计数稀释板中标记所有菌落并重新计算,使浓度变为 # of CFU/mL。
注:可计数稀释因子表示单个板上具有 20-100 CFU 的板。初始计数浓度结果 # 计数 CFU/50 μL。使用铺展板蘸有未稀释的细菌溶液,确定潜在的最低杀菌浓度。 - 使用获得的数据表示活细菌相对于阴性对照中细菌的百分比。
注:活菌百分比 (%) =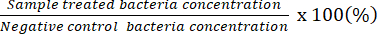
- 选择每个组可计数的稀释因子。在可计数稀释板中标记所有菌落并重新计算,使浓度变为 # of CFU/mL。
结果
使用透射电子显微镜 (TEM) 证实了 ZnO NPs 的成功合成,如图 1A 所示。观察到获得的 ZnO NPs 呈圆形,平均粒径为 35.35 nm,标准差为 6.81 nm。通过向乙酸锌中加入 NaOH 溶液的双置换反应观察到这些纳米颗粒的沉淀,其中 Zn2+ 离子发生水解。
使用动态光散射 (DLS),合成纳米颗粒的平均尺寸和 zeta 电位分别为 130.4 nm 和 28.92 ...
讨论
通过沉淀合成 ZnO NPs 相对简单明了。要使用这种方法成功合成 ZnO NPs,搅拌对于确保前驱体(乙酸锌)完全溶解在溶剂中至关重要。此外,提高温度有助于诱导成功的双置换反应。在 ZnO NPs 的合成中,决定大小和形状的因素很多,包括沉淀剂、沉淀剂的浓度和表面活性剂。使用 NaOH 以外的沉淀剂会改变颗粒形状。正如 Gharpure 等人报道的那样25,当?...
披露声明
Jonghoon Choi 博士是 Nanomedicine Corporation 费曼理工学院的首席执行官/创始人,Yonghyun Choi 博士是 The Nanomedicine Corporation 的 Feynman Institute of Technology 的首席技术官。
致谢
这项研究得到了 2022 年中央大学研究生研究奖学金(Gahyun Lee 女士)的支持。这项工作还得到了韩国政府 (MSIT) 资助的韩国国家研究基金会 (NRF) 资助(编号 2020R1A5A1018052)和中小企业和初创企业部(MSS,韩国)资助的技术开发计划 (RS202300261938) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
参考文献
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。