Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Çinko Oksit Nanopartiküllerinin Hazırlanması ve Antibakteriyel Etkilerinin Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışmada, çinko oksit nanopartikülleri bir çökeltme yöntemi kullanılarak sentezlenmiştir. Sentezlenen partiküllerin antibakteriyel etkisi, çoklu ilaca dirençli metisiline dirençli Staphylococcus aureus (MRSA) ve Pseudomonas aeruginosa bakteri suşlarına karşı test edilmiştir.
Özet
Nozokomiyal bakteriyel enfeksiyonlar, antibiyotiklere karşı doğal dirençleri nedeniyle giderek daha zor hale gelmiştir. Hastanelerde çoklu ilaca dirençli bakteri suşlarının ortaya çıkması, antibiyotiklerin yaygın ve çeşitli kullanımına bağlanmış ve antibiyotik direnci sorununu daha da kötüleştirmiştir. Metal nanomalzemeler, antibiyotiğe dirençli bakteri hücrelerini yok etmek için alternatif bir çözüm olarak geniş çapta incelenmiştir. Metalik nanopartiküller, antibakteriyel iyonların salınması, reaktif oksijen türlerinin oluşumu veya bakterilerin direnç geliştiremediği fiziksel bozulma gibi çeşitli mekanizmalar yoluyla bakteri hücrelerine saldırır. Aktif olarak araştırılan antimikrobiyal metal nanopartikülleri arasında FDA onaylı olan çinko oksit nanopartikülleri, biyouyumlulukları ve antibakteriyel özellikleri ile bilinmektedir. Bu çalışmada, çinko oksit nanopartiküllerinin sentezlenmesi, bu nanopartiküllerin özelliklerinin analiz edilmesi ve antimikrobiyal testlerin yapılması için başarılı bir çökeltme yöntemi geliştirmeye odaklandık. Çinko oksit nanopartikülleri, transmisyon elektron mikroskobu (TEM), dinamik ışık saçılımı (DLS), ultraviyole/görünür spektroskopi ve X-ışını kırınımı (XRD) kullanılarak karakterize edildi. Antibakteriyel testler, metisiline dirençli Staphylococcus aureus (MRSA) ve Pseudomonas aeruginosa'nın çoklu ilaca dirençli suşları ile et suyu mikrodilüsyon testi kullanılarak gerçekleştirildi. Bu çalışma, çinko oksit nanopartiküllerinin antibiyotiğe dirençli bakterilerin çoğalmasını engelleme potansiyelini göstermiştir.
Giriş
Çoklu ilaca dirençli (MDR) bakteriyel enfeksiyonlar, insan sağlığı için önemli bir küresel tehdit oluşturmaktadır1. Bu enfeksiyonlar altta yatan rahatsızlıkları olan hastalarda ölümcül olabileceğinden, aktif araştırmalar bu sorunu ele almaya çalışmaktadır2. Bakteriler, çeşitli ilaçların etkisinden kaçmak için evrimleşmiştir. Yaygın olarak bilinen ve dünya çapında milyonlarca hayat kurtarmasıyla tanınan penisilin, bakteri hücre duvarınınsentezini engelleyen β-laktam bir antibiyotiktir 3. Bununla birlikte, bakteriler, akış pompaları, transpeptidaz değişiklikleri veya azalmış geçirgenlik gibi çeşitli mekanizmalar yoluyla ilaçların etkinliğini nötralize etmek için evrimleşmiştir4. Ek olarak, bakteri hücreleri bu direnç genlerini bir sonraki nesle iletebilir, bu da bir sonraki neslin hayatta kalma oranlarını arttırır ve dirençli suşlar problemini güçlendirir5.
Antibiyotiğe dirençli bakterilerin artması, yaygın olarak çoklu antibiyotiğe direnç gösteren MDR bakterilerinin ortaya çıkmasına neden olmuştur. ÇİD suşlarına en sık hastane ortamlarında rastlanır, burada birden fazla bakteri suşuna maruz kalınır ve sonuç olarak farklı antibiyotiklere direnç gelişir6. Staphylococcus aureus, özellikle metisiline dirençli S. aureus (MRSA), insanların yaklaşık %30'unun cildinde kümeler oluşturan gram pozitif kommensal bir bakteridir 7,8. İlk olarak 1960'larda tanımlanan MRSA, β-laktam antibiyotiklere karşı azalmış duyarlılık sergiler ve bu da 1990'lardan bu yana enfeksiyon oranlarında keskin bir artışa neden olur9. Gram negatif bakteriler arasında, Pseudomonas aeruginosa (P. aeruginosa) hastanelerde edinilen en yaygın suşlardan biridir. Fakültatif çubuk şeklinde bir bakteri olan bu tür, insanlarda fırsatçı enfeksiyonlara neden olur10. Özellikle, insan sağlığını doğrudan etkileyen MDR suşları, sağlık hizmetleriyle ilişkili enfeksiyonların %50'sinden fazlasından sorumludur11. Bu çalışmada hastanelerde en sık karşılaşılan çoklu ilaca dirençli suşlar olan MRSA ve P. aeruginosa kullanıldı.
Nanopartiküllerin (NP'ler) antimikrobiyal amaçlar için kullanımı, antibiyotik direnci sorununun üstesinden gelmek için kapsamlı bir şekilde araştırılmıştır. Özellikle metalik NP'ler, çeşitli mekanizmalar yoluyla bakteriyel hücre ölümüne neden olarak ilaç direnci sorununa potansiyel bir çözüm sunar. Metalik NP'ler, diğer yolların yanı sıra antimikrobiyal iyonların salınması, reaktif oksijen türlerinin (ROS) üretilmesi ve hücrelerin fiziksel olarak bozulması dahil olmak üzere çoklu mekanizmalar yoluyla antimikrobiyal aktivite uygular12. Gümüş, bakır, çinko oksit (ZnO) ve titanyum oksitten oluşan NP'ler yüksek antimikrobiyal etkinliğe sahiptir ve bu nedenle aktif olarak araştırılmaktadır13.
ZnO NP'ler, insanlarda kullanım için ABD Gıda ve İlaç Dairesi (FDA) tarafından onaylanmıştır. Tersine, yüksek antimikrobiyal etkinliklerine rağmen, insanlarda gümüş ve bakır NP'lerin kullanımı, yüksek sitotoksisiteleri ile sınırlıdır. Bununla birlikte, ZnO NP'ler günlük yaşamda yaygın olarak bulunur ve yaygın olarak kullanılan güneş koruyucu formülasyonlarda bile bulunur14. Dikkat çekici bir şekilde, ZnO NP'lerden salınan Zn2 + iyonları, bakteriyel tedavide oldukça etkilidir ve ROS oluşumu ve diğer fiziksel hasar mekanizmaları15 yoluyla bakteriyel hücre ölümüne neden olur.
Bu çalışma, bir çökeltme yöntemi kullanılarak ZnO nanopartiküllerinin (NP'ler) sentezlenmesi için protokolün ana hatlarını çizmekte ve MRSA ve P. aeruginosa'nın klinik örnekleri ile bir mikrobroth seyreltme yöntemi kullanan bir antimikrobiyal test yaklaşımı sunmaktadır. ZnO NP'ler için çökeltme yöntemi, çinko asetat veya çinko nitrat16 gibi çözünür öncüler kullanılarak pH ve sıcaklığı ayarlayarak çözünmeyen katı ZnO NP'lerin sentezlenmesini içerir. Nispeten kolay ve hızlı üretimin yanı sıra, bu yöntem sentezde tekrarlanabilirliği sağlar ve parçacık boyutu ve morfolojisi üzerinde kontrolü kolaylaştırır17. Bu sentez protokolünde, çinko asetatı çökeltmek için en yaygın kullanılan çökeltme ajanlarından biri olan sodyum hidroksit (NaOH) kullanıldı ve nanopartiküllerin18 kontrolsüz sentezini inhibe etmek için az miktarda hekzadesiltrimetilamonyum bromür (CTAB) kullanıldı. Çeşitli antimikrobiyal testler arasında, ZnO nanopartiküllerinin antibakteriyel aktivitesi, metal oksit nanopartiküllerinden optik paraziti önleyen ve MIC19'u belirlemek için doğrudan koloni ölçümünü mümkün kılan mikrobroth seyreltme yöntemi kullanılarak değerlendirildi.
Protokol
Bu çalışmada kullanılan reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir.
1. Çinko oksit nanopartiküllerinin hazırlanması
- 200 mL mutlak etil alkolü ölçün ve cam yuvarlak tabanlı bir şişeye dökün.
- Yuvarlak tabanlı şişeyi bir ısıtma mantosu üzerine yerleştirin ve 25-40 °C'de karıştırmaya devam edin.
- 50 mL'lik bir şişede 500 mg CTAB ölçün ve şişedeki etil alkole ekleyin. CTAB tamamen eriyene kadar karıştırın.
- Çözeltiye 1.4 g çinko asetat ekleyin ve tamamen eriyene kadar karıştırın.
- Isıtma mantosu sıcaklığını 70 °C'ye ayarlayarak çözeltinin sıcaklığını yükseltin.
- Karışıma 25 mL 0.5 M NaOH çözeltisi ekleyin ve berrak çözelti beyaz renk alana kadar 1 saat reaksiyona girmesine izin verin.
- Çözeltiyi 50 mL konik tüplere alın, oda sıcaklığında 15 dakika boyunca 15000 × g'da santrifüjleyin ve ardından süpernatanı atın.
- Konik tüplerden birine 10 mL damıtılmış su ekleyin ve çözeltiyi sonikleştirerek nanopartikülleri yeniden süspanse edin. Askıda kalan çözeltiyi ZnO peletini içeren farklı bir konik tüpe aktarın ve tüm ZnO çözeltileri tek bir konik tüpte toplanana kadar tekrarlayın.
- Nanopartikülleri 15000 × g'da 15 dakika (oda sıcaklığında) santrifüjleme yoluyla yıkayın, süpernatanı çıkarın ve damıtılmış suda yeniden süspanse edin. pH test kağıdı kullanarak süpernatan çözeltinin pH'ını kontrol edin ve çözeltinin pH'ı nötr olana kadar tekrarlayın.
NOT: Süpernatant çözeltinin pH'ı nötr hale geldiğinde (pH = 7), süpernatan çözeltiyi atın ve damıtılmış su ile yeniden süspanse etmeyin. - Numune paletini 60 °C'de 24 saat vakumla kurutun ve ZnO NP tozunu elde edin.
2. MRSA ve P. aeruginosa kullanılarak yapılan antibakteriyel testler
- Bakteri kültürü
NOT: Klinik MDR bakteri suşları, Güney Kore'nin Seul kentindeki Chung-Ang Üniversite Hastanesi'nden elde edilmiştir.- Triptik Soya Suyu (TSB) içinde stoklanan MRSA ve P. aeruginosa bakteri türlerini derin dondurucudan çıkarın.
- Bakteriyel çözeltileri çözdükten sonra, çözeltiyi tek kullanımlık bir aşılama döngüsü kullanarak bir Triptik Soya Agar (TSA) plakasına sürün. Çizgili agar plakalarını inkübatöre yerleştirin ve 24 saat inkübe edin.
NOT: TSA plakasından alınan tek bir koloni, bir bakteri aşılama halkası kullanılarak 50 mL'lik konik bir tüpte 10 mL TSB ortamına eklendi. Bakteriler 24 saat boyunca kültürlendi. Bakteriler aerobik kültür koşulları altında 37 °C'de kültürlendi. - Bakteri çözeltisinin konsantrasyonunu ölçmek için, kültürlenmiş çözeltiyi 10 kat seri seyreltme kullanarak damıtılmış su kullanarak 10-6'ya seyreltin. Daha sonra, seyreltilmiş çözeltinin 50 μL'sini TSA plakalarına yerleştirin ve çözeltiyi L şeklinde bir yayıcı kullanarak yayın.
- Plakaları inkübatörde 24 saat inkübe edin.
NOT: Koloniler optik olarak sayıldı ve kültürlenmiş çözeltinin konsantrasyonu, seyreltme faktörlerinin sayılan koloni sayısı ile çarpılmasıyla hesaplandı.
- Bakteri örneklemesi
- Çok çeşitli ZnO konsantrasyonlarını test etmek için, Dulbecco'nun Fosfat Tamponlu Tuzlu Suyunu (DPBS) kullanarak 2 mg / mL ZnO NP çözeltisi hazırlayın ve farklı konsantrasyonlar yapmak için 2 kat seri seyreltme gerçekleştirin.
NOT: 1000 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL ve 62.5 μg/mL test edildi. - Test edilen ZnO NP konsantrasyonlarının her biri için 96 oyuklu bir plakaya 100 μL ekleyin.
NOT: Kuyucuktaki her numune 100 μL bakteri kültürü ilavesiyle seyreltileceğinden, istenen nihai ZnO NP konsantrasyonunun iki katını (2x) kullanın. Pozitif kontrol olarak% 2 Antibiyotik-Antimikotik (A / A) çözeltisi ve negatif kontrol olarak DPBS kullanın. A/A, sırasıyla gram pozitif ve gram negatif bakterilere karşı etkili olan bir penisilin ve streptomisin antibiyotik kompleksidir. - TSB ortamı kullanarak bakteri kültürünü 1 × 106 CFU / mL'ye seyreltin ve farklı konsantrasyonlarda ZnO NP'leri içeren her bir oyuğa 100 μL ekleyin.
NOT: İlk MRSA ve P. aeruginosa kültür çözeltisi konsantrasyonları 3 x 109 CFU/mL idi. Bakteri kültürü konsantrasyonu 1 x 106 CFU/mL, kültür çözeltisinin 1/20 ve 1/150 seyreltilmesiyle yapılmıştır. 100 μL ZnO NP ile karıştırıldıktan sonra, nihai bakteri konsantrasyonu 5 × 105 CFU/mL olacaktır. - 96 oyuklu plakayı 37 °C'lik bir inkübatöre yerleştirin ve 24 saat inkübe edin.
- Çok çeşitli ZnO konsantrasyonlarını test etmek için, Dulbecco'nun Fosfat Tamponlu Tuzlu Suyunu (DPBS) kullanarak 2 mg / mL ZnO NP çözeltisi hazırlayın ve farklı konsantrasyonlar yapmak için 2 kat seri seyreltme gerçekleştirin.
- Bakteri yayılması
- Her oyuktan 100 μL pipetleyin ve 10-6 yılına kadar çeşitli 10 kat seri seyreltmeler hazırlayın.
NOT: 900 μL sterilize edilmiş damıtılmış suya bakteriyel çözelti içeren 100 μL ZnO NP ekleyin ve 6 kez tekrarlayın. - Dört seyreltilmiş çözeltiden 50 μL pipetleyin ve TSA ortam plakalarına ekleyin. Bakteriyel süspansiyonu agar plakasına yaymak için L şeklinde bir hücre yayıcı kullanın.
NOT: 100, 10-2, 10-4 ve 10-6 seyreltmelerini kullanın. Tüm deneyleri üç nüsha halinde yapın. Tüm bakteri çözeltisi agar plakasına emilene kadar yayın. - Agar plakalarını 37 °C'lik bir inkübatöre yerleştirin ve 24 saat inkübe edin.
- Her oyuktan 100 μL pipetleyin ve 10-6 yılına kadar çeşitli 10 kat seri seyreltmeler hazırlayın.
- Bakteriyel CFU sayımı
- Her grup için sayılabilen bir seyreltme faktörü seçin. Sayılabilir seyreltme plakasındaki tüm kolonileri işaretleyin ve konsantrasyon # CFU/mL olacak şekilde yeniden hesaplayın.
NOT: Sayılabilir seyreltme faktörü, tek bir plaka üzerinde 20-100 CFU olan plakaları gösterir. Başlangıçta sayılan konsantrasyon sonuçları # Sayılan CFU / 50 μL. Seyreltilmemiş bakteri çözeltisi ile yayılmış plakayı kullanarak, potansiyel minimum bakterisidal konsantrasyonu belirleyin. - Negatif kontroldekilere göre canlı bakteri yüzdesini temsil etmek için elde edilen verileri kullanın.
NOT: Canlı bakteri yüzdesi (%) =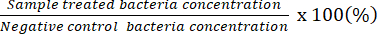
- Her grup için sayılabilen bir seyreltme faktörü seçin. Sayılabilir seyreltme plakasındaki tüm kolonileri işaretleyin ve konsantrasyon # CFU/mL olacak şekilde yeniden hesaplayın.
Sonuçlar
ZnO NP'lerin başarılı sentezi, Şekil 1A'da gösterildiği gibi transmisyon elektron mikroskobu (TEM) kullanılarak doğrulandı. Elde edilen ZnO NP'lerin yuvarlak şekilli, ortalama parçacık boyutu 35.35 nm ve standart sapması 6.81 nm olarak gözlendi. Bu nanopartiküllerin çökelmesi,Zn2+ iyonlarının hidrolize uğradığı çinko asetata NaOH çözeltisi eklenerek çift yer değiştirme reaksiyonu yoluyla gözlemlendi.
Tartışmalar
ZnO NP'lerin yağış yoluyla sentezi nispeten basit ve anlaşılırdır. Bu yöntemi kullanarak ZnO NP'leri başarılı bir şekilde sentezlemek için, öncüsün (çinko asetat) çözücü içinde tamamen çözünmesini sağlamak için karıştırma çok önemlidir. Ayrıca, sıcaklığın arttırılması, başarılı bir çift yer değiştirme reaksiyonunun indüklenmesine yardımcı olur. ZnO NP'lerin sentezinde, çökeltme maddesi, çökeltme maddesinin konsantrasyonu ve y?...
Açıklamalar
Dr. Jonghoon Choi, Nanomedicine Corporation'daki Feynman Teknoloji Enstitüsü'nün CEO'su/Kurucusudur ve Dr. Yonghyun Choi, Cto'dur.
Teşekkürler
Bu araştırma, 2022 yılında Chung-Ang Üniversitesi Lisansüstü Araştırma Bursu (Bayan Gahyun Lee) tarafından desteklenmiştir. Bu çalışma aynı zamanda Kore hükümeti (MSIT) tarafından finanse edilen Kore Ulusal Araştırma Vakfı (NRF) hibesi (No. 2020R1A5A1018052) ve KOBİ'ler ve Startup'lar Bakanlığı (MSS, Kore) tarafından finanse edilen Teknoloji Geliştirme Programı (RS202300261938) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
Referanslar
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır