É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de nanopartículas de óxido de zinco e avaliação de seus efeitos antibacterianos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste estudo, nanopartículas de óxido de zinco foram sintetizadas usando um método de precipitação. O efeito antibacteriano das partículas sintetizadas foi testado contra cepas bacterianas multirresistentes de Staphylococcus aureus resistente à meticilina (MRSA) e Pseudomonas aeruginosa .
Resumo
As infecções bacterianas nosocomiais tornaram-se cada vez mais desafiadoras devido à sua resistência inerente aos antibióticos. O surgimento de cepas bacterianas multirresistentes em hospitais tem sido atribuído ao uso extensivo e variado de antibióticos, exacerbando ainda mais o problema da resistência aos antibióticos. Os nanomateriais metálicos têm sido amplamente estudados como uma solução alternativa para erradicar células bacterianas resistentes a antibióticos. As nanopartículas metálicas atacam as células bacterianas por meio de vários mecanismos, como a liberação de íons antibacterianos, geração de espécies reativas de oxigênio ou interrupção física, contra as quais as bactérias não podem desenvolver resistência. Entre as nanopartículas metálicas antimicrobianas ativamente pesquisadas, as nanopartículas de óxido de zinco, aprovadas pela FDA, são conhecidas por sua biocompatibilidade e propriedades antibacterianas. Neste estudo, nos concentramos no desenvolvimento bem-sucedido de um método de precipitação para sintetizar nanopartículas de óxido de zinco, analisando as propriedades dessas nanopartículas e realizando testes antimicrobianos. As nanopartículas de óxido de zinco foram caracterizadas por microscopia eletrônica de transmissão (MET), espalhamento dinâmico de luz (DLS), espectroscopia ultravioleta/visível e difração de raios-X (DRX). Os testes antibacterianos foram realizados usando o teste de microdiluição em caldo com as cepas multirresistentes de Staphylococcus aureus resistente à meticilina (MRSA) e Pseudomonas aeruginosa. Este estudo demonstrou o potencial das nanopartículas de óxido de zinco na inibição da proliferação de bactérias resistentes a antibióticos.
Introdução
As infecções bacterianas multirresistentes (MDR) representam uma ameaça global significativa à saúde humana1. Como essas infecções podem ser fatais em pacientes com condições subjacentes, pesquisas ativas estão tentando resolver esse problema2. As bactérias evoluíram para escapar da ação de vários medicamentos. A penicilina, amplamente conhecida e creditada por salvar milhões de vidas em todo o mundo, é um antibiótico β-lactâmico que inibe a síntese da parede celular bacteriana3. No entanto, as bactérias evoluíram para neutralizar a eficácia dos medicamentos por meio de vários mecanismos, como bombas de efluxo, alterações da transpeptidase ou diminuição da permeabilidade4. Além disso, as células bacterianas podem transmitir esses genes de resistência para a próxima geração, aumentando as taxas de sobrevivência da geração subsequente e fortalecendo o problema das cepas resistentes5.
O aumento de bactérias resistentes a antibióticos levou ao surgimento de bactérias MDR, que comumente exibem resistência a vários antibióticos. As cepas MDR são mais frequentemente encontradas em ambientes hospitalares, onde várias cepas bacterianas são expostas e, consequentemente, desenvolvem resistência a diferentes antibióticos6. O Staphylococcus aureus, particularmente o S. aureus resistente à meticilina (MRSA), é uma bactéria comensal gram-positiva que forma aglomerados na pele de aproximadamente 30% dos seres humanos 7,8. O MRSA, que foi identificado pela primeira vez na década de 1960, apresenta sensibilidade reduzida aos antibióticos β-lactâmicos, resultando em um aumento acentuado nas taxas de infecção desde a década de 19909. Dentre as bactérias gram-negativas, a Pseudomonas aeruginosa (P. aeruginosa) é uma das cepas mais prevalentes adquiridas em hospitais. Esta espécie, uma bactéria facultativa em forma de bastonete, causa infecções oportunistas em humanos10. Particularmente, as cepas MDR que afetam diretamente a saúde humana são responsáveis por mais de 50% das infecções associadas aos cuidados de saúde11. Neste estudo, utilizamos as cepas multirresistentes mais comumente encontradas em hospitais, MRSA e P. aeruginosa.
O uso de nanopartículas (NPs) para fins antimicrobianos tem sido extensivamente investigado para enfrentar a questão da resistência a antibióticos. As NPs metálicas, em particular, induzem a morte celular bacteriana por meio de vários mecanismos, oferecendo uma solução potencial para o problema da resistência aos medicamentos. As NPs metálicas exercem atividade antimicrobiana por meio de múltiplos mecanismos, incluindo a liberação de íons antimicrobianos, geração de espécies reativas de oxigênio (ROS) e ruptura física das células, entre outros meios12. NPs compostas por prata, cobre, óxido de zinco (ZnO) e óxido de titânio possuem alta eficácia antimicrobiana e, portanto, estão sendo pesquisadas ativamente13.
Os NPs de ZnO foram aprovados pela Food and Drug Administration (FDA) dos EUA para uso em humanos. Por outro lado, apesar de sua alta eficácia antimicrobiana, o uso de NPs de prata e cobre em humanos é limitado por sua alta citotoxicidade. No entanto, os NPs de ZnO são comumente encontrados na vida cotidiana e estão presentes até mesmo em formulações de protetores solares amplamente utilizados14. É importante notar que os íons Zn2+ liberados dos NPs de ZnO são altamente eficazes no tratamento bacteriano, induzindo a morte celular bacteriana por meio da geração de ROS e outros mecanismos de dano físico15.
Este estudo descreve o protocolo para sintetizar nanopartículas de ZnO (NPs) usando um método de precipitação e introduz uma abordagem de teste antimicrobiano usando um método de diluição em microcaldo com amostras clínicas de MRSA e P. aeruginosa. O método de precipitação para NPs de ZnO envolve a síntese de NPs de ZnO sólidos insolúveis, ajustando o pH e a temperatura usando precursores solúveis, como acetato de zinco ou nitrato de zinco16. Juntamente com uma produção relativamente fácil e rápida, esse método garante a repetibilidade na síntese e facilita o controle sobre o tamanho e a morfologia das partículas17. Neste protocolo de síntese, o hidróxido de sódio (NaOH), um dos agentes de precipitação mais comumente usados, foi utilizado para precipitar o acetato de zinco, e uma pequena quantidade de brometo de hexadeciltrimetilamônio (CTAB) foi empregada para inibir a síntese descontrolada das nanopartículas18. Dentre os vários testes antimicrobianos, a atividade antibacteriana das nanopartículas de ZnO foi avaliada pelo método de diluição em microcaldo, que evita a interferência óptica das nanopartículas de óxido metálico e permite a medição direta da colônia para determinação da CIM19.
Protocolo
Os reagentes e equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Preparação de nanopartículas de óxido de zinco
- Meça 200 mL de álcool etílico absoluto e despeje em um frasco de vidro com fundo redondo.
- Colocar o balão de fundo redondo sobre um manto de aquecimento e manter a agitação a 25-40 °C.
- Meça 500 mg de CTAB em um frasco de 50 mL e adicione-o ao álcool etílico no balão. Mexa até que o CTAB esteja completamente dissolvido.
- Adicione 1,4 g de acetato de zinco à solução e mexa até que esteja completamente dissolvido.
- Aumentar a temperatura da solução regulando a temperatura da manta de aquecimento para 70 °C.
- Adicione 25 mL de solução de NaOH 0,5 M à mistura e deixe reagir por 1 h até que a solução límpida fique branca.
- Alíquota da solução para tubos cônicos de 50 mL, centrifugue a 15000 × g por 15 min à temperatura ambiente e descarte o sobrenadante.
- Adicione 10 mL de água destilada a um dos tubos cônicos e ressuspenda as nanopartículas sonicando a solução. Transfira a solução suspensa para um tubo cônico diferente contendo o pellet de ZnO e repita até que todas as soluções de ZnO sejam coletadas em um tubo cônico.
- Lave as nanopartículas por centrifugação a 15000 × g por 15 min (temperatura ambiente), remova o sobrenadante e ressuspenda em água destilada. Verificar o pH da solução sobrenadante com papel de ensaio de pH e repetir até que o pH da solução se torne neutro.
NOTA: Quando o pH da solução sobrenadante se tornar neutro (pH = 7), descarte a solução sobrenadante e não ressuspenda com água destilada. - Seque a pálete de amostras a vácuo a 60 °C durante 24 h e obtenha o pó de ZnO NP.
2. Testes antibacterianos usando MRSA e P. aeruginosa
- Cultura bacteriana
NOTA: As cepas bacterianas MDR clínicas foram obtidas no Hospital Universitário Chung-Ang, Seul, Coréia do Sul.- Retire do congelador as estirpes bacterianas MRSA e P. aeruginosa estocadas em Caldo de Soja Tríptico (TSB).
- Depois de descongelar as soluções bacterianas, coloque a solução em uma placa de ágar soja tríptica (TSA) usando uma alça de inoculação descartável. Coloque as placas de ágar-ágar listrado na incubadora e incube por 24 h.
NOTA: Uma única colônia retirada da placa TSA foi adicionada a 10 mL de meio TSB em um tubo cônico de 50 mL usando uma alça de inoculação bacteriana. As bactérias foram cultivadas por 24 h. As bactérias foram cultivadas em condições de cultivo aeróbio a 37 °C. - Para medir a concentração da solução bacteriana, diluir a solução cultivada usando diluição seriada de 10 vezes para 10-6 usando água destilada. Em seguida, coloque 50 μL da solução diluída em placas TSA e espalhe a solução usando um espalhador em forma de L.
- Incube as placas na incubadora por 24 h.
NOTA: As colônias foram contadas opticamente e a concentração da solução cultivada foi calculada multiplicando os fatores de diluição pelo número de colônias contadas.
- Amostragem bacteriana
- Para testar uma ampla gama de concentrações de ZnO, prepare uma solução de NPs de ZnO de 2 mg/mL usando a solução salina tamponada com fosfato (DPBS) de Dulbecco e realize uma diluição serial de 2 vezes para fazer diferentes concentrações.
NOTA: 1000 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL e 62,5 μg/mL foram testados. - Adicione 100 μL para cada uma das concentrações testadas de NPs de ZnO em uma placa de 96 poços.
NOTA: Use o dobro (2x) da concentração final desejada de NPs de ZnO, pois cada amostra no poço será diluída com a adição de 100 μL de cultura de bactérias. Use uma solução antibiótica-antimicótica (A/A) a 2% como controle positivo e DPBS como controle negativo. A/A é um complexo antibiótico de penicilina e estreptomicina, que é eficaz contra bactérias gram-positivas e gram-negativas, respectivamente. - Diluir a cultura bacteriana a 1 × 106 UFC/ml utilizando o meio TSB e adicionar 100 μL a cada alvéolo contendo diferentes concentrações de NPs de ZnO.
NOTA: As concentrações iniciais de MRSA e solução de cultura de P. aeruginosa foram de 3 x 109 UFC/mL. A concentração de cultura de bactérias 1 x 106 UFC/mL foi feita por diluição de 1/20 e 1/150 da solução de cultura. Após a mistura com 100 μL de NPs de ZnO, a concentração final de bactérias será de 5 × 105 UFC/mL. - Coloque a placa de 96 poços em uma incubadora a 37 °C e incube por 24 h.
- Para testar uma ampla gama de concentrações de ZnO, prepare uma solução de NPs de ZnO de 2 mg/mL usando a solução salina tamponada com fosfato (DPBS) de Dulbecco e realize uma diluição serial de 2 vezes para fazer diferentes concentrações.
- Espalhamento bacteriano
- Pipetar 100 μL de cada alvéolo e preparar várias diluições seriadas de 10 vezes até 10-6.
NOTA: Adicione 100 μL de NPs de ZnO contendo solução bacteriana em 900 μL de água destilada esterilizada e repita 6 vezes. - Pipetar 50 μL de quatro soluções diluídas e adicionar às placas de mídia TSA. Use um espalhador de células em forma de L para espalhar a suspensão bacteriana na placa de ágar.
NOTA: Use as diluições 100, 10-2, 10-4 e 10-6 . Realize todos os experimentos em triplicado. Espalhe até que toda a solução bacteriana seja absorvida na placa de ágar. - Colocar as placas de ágar-ágar numa incubadora a 37 °C e incubar durante 24 h.
- Pipetar 100 μL de cada alvéolo e preparar várias diluições seriadas de 10 vezes até 10-6.
- Contagem de UFC bacteriana
- Selecione um fator de diluição que seja contável para cada grupo. Marque todas as colónias na placa de diluição contável e recalcule de modo a que a concentração se torne # de UFC/ml.
NOTA: O fator de diluição contável indica placas que têm 20-100 UFC em uma placa individual. Resultados da concentração inicialmente contada # de UFC contado/50 μL. Usando a placa de espalhamento com a solução bacteriana não diluída, determine a concentração bactericida mínima potencial. - Use os dados obtidos para representar a porcentagem de bactérias vivas em relação àquelas no controle negativo.
NOTA: Porcentagem de bactérias vivas (%) =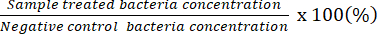
- Selecione um fator de diluição que seja contável para cada grupo. Marque todas as colónias na placa de diluição contável e recalcule de modo a que a concentração se torne # de UFC/ml.
Resultados
A síntese bem-sucedida de NPs de ZnO foi confirmada usando microscopia eletrônica de transmissão (MET), conforme mostrado na Figura 1A. As NPs de ZnO obtidas foram observadas de forma redonda, com tamanho médio de partícula de 35,35 nm e desvio padrão de 6,81 nm. A precipitação dessas nanopartículas foi observada através de uma reação de duplo deslocamento pela adição de solução de NaOH ao acetato de zinco, onde os íons Zn2+ sofre...
Discussão
A síntese de NPs de ZnO via precipitação é relativamente simples e direta. Para sintetizar com sucesso NPs de ZnO usando este método, a agitação é crucial para garantir que o precursor (acetato de zinco) seja totalmente dissolvido no solvente. Além disso, aumentar a temperatura ajuda a induzir uma reação de duplo deslocamento bem-sucedida. Na síntese de NPs de ZnO, existem muitos fatores que determinam o tamanho e a forma, incluindo o agente de precipitação, a conc...
Divulgações
O Dr. Jonghoon Choi é o CEO/Fundador, e o Dr. Yonghyun Choi é o CTO do Instituto de Tecnologia Feynman da Nanomedicine Corporation.
Agradecimentos
Esta pesquisa foi apoiada pela Bolsa de Pesquisa de Pós-Graduação da Universidade Chung-Ang em 2022 (Sra. Gahyun Lee). Este trabalho também foi apoiado pela subvenção da Fundação Nacional de Pesquisa da Coreia (NRF) financiada pelo governo coreano (MSIT) (nº 2020R1A5A1018052) e pelo Programa de Desenvolvimento de Tecnologia (RS202300261938) financiado pelo Ministério de PMEs e Startups (MSS, Coreia).
Materiais
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
Referências
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados