Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von Zinkoxid-Nanopartikeln und die Bewertung ihrer antibakteriellen Wirkung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Studie wurden Zinkoxid-Nanopartikel mit Hilfe eines Fällungsverfahrens synthetisiert. Die antibakterielle Wirkung der synthetisierten Partikel wurde gegen multiresistente Methicillin-resistente Staphylococcus aureus (MRSA) und Pseudomonas aeruginosa Bakterienstämme getestet.
Zusammenfassung
Nosokomiale bakterielle Infektionen sind aufgrund ihrer inhärenten Resistenz gegen Antibiotika immer schwieriger geworden. Das Auftreten multiresistenter Bakterienstämme in Krankenhäusern wird auf den umfangreichen und vielfältigen Einsatz von Antibiotika zurückgeführt, der das Problem der Antibiotikaresistenz weiter verschärft. Metall-Nanomaterialien wurden umfassend als alternative Lösung zur Ausrottung antibiotikaresistenter Bakterienzellen untersucht. Metallische Nanopartikel greifen Bakterienzellen durch verschiedene Mechanismen an, wie z. B. die Freisetzung antibakterieller Ionen, die Erzeugung reaktiver Sauerstoffspezies oder physikalische Störungen, gegen die Bakterien keine Resistenz entwickeln können. Unter den aktiv erforschten antimikrobiellen Metall-Nanopartikeln sind Zinkoxid-Nanopartikel, die von der FDA zugelassen sind, für ihre Biokompatibilität und antibakteriellen Eigenschaften bekannt. In dieser Studie konzentrierten wir uns auf die erfolgreiche Entwicklung einer Fällungsmethode zur Synthese von Zinkoxid-Nanopartikeln, die Analyse der Eigenschaften dieser Nanopartikel und die Durchführung antimikrobieller Tests. Zinkoxid-Nanopartikel wurden mittels Transmissionselektronenmikroskopie (TEM), dynamischer Lichtstreuung (DLS), Ultraviolett-/Sichtspektroskopie und Röntgenbeugung (XRD) charakterisiert. Antibakterielle Tests wurden unter Verwendung des Bouillon-Mikrodilutionstests mit den multiresistenten Stämmen des Methicillin-resistenten Staphylococcus aureus (MRSA) und Pseudomonas aeruginosa durchgeführt. Diese Studie zeigte das Potenzial von Zinkoxid-Nanopartikeln bei der Hemmung der Vermehrung von antibiotikaresistenten Bakterien.
Einleitung
Multiresistente (MDR) bakterielle Infektionen stellen eine erhebliche globale Bedrohung für die menschliche Gesundheitdar 1. Da diese Infektionen bei Patienten mit Grunderkrankungen tödlich verlaufen können, versucht die aktive Forschung, dieses Problem anzugehen2. Bakterien haben sich so entwickelt, dass sie sich der Wirkung verschiedener Medikamente entziehen. Penicillin, weithin bekannt und für die Rettung von Millionen von Menschenleben weltweit verantwortlich, ist ein β-Lactam-Antibiotikum, das die Synthese der bakteriellen Zellwand hemmt3. Bakterien haben sich jedoch so entwickelt, dass sie die Wirksamkeit von Arzneimitteln durch verschiedene Mechanismen wie Effluxpumpen, Transpeptidase-Veränderungen oder verminderte Permeabilität neutralisieren4. Darüber hinaus können Bakterienzellen diese Resistenzgene an die nächste Generation weitergeben, was die Überlebensraten der nachfolgenden Generation erhöht und das Problem resistenter Stämme verstärkt5.
Die Zunahme antibiotikaresistenter Bakterien hat zum Auftreten von MDR-Bakterien geführt, die häufig Resistenzen gegen mehrere Antibiotika aufweisen. MDR-Stämme sind am häufigsten in Krankenhäusern anzutreffen, wo mehrere Bakterienstämme verschiedenen Antibiotika ausgesetzt sind und daher Resistenzen gegen sie entwickeln6. Staphylococcus aureus, insbesondere der Methicillin-resistente S. aureus (MRSA), ist ein grampositives kommensales Bakterium, das bei etwa 30 % der Menschen Cluster auf der Haut bildet 7,8. MRSA, das erstmals in den 1960er Jahren identifiziert wurde, weist eine verminderte Empfindlichkeit gegenüber β-Lactam-Antibiotika auf, was zu einem starken Anstieg der Infektionsraten seit den 1990er Jahren führte9. Unter den gramnegativen Bakterien ist Pseudomonas aeruginosa (P. aeruginosa) einer der am weitesten verbreiteten Stämme, die in Krankenhäusern erworben werden. Diese Spezies, ein fakultatives stäbchenförmiges Bakterium, verursacht beim Menschen opportunistische Infektionen10. Insbesondere MDR-Stämme, die sich direkt auf die menschliche Gesundheit auswirken, sind für über 50 % der nosokomialen Infektionen verantwortlich11. In dieser Studie haben wir die in Krankenhäusern am häufigsten vorkommenden multiresistenten Stämme, MRSA und P. aeruginosa, verwendet.
Die Verwendung von Nanopartikeln (NPs) für antimikrobielle Zwecke wurde umfassend untersucht, um das Problem der Antibiotikaresistenz anzugehen. Insbesondere metallische NPs induzieren den bakteriellen Zelltod durch verschiedene Mechanismen und bieten eine mögliche Lösung für das Problem der Arzneimittelresistenz. Metallische NP üben eine antimikrobielle Aktivität durch mehrere Mechanismen aus, darunter die Freisetzung antimikrobieller Ionen, die Erzeugung reaktiver Sauerstoffspezies (ROS) und die physikalische Zerstörung von Zellen,unter anderem 12. NPs, die aus Silber, Kupfer, Zinkoxid (ZnO) und Titanoxid bestehen, besitzen eine hohe antimikrobielle Wirksamkeit und werden daher aktiv erforscht13.
ZnO NPs wurden von der U.S. Food and Drug Administration (FDA) für die Anwendung beim Menschen zugelassen. Umgekehrt ist der Einsatz von Silber- und Kupfer-NPs beim Menschen trotz ihrer hohen antimikrobiellen Wirksamkeit durch ihre hohe Zytotoxizität begrenzt. ZnO-NPs sind jedoch häufig im Alltag zu finden und sogar in weit verbreiteten Sonnenschutzformulierungen enthalten14. Bemerkenswert ist, dass Zn2+ -Ionen, die von ZnO-NPs freigesetzt werden, bei der bakteriellen Behandlung hochwirksam sind und durch die Bildung von ROS und anderen physikalischen Schadensmechanismen den bakteriellen Zelltod induzieren15.
Diese Studie skizziert das Protokoll für die Synthese von ZnO-Nanopartikeln (NPs) unter Verwendung einer Fällungsmethode und stellt einen antimikrobiellen Testansatz unter Verwendung einer Mikrobouillon-Verdünnungsmethode mit klinischen Proben von MRSA und P. aeruginosa vor. Die Fällungsmethode für ZnO-NP umfasst die Synthese unlöslicher fester ZnO-NP durch Einstellen des pH-Werts und der Temperatur unter Verwendung löslicher Vorläufer wie Zinkacetat oder Zinknitrat16. Neben der relativ einfachen und schnellen Produktion gewährleistet diese Methode die Wiederholbarkeit in der Synthese und erleichtert die Kontrolle über Partikelgröße und Morphologie17. In diesem Syntheseprotokoll wurde Natriumhydroxid (NaOH), eines der am häufigsten verwendeten Fällungsmittel, zur Ausfällung von Zinkacetat verwendet, und eine kleine Menge Hexadecyltrimethylammoniumbromid (CTAB) wurde verwendet, um die unkontrollierte Synthese der Nanopartikelzu hemmen 18. Neben verschiedenen antimikrobiellen Tests wurde die antibakterielle Aktivität von ZnO-Nanopartikeln mit der Mikrobouillon-Verdünnungsmethode bewertet, die optische Interferenzen durch Metalloxid-Nanopartikel vermeidet und eine direkte Koloniemessung zur Bestimmung von MHK19 ermöglicht.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die in dieser Studie verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Herstellung von Zinkoxid-Nanopartikeln
- Messen Sie 200 ml absoluten Ethylalkohol ab und gießen Sie ihn in einen Glaskolben mit rundem Boden.
- Den Rundkolben auf eine Heizhaube stellen und bei 25-40 °C weiterrühren.
- Messen Sie 500 mg CTAB in einer 50-ml-Durchstechflasche und fügen Sie es dem Ethylalkohol im Kolben hinzu. Rühren, bis sich das CTAB vollständig aufgelöst hat.
- Geben Sie 1,4 g Zinkacetat in die Lösung und rühren Sie, bis es sich vollständig aufgelöst hat.
- Erhöhen Sie die Temperatur der Lösung, indem Sie die Temperatur der Heizhaube auf 70 °C einstellen.
- Geben Sie 25 ml 0,5 M NaOH-Lösung zu der Mischung und lassen Sie sie 1 h lang reagieren, bis die klare Lösung eine weiße Farbe annimmt.
- Aliquotieren Sie die Lösung in konische 50-ml-Röhrchen, zentrifugieren Sie sie 15 Minuten lang bei Raumtemperatur bei 15000 × g und verwerfen Sie dann den Überstand.
- Geben Sie 10 ml destilliertes Wasser in eines der konischen Röhrchen und resuspendieren Sie die Nanopartikel durch Beschallung der Lösung. Übertragen Sie die suspendierte Lösung in ein anderes konisches Röhrchen, das das ZnO-Pellet enthält, und wiederholen Sie den Vorgang, bis alle ZnO-Lösungen in einem konischen Röhrchen gesammelt sind.
- Waschen Sie die Nanopartikel 15 Minuten lang bei 15000 × g durch Zentrifugation, entfernen Sie den Überstand und suspendieren Sie sie wieder in destilliertem Wasser. Überprüfen Sie den pH-Wert der überstehenden Lösung mit pH-Testpapier und wiederholen Sie den Vorgang, bis der pH-Wert der Lösung neutral wird.
HINWEIS: Wenn der pH-Wert der überstehenden Lösung neutral wird (pH = 7), verwerfen Sie die überstehende Lösung und resuspendieren Sie sie nicht mit destilliertem Wasser. - Die Probenpalette wird 24 h lang bei 60 °C vakuumgetrocknet und das ZnO NP-Pulver erhalten.
2. Antibakterielle Tests mit MRSA und P. aeruginosa
- Bakterienkultur
HINWEIS: Klinische MDR-Bakterienstämme wurden aus dem Chung-Ang University Hospital, Seoul, Südkorea, bezogen.- Nehmen Sie MRSA- und P. aeruginosa-Bakterienstämme , die in Tryptischer Sojabrühe (TSB) gelagert sind, aus dem Tiefkühlschrank.
- Nachdem Sie die bakteriellen Lösungen aufgetaut haben, streichen Sie die Lösung mit einer Einweg-Impfschlaufe auf eine Tryptische Soja-Agar (TSA)-Platte. Legen Sie die gestreiften Agarplatten in den Inkubator und inkubieren Sie sie 24 h lang.
HINWEIS: Eine einzelne Kolonie, die aus der TSA-Platte entnommen wurde, wurde mit einer bakteriellen Impfschlaufe zu 10 ml TSB-Medium in einem konischen 50-ml-Röhrchen gegeben. Die Bakterien wurden 24 Stunden lang kultiviert. Die Bakterien wurden unter aeroben Kulturbedingungen bei 37 °C kultiviert. - Um die Konzentration der Bakterienlösung zu messen, verdünnen Sie die kultivierte Lösung mit 10-facher Serienverdünnung auf 10-6 mit destilliertem Wasser. Geben Sie anschließend 50 μl der verdünnten Lösung auf TSA-Platten und verteilen Sie die Lösung mit einem L-förmigen Spreizer.
- Inkubieren Sie die Platten 24 h lang im Inkubator.
HINWEIS: Die Kolonien wurden optisch gezählt, und die Konzentration der kultivierten Lösung wurde berechnet, indem die Verdünnungsfaktoren mit der Anzahl der gezählten Kolonien multipliziert wurden.
- Probenahme von Bakterien
- Um einen breiten Bereich von ZnO-Konzentrationen zu testen, bereiten Sie eine 2 mg/ml-ZnO-NPs-Lösung unter Verwendung von Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS) vor und führen Sie eine 2-fache serielle Verdünnung durch, um unterschiedliche Konzentrationen zu erhalten.
HINWEIS: Getestet wurden 1000 μg/ml, 500 μg/ml, 250 μg/ml, 125 μg/ml und 62,5 μg/ml. - Geben Sie 100 μl für jede der getesteten Konzentrationen von ZnO-NPs in eine 96-Well-Platte.
HINWEIS: Verwenden Sie das Doppelte (2x) der gewünschten Endkonzentration an ZnO-NPs, da jede Probe in der Vertiefung unter Zugabe von 100 μl Bakterienkultur verdünnt wird. Verwenden Sie eine 2%ige Antibiotikum-Antimykotikum-Lösung (A/A) als Positivkontrolle und DPBS als Negativkontrolle. A/A ist ein Penicillin- und Streptomycin-Antibiotika-Komplex, der gegen grampositive bzw. gramnegative Bakterien wirksam ist. - Verdünnen Sie die Bakterienkultur mit TSB-Medien auf 1 × 106 KBE/ml und geben Sie 100 μl in jede Vertiefung, die unterschiedliche Konzentrationen von ZnO-NPs enthält.
HINWEIS: Die anfänglichen Konzentrationen der MRSA- und P. aeruginosa-Kulturlösung betrugen 3 x 109 KBE/ml. Die Bakterienkulturkonzentration 1 x 106 KBE/ml wurde durch Verdünnung der Kulturlösung von 1/20 und 1/150 hergestellt. Nach dem Mischen mit 100 μl ZnO-NP beträgt die Endkonzentration der Bakterien 5 × 105 KBE/ml. - Stellen Sie die 96-Well-Platte in einen 37 °C heißen Inkubator und inkubieren Sie sie 24 Stunden lang.
- Um einen breiten Bereich von ZnO-Konzentrationen zu testen, bereiten Sie eine 2 mg/ml-ZnO-NPs-Lösung unter Verwendung von Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS) vor und führen Sie eine 2-fache serielle Verdünnung durch, um unterschiedliche Konzentrationen zu erhalten.
- Ausbreitung von Bakterien
- Pipettieren Sie 100 μl aus jeder Vertiefung und bereiten Sie verschiedene 10-fache Serienverdünnungen bis 10-6 vor.
HINWEIS: Geben Sie 100 μl ZnO NPs, die eine bakterielle Lösung enthalten, in 900 μl sterilisiertes destilliertes Wasser und wiederholen Sie den Vorgang 6 Mal. - 50 μl aus vier verdünnten Lösungen pipettieren und auf TSA-Medienplatten geben. Verwenden Sie einen L-förmigen Zellspreizer, um die Bakteriensuspension auf der Agarplatte zu verteilen.
HINWEIS: Verwenden Sie die Verdünnungen 100, 10-2, 10-4 und 10-6 . Führen Sie alle Experimente in dreifacher Ausfertigung durch. Verteilen, bis die gesamte bakterielle Lösung auf der Agarplatte absorbiert ist. - Legen Sie die Agarplatten in einen 37 °C heißen Inkubator und inkubieren Sie sie 24 Stunden lang.
- Pipettieren Sie 100 μl aus jeder Vertiefung und bereiten Sie verschiedene 10-fache Serienverdünnungen bis 10-6 vor.
- Zählung von bakteriellen KBE
- Wählen Sie einen Verdünnungsfaktor aus, der für jede Gruppe zählbar ist. Markieren Sie alle Kolonien in der zählbaren Verdünnungsplatte und berechnen Sie neu, so dass die Konzentration # von KBE/ml beträgt.
HINWEIS: Der zählbare Verdünnungsfaktor gibt Platten an, die 20-100 KBE auf einer einzelnen Platte haben. Die anfänglich gezählte Konzentration ergibt # von gezählter KBE/50 μl. Bestimmen Sie unter Verwendung der Spreizplatte mit der unverdünnten Bakterienlösung die potenzielle minimale bakterizide Konzentration. - Verwenden Sie die erhaltenen Daten, um den prozentualen Anteil lebender Bakterien im Verhältnis zu denen in der Negativkontrolle darzustellen.
HINWEIS: Anteil lebender Bakterien (%) =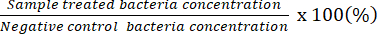
- Wählen Sie einen Verdünnungsfaktor aus, der für jede Gruppe zählbar ist. Markieren Sie alle Kolonien in der zählbaren Verdünnungsplatte und berechnen Sie neu, so dass die Konzentration # von KBE/ml beträgt.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die erfolgreiche Synthese von ZnO-NPs wurde mit Hilfe der Transmissionselektronenmikroskopie (TEM) bestätigt, wie in Abbildung 1A dargestellt. Es wurde beobachtet, dass die erhaltenen ZnO-NPs eine runde Form haben, mit einer durchschnittlichen Partikelgröße von 35,35 nm und einer Standardabweichung von 6,81 nm. Die Ausfällung dieser Nanopartikel wurde durch eine Doppelverdrängungsreaktion durch Zugabe von NaOH-Lösung zu Zinkacetat beobachtet, wo Zn
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Synthese von ZnO NP über die Fällung ist relativ einfach und unkompliziert. Um ZnO-NPs mit dieser Methode erfolgreich zu synthetisieren, ist das Rühren entscheidend, um sicherzustellen, dass der Vorläufer (Zinkacetat) vollständig im Lösungsmittel gelöst ist. Darüber hinaus trägt eine Erhöhung der Temperatur dazu bei, eine erfolgreiche Doppelverdrängungsreaktion zu induzieren. Bei der Synthese von ZnO-NPs gibt es viele Faktoren, die die Größe und Form bestimmen, ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Dr. Jonghoon Choi ist der CEO/Gründer, und Dr. Yonghyun Choi ist der CTO des Feynman Institute of Technology bei der Nanomedicine Corporation.
Danksagungen
Diese Forschung wurde durch das Chung-Ang University Graduate Research Scholarship im Jahr 2022 (Frau Gahyun Lee) unterstützt. Diese Arbeit wurde auch durch das von der koreanischen Regierung finanzierte Stipendium der National Research Foundation of Korea (NRF) (Nr. 2020R1A5A1018052) und durch das Technology Development Program (RS202300261938) unterstützt, das vom Ministerium für KMU und Startups (MSS, Korea) finanziert wurde.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
Referenzen
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616(2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907(2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582(2022).
- Jiang, J. -H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300(2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441(2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. McNeil, S. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63(2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148(2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292(2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771(2023).
- Choi, K. -C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055(2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -L., Zhu, Y. -J., Wang, S. -W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452(2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500(2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349(2020).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten