A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التثقيب الكهربائي القائم على الركيزة المسامية مع مراقبة المعاوقة الكهربائية عبر الظهارة
In This Article
Summary
أزواج التثقيب الكهربائي للركيزة المسامية (PSEP) توصيل متسق وعالي الإنتاجية مع قابلية عالية للخلية. يوفر إدخال قياسات المعاوقة الكهربائية عبر الظهارة (TEEI) نظرة ثاقبة للعمليات الوسيطة ل PSEP ويسمح بالتسليم بدون ملصقات. تتناول هذه المقالة طريقة لإجراء تجارب تسليم PSEP وتحليل قياس TEEI في وقت واحد.
Abstract
التثقيب الكهربائي للركيزة المسامية (PSEP) هو طريقة ناشئة للتثقيب الكهربائي توفر إنتاجية عالية وتسليما متسقا. مثل العديد من الأنواع الأخرى من التسليم داخل الخلايا ، يعتمد PSEP بشكل كبير على علامات الفلورسنت والفحص المجهري الفلوري لتحديد التسليم الناجح. لاكتساب نظرة ثاقبة على الخطوات الوسيطة لعملية التثقيب الكهربائي ، تم تطوير منصة PSEP مع مراقبة متكاملة للمقاومة الكهربائية عبر الظهارة (TEEI). يتم استزراع الخلايا في إدخالات متاحة تجاريا مع أغشية مسامية. بعد فترة حضانة مدتها 12 ساعة للسماح بتكوين طبقة أحادية الخلية متقاربة بالكامل ، يتم وضع الإدخالات في وسائط النقل الموجودة في آبار جهاز PSEP. ثم تخضع الطبقة الأحادية للخلية لشكل موجي محدد من قبل المستخدم ، ويتم تأكيد كفاءة التوصيل من خلال الفحص المجهري الفلوري. يمكن تحسين سير العمل هذا بشكل كبير باستخدام قياسات TEEI بين الفحص المجهري النابض والفلوري لجمع بيانات إضافية حول عملية PSEP ، وترتبط بيانات TEEI الإضافية هذه بمقاييس التسليم مثل كفاءة التسليم والجدوى. توضح هذه المقالة بروتوكولا لإجراء PSEP مع قياسات TEEI.
Introduction
التثقيب الكهربائي هو تقنية تتعرض فيها الخلايا لمجال كهربائي ، مما يخلق مسام مؤقتة في غشاء الخلية يمكن من خلالها للشحنات ، بما في ذلك البروتينات والحمض النووي الريبي والحمض النووي ، تمرير 1,2. الإصدار الأكثر استخداما هو التثقيب الكهربائي السائب (BEP). يتم تنفيذ أفضل الممارسات البيئية عن طريق ملء كوفيت بإلكتروليت يحتوي على ملايين الخلايا ، وتعريض المنحل بالكهرباء للجهد العالي ، والسماح للبضائع بدخول الخلايا من خلال الانتشار أو البطانة1. هناك العديد من المزايا لأفضل الممارسات البيئية ، بما في ذلك الإنتاجية العالية والعديد من الأنظمة المتاحة تجاريا. ومع ذلك ، هناك قيود على تسليم أفضل الممارسات البيئية. يؤدي وضع الخلايا غير المتسق بالنسبة للأقطاب الكهربائية وحماية المجال الكهربائي من الخلايا المجاورة إلى تباين كبير في التعرض للمجال الكهربائي خلال أفضل الممارسات البيئية 3,4. الجهد العالي المطلوب ل BEP له أيضا تأثير سلبي كبير على صلاحية الخلية5. منذ إنشائها في عام 20116 ، كان هناك اهتمام متزايد بطريقة التثقيب الكهربائي تسمى التثقيب الكهربائي للركيزة المسامية (PSEP) ، على الرغم من أنه يشار إليها أحيانا بأسماء أخرى ، بما في ذلك التثقيب الكهربائي الموضعي والتثقيب الكهربائي النانوي أو الجزئي1،7،8. على عكس تعليق الخلايا من أفضل الممارسات البيئية ، يتم إجراء PSEP على الخلايا الملتصقة بالركيزة المسامية. لا يقتصر الأمر على تفضيل الحالة الملتصقة لغالبية خطوط الخلايا البشرية9 ، ولكن المسام الموجودة في الركيزة تركز أيضا على التيار الكهربائي ، مما يؤدي إلى توطين الجهد الكهربائي عبر الغشاء (TMP) إلى مناطق محددة من غشاء الخلية10,11. يسمح هذا التوطين بانخفاض كبير في الجهد المطبق وتقليل الضرر وزيادة صلاحية الخلية. يساعد هذا المزيج من التأثيرات على التحكم في تطور مسام غشاء الخلية ، مما يؤدي إلى توصيل أكثر اتساقا وكفاءة1،5،12.
قدمت دراسة حديثة جهاز PSEP مع مجموعة أقطاب كهربائية مطلية بالذهب من ستة آبار لعقد إدخالات الغشاء المسامي المتاحة تجاريا13 (الشكل 1A ، B) ، وهي ممارسة تم تقديمها لأول مرة بواسطة Vindis et al.14. يمكن للجهاز تطبيق النبضات وقياس المعاوقة الكهربائية عبر الطبقة الأحادية للخلية ، والمعروفة باسم المعاوقة الكهربائية عبر الظهارة (TEEI) ، في الوقت الفعلي13. تسمح واجهة المستخدم الخاصة بالجهاز بالتحكم الكامل في شكل موجة التثقيب الكهربائي والقطبية. الأهم من ذلك ، يمكن استخدام قياسات المعاوقة في الوقت الفعلي للتنبؤ بنتائج التسليم دون الحاجة إلى كواشف باهظة الثمن أو علامات فلورية ، وهو مفهوم يعرف باسم التسليم بدون ملصق15.
تتكون منصة PSEP من مكونين كهربائيين مخصصين رئيسيين: الجسم الرئيسي للجهاز ، الذي يضم مولد النبض ومعدات قياس TEEI ، ومجموعة الأقطاب الكهربائية ، حيث يتم إدخال الركائز المسامية ، ويحدث التثقيب الكهربائي. يمكن العثور على الرسوم البيانية لجميع الإلكترونيات المخصصة والمكونات المطبوعة 3D في GitHub: https://github.com/YangLabUNL/PSEP-TEEI. بالإضافة إلى الإلكترونيات المخصصة ، يلزم أيضا وجود جهاز كمبيوتر حتى تعمل المنصة بشكل صحيح. يتطلب البرنامج المخصص تشغيل MATLAB (الإصدار 2021a أو أحدث) ، و Microsoft Excel لتخزين البيانات والوصول إليها للتحليل. يتحكم البرنامج في الإلكترونيات المخصصة ويوفر واجهة المستخدم الرسومية (GUI) لضبط الإعدادات. تم توفير هذه البرامج أيضا في GitHub: https://github.com/YangLabUNL/PSEP-TEEI.
تشير البيانات الأولية إلى أن هذه العملية ممكنة لأنواع مختلفة من الخلايا الملتصقة (الشكل 1C) ، لكن هذه المقالة ستناقش فقط تحضير خلايا A431 باستخدام المعلمات التي وجد أنها مثالية لخط الخلية هذا بواسطة Brooks et al.13. بالإضافة إلى ذلك ، نظرا لأن شحنة يوديد البروبيديوم (PI) سامة للخلايا ، يتم إجراء تجربتين ، الأولى مع وسائط نقل PI عالية التركيز لتحديد كفاءة التسليم ، والثانية مع وسائط زراعة الخلايا فقط لقياس TEEI على مدى فترات زمنية أطول. تستخدم هذه التجارب أشكالا موجية متطابقة للتثقيب الكهربائي ، مما يسمح بربط النتائج (الشكل 1 د).
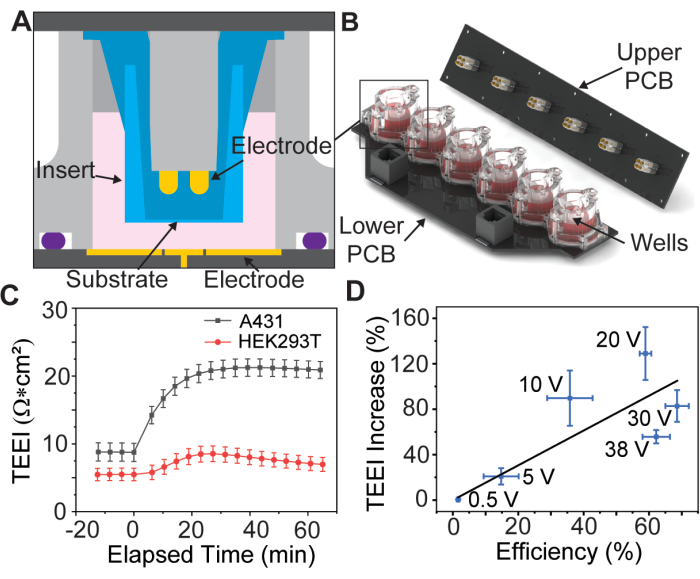
الشكل 1: مخطط تجميع صفيف الأقطاب الكهربائية والبيانات الأساسية. (أ) نموذج CAD لإدراج داخل بئر من صفيف الأقطاب الكهربائية. (ب) نموذج CAD لمصفوفة الأقطاب الكهربائية. (ج) زيادة المعاوقة بسبب PSEP لخطوط الخلايا المحددة ، n = 3 لكل خط خلية. شريط الخطأ: خطأ قياسي للمتوسط. (د) كفاءة التسليم مقابل TEEI زيادة بيانات الارتباط. تم حساب كفاءة التسليم بقسمة عدد الخلايا الموسومة في كل من صور PI و calcein من تجارب التسليم على العدد الإجمالي للخلايا المحددة مع Hoechst. تم تحديد عدد الخلايا باستخدام خط أنابيب CellProfiler مخصص ، n = 6 لكل جهد. شريط الخطأ: (المحور س و ص) خطأ قياسي للمتوسط. هذا الرقم مستنسخ من Brooks et al.13 بإذن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
يتم سرد تفاصيل الكواشف والمعدات المستخدمة في الدراسة في جدول المواد.
1. إعداد الكواشف وزراعة الخلايا
- قم بإعداد وسائط زراعة الخلايا عن طريق إضافة 50 مل من مصل الجنين البقري (FBS) و 5 مل من البنسلين والستربتومايسين إلى حاوية سعة 500 مل من وسط النسر المعدل من Dulbecco (DMEM). أنتج أحد عشر حصة سعة 50 مل لتقليل مخاطر التلوث وقم بالتبريد عند 4 درجات مئوية.
- قم بإنشاء 1 مل من 25 ميكروغرام / مل من فبرونيكتين البلازما البشرية في محلول ملحي مخزن بالفوسفات (PBS) وفقا لتعليمات الشركة المصنعة.
- قم بإنشاء 15 مل من يوديد البروبيديوم 0.1 مجم / مل في محلول مخزون DMEM للسماح بإجراء تجارب بتركيزات مختلفة من البضائع.
- زراعة خلايا A431 في دورق T75 يحتوي على 12 مل من وسائط زراعة الخلايا المحضرة. تم تمرير الخلايا كل 1-2 أيام للحفاظ على التقاء 50٪.
2. إعداد عينة
- طلاء الفبرونيكتين
- حدد اثني عشر إدراج ولوحين من 24 بئرا. ضع الإدخالات في لوحة بئر واحدة ، مما أدى إلى إنشاء صفين من ستة. ضع لوحة البئر الثانية جانبا حتى وقت لاحق.
- قم بإنشاء 1,300 ميكرولتر من 1 ميكروغرام / مل من محلول الفبرونيكتين عن طريق خلط 52 ميكرولتر من محلول مخزون الفبرونيكتين و 1,248 ميكرولتر من برنامج تلفزيوني في أنبوب 1.5 مل.
- توزيع 100 ميكرولتر من محلول الفبرونيكتين في كل إدراج. احتضان الحشوات في لوحة البئر عند 37 درجة مئوية لمدة 3 ساعات.
- ضبط تركيز الخلية لتحسين كثافة الخلية
- حوالي 1 ساعة قبل اكتمال حضانة الفبرونيكتين ، قم بإزالة قارورة T75 من خلايا A431 من الحاضنة لاستخراج الخلايا.
- قم بإزالة الوسائط في القارورة باستخدام شفاط واغسلها ب 5 مل من PBS. إزالة برنامج تلفزيوني بنفس الطريقة وإضافة 3 مل من التربسين. احتضن لمدة 3-4 دقائق قبل النقر على جانب القارورة لفصل الخلايا تماما.
- أضف 6 مل من وسائط زراعة الخلايا إلى القارورة ، واخلطها بقوة مع ماصة لفصل أي خلايا متبقية ، ونقل المحتويات إلى أنبوب طرد مركزي سعة 15 مل. أجهزة الطرد المركزي عند 100 × جم و 20 درجة مئوية لمدة 5 دقائق.
- قم بإزالة وسائط زراعة الخلايا والتربسين من أنبوب الطرد المركزي باستخدام شفاط ، مع الحرص على عدم إزعاج حبيبات الخلية. أضف 1 مل من الوسائط إلى أنبوب الطرد المركزي والماصة ذهابا وإيابا (دون إنتاج فقاعات) لتفتيت حبيبات الخلية وإعادة تعليق الخلايا.
- ماصة 10 ميكرولتر من تعليق الخلية ، و 40 ميكرولتر من وسائط زراعة الخلايا ، و 50 ميكرولتر من صبغة التريبان الزرقاء في أنبوب 200 ميكرولتر ، باستخدام ماصة للخلط جيدا.
- إزالة 10 ميكرولتر من خليط الصبغة وحقنه في مقياس الدم. عد الخلايا باستخدام تخفيف 10٪ من خليط الصبغة لتقدير إجمالي عدد الخلايا في أنبوب الطرد المركزي 15 مل.
ملاحظة: بالنسبة لهذا البروتوكول ، افترض تركيز 5,000,000 خلية / مل. - اضرب كثافة البذر المطلوبة في مساحة سطح غشاء الإدخال ، واقسمها على الخلايا المحسوبة / مل في التعليق ، واضرب في 1,000 لحساب الميكرولتر المطلوب من تعليق الخلية لكل إدخال.
- للعثور على الكمية الإجمالية لتعليق الخلية المطلوبة ، اضرب هذا الرقم في 10 (لضمان خلايا كافية ل 9 عينات ، حيث أن 3 من 12 إدراجا ستكون عناصر تحكم خالية من الخلايا) ، وقم بالتقريب إلى أقرب عدد صحيح. في هذه الحالة ، يلزم ما مجموعه 135 ميكرولتر من تعليق الخلية لهذه التجربة.
- قم بإنشاء 2000 ميكرولتر من محلول الخلية المعدل عن طريق خلط 135 ميكرولتر المحسوبة مسبقا من معلق الخلية مع 1865 ميكرولتر من وسائط زراعة الخلايا في أنبوب طرد مركزي منفصل سعة 15 مل.
- خلايا البذر
- قم بإزالة الفبرونيكتين الزائد من كل ملحق بمجرد اكتمال حضانة الفبرونيكتين.
- اغسل الحشوات مرتين بإضافة 100 ميكرولتر من الماء المقطر المعقم إلى كل ملحق. قم بإزالة الماء باتباع نفس الترتيب الذي تمت إضافته به لضمان وقت غسيل ثابت بين الإدخالات.
- اغسل الملحق مرة أخرى بإضافة وسائط زراعة خلايا 100 ميكرولتر إلى كل ملحق. قم بإزالة الوسائط باتباع نفس الترتيب الذي تمت إضافته لضمان وقت غسيل ثابت بين الإدخالات.
- إدراج عينة الخلية
- خلايا البذور عن طريق سحب 200 ميكرولتر من محلول الخلية المعدل في كل إدخال. لضمان التقاء متسق بين الإدخالات ، امزج محلول الخلية في أنبوب الطرد المركزي قبل التوزيع واخلطه مرة أخرى داخل كل ملحق بعد التوزيع.
- إدراج السيطرة السلبية
- ماصة 200 ميكرولتر من وسائط زراعة الخلايا في كل إدراج. للحفاظ على الاتساق مع إدخالات عينة الخلية ، استخدم الماصة لخلط وسائط زراعة الخلايا داخل كل إدخال.
- وضع العلامات والحضانة
- ارسم خطا يقسم صفيحة البئر الثانية إلى عمودين بعرض ثلاثة آبار (للظروف التي تعمل في ثلاث نسخ) باستخدام علامة دائمة. افصل كل عمود إلى صفوف. قم بتسمية كل منطقة في الشبكة بالمعلمات ذات الصلة.
- أضف 1 مل من وسائط زراعة الخلايا إلى كل بئر لتلقي ملحق للتجربة. نقل الحشوات من لوحة بئر التحضير إلى موقعها المناسب في لوحة بئر التجربة المسمى واحتضانها عند 37 درجة مئوية لمدة 12 ساعة على الأقل.
3. الإجراء التجريبي
- تجربة التسليم
- ماصة 1.5 مل من محلول PI 0.1 مجم / مل في كل بئر في مجموعة الأقطاب الكهربائية. ضع ملحقا في كل بئر في صفيف الأقطاب الكهربائية ، وقم بتركيب أقدام الإدخال في أخاديد المحاذاة بحيث يكون الملحق متدفقا مع السطح العلوي للبئر (الشكل 1 أ ، ب).
- قم بربط لوحة الدوائر المطبوعة بالقطب العلوي (PCB) بأعلى آبار صفيف الأقطاب الكهربائية وقم بتوصيل صفيف القطب بجهاز PSEP.
- ضع مجموعة الأقطاب الكهربائية في حاضنة 37 درجة مئوية لمدة 1 ساعة على الأقل للسماح بتوازن درجة الحرارة.
- انقر فوق القائمة المنسدلة بجوار "الغشاء" في الزاوية العلوية اليسرى من واجهة المستخدم الرسومية وانقر فوق 400 نانومتر GBO. كرر هذه الخطوة مع "المنحل بالكهرباء" و "الخلايا" و "كثافة بذر الخلية" و "مدة الخلية" ، مع تحديد DMEM و A431 و 200 و 12 على التوالي.
ملاحظة: هذه القيم هي لأغراض حفظ السجلات فقط، ولا تؤثر على وظيفة الجهاز. يرجى التأكد من ضبط هذه القيم حسب الضرورة لتتبع البيانات بشكل صحيح. - اكتب 1 في حقل تحرير مدة ما بعد النبض (دقيقة) على الجانب الأيمن من واجهة المستخدم الرسومية لتغيير وقت القياس الافتراضي بعد النبض إلى دقيقة واحدة. اترك جميع الإعدادات الأخرى في الحالة الافتراضية.
ملاحظة: تقوم معلمات النبضة الافتراضية بإنشاء شكل موجي مربع بجهد 30 فولت و 20 هرتز ومدة 1 مللي ثانية و 200 نبضة. معلمات قياس TEEI الافتراضية هي 0.5 فولت و 100 هرتز و 1,000 هرتز و 10,000 هرتز و 100,000 هرتز. - انقر فوق الزر "تشغيل " وأدخل الأسماء المناسبة للآبار 1-3 و 4-6 عندما يطلب منك ذلك. انقر فوق "موافق " لبدء التجربة.
- قم بإزالة مصفوفة الأقطاب الكهربائية من الحاضنة ونقل الإدخالات مرة أخرى إلى المواقع الأصلية في لوحة بئر التجربة عند انتهاء البرنامج من التنفيذ.
- امزج 2 ميكرولتر من Hoechst 33342 و 5 ميكرولتر من الكالسيين AM مع 123 ميكرولتر من وسائط زراعة الخلايا في أنبوب 200 ميكرولتر.
- ماصة بلطف 10 ميكرولتر من محلول البقع في كل ملحق بعد النبض ووضع الحشوات مرة أخرى في الحاضنة لمدة 5 دقائق.
- انقل لوحة البئر إلى حامل لوحة مجهر الفلورسنت بهدف تكبير 5x. صورة باستخدام برايتفيلد ومضان كل بقعة. قم بتوسيط الملحق فوق الهدف قبل تشغيل الكاميرا.
ملاحظة: الأطوال الموجية للإثارة ل PI و calcein AM و Hoechst 33342 هي 558 نانومتر و 495 نانومتر و 353 نانومتر على التوالي. الأطوال الموجية للانبعاث هي 575 نانومتر و 519 نانومتر و 465 نانومتر على التوالي.
- تجربة قياس TEEI
- ماصة 1.5 مل من وسائط زراعة الخلايا في كل بئر في مجموعة الأقطاب الكهربائية. ضع عينة الخلية في الآبار 1-3 وإدراج التحكم في الآبار 4-6 ، مع تركيب أقدام الإدخال في أخاديد المحاذاة بحيث يكون الإدخال متدفقا مع السطح العلوي للبئر.
- قم بربط ثنائي الفينيل متعدد الكلور بالقطب العلوي بأعلى آبار صفيف الأقطاب الكهربائية وقم بتوصيل صفيف القطب بجهاز PSEP.
- ضع مجموعة الأقطاب الكهربائية في حاضنة 37 درجة مئوية لمدة 1 ساعة على الأقل للسماح بتوازن درجة الحرارة.
- انقر فوق القائمة المنسدلة بجوار "الغشاء" في الزاوية العلوية اليسرى من واجهة المستخدم الرسومية وانقر فوق 400 نانومتر GBO. كرر هذه الخطوة مع "المنحل بالكهرباء" و "الخلايا" و "كثافة بذر الخلية" و "مدة الخلية" ، مع تحديد DMEM و A431 و 200 و 12 على التوالي.
ملاحظة: هذه القيم هي لأغراض حفظ السجلات فقط، ولا تؤثر على وظيفة الجهاز. يرجى التأكد من ضبط هذه القيم حسب الضرورة لتتبع البيانات بشكل صحيح. - اترك جميع الإعدادات المتبقية في حالتها الافتراضية.
ملاحظة: تقوم معلمات النبضة الافتراضية بإنشاء شكل موجي مربع بجهد 30 فولت و 20 هرتز ومدة 1 مللي ثانية و 200 نبضة. معلمات قياس TEEI الافتراضية هي 0.5 فولت و 100 هرتز و 1,000 هرتز و 10,000 هرتز و 100,000 هرتز. - انقر فوق الزر "تشغيل " وأدخل الأسماء المناسبة للآبار 1-3 و 4-6 عندما يطلب منك ذلك. انقر فوق "موافق " لبدء التجربة.
- قم بإزالة مصفوفة الأقطاب الكهربائية من الحاضنة ونقل الإدخالات مرة أخرى إلى المواقع الأصلية في لوحة بئر التجربة عند انتهاء البرنامج من التنفيذ.
- امزج 2 ميكرولتر من Hoechst 33342 ، و 5 ميكرولتر من الكالسيين AM ، و 10 ميكرولتر من PI مع 113 ميكرولتر من وسائط زراعة الخلايا في أنبوب تفاعل 200 ميكرولتر.
- ماصة 10 ميكرولتر من محلول البقع في كل ملحق بعد النبض ووضع الحشوات مرة أخرى في الحاضنة لمدة 5 دقائق.
- انقل لوحة البئر إلى حامل لوحة مجهر التصوير الفلوري بعدسة موضوعية 5x. صورة باستخدام برايتفيلد ومضان كل بقعة. ضع الحشوة في المنتصف فوق العدسة قبل تشغيل الكاميرا.
ملاحظة: الأطوال الموجية للإثارة ل PI و calcein AM و Hoechst 33342 هي 558 نانومتر و 495 نانومتر و 353 نانومتر على التوالي. الأطوال الموجية للانبعاث هي 575 نانومتر و 519 نانومتر و 465 نانومتر على التوالي.
4. تحليل البيانات
- تحليل بيانات الصورة باستخدام خط أنابيب CellProfiler
- استخدم سير عمل CellProfiler المخصص الذي يتم توفيره في GitHub:https://github.com/YangLabUNL/PSEP-TEEI لمعالجة التسليم وصور تجربة قياس TEEI.
- تحليل TEEI
- انقر فوق علامة التبويب تحليل في واجهة المستخدم الرسومية.
- قم بتبديل مؤشر نوع المعاوقة إلى TEEI في الجزء السفلي من واجهة المستخدم الرسومية.
- انقر على السهم في المربع العلوي الأيمن لعرض جميع أسماء التجارب في ملف البيانات. حدد جميع بيانات عينة الخلية من تجربة قياس TEEI.
- انقر على السهم في المربع التالي إلى اليسار لعرض جميع أسماء التجارب في ملف البيانات. حدد جميع بيانات إدراج عنصر التحكم من قياس TEEI.
- انقر فوق تشغيل. سيظهر شكل أساسي يحتوي على بيانات عينة الخلية المحددة بأقل تردد قياس.
- في مربع خيارات العينة على الجانب الأيمن من واجهة المستخدم الرسومية ، انقر فوق السهم لإظهار جميع بيانات الإدراج المحددة. يمكن إزالة القيم المتطرفة عن طريق تحديد البيانات المناسبة والنقر فوق إزالة أدناه.
ملاحظة: يمكن استرداد أي بيانات تمت إزالتها من التحليل عن طريق النقرة الأخيرة على الزر إزالة بواسطة الزر تراجع . - انقر فوق تم للانتقال إلى الشكل التالي عندما تظهر البيانات المطلوبة في الشكل.
- كرر الخطوتين 4.2.6 و4.2.7 لبيانات عينة الخلية المتبقية وبيانات التحكم. عندما يتم تأكيد مجموعة البيانات النهائية بالنقر فوق "تم" ، سيظهر رقم التحليل الكامل.
- احفظ رقم التحليل.
النتائج
يحدد البروتوكول المعطى طريقة لاستخدام قياسات TEEI لفحص العمليات الوسيطة للتثقيب الكهربائي وإجراء تنبؤات التسليم ، وتحديدا لخط خلية A431 وشحنة PI. وفي حين أن تعديل هذا البروتوكول يناقش بمزيد من التفصيل في المادة، فمن المهم أن نلاحظ الآن أنه في حين أن القيم المحددة قد تتغير، ف...
Discussion
يوضح الشكل 2C أن زيادات TEEI من الحد الأدنى والانخفاضات من خط الأساس يتم رسمها لكل جهد شكل موجة PSEP. تخلق زيادة TEEI قوسا مكافئا ، يبلغ ذروته حوالي 20 فولت قبل التقليل ، بينما يزداد انخفاض TEEI من خط الأساس بشكل كبير مع زيادة الجهد. تعكس كفاءة التوصيل ونسب الوفيات ف?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نحن نعترف بدعم التمويل من NSF (جوائز 1826135 ، 1936065 ، 2143997) ، والمعاهد الوطنية للصحة للعلوم الطبية العامة P20GM113126 (مركز نبراسكا للاتصالات الجزيئية الحيوية المتكاملة) و P30GM127200 (مركز نبراسكا للطب النانوي) ، ومبادرة نبراسكا التعاونية ودعم الهندسة الحيوية Voelte-Keegan. تم تصنيع الجهاز في المرفق الأساسي لأبحاث هندسة النانو (NERCF) ، والذي يتم تمويله جزئيا من قبل مبادرة أبحاث نبراسكا.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
References
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved