È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Elettroporazione basata su substrato poroso con monitoraggio dell'impedenza elettrica transepiteliale
In questo articolo
Riepilogo
L'elettroporazione del substrato poroso (PSEP) abbina un'erogazione costante e ad alta produttività con un'elevata vitalità cellulare. L'introduzione delle misure dell'impedenza elettrica transepiteliale (TEEI) fornisce informazioni sui processi intermedi del PSEP e consente la somministrazione senza marcatura. Questo articolo illustra un metodo per eseguire contemporaneamente esperimenti di consegna PSEP e analisi delle misure TEEI.
Abstract
L'elettroporazione del substrato poroso (PSEP) è un metodo emergente di elettroporazione che fornisce un'elevata produttività e un'erogazione costante. Come molti altri tipi di somministrazione intracellulare, la PSEP si basa fortemente sui marcatori fluorescenti e sulla microscopia fluorescente per determinare il successo della consegna. Per ottenere informazioni sulle fasi intermedie del processo di elettroporazione, è stata sviluppata una piattaforma PSEP con monitoraggio integrato dell'impedenza elettrica transepiteliale (TEEI). Le cellule vengono coltivate in inserti disponibili in commercio con membrane porose. Dopo un periodo di incubazione di 12 ore per consentire la formazione di un monostrato cellulare completamente confluente, gli inserti vengono inseriti in un terreno di trasfezione situato nei pozzetti del dispositivo PSEP. I monostrati cellulari vengono quindi sottoposti a una forma d'onda definita dall'utente e l'efficienza di erogazione viene confermata attraverso la microscopia a fluorescenza. Questo flusso di lavoro può essere notevolmente migliorato con le misure TEEI tra microscopia a impulsi e a fluorescenza per raccogliere dati aggiuntivi sul processo PSEP, e questi dati TEEI aggiuntivi sono correlati a metriche di consegna come l'efficienza e la fattibilità della consegna. In questo articolo viene descritto un protocollo per l'esecuzione di misure PSEP con TEEI.
Introduzione
L'elettroporazione è una tecnica in cui le cellule sono esposte a un campo elettrico, creando pori temporanei nella membrana cellulare attraverso i quali i carichi, tra cui proteine, RNA e DNA, possono passare 1,2. La versione più utilizzata è l'elettroporazione di massa (BEP). La BEP viene eseguita riempiendo una cuvetta con un elettrolita contenente milioni di cellule, esponendo l'elettrolita ad alta tensione e consentendo al carico di entrare nelle cellule attraverso la diffusione o l'endocitosi1. Ci sono molti vantaggi per BEP, tra cui un'elevata produttività e numerosi sistemi disponibili in commercio. Tuttavia, ci sono limitazioni all'erogazione del BEP. Il posizionamento incoerente delle celle rispetto agli elettrodi e la schermatura del campo elettrico dalle celle adiacenti causano una significativa variabilità nell'esposizione al campo elettrico durante BEP 3,4. L'alta tensione richiesta per la BEP ha anche un impatto negativo significativo sulla vitalità delle celle5. Sin dal suo inizio nel 20116, c'è stato un crescente interesse per un metodo di elettroporazione chiamato elettroporazione del substrato poroso (PSEP), anche se a volte viene indicato con altri nomi, tra cui elettroporazione localizzata e nano- o micro-elettroporazione 1,7,8. A differenza della sospensione cellulare di BEP, il PSEP viene condotto su cellule aderenti a un substrato poroso. Non solo uno stato aderente è preferito per la maggior parte delle linee cellulari umane9, ma i pori nel substrato si concentrano anche sulla corrente elettrica, localizzando il potenziale elettrico transmembrana (TMP) in regioni specifiche della membrana cellulare10,11. Questa localizzazione consente una significativa riduzione della tensione applicata, diminuendo il danno e aumentando la vitalità cellulare. Questa combinazione di effetti aiuta a controllare lo sviluppo dei pori della membrana cellulare, risultando in un'erogazione più coerente ed efficiente 1,5,12.
Uno studio recente ha introdotto un dispositivo PSEP con un array di elettrodi placcati in oro a sei pozzetti per contenere inserti a membrana porosa13 disponibili in commercio (Figura 1A, B), una pratica che è stata introdotta per la prima volta da Vindis et al.14. Il dispositivo è in grado di applicare impulsi e misurare l'impedenza elettrica attraverso il monostrato cellulare, nota come impedenza elettrica transepiteliale (TEEI), in tempo reale13. L'interfaccia utente del dispositivo consente il controllo completo della forma d'onda e della polarità dell'elettroporazione. È importante sottolineare che le misurazioni dell'impedenza in tempo reale possono essere utilizzate per prevedere i risultati della somministrazione senza la necessità di costosi reagenti o marcatori fluorescenti, un concetto noto come consegna senza etichetta15.
La piattaforma PSEP è costituita da due principali componenti elettrici personalizzati: il corpo principale del dispositivo, che ospita il generatore di impulsi e l'apparecchiatura di misurazione TEEI, e l'array di elettrodi, dove vengono inseriti i substrati porosi e avviene l'elettroporazione. I diagrammi per tutta l'elettronica personalizzata e i componenti stampati in 3D sono disponibili all'indirizzo GitHub: https://github.com/YangLabUNL/PSEP-TEEI. Oltre all'elettronica personalizzata, è necessario anche un computer per il corretto funzionamento della piattaforma. Il software personalizzato richiede l'esecuzione di MATLAB (versione 2021a o successiva) e Microsoft Excel per l'archiviazione e l'accesso ai dati per l'analisi. Il programma controlla l'elettronica personalizzata e fornisce l'interfaccia utente grafica (GUI) per la regolazione delle impostazioni. Questi programmi sono stati resi disponibili anche su GitHub: https://github.com/YangLabUNL/PSEP-TEEI.
I dati preliminari suggeriscono che questo processo è possibile per diversi tipi di cellule aderenti (Figura 1C), ma questo articolo discuterà solo la preparazione delle cellule A431 utilizzando parametri che sono stati trovati ottimali per questa linea cellulare da Brooks et al.13. Inoltre, poiché il carico di ioduro di propidio (PI) è citotossico, vengono eseguiti due esperimenti, il primo con un terreno di trasfezione PI ad alta concentrazione per quantificare l'efficienza di somministrazione e il secondo con solo terreni di coltura cellulare per misurare il TEEI su scale temporali più lunghe. Questi esperimenti utilizzano forme d'onda di elettroporazione identiche, consentendo di correlare i risultati (Figura 1D).
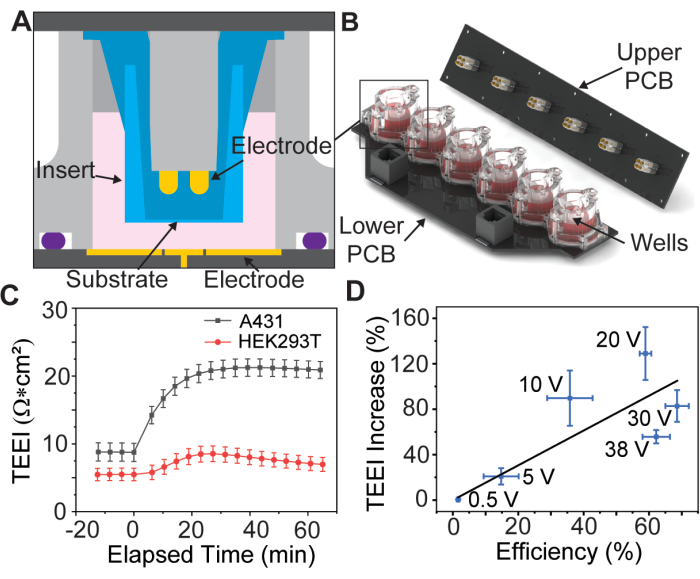
Figura 1: Schema di assemblaggio dell'array di elettrodi e dati fondamentali. (A) Modello CAD di un inserto all'interno di un pozzetto dell'array di elettrodi. (B) Modello CAD dell'array di elettrodi. (C) Aumento dell'impedenza dovuto al PSEP per linee cellulari selezionate, n = 3 per linea cellulare. Barra di errore: errore standard della media. (D) Efficienza della consegna vs. TEEI aumenta i dati di correlazione. L'efficienza di somministrazione è stata calcolata dividendo il numero di cellule marcate nelle immagini PI e calceina dagli esperimenti di somministrazione per il numero totale di cellule identificate con Hoechst. Il numero di celle è stato determinato utilizzando una pipeline CellProfiler personalizzata, n = 6 per tensione. Barra di errore: (asse x e y) errore standard della media. Questa figura è riprodotta da Brooks et al.13 con il permesso. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
I dettagli dei reagenti e delle attrezzature utilizzate nello studio sono elencati nella tabella dei materiali.
1. Preparazione dei reagenti e coltura cellulare
- Preparare i terreni di coltura cellulare aggiungendo 50 ml di siero fetale bovino (FBS) e 5 ml di penicillina-streptomicina a un contenitore da 500 ml di Dulbecco's Modified Eagle Medium (DMEM). Produrre undici aliquote da 50 ml per ridurre il rischio di contaminazione e conservare in frigorifero a 4 °C.
- Creare 1 mL di 25 μg/mL di fibronectina plasmatica umana in soluzione madre tamponata con fosfato (PBS) secondo le istruzioni del produttore.
- Creare 15 mL di ioduro di propidio 0,1 mg/mL in una soluzione madre DMEM per consentire esperimenti con concentrazioni di carico variabili.
- Coltura di cellule A431 in un matraccio T75 contenente 12 mL di terreno di coltura cellulare preparato. Le cellule sono state fatte passare ogni 1-2 giorni per mantenere la confluenza del 50%.
2. Preparazione del campione
- Rivestimento di fibronectina
- È possibile selezionare dodici inserti e due piastre a 24 pozzetti. Posizionare gli inserti in una piastra a pozzetti, creando due file da sei. Metti da parte la piastra del secondo pozzetto fino a più tardi.
- Creare 1.300 μL di soluzione di fibronectina da 1 μg/mL mescolando 52 μL di soluzione madre di fibronectina e 1.248 μL di PBS in una provetta da 1,5 mL.
- Distribuire 100 μl della soluzione di fibronectina in ciascun inserto. Incubare gli inserti nella piastra a pozzetti a 37 °C per 3 ore.
- Regolazione della concentrazione cellulare per ottimizzare la densità cellulare
- Circa 1 ora prima del completamento dell'incubazione della fibronectina, rimuovere il pallone T75 di cellule A431 dall'incubatore per l'estrazione delle cellule.
- Rimuovere il terreno nel pallone con un aspiratore e lavare con 5 ml di PBS. Rimuovere il PBS allo stesso modo e aggiungere 3 ml di tripsina. Incubare per 3-4 minuti prima di picchiettare il lato del pallone per staccare completamente le cellule.
- Aggiungere 6 mL di terreno di coltura cellulare al pallone, mescolando energicamente con una pipetta per staccare le cellule rimanenti, e trasferire il contenuto in una provetta da centrifuga da 15 mL. Centrifugare a 100 x g e 20 °C per 5 min.
- Rimuovere il terreno di coltura cellulare e la tripsina dalla provetta da centrifuga utilizzando un aspiratore, facendo attenzione a non disturbare il pellet cellulare. Aggiungere 1 mL di terreno alla provetta da centrifuga e pipettare avanti e indietro (senza produrre bolle) per rompere il pellet cellulare e risospendere le cellule.
- Pipettare 10 μl di sospensione cellulare, 40 μl di terreno di coltura cellulare e 50 μl di colorante blu di tripano in una provetta da 200 μl, utilizzando una pipetta per miscelare accuratamente.
- Rimuovere 10 μl della miscela di colorante e iniettarla in un emocitometro. Contare le cellule utilizzando la diluizione del 10% della miscela di coloranti per stimare la conta totale delle cellule nella provetta da centrifuga da 15 mL.
NOTA: Per questo protocollo, assumere una concentrazione di 5.000.000 di cellule/mL. - Moltiplicare la densità di semina desiderata per la superficie della membrana dell'inserto, dividere per le cellule contate/mL nella sospensione e moltiplicare per 1.000 per calcolare i microlitri di sospensione cellulare necessari per inserto.
- Per trovare la quantità totale di sospensione cellulare richiesta, moltiplicare questa cifra per 10 (per garantire un numero sufficiente di cellule per 9 campioni, poiché 3 dei 12 inserti saranno controlli privi di cellule) e arrotondare per eccesso al numero intero più vicino. In questo caso, per questo esperimento sono necessari un totale di 135 μl di sospensione cellulare.
- Creare 2.000 μl di soluzione cellulare regolata mescolando i 135 μl della sospensione cellulare precedentemente calcolati con 1.865 μl di terreno di coltura cellulare in una provetta da centrifuga separata da 15 mL.
- Cellule di semina
- Rimuovere la fibronectina in eccesso da ciascun inserto una volta completata l'incubazione della fibronectina.
- Lavare gli inserti due volte aggiungendo 100 μl di acqua distillata sterile a ciascun inserto. Rimuovere l'acqua seguendo lo stesso ordine in cui è stata aggiunta per garantire un tempo di lavaggio costante tra gli inserti.
- Lavare nuovamente l'inserto aggiungendo 100 μL di terreno di coltura cellulare a ciascun inserto. Rimuovere il supporto seguendo lo stesso ordine in cui è stato aggiunto per garantire un tempo di lavaggio costante tra gli inserti.
- Inserti per campioni cellulari
- Seminare le cellule pipettando 200 μL di soluzione cellulare regolata in ciascun inserto. Per garantire una confluenza costante tra gli inserti, miscelare la soluzione cellulare nella provetta da centrifuga prima della distribuzione e mescolare nuovamente all'interno di ciascun inserto dopo la distribuzione.
- Inserti di controllo negativo
- Pipettare 200 μL di terreno di coltura cellulare in ciascun inserto. Per mantenere la coerenza con i foglietti illustrativi dei campioni cellulari, utilizzare la pipetta per miscelare i terreni di coltura cellulare all'interno di ciascun inserto.
- Etichettatura e incubazione
- Tracciare una linea che divida la piastra del secondo pozzetto in due colonne larghe tre pozzetti (per le condizioni eseguite in triplice copia) utilizzando un pennarello indelebile. Separa ogni colonna in righe. Etichettare ogni regione della griglia con i parametri pertinenti.
- Aggiungere 1 mL di terreno di coltura cellulare a ogni pozzetto per ricevere un inserto per l'esperimento. Trasferire gli inserti dalla piastra a pozzetti di preparazione nella posizione appropriata nella piastra a pozzetti per esperimenti etichettata e incubare a 37 °C per almeno 12 ore.
3. Procedura sperimentale
- Esperimento di consegna
- Pipettare 1,5 mL della soluzione PI 0,1 mg/mL in ciascun pozzetto dell'array di elettrodi. Posizionare un inserto in ciascun pozzetto dell'array di elettrodi, inserendo i piedini dell'inserto nelle scanalature di allineamento in modo che l'inserto sia a filo con la superficie superiore del pozzetto (Figura 1A, B).
- Avvitare il circuito stampato (PCB) dell'elettrodo superiore alla parte superiore dei pozzetti dell'array di elettrodi e collegare l'array di elettrodi al dispositivo PSEP.
- Posizionare la matrice di elettrodi nell'incubatore a 37 °C per almeno 1 ora per consentire alla temperatura di stabilizzarsi.
- Fare clic sul menu a discesa accanto a "Membrana" nell'angolo in alto a sinistra della GUI e fare clic su 400 nm GBO. Ripetere questo passaggio per "Elettrolita", "Celle", "Densità di semina cellulare" e "Durata cella", selezionando rispettivamente DMEM, A431, 200 e 12.
NOTA: Questi valori sono solo a scopo di registrazione e non influiscono sul funzionamento del dispositivo. Assicurarsi di regolare questi valori se necessario per il corretto tracciamento dei dati. - Digitare 1 nel campo di modifica Post Pulse Time Duration (min) sul lato destro della GUI per modificare il tempo di misurazione post-impulso predefinito a 1 min. Lasciare tutte le altre impostazioni nello stato predefinito.
NOTA: I parametri predefiniti dell'impulso creano una forma d'onda quadra con 30 volt, 20 Hz, durata di 1 ms e 200 impulsi. I parametri di misurazione TEEI predefiniti sono 0,5 volt e 100 Hz, 1.000 Hz, 10.000 Hz e 100.000 Hz. - Fare clic sul pulsante Esegui e inserire i nomi appropriati per i pozzetti 1-3 e 4-6 quando richiesto. Fare clic su OK per avviare l'esperimento.
- Rimuovere l'array di elettrodi dall'incubatore e trasferire nuovamente gli inserti nelle posizioni originali nella piastra del pozzetto dell'esperimento al termine dell'esecuzione del programma.
- Miscelare 2 μl di Hoechst 33342 e 5 μl di calceina AM con 123 μl di terreno di coltura cellulare in una provetta da 200 μl.
- Pipettare delicatamente 10 μL della soluzione colorante in ciascun inserto post-impulso e riposizionare gli inserti nell'incubatore per 5 minuti.
- Trasferire la piastra a pozzetti nel supporto per piastre di un microscopio a fluorescenza con un obiettivo di ingrandimento 5x. Immagine utilizzando il campo chiaro e la fluorescenza di ogni colorazione. Centrare l'inserto sull'obiettivo prima di attivare la fotocamera.
NOTA: Le lunghezze d'onda di eccitazione per PI, calceina AM e Hoechst 33342 sono rispettivamente di 558 nm, 495 nm e 353 nm. Le lunghezze d'onda di emissione sono rispettivamente di 575 nm, 519 nm e 465 nm.
- Esperimento di misurazione TEEI
- Pipettare 1,5 mL di terreno di coltura cellulare in ciascun pozzetto dell'array di elettrodi. Posizionare gli inserti del campione cellulare nei pozzetti 1-3 e gli inserti di controllo nei pozzetti 4-6, inserendo i piedini dell'inserto nelle scanalature di allineamento in modo che l'inserto sia a filo con la superficie superiore del pozzetto.
- Avvitare il PCB dell'elettrodo superiore alla parte superiore dei pozzetti dell'array di elettrodi e collegare l'array di elettrodi al dispositivo PSEP.
- Posizionare la matrice di elettrodi nell'incubatore a 37 °C per almeno 1 ora per consentire alla temperatura di stabilizzarsi.
- Fare clic sul menu a discesa accanto a "Membrana" nell'angolo in alto a sinistra della GUI e fare clic su 400 nm GBO. Ripetere questo passaggio per "Elettrolita", "Celle", "Densità di semina cellulare" e "Durata cella", selezionando rispettivamente DMEM, A431, 200 e 12.
NOTA: Questi valori sono solo a scopo di registrazione e non influiscono sul funzionamento del dispositivo. Assicurarsi di regolare questi valori se necessario per il corretto tracciamento dei dati. - Lasciare tutte le impostazioni rimanenti nello stato predefinito.
NOTA: I parametri predefiniti dell'impulso creano una forma d'onda quadra con 30 volt, 20 Hz, durata di 1 ms e 200 impulsi. I parametri di misurazione TEEI predefiniti sono 0,5 volt e 100 Hz, 1.000 Hz, 10.000 Hz e 100.000 Hz. - Fare clic sul pulsante Esegui e inserire i nomi appropriati per i pozzetti 1-3 e 4-6 quando richiesto. Fare clic su OK per avviare l'esperimento.
- Rimuovere l'array di elettrodi dall'incubatore e trasferire nuovamente gli inserti nelle posizioni originali nella piastra del pozzetto dell'esperimento al termine dell'esecuzione del programma.
- Miscelare 2 μL di Hoechst 33342, 5 μL di calceina AM e 10 μL di PI con 113 μL di terreno di coltura cellulare in una provetta di reazione da 200 μL.
- Pipettare 10 μl di soluzione colorante in ciascun inserto post-impulso e riposizionare gli inserti nell'incubatore per 5 minuti.
- Trasferire la piastra a pozzetti nel supporto della piastra di un microscopio per immagini a fluorescenza con una lente dell'obiettivo 5x. Immagine utilizzando il campo chiaro e la fluorescenza di ogni colorazione. Centrare l'inserto sull'obiettivo prima di attivare la fotocamera.
NOTA: Le lunghezze d'onda di eccitazione per PI, calceina AM e Hoechst 33342 sono rispettivamente di 558 nm, 495 nm e 353 nm. Le lunghezze d'onda di emissione sono rispettivamente di 575 nm, 519 nm e 465 nm.
4. Analisi dei dati
- Analisi dei dati delle immagini con la pipeline CellProfiler
- Usare il flusso di lavoro CellProfiler personalizzato fornito in GitHub:https://github.com/YangLabUNL/PSEP-TEEI per elaborare le immagini dell'esperimento di consegna e di misurazione TEEI.
- Analisi TEEI
- Fare clic sulla scheda Analisi nella GUI.
- Spostare l'indicatore del tipo di impedenza su TEEI nella parte inferiore della GUI.
- Fai clic sulla freccia nella casella in alto a sinistra per visualizzare tutti i nomi degli esperimenti nel file di dati. Seleziona tutti i dati del campione di cellule dall'esperimento di misurazione TEEI.
- Fai clic sulla freccia nella casella successiva a destra per visualizzare tutti i nomi degli esperimenti nel file di dati. Selezionare tutti i dati dell'inserto di controllo dalla misurazione TEEI.
- Fare clic su Esegui. Apparirà una figura di base contenente i dati del campione di cella selezionato alla frequenza di misurazione più bassa.
- Nella casella delle opzioni di esempio sul lato destro della GUI, fare clic sulla freccia per visualizzare tutti i dati di inserimento selezionati. I valori anomali possono essere rimossi selezionando i dati appropriati e facendo clic su Rimuovi di seguito.
NOTA: tutti i dati che sono stati rimossi dall'analisi con l'ultimo clic del pulsante Rimuovi possono essere recuperati dal pulsante Annulla . - Fare clic su Fine per passare alla figura successiva quando nella figura vengono visualizzati i dati desiderati.
- Ripetere i passaggi 4.2.6 e 4.2.7 per i dati del campione di cella rimanente e per i dati di controllo. Quando il set di dati finale è stato confermato facendo clic su "Fine", verrà visualizzata la figura completa dell'analisi.
- Salvate la figura dell'analisi.
Risultati
Il protocollo fornito stabilisce un metodo per l'utilizzo delle misure TEEI per esaminare i processi intermedi di elettroporazione e fare previsioni di consegna, in particolare per la linea cellulare A431 e il carico PI. Sebbene la modifica di questo protocollo sia discussa più avanti nell'articolo, è importante notare ora che, sebbene i valori specifici possano cambiare, le tendenze generali nella risposta rimangono coerenti. Ad esempio, i dati TEEI che scendono al di sotto del basale...
Discussione
La Figura 2C mostra che gli aumenti del TEEI rispetto al minimo e le diminuzioni rispetto alla linea di base sono tracciati per ciascuna tensione della forma d'onda PSEP. L'aumento del TEEI crea un arco parabolico, con un picco di circa 20 volt prima di ridursi, mentre la diminuzione del TEEI rispetto alla linea di base aumenta esponenzialmente all'aumentare della tensione. L'efficienza di erogazione e le percentuali di morte nella Figur...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Riconosciamo il sostegno finanziario da parte della NSF (Awards 1826135, 1936065, 2143997), NIH National Institutes of General Medical Sciences P20GM113126 (Nebraska Center for Integrated Biomolecular Communication) e P30GM127200 (Nebraska Center for Nanomedicine), la Nebraska Collaborative Initiative e il Voelte-Keegan Bioengineering Support. Il dispositivo è stato prodotto presso la NanoEngineering Research Core Facility (NERCF), che è parzialmente finanziata dalla Nebraska Research Initiative.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
Riferimenti
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon