Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Poröse substratbasierte Elektroporation mit transepithelialer elektrischer Impedanzüberwachung
In diesem Artikel
Zusammenfassung
Die Elektroporation mit porösen Substraten (PSEP) kombiniert eine konsistente Abgabe mit hohem Durchsatz und einer hohen Zellviabilität. Die Einführung von transepithelialen elektrischen Impedanzmessungen (TEEI) gibt Einblick in die Zwischenprozesse von PSEP und ermöglicht eine markierungsfreie Verabreichung. In diesem Artikel wird eine Methode zur gleichzeitigen Durchführung von PSEP-Verabreichungsexperimenten und TEEI-Messanalysen erläutert.
Zusammenfassung
Die Elektroporation poröser Substrate (PSEP) ist eine aufstrebende Methode der Elektroporation, die einen hohen Durchsatz und eine gleichmäßige Abgabe bietet. Wie viele andere Arten der intrazellulären Verabreichung stützt sich PSEP stark auf Fluoreszenzmarker und Fluoreszenzmikroskopie, um eine erfolgreiche Verabreichung zu bestimmen. Um einen Einblick in die Zwischenschritte des Elektroporationsprozesses zu erhalten, wurde eine PSEP-Plattform mit integrierter transepithelialer elektrischer Impedanzüberwachung (TEEI) entwickelt. Die Zellen werden in kommerziell erhältlichen Inserts mit porösen Membranen kultiviert. Nach einer Inkubationszeit von 12 Stunden, um die Bildung einer vollständig konfluenten Zellmonoschicht zu ermöglichen, werden die Inserts in Transfektionsmedien gelegt, die sich in den Vertiefungen des PSEP-Geräts befinden. Die Zellmonoschichten werden dann einer benutzerdefinierten Wellenform unterzogen, und die Abgabeeffizienz wird durch Fluoreszenzmikroskopie bestätigt. Dieser Arbeitsablauf kann mit TEEI-Messungen zwischen Puls- und Fluoreszenzmikroskopie erheblich verbessert werden, um zusätzliche Daten über den PSEP-Prozess zu sammeln, und diese zusätzlichen TEEI-Daten werden mit Verabreichungsmetriken wie Verabreichungseffizienz und Durchführbarkeit korreliert. In diesem Artikel wird ein Protokoll für die Durchführung von PSEP mit TEEI-Messungen beschrieben.
Einleitung
Die Elektroporation ist eine Technik, bei der Zellen einem elektrischen Feld ausgesetzt werden, wodurch temporäre Poren in der Zellmembran entstehen, durch die Frachten, einschließlich Proteine, RNA und DNA, gelangen können 1,2. Die am weitesten verbreitete Variante ist die Bulk-Elektroporation (BEP). Die BEP wird durchgeführt, indem eine Küvette mit einem Elektrolyten gefüllt wird, der Millionen von Zellen enthält, der Elektrolyt einer Hochspannung ausgesetzt wird und die Fracht durch Diffusion oder Endozytosein die Zellen gelangt 1. BEP bietet viele Vorteile, darunter einen hohen Durchsatz und zahlreiche kommerziell erhältliche Systeme. Es gibt jedoch Einschränkungen bei der BEP-Lieferung. Eine inkonsistente Zellpositionierung relativ zu den Elektroden und die Abschirmung des elektrischen Feldes von benachbarten Zellen führen zu einer signifikanten Variabilität der Exposition gegenüber elektrischen Feldern während BEP 3,4. Die für BEP erforderliche hohe Spannung hat auch einen erheblichen negativen Einfluss auf die Lebensfähigkeit der Zellen5. Seit ihrer Einführung im Jahr 20116 besteht ein wachsendes Interesse an einer Elektroporationsmethode, die als poröse Substratelektroporation (PSEP) bezeichnet wird, obwohl sie manchmal auch mit anderen Namen bezeichnet wird, darunter lokalisierte Elektroporation und Nano- oder Mikroelektroporation 1,7,8. Im Gegensatz zur Zellsuspension von BEP wird PSEP an Zellen durchgeführt, die an einem porösen Substrat haften. Nicht nur, dass für die Mehrzahl der menschlichen Zelllinien9 ein adhärenter Zustand bevorzugt ist, sondern die Poren im Substrat fokussieren sich auch auf den elektrischen Strom, wodurch das elektrische Transmembranpotential (TMP) in spezifischen Regionen der Zellmembranlokalisiert wird 10,11. Diese Lokalisierung ermöglicht eine signifikante Reduzierung der angelegten Spannung, eine Verringerung der Beschädigung und eine Erhöhung der Zellviabilität. Diese Kombination von Effekten hilft, die Porenentwicklung der Zellmembran zu kontrollieren, was zu einer konsistenteren und effizienteren Abgabe führt 1,5,12.
In einer kürzlich durchgeführten Studie wurde ein PSEP-Gerät mit einem vergoldeten Elektrodenarray mit sechs Vertiefungen zum Halten von kommerziell erhältlichen porösen Membraneinsätzen13 vorgestellt (Abbildung 1A,B), eine Praxis, die erstmals von Vindis et al. eingeführt wurde14. Das Gerät kann Impulse anlegen und die elektrische Impedanz über die Zellmonoschicht, die als transepitheliale elektrische Impedanz (TEEI) bezeichnet wird, in Echtzeit messen13. Die Benutzeroberfläche des Geräts ermöglicht die vollständige Kontrolle über die Wellenform und Polarität der Elektroporation. Wichtig ist, dass Echtzeit-Impedanzmessungen verwendet werden können, um die Verabreichungsergebnisse vorherzusagen, ohne dass teure Reagenzien oder Fluoreszenzmarker erforderlich sind, ein Konzept, das als markierungsfreie Verabreichung bekannt ist15.
Die PSEP-Plattform besteht aus zwei großen kundenspezifischen elektrischen Komponenten: dem Hauptkörper des Geräts, in dem sich der Impulsgenerator und die TEEI-Messgeräte befinden, und dem Elektrodenarray, in das die porösen Substrate eingebracht werden und die Elektroporation stattfindet. Diagramme für alle kundenspezifischen Elektronikgeräte und 3D-gedruckten Komponenten finden Sie auf GitHub: https://github.com/YangLabUNL/PSEP-TEEI. Neben der kundenspezifischen Elektronik ist auch ein Computer erforderlich, damit die Plattform ordnungsgemäß funktioniert. Die benutzerdefinierte Software erfordert MATLAB (Version 2021a oder höher), um ausgeführt zu werden, und Microsoft Excel, um Daten für die Analyse zu speichern und darauf zuzugreifen. Das Programm steuert die kundenspezifische Elektronik und stellt die grafische Benutzeroberfläche (GUI) zum Anpassen von Einstellungen zur Verfügung. Diese Programme wurden auch auf GitHub zur Verfügung gestellt: https://github.com/YangLabUNL/PSEP-TEEI.
Vorläufige Daten deuten darauf hin, dass dieser Prozess für verschiedene Arten von adhärenten Zellen möglich ist (Abbildung 1C), aber in diesem Artikel wird nur die Präparation von A431-Zellen unter Verwendung von Parametern behandelt, die von Brooks et al. als optimal für diese Zelllinie befunden wurden.13. Da die Propidiumiodid (PI)-Fracht zytotoxisch ist, werden außerdem zwei Experimente durchgeführt, das erste mit einem hochkonzentrierten PI-Transfektionsmedium zur Quantifizierung der Verabreichungseffizienz und das zweite nur mit Zellkulturmedien zur Messung von TEEI über längere Zeiträume. Bei diesen Experimenten werden identische Elektroporationswellenformen verwendet, so dass die Ergebnisse korreliert werden können (Abbildung 1D).
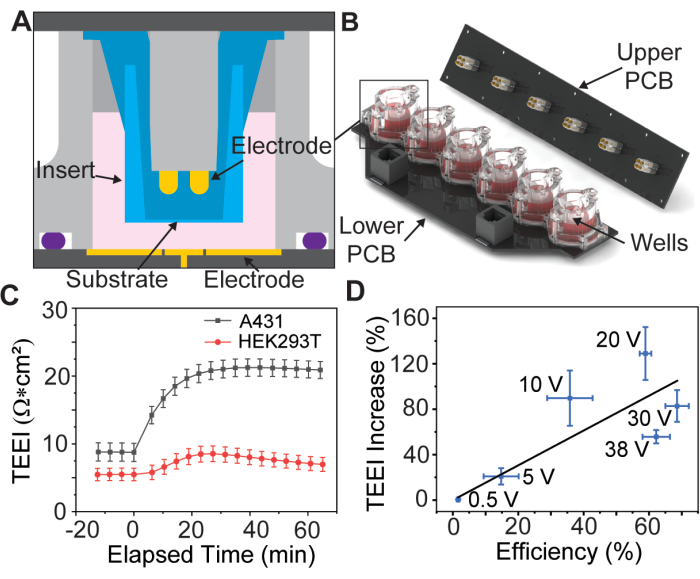
Abbildung 1: Montagediagramm des Elektrodenarrays und grundlegende Daten. (A) CAD-Modell eines Einsatzes in einer Vertiefung des Elektrodenarrays. (B) CAD-Modell des Elektrodenarrays. (C) Impedanzerhöhung aufgrund von PSEP für ausgewählte Zelllinien, n = 3 pro Zelllinie. Fehlerbalken: Standardfehler des Mittelwerts. (D) Liefereffizienz vs. TEEI erhöhen die Korrelationsdaten. Die Verabreichungseffizienz wurde berechnet, indem die Anzahl der Zellen, die sowohl in PI- als auch in Calstein-Bildern aus Verabreichungsexperimenten markiert waren, durch die Gesamtzahl der mit Hoechst identifizierten Zellen dividiert wurde. Die Zellzahl wurde mit einer benutzerdefinierten CellProfiler-Pipeline bestimmt, n = 6 pro Spannung. Fehlerbalken: (x- und y-Achse) Standardfehler des Mittelwerts. Diese Abbildung wurde mit Genehmigung von Brooks et al.13 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Die Einzelheiten zu den Reagenzien und der in der Studie verwendeten Ausrüstung sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Reagenzien und Zellkultur
- Bereiten Sie das Zellkulturmedium vor, indem Sie 50 ml fötales Rinderserum (FBS) und 5 ml Penicillin-Streptomycin in einen 500-ml-Behälter mit Dulbecco's Modified Eagle Medium (DMEM) geben. Elf 50-ml-Aliquote herstellen, um das Kontaminationsrisiko zu verringern, und bei 4 °C kühlen.
- 1 ml Fibronektin im humanen Plasma mit 25 μg/ml in phosphatgepufferter Kochsalzlösung (PBS) gemäß den Anweisungen des Herstellers herstellen.
- 15 ml 0,1 mg/ml Propidiumiodid in DMEM-Stammlösung herstellen, um Experimente mit unterschiedlichen Ladungskonzentrationen zu ermöglichen.
- Kultivieren Sie A431-Zellen in einem T75-Kolben, der 12 ml des vorbereiteten Zellkulturmediums enthält. Die Zellen wurden alle 1-2 Tage passageiert, um eine Konfluenz von 50 % aufrechtzuerhalten.
2. Vorbereitung der Probe
- Fibronektin-Beschichtung
- Wählen Sie zwölf Einsätze und zwei 24-Well-Platten. Platzieren Sie die Einsätze in einer Well-Platte, so dass zwei Reihen mit je sechs Vertiefungen entstehen. Stellen Sie die zweite Vertiefungsplatte für später beiseite.
- Stellen Sie 1.300 μl 1 μg/ml Fibronektinlösung her, indem Sie 52 μl Fibronektin-Stammlösung und 1.248 μl PBS in einem 1,5-ml-Röhrchen mischen.
- Verteilen Sie 100 μl der Fibronektinlösung in jede Einlage. Inkubieren Sie die Einsätze in der Well-Platte bei 37 °C für 3 h.
- Einstellen der Zellkonzentration für eine optimierte Zelldichte
- Etwa 1 Stunde vor Abschluss der Fibronektin-Inkubation den T75-Kolben mit A431-Zellen für die Zellextraktion aus dem Inkubator nehmen.
- Entfernen Sie das Medium mit einem Aspirator aus dem Kolben und waschen Sie es mit 5 ml PBS. Entfernen Sie das PBS auf die gleiche Weise und fügen Sie 3 ml Trypsin hinzu. Inkubieren Sie 3-4 Minuten lang, bevor Sie auf die Seite des Kolbens klopfen, um die Zellen vollständig zu lösen.
- Geben Sie 6 ml Zellkulturmedium in den Kolben, mischen Sie kräftig mit einer Pipette, um alle verbleibenden Zellen zu lösen, und geben Sie den Inhalt in ein 15-ml-Zentrifugenröhrchen. Bei 100 x g und 20 °C 5 min zentrifugieren.
- Entfernen Sie das Zellkulturmedium und das Trypsin mit einem Aspirator aus dem Zentrifugenröhrchen und achten Sie darauf, das Zellpellet nicht zu beschädigen. Geben Sie 1 ml Medium in das Zentrifugenröhrchen und pipettieren Sie hin und her (ohne Blasen zu erzeugen), um das Zellpellet aufzubrechen und die Zellen wieder zu suspendieren.
- Pipettieren Sie 10 μl der Zellsuspension, 40 μl Zellkulturmedium und 50 μl Trypanblau-Farbstoff in ein 200-μl-Röhrchen und mischen Sie es mit einer Pipette gründlich.
- Entfernen Sie 10 μl der Farbstoffmischung und injizieren Sie sie in ein Hämozytometer. Zählen Sie die Zellen mit der 10%igen Verdünnung der Farbstoffmischung, um die Gesamtzellzahl im 15-ml-Zentrifugenröhrchen zu schätzen.
HINWEIS: Für dieses Protokoll wird von einer Konzentration von 5.000.000 Zellen/ml ausgegangen. - Multiplizieren Sie die gewünschte Aussaatdichte mit der Oberfläche der Insert-Membran, dividieren Sie durch die gezählten Zellen/ml in der Suspension und multiplizieren Sie mit 1.000, um die erforderlichen Mikroliter Zellsuspension pro Insert zu berechnen.
- Um die Gesamtmenge der benötigten Zellsuspension zu ermitteln, multiplizieren Sie diese Zahl mit 10 (um genügend Zellen für 9 Proben zu gewährleisten, da 3 der 12 Einsätze zellfreie Kontrollen sind) und runden Sie auf die nächste ganze Zahl auf. In diesem Fall werden für dieses Experiment insgesamt 135 μL der Zellsuspension benötigt.
- Stellen Sie 2.000 μl angepasste Zelllösung her, indem Sie die zuvor berechneten 135 μl der Zellsuspension mit 1.865 μl Zellkulturmedium in einem separaten 15-ml-Zentrifugenröhrchen mischen.
- Zellen aussäen
- Entfernen Sie das überschüssige Fibronektin von jedem Einsatz, sobald die Fibronektin-Inkubation abgeschlossen ist.
- Waschen Sie die Einsätze zweimal, indem Sie jedem Einsatz 100 μl steriles destilliertes Wasser hinzufügen. Entfernen Sie das Wasser in der gleichen Reihenfolge, in der es hinzugefügt wurde, um eine gleichmäßige Waschzeit zwischen den Einlegeeinlagen zu gewährleisten.
- Waschen Sie den Einsatz erneut, indem Sie jedem Einsatz 100 μl Zellkulturmedium hinzufügen. Entfernen Sie das Medium in der gleichen Reihenfolge, in der es hinzugefügt wurde, um eine gleichmäßige Waschzeit zwischen den Einlegern zu gewährleisten.
- Einsätze von Zellproben
- Keimzellen durch Pipettieren von 200 μl angepasster Zelllösung in jeden Einsatz. Um eine gleichmäßige Konfluenz zwischen den Einsätzen zu gewährleisten, mischen Sie die Zelllösung vor der Verteilung im Zentrifugenröhrchen und mischen Sie sie nach der Verteilung erneut in jedem Einsatz.
- Einsätze für Negativkontrollen
- Pipettieren Sie 200 μl Zellkulturmedium in jeden Einsatz. Um die Konsistenz mit den Zellprobeneinsätzen zu gewährleisten, verwenden Sie die Pipette, um das Zellkulturmedium in jedem Einsatz zu mischen.
- Markierung und Inkubation
- Zeichnen Sie mit einem Permanentmarker eine Linie, die die zweite Well-Platte in zwei Spalten unterteilt, die drei Wells breit sind (für Bedingungen, die in dreifacher Ausführung ausgeführt werden). Trennen Sie jede Spalte in Zeilen. Beschriften Sie jeden Bereich im Raster mit relevanten Parametern.
- Geben Sie 1 ml Zellkulturmedium in jede Vertiefung, um eine Einlage für das Experiment zu erhalten. Übertragen Sie die Einsätze aus der Präparationsvertiefungsplatte an die entsprechende Stelle in der beschrifteten Versuchsvertiefungsplatte und inkubieren Sie mindestens 12 h lang bei 37 °C.
3. Experimentelles Vorgehen
- Experiment zur Auslieferung
- Pipettieren Sie 1,5 ml der 0,1 mg/ml PI-Lösung in jede Vertiefung im Elektrodenarray. Platzieren Sie einen Einsatz in jeder Vertiefung des Elektrodenarrays und setzen Sie die Füße des Einsatzes in die Ausrichtungsnuten ein, sodass der Einsatz bündig mit der Oberseite der Vertiefung abschließt (Abbildung 1A, B).
- Schrauben Sie die obere Elektrodenleiterplatte (PCB) an die Oberseite der Elektrodenarray-Vertiefungen und verbinden Sie das Elektrodenarray mit dem PSEP-Gerät.
- Stellen Sie das Elektrodenarray für mindestens 1 h in den 37 °C heißen Inkubator, damit sich die Temperatur ausgleichen kann.
- Klicken Sie auf das Dropdown-Menü neben "Membran" in der oberen linken Ecke der GUI und klicken Sie auf 400 nm GBO. Wiederholen Sie diesen Schritt für "Elektrolyt", "Zellen", "Zellaussaatdichte" und "Zelldauer" und wählen Sie DMEM, A431, 200 bzw. 12 aus.
HINWEIS: Diese Werte dienen nur zu Aufzeichnungszwecken und haben keinen Einfluss auf die Funktion des Geräts. Bitte stellen Sie sicher, dass Sie diese Werte bei Bedarf anpassen, um eine korrekte Datenverfolgung zu gewährleisten. - Geben Sie 1 in das Bearbeitungsfeld "Post-Pulse-Zeitdauer (min)" auf der rechten Seite der GUI ein, um die Standard-Nach-Puls-Messzeit auf 1 Minute zu ändern. Behalten Sie alle anderen Einstellungen im Standardzustand bei.
HINWEIS: Die Standard-Impulsparameter erzeugen eine Rechteckwellenform mit 30 Volt, 20 Hz, 1 ms Dauer und 200 Impulsen. Die standardmäßigen TEEI-Messparameter sind 0,5 Volt und 100 Hz, 1.000 Hz, 10.000 Hz und 100.000 Hz. - Klicken Sie auf die Schaltfläche Ausführen und geben Sie die entsprechenden Namen für die Bohrlöcher 1-3 und 4-6 ein, wenn Sie dazu aufgefordert werden. Klicken Sie auf OK , um das Experiment zu starten.
- Nehmen Sie das Elektrodenarray aus dem Inkubator und übertragen Sie die Einsätze zurück an die ursprünglichen Positionen in der Experimentvertiefungsplatte, wenn die Ausführung des Programms abgeschlossen ist.
- Mischen Sie 2 μl Hoechst 33342 und 5 μl Calcein AM mit 123 μl Zellkulturmedium in einem 200 μl Röhrchen.
- Pipettieren Sie vorsichtig 10 μl der Färbelösung in jeden Post-Puls-Einsatz und legen Sie die Einsätze für 5 Minuten zurück in den Inkubator.
- Übertragen Sie die Well-Platte in den Plattenhalter eines Fluoreszenzmikroskops mit einem Objektiv mit 5-facher Vergrößerung. Bild mit Hellfeld und der Fluoreszenz jedes Flecks. Zentrieren Sie den Einsatz über dem Objektiv, bevor Sie die Kamera auslösen.
HINWEIS: Die Anregungswellenlängen für PI, Calcein AM und Hoechst 33342 betragen 558 nm, 495 nm bzw. 353 nm. Die Emissionswellenlängen betragen 575 nm, 519 nm bzw. 465 nm.
- TEEI-Messexperiment
- Pipettieren Sie 1,5 ml des Zellkulturmediums in jede Vertiefung im Elektrodenarray. Platzieren Sie die Zellprobeneinsätze in den Vertiefungen 1-3 und die Kontrolleinsätze in den Vertiefungen 4-6, wobei Sie die Füße des Einsatzes in die Ausrichtungsrillen einpassen, so dass der Einsatz bündig mit der Oberseite der Vertiefung abschließt.
- Schrauben Sie die obere Elektrodenplatine an die Oberseite der Elektrodenarray-Vertiefungen und verbinden Sie das Elektrodenarray mit dem PSEP-Gerät.
- Stellen Sie das Elektrodenarray für mindestens 1 h in den 37 °C heißen Inkubator, damit sich die Temperatur ausgleichen kann.
- Klicken Sie auf das Dropdown-Menü neben "Membran" in der oberen linken Ecke der GUI und klicken Sie auf 400 nm GBO. Wiederholen Sie diesen Schritt für "Elektrolyt", "Zellen", "Zellaussaatdichte" und "Zelldauer" und wählen Sie DMEM, A431, 200 bzw. 12 aus.
HINWEIS: Diese Werte dienen nur zu Aufzeichnungszwecken und haben keinen Einfluss auf die Funktion des Geräts. Bitte stellen Sie sicher, dass Sie diese Werte bei Bedarf anpassen, um eine korrekte Datenverfolgung zu gewährleisten. - Belassen Sie alle verbleibenden Einstellungen im Standardzustand.
HINWEIS: Die Standard-Impulsparameter erzeugen eine Rechteckwellenform mit 30 Volt, 20 Hz, 1 ms Dauer und 200 Impulsen. Die standardmäßigen TEEI-Messparameter sind 0,5 Volt und 100 Hz, 1.000 Hz, 10.000 Hz und 100.000 Hz. - Klicken Sie auf die Schaltfläche Ausführen und geben Sie die entsprechenden Namen für die Bohrlöcher 1-3 und 4-6 ein, wenn Sie dazu aufgefordert werden. Klicken Sie auf OK , um das Experiment zu starten.
- Nehmen Sie das Elektrodenarray aus dem Inkubator und übertragen Sie die Einsätze zurück an die ursprünglichen Positionen in der Experimentvertiefungsplatte, wenn die Ausführung des Programms abgeschlossen ist.
- Mischen Sie 2 μl Hoechst 33342, 5 μl Calcein AM und 10 μl PI mit 113 μl Zellkulturmedium in einem 200 μl Reaktionsgefäß.
- Pipettieren Sie 10 μl der Fleckenlösung in jeden Post-Puls-Einsatz und legen Sie die Einsätze für 5 Minuten zurück in den Inkubator.
- Übertragen Sie die Well-Platte in den Plattenhalter eines Fluoreszenzmikroskops mit einer 5-fach-Objektivlinse. Bild mit Hellfeld und der Fluoreszenz jedes Flecks. Zentrieren Sie den Einsatz über dem Objektiv, bevor Sie die Kamera auslösen.
HINWEIS: Die Anregungswellenlängen für PI, Calcein AM und Hoechst 33342 betragen 558 nm, 495 nm bzw. 353 nm. Die Emissionswellenlängen betragen 575 nm, 519 nm bzw. 465 nm.
4. Datenanalyse
- Analysieren von Bilddaten mit der CellProfiler-Pipeline
- Verwenden Sie den benutzerdefinierten CellProfiler-Workflow, der unter GitHub:https://github.com/YangLabUNL/PSEP-TEEI bereitgestellt wird, um die Bilder des Bereitstellungs- und TEEI-Messexperiments zu verarbeiten.
- TEEI-Analyse
- Klicken Sie in der GUI auf die Registerkarte Analyse .
- Schalten Sie die Impedanztypanzeige am unteren Rand der GUI auf TEEI um.
- Klicken Sie auf den Pfeil im oberen linken Feld, um alle Experimentnamen in der Datendatei anzuzeigen. Wählen Sie alle Zellprobendaten aus dem TEEI-Messexperiment aus.
- Klicken Sie auf den Pfeil im nächsten Feld rechts, um alle Experimentnamen in der Datendatei anzuzeigen. Wählen Sie alle Einfügedaten aus der TEEI-Messung aus.
- Klicken Sie auf Ausführen. Es erscheint eine Basisabbildung mit ausgewählten Zellprobendaten mit der niedrigsten Messfrequenz.
- Klicken Sie im Feld für Beispieloptionen auf der rechten Seite der GUI auf den Pfeil, um alle ausgewählten Einfügedaten anzuzeigen. Ausreißer können entfernt werden, indem Sie die entsprechenden Daten auswählen und unten auf Entfernen klicken.
HINWEIS: Alle Daten, die durch den letzten Klick auf die Schaltfläche Entfernen aus der Analyse entfernt wurden, können mit der Schaltfläche Rückgängig abgerufen werden. - Klicken Sie auf Fertig , um zur nächsten Abbildung zu gelangen, wenn die gewünschten Daten in der Abbildung angezeigt werden.
- Wiederholen Sie die Schritte 4.2.6 und 4.2.7 für die verbleibenden Zellprobendaten und Kontrolldaten. Wenn der endgültige Datensatz mit einem Klick auf "Fertig" bestätigt wurde, erscheint die vollständige Analysezahl.
- Speichern Sie die Analysezahl.
Ergebnisse
Das vorliegende Protokoll etabliert eine Methode zur Verwendung von TEEI-Messungen, um die Zwischenprozesse der Elektroporation zu untersuchen und Vorhersagen über die Verabreichung zu treffen, insbesondere für die A431-Zelllinie und die PI-Fracht. Während die Modifikation dieses Protokolls in diesem Artikel weiter diskutiert wird, ist es wichtig zu beachten, dass sich die spezifischen Werte zwar ändern können, die allgemeinen Trends in der Reaktion jedoch konsistent bleiben. Zum Be...
Diskussion
Abbildung 2C zeigt, dass TEEI-Anstiege von der Minimal- und die Abnahme gegenüber dem Ausgangswert für jede PSEP-Wellenformspannung aufgetragen werden. Die TEEI-Erhöhung erzeugt einen Parabolbogen, der einen Spitzenwert von etwa 20 Volt erreicht, bevor er abnimmt, während die TEEI-Abnahme gegenüber der Grundlinie mit steigender Spannung exponentiell ansteigt. Der Förderwirkungsgrad und der Todesprozentsatz in Abbildung 2D ...
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Wir danken für die finanzielle Unterstützung durch die NSF (Awards 1826135, 1936065, 2143997), die NIH National Institutes of General Medical Sciences P20GM113126 (Nebraska Center for Integrated Biomolecular Communication) und P30GM127200 (Nebraska Center for Nanomedicine), die Nebraska Collaborative Initiative und die Voelte-Keegan Bioengineering Support. Das Gerät wurde in der NanoEngineering Research Core Facility (NERCF) hergestellt, die teilweise von der Nebraska Research Initiative finanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
Referenzen
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten